阿托伐他汀对哮喘大鼠气道炎症及气道重构的影响
2016-09-19潘文森于金香顾莹杨红申
潘文森 于金香 顾莹 杨红申
·论著·
阿托伐他汀对哮喘大鼠气道炎症及气道重构的影响
潘文森于金香顾莹杨红申
目的探讨阿托伐他汀对卵清白蛋白致敏哮喘模型大鼠气道炎症和重构的影响。方法清洁级SD雄性大鼠24只按随机数字表法分为对照组、哮喘组和阿托伐他汀组,每组8只。对照组大鼠采用0.9%氯化钠溶液(生理盐水)进行致敏和激发,哮喘组大鼠采用卵清白蛋白致敏和激发,阿托伐他汀组在致敏和激发前以阿托伐他汀口服。采用肺功能检测3组大鼠气道呼气阻力;采用图像分析软件测定肺组织切片中的支气管壁内周长、支气管管壁面积、支气管平滑肌面积;胶原表达通过气道壁Masson染色进行观察;实验动物血清中白介素-13(IL-13)及转化生长因子-β1(TGF-β1)的水平以ELISA法测定。结果肺功能检测显示哮喘组平均呼气阻力显著升高,阿托伐他汀组低于哮喘模型组(P<0.05);病理检查显示哮喘组气道炎症明显,对照组和阿托伐他汀组与之相比炎症轻微;阿托伐他汀组大鼠气道管壁面积、平滑肌面积图像分析和哮喘组比较差异有统计学意义(P<0.05);阿托伐他汀组肺组织中胶原沉积表达较哮喘组减少(P<0.05);阿托伐他汀组大鼠血清中IL-13和TGF-β1较哮喘组降低(P<0.05)。结论阿托伐他汀能够明显减轻哮喘大鼠气道炎症,降低哮喘大鼠的气道基本阻力;减少肺组织中胶原沉积,降低气道管壁面积、平滑肌层面积,减轻哮喘气道重构。阿托伐他汀治疗能够降低血清中TGF-β1和IL-13水平,或为其减轻炎症和气道重构的机制。
哮喘;炎症;气道重构;阿托伐他汀;白介素-13;转化生长因子-β1
支气管哮喘是一种以反复发作的喘息、咳嗽、呼吸困难为特征的疾病[1,2]。哮喘的病生理学基础为气道炎症引起的高反应性,随着病情进展可出现内膜、肌层增厚等气道重构改变,造成疾病难以控制。哮喘患者存在Th1/Th2失衡,白介素-13(IL-13)是重要的Th2细胞因子,通过多种途径促进气道炎症和重构,其中IL-13能刺激转化生长因子-β1(TGF-β1)在体内的合成。人体存在多种促纤维化细胞因子,TGF-β1是其中之一,既往研究发现TGF-β1影响气道重构[3-5]。过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPARs),参与调控炎性细胞的趋化和活化,在哮喘患者还影响气道平滑肌细胞和上皮细胞的增殖和活化。有研究表明,应用PPARγ激动剂能够同时抑制气道炎症和气道重构过程[6]。阿托伐他汀除了调节脂代谢以外,还存在一定的抗炎作用,有针对人外周血单核细胞的研究发现,阿托伐他汀增加PPARγ的表达,推测可能与抗炎作用有关[7]。因此推测阿托伐他汀能够抑制气道炎症和气道重构过程。本实验通过成功复制哮喘大鼠模型,并应用阿托伐他汀进行干预,通过观察气道阻力、气道炎症病理改变、气道重构指标、肺组织中胶原沉积及血清中IL-13与TGF-β1的变化。
1 材料与方法
1.1材料
1.1.1动物及分组:健康雄性SD大鼠24只,体重180~220 g,购于河北医科大学动物中心(实验动物许可证号:1505010)。按随机数字表法分为健康对照组、哮喘模型组和阿托伐他汀干预组,每组8只。
1.1.2主要试剂:鸡卵清白蛋白(OVA)购自美国Sigma公司;阿托伐他汀(Liptor,立普妥,美国辉瑞制药公司)购自河北医科大学第二医院;IL-13及 TGF-β1 ELISA试剂盒购自美国R&D公司。
1.2方法
1.2.1模型制作:哮喘组、干预组大鼠于第1天、第7天腹腔注射含OVA 100 mg和氢氧化铝100 mg的混悬液2 ml和百日咳疫苗1 ml进行致敏。于第15天开始将大鼠置于熏箱中雾化吸入OVA进行激发,隔日1次,30 min/次,每激发4次后增加1次OVA浓度(其浓度由1%、1.5%、2%、2.5%、3%逐渐递增),共激发20次。阿托伐他汀干预组,造模同时开始服用阿托伐他汀4 mg·kg-1·d-1,直至整个实验结束外,余与哮喘模型组相同。正常对照组的试验流程与上2组相同,但使用0.9%氯化钠溶液进行致敏与激发。
1.2.2动物肺功能检测:最后1次激发后,用1%戊巴比妥钠(100 mg/kg)腹腔注射麻醉。行颈静脉穿刺留置导管,切开气管行气管插管。连接动物呼吸机进行通气,待呼吸机基线平稳后检测动物肺功能,通过软件计算气道阻力。
1.2.3血清采集及TGF-β1与IL-13的ELISA检测:待2组大鼠在检测完肺功能后将动物处死,打开胸腔右心室穿刺采血,离心(3 000 r/min)10 min,收集血清,冻存于-70℃冰箱待测TGF-β1与IL-13。应用大鼠TGF-β1与IL-13的ELISA检测试剂盒检测其血清水平,步骤按试剂说明书进行。
1.2.4肺组织标本制作:右肺上叶置于4%的甲醛中浸泡24 h,然后将固定好的组织经酒精梯度脱水、二甲苯透明、浸蜡后冷却行石蜡包埋。切片机连续石蜡切片(厚约5 μm),干燥、二甲苯脱蜡,部分切片常规苏木精及伊红(HE)染色。光镜下观察支气管-肺组织病理学变化。
1.2.5Masson染色:肺组织切片脱蜡,丽春红染色2 min,0.2%冰醋酸2 min,5%磷钼酸水溶液2 min,再以0.2%冰醋酸洗2 min,甲基绿染色3 min,自来水冲洗。酒精分色、梯度酒精脱水、透明及封片。染色后的肺组织切片镜下观察病变程度。
1.2.6肺组织切片图像分析:采用麦克迪病理图像分析软件测量分析(厦门麦克迪仪器仪表有限公司)。每张肺组织切片(光镜,×100倍)找到完整的支气管横切面,图像采集系统获取图像。测量支气管壁内周长(Pi)、支气管管壁面积(WAt)和支气管平滑肌面积(WAm),以WAt/ Pi和WAm/ Pi进行比较。

2 结果
2.1气道阻力检测哮喘模型组和阿托伐他汀组大鼠气道基本阻力均高于正常对照组(P<0.05)。阿托伐他汀组低于哮喘模型组(P<0.05)。见表1。
表1各组实验动物气道阻力比较

项目对照组哮喘模型组阿托伐他汀组F值P值气道阻力1.090±0.1521.793±0.164*1.441±0.240*#27.5260.001*#
注:与对照组比较,*P<0.05;与哮喘模型组比较,#P<0.05
2.2病理学改变对照组大鼠支气管黏膜上皮、肌层、肺组织结构完整,支气管管腔规则,无明显炎性细胞浸润。哮喘模型组及阿托伐他汀组大鼠气道黏膜光镜下可见破坏,杯状细胞表达增加,黏液分泌增加,可见明显的炎性细胞浸润,基底膜增厚,平滑肌细胞增殖,阿托伐他汀组较哮喘模型组上述改变明显减轻。见图1。
2.33组WAt/Pi、WAm/pi、胶原沉积比较哮喘模型组和阿托伐他汀组WAt/Pi、WAm/pi、胶原沉积均高于对照组,阿托伐他汀组低于哮喘模型组,差异有统计学意义(P<0.05)。见表2,图2。
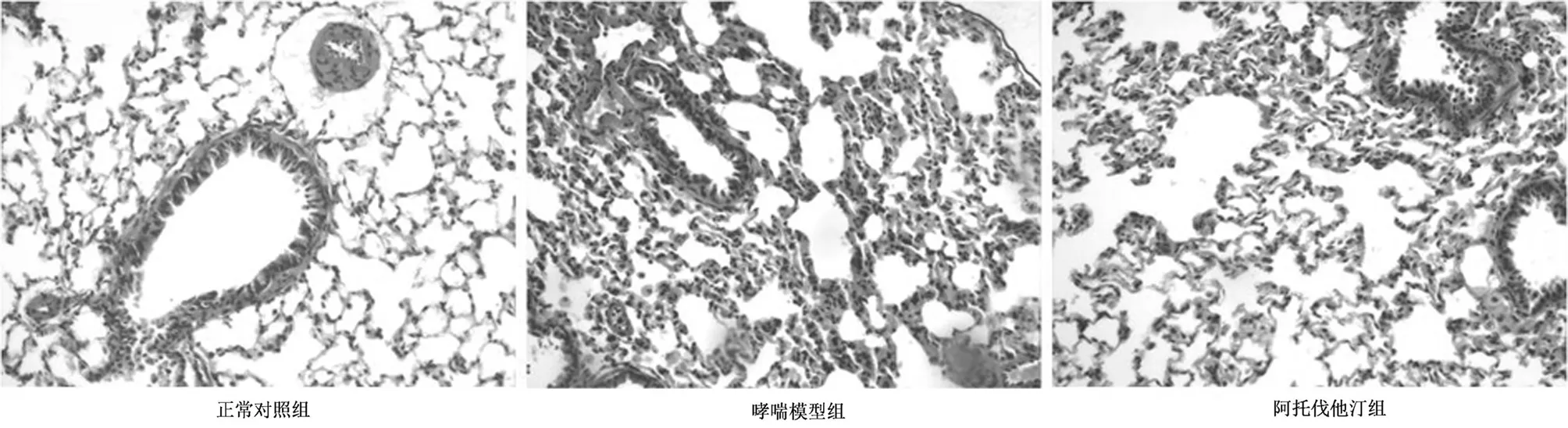
图1 大鼠肺组织(HE×100)

图2 大鼠肺组织(Masson×100)

组别WAt/Pi(μm)WAm/pi(μm)胶原沉积(面密度比值)对照组6.50±0.823.01±0.510.019±0.002哮喘模型组12.48±1.04*5.50±0.92*0.044±0.010*阿托伐他汀组8.81±0.55*#4.40±0.61*#0.032±0.006*# F值106.50325.28227.074 P值0.0010.0010.001
注:与对照组比较,*P<0.05;与哮喘模型组比较,#P<0.05
2.4血清中IL-13、TGF-β1大鼠血清中IL-13、TGF-β1哮喘模型组及阿托伐他汀组均高于正常对照组(P<0.05);阿托伐他汀组低于哮喘模型组(P<0.05)。见表3。
表33组实验动物血清IL-13及TGF-β1的方差分析


组别IL-13TGF-β1对照组30.91±6.5939.95±5.58哮喘模型组49.02±6.31*70.99±12.81*阿托伐他汀组40.45±8.09*#51.64±8.06*# F值13.24322.683 P值0.0010.001
注:与对照组比较,*P<0.05;与哮喘模型组比较,#P<0.05
3 讨论
气道炎症和气道重构是支气管哮喘的基本特征,哮喘发病时气道炎症造成管壁充血、水肿及增厚,平滑肌增生、肥大和基底膜增厚,这些改变造成气道内径减小、阻力大幅度增加,临床上出现咳嗽、喘息及呼吸困难等症征[1,2]。
本研究中,卵蛋白反复激发致敏的大鼠,气道黏膜破坏,杯状细胞表达增加,黏液分泌增加,可见明显的炎性细胞浸润,呈现明显的炎症改变。同时可见基底膜增厚,平滑肌细胞增殖,上述造成所见气道内腔缩窄甚至闭锁。通过病理分析软件,可见哮喘大鼠气道管壁面积、平滑肌面积及肺组织胶原沉积均有显著增加。针对实验动物的肺功能检查,也提示气道阻力较对照组显著增加。
以往研究表明,失控的炎症是造成气道重构的主要原因。许多细胞因子、生长因子均可能参与了哮喘气道重构的病理生理机制。其中,IL-13和TGF-β1在哮喘气道炎症和重构的研究中尤为重要。哮喘患者存在Th1/Th2 失衡,表现为Th1 细胞因子IL-12、IFN2-γ等减少,而TH2细胞因子IL-4、IL-13明显增高[3]。TGF-β1是体内重要的促纤维化细胞因子,可能通过上皮细胞损伤、黏液腺与杯状细胞增生、上皮下纤维化、气道平滑肌细胞增生以及微环境重构等多个环节与途径影响气道重构[4]。因此,推测IL-13或许通过刺激TGF-β1表达参与气道重构的发生发展[5]。本研究中,大鼠血清中IL-13及TGF-β1含量在哮喘模型组较正常对照组显著升高,病理学可见气道炎症、支气管管壁面积、气道平滑肌面积及肺组织胶原沉积也显示相同趋势,进一步验证了二者或在气道炎症乃至重构中起重要作用。
支气管哮喘时PPARs(尤其是PPARγ)参与调控炎性细胞的趋化和活化,影响气道平滑肌细胞和上皮细胞的增殖和活化,可能参与了哮喘发病的过程。应用PPARγ激动剂能够同时抑制气道炎症和气道重构,可作为哮喘治疗的新靶点,有望成为一类新型的抗哮喘药物[6]。有研究发现他汀类药物能增加人外周血单核细胞上PPARγ的表达,提示其抗炎作用可能与激活PPARγ的表达有关[7]。因此,推测阿托伐他汀能够抑制气道炎症和气道重构过程。近年来,关于他汀类药物对于哮喘的研究逐渐增多,认为可他汀类药物通过多种途径产生抗炎作用[8,9]。
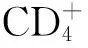
成人肥胖型哮喘是一种特殊类型的哮喘,常常治疗效果不佳,Linderholm等认为在常规药物治疗的同时,加用二甲双弧和(或)他汀类药物可以改善气道炎症,从而改善疗效[13]。流行病学资料显示,肥胖和哮喘发病之间存在联系,同时针对其他代谢综合征的研究也发现了与哮喘之间的复杂关系,因此作为代谢综合征常用的他汀类药物,其对于哮喘的影响值得重视[14]。虽然他汀类对于哮喘的影响机制尚未完全明了,Huang等[15]的研究中3 965例服用他汀类药物的哮喘患者与7 843例病情相当的患者进行对照,发现他汀类药物可以有效减少哮喘急性发作引起的住院需求。
本研究中,阿托伐他汀干预组大鼠肺功能气道阻力较哮喘模型组显著降低,病理学分析可见气道炎症显著改善,对支气管管壁面积、气道平滑肌面积及肺组织胶原沉积的图像分析也显示相同的减低趋势,提示阿托伐他汀干预改善了卵蛋白反复激发致敏大鼠的气道炎症及重构过程。检测大鼠血清IL-13及TGF-β1水平较哮喘模型组明显降低,进而可以推测阿托伐他汀或许通过上调PPARγ的表达,进而影响IL-13及TGF-β1的代谢,并最终改善了气道炎症和重构。
总之,阿托伐他汀可能通过上调IL-13及TGF-β1的表达,从而产生了对于哮喘气道炎症和重构的调节作用,其机制有待更深入的研究揭示。
1中华医学会儿科学分会呼吸学组,中华儿科杂志编辑委员会.儿童支气管哮喘诊断与防治指南(2016年版).中华儿科杂志,2016,54:167-181.
2中华医学会呼吸病学分会哮喘学组.中华医学会全科医学分会.中国支气管哮喘防治指南(基层版)中华结核和呼吸杂志,2013,36:331-336.
3Albano GD,Zhao J,Etling EB,et al. IL-13desensitizesβ2-adrenergic receptors in human airway epithelial cells through a 15-lipoxygenase/G proteinreceptor kinase2 mechanism. J Allergy Clin Immunol,2015,135:1144-1153.
4Cho SH,Lee SH,Kato A,et al. Cross-talk between human mast cells and bronchial epithelial cells in plasminogen activator inhibitor-1 production via transforming growth factor-β1. Am J Respir Cell Mol Biol,2015,52:88-95.
5Ma Y,Halayko AJ,Basu S,et al. Sustained suppression of il-13 by a vaccine attenuated airway inflammation and remodeling in mice. Am J Respir Cell Mol Biol,2013,48:540-549.
6Li W,Dai W,Sun J,et al. Association ofperoxisome proliferator-activated receptor-gammagene polymorphisms and gene-gene interaction withasthmarisk in a Chinese adults population. Int J Clin Exp Med,2015,15:19346-19352.
7Shen Y,Wu H,Wang C, et al. Simvastatin attenuates cardiopulmonary bypass-induced myocardial inflammatory injury in rats by activating peroxisome proliferator-activated receptor γ. European Journal of Pharmacology,2010,649: 255-262.
8Bhattacharjee D,Chogtu B,Magazine R. Statins in Asthma:Potential Beneficial Effects and Limitations. Pulm Med,2015,2015: 835204.
9Liu JN,Suh DH,Yang EM, et al. Attenuation of airway inflammation by simvastatin and the implications for asthma treatment: is the jury still out.Exp Mol Med,2014,46:e113.
10Zeki AA,Bratt JM,Chang KY,et al. Intratracheal instillation of pravastatin for the treatment of murine allergic asthma: a lung-targeted approach to deliver statins. Physiol Rep,2015,11: e12352.
11Zeki AA,Bratt JM,Rabowsky M,et al. Simvastatin inhibits goblet cell hyperplasia andlungarginasein a mouse model of allergic asthma: a novel treatment for airway remodeling.Transl Res,2010,156:335-349.
12Maneechotesuwan K,Kasetsinsombat K,Wamanuttajinda V, et al. Statins enhance the effects of corticosteroids on the balance betweenregulatory T cells and Th17 cells. Clin Exp Allergy,2013,43:212-222.
13Linderholm AL,Bratt JM,Schuster GU,et al. Noveltherapeutic strategiesforadultobeseasthmatics. Immunol Allergy Clin North Am,2014,34:809-823.
14Serafino-Agrusa L,Spatafora M,Scichilone N. Asthma and metabolic syndrome: Current knowledge and future perspectives. World J Clin Cases,2015,16:285-292.
15Huang CC,Chan WL,Chen YC,et al. Statin use in patients with asthma: a nationwide population-based study. Eur J Clin Invest,2011,41:507-512.
Effects of atorvastatin on airway inflammation and airway remodeling in rats with asthma
PANWensen,YUJinxiang,GUYing,etal.
TheSecondDepartmentofRespiratorydiseases,TheSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China
ObjectiveTo observe the effects of atorvastatin on airway inflammation and airway remodeling in rats with asthma caused by ovalbumin.MethodsTwenty-four male SD rats were randomly divided into three groups:control group, asthma model group and atorvastatin group,with 8 rats in each group. The rats in control group were given 0.9% sodium chloride solution, the rats in asthma model group were sensitized and stimulated by ovalbumin, however,the rats in atorvastatin group were given orally atorvastatin before sensitization. The airway expiratory resistance was detected by pulmonary function test for the three groups,and the inner circumference and area of bronchus wall,the area of tracheal smooth muscle were measured by image analysis software. The airway collagen deposition was detected by Masson stainingand,and the serum levels of interleukin-13 (IL-13) and transforming growth factorβ1 (TGF-β1) were measured by ELISA.ResultsThe average expiratory resistance in asthma model group was significantly higher than that in control group and atorvastatin group (P<0.05).The pathological examination showed that the airway inflammation in asthma model group was more obvious than that in control group and atorvastatin group.There were significant differences in the area of bronchus wall and the area of tracheal smooth muscle between atorvastatin group and asthma model group (P<0.05).The collagen deposition in pulmonary tissues in atorvastatin group was significantly decreased,as compared with that in asthma model group (P<0.05). The expression levels of IL-13 and TGF-β1in atorvastatin group were significantly decreased,as compared with those in asthma model group (P<0.05).ConclusionAtorvastatin can obviously relieve the airway inflammation and decrease airway basic resistance in rats with asthma,moreover,which can lessen the collagen deposition in lung tissues and decrease the area of bronchus wall and area of tracheal smooth muscle to alleviate airway remodeling.Moreover atorvastatin can decrease the expression levels of IL-13 and TGF-β1, which may be the action mechanism in alleviating inflammation and airway remodeling.
asthma;inflammation; airway remodeling; atorvastatin; interleukin-13; transforming growth factor β1
10.3969/j.issn.1002-7386.2016.18.001
050000石家庄市,河北医科大学第二医院呼吸二科
R 562.25
A
1002-7386(2016)18-2725-04
2016-02-16)
项目来源:河北省医学科学研究重点课题(编号:20100068)
