TGF-/Smad传导通路与慢性移植性肾肾病相关性研究
2016-09-19祁洪刚陈亮亮李毛毛姚许平翁国斌
祁洪刚,陈亮亮,李毛毛,姚许平,翁国斌
祁洪刚,陈亮亮,李毛毛,姚许平,翁国斌
目前慢性移植肾肾病(CAN)被认为是在组织学上表现为移植肾病理慢性损伤,即CAN仅特指移植肾出现缺血性肾小球病(肾小球硬化)、动脉血管纤维性内膜增厚、肾小管萎缩及肾间质纤维化等主要的组织病理学特征,而没有其他特殊疾病。CAN仅仅代表了移植肾功能不全的最终结局,它既不是一种疾病,也不是病因诊断,而是导致移植后期肾功能丧失的主要原因[1]。目前CAN的发病机制还未阐明,转化生长因子(TGF-)在CAN发病中作为最关键的促纤维化细胞因子的作用目前还未研究清楚,但其在CAN发病机制中的作用不容忽视,近年国内外研究显示TGF-高表达水平与CAN纤维化表现进程密切相关,经证实CAN纤维化进程与TGF-高表达有关。Smad蛋白是TGF-下游信号的重要转导分子,介导了TGF-的胞内信号转导。本文对TGF-/Smad信号通路在CAN发病中的作用和最新研究进展作一综述。
1 TGF-和Smad蛋白
1.1 TGF-分子结构及其受体 转化生长因子 (TGF-)是转化生长因子超家族成员之一,其分布于多种组织细胞内,属于一种多功能的细胞调节蛋白,哺乳动物组织中TGF-存在3种亚单位,分别是TGF-1,TGF-2及TGF-3。它们由不同的染色体编码而成,由不同的细胞分泌和表达,其分布具有一定的组织特异性。TGF-1在肾脏组织表达最多,且主要存在于肾小管上皮和肾小球,在哺乳动物的发育和机体功能平衡方面发挥重要作用。TGF-与受体的结合是TGF-/Smad信号转导的第一步,TGF-受体有5型,其中参与该信号转导的主要有I型和Ⅱ型受体,属丝/苏氨酸激酶受体家族,它由胞外区、跨膜区及含丝-苏氨酸激酶结构的胞质3部分组成,其中I、II型受体与细胞内信号转导有关,III型受体分膜结合型和游离型,前者无信号传递活性,但能增加II型受体与TGF-的亲和力,后者结合后阻止TGF-与靶位点的结合,从而干扰了TGF-的生物活性,Ⅳ型、V型受体的作用目前尚不清楚。TGF-1型受体活化是 TGF-信号转导的起点和关键步骤,而Smad蛋白是目前所知的惟一的TGF-受体的胞内激酶底物。
1.2 Smad蛋白的结构、分类与功能Smad是一种分子量为42~60kD的蛋白质,其在蛋白质分子的N端和C端有两个结构域:分别为MH1和MH2区,其间有富含脯氨酸的间隔区,在无活性状态下,MH1和MH2相互接触,使其形成无活性构象,Smad家族蛋白是参与TGF-在细胞内信号转导的一种重要细胞因子。目前哺乳类动物中发现的Smad蛋白有9种,分别用Smad l~9表示[2]。根据Smad蛋白家族结构和功能的特点,其可分为3类:(1)受体调节型Smads蛋白(R-Smads)包括 Smad1、Smad2、Smad3、Smad5和Smad8。(2)共同调节型Smads蛋白(Co-Smads),即Smad4。(3)抑制性型Smads蛋白(anti-Smads),包括Smad6和Smad7。其中Smad2、3、4、7蛋白参与TGF-/Smad信号转导过程,Smad2、3主要参与TGF-信号转导,Smad4是TGF-信号转导过程中共同需要的介质,Smad6、7可与TGF-I型受体结合,结合反应的稳定性比R-Smad更强,从而限制R-Smad被磷酸化,抑制TGF-信号通路[3]。Smad蛋白在其功能上表现的十分复杂。同一类Smad蛋白其功能也并非是完全相同的,即使同一种Smad蛋白,其在不同细胞或不同微环境下其作用也不同的。这种复杂性导致TGF-功能的多样性。Smad蛋白结合于靶基因启动子特定区域Smad蛋白转录复合物调节转录活性是通过直接招募转录合作激活因子或抑制因子而得以实现的[4]。除此之外,还存在另外一些调节方式,如Smad蛋白与DNA结合因子合作调节自身基因的表达和Smad蛋白直接与激活因子或者抑制因子作用等[5]。Smad蛋白可以通过广泛地与辅助激活因子相互作用,将各种激活信号进行整合。白细胞抑制因子(LIF)通过与骨形态发生蛋白-2(BMP2)协作诱导星形胶质细胞分化过程,刺激结合于它们信号通路下游 P300不同部位的信号传导与转录激活因子-3(STAT3)和Smadl,于整合信号后诱导胶质纤维酸性蛋白基因启动子激活来获得实现[6]。TGF-通过Smad蛋白所介导的胞内信号转导可增加P15和P21的转录,这些蛋白与细胞周期蛋白或细胞周期蛋白依赖性激酶相结合并使之失活,使细胞周期停滞在G期,并诱导细胞凋亡。所以TGF-信号通路发生缺陷将导致肿瘤发生。
2 TGF-/Smad信号通路的路径
TGF-受体复合物活化后促进Smad蛋白磷酸化是 TGF-/Smad信号转导通路中最为关键的一步,与Smad蛋白信号传导有关的TGF-超家族成员有TGF-1和TGF-Ⅱ两种受体,这两种受体均有丝/苏氨酸激酶活性,TGF-信号转导由 TGF-配体首先与细胞表面的TGF-Ⅱ型受体结合,形成复合物,再激活TGF-I型受体的丝/苏氨酸残基磷酸化,形成异源三聚体,磷酸化的TGF-受体I(TBRI)可结合并磷酸化R-Smad (Smad2和 Smad3),从而解除了 RSmads蛋白N端MH1区和C端MH2的相互抑制作用,与I型受体分离,激活Smad2和Smad3蛋白才与Smad4结合形成活性的异聚体转录复合物,转位进入细胞核,这样才将信号从胞质转导到细胞核,磷酸化的R-Smad和Smad4复合物入核后并和其他的核协同或抑制因子结合后以不同方式调节转录活动[7]。在TGF-/Smad信号转导通路机制的调控下,TGF-1主要是通过其下游因子Smad2、3、7等参与纤维化的信号转导过程。Smad蛋白是TGF-受体的胞内激酶底物,当R-Smad(Smad2、Smad3)表达增高,对纤维化的信号转导过程起到正调节作用;而I-Smad(Smad7)表达增高,则起到负性调节作用;除此之外,上述复合物还可以通过激活细胞核内细胞外基质(ECM)成分如各型胶原、纤维粘连蛋白等启动子的活性,从而增加ECM合成并沉积[8]。I-Smad(Smad7)可以通过两种不同途径发挥其负性调节作用:一方面是可竞争性的与 TGF-I型受体结合,抑制R-Smads(Smad2、Smad3)磷酸化,阻止受体复合物的形成及转核入位,从而对TGF-信号转导通路起到负反馈调节作用;另一方面是通过与Smad泛素化调节因子(sumrf)结合,smurf是一种泛素连接酶,包括smurfl、smurf2等,smurfl、smurf2结合 I-Smads的能力比结合 RSmads强得多[9],Smad7可通过与smurf2结合使其变构激活,激活了的smurf2通过泛素化降解TGF-受体[10],从而达到对TGF-通路的负反馈抑制作用。
3 TGF-/Smad信号通路与CAN相关性
CAN的病因可分为免疫性和非免疫性因素两大类。其中免疫因素如移植物急、慢性排斥反应及人类白细胞抗原(HLA)配型不合等;非免疫因素如供受者在性别、年龄、体重、身高等相关因素不匹配,缺血再灌注损伤、高血压、高血脂、高血糖、免疫抑制剂的肾脏毒性作用和巨细胞病毒感染等。同种异体肾移植后,机体为了修复损伤,移植物的内皮和上皮细胞就会产生TGF-和结缔组织生长因子(CTGF)等,通过这些细胞因子来修复损伤。体外实验或动物模型实验表明几乎导致CAN发生发展的所有危险因素都能影响 TGF-的表达,这表明TGF-在 CAN的形成和发展中起到非常重要的作用。
3.1 肾移植排斥反应对TGF-/Smad信号通路的影响 在CAN的各种危险因素中机体持续的免疫应答状态是导致移植物失败的主要原因。在肾移植后机体发生急、慢性排斥反应时,机体内TGF-表达均明显高于正常人。急性排斥反应时,TGF-主要在肾小管间质区内表达,而慢性时则主要在肾小管间质和肾小球细胞内表达。发生急性排斥反应时肾小管间质区的TGF-及其受体的表达水平均明显增加,而发生慢性排斥反应时,在移植肾的皮质区内TGF-及基质蛋白则会过度表达。有研究发现,进行过同种异体肾移植的患者,如果对肿瘤坏死因子表现为遗传性的高反应性状态时,那么该患者也将处于急性排异反应的高危险状态[11]。在对上述移植患者进行TCF-基因型的分析后发现,该患者倘若同时也是遗传性的高 TGF-表达者,那么其发生急性排异反应的危险性将增加4倍以上,而发生可的松抗性的急性排异反应的危险性也将明显增加。如果移植肾供体同样也是高TGF-表达者,那么其发生急性排异反应和可的松抗性排异反应的危险性会更高[11]。研究者对100例肾移植患者进行了长达5年的跟踪随访,发现肾移植患者中有9例发生 CAN。检查发现这9例患者均为TGF-高表达者。而且,在这9例患者的供体中,有8例供体也同样是高TGF-表达者[11]。有关研究显示有高TGF-表达的肾移植患者,不管其TGF-来自肾移植物本身或浸润的受体细胞内,发现其都与患者发生CAN有关。同样的慢性排斥反应结果也出现在心、肺等器官移植患者[12-13]。
3.2 免疫抑制药物对TGF-/Smad信号通路的影响 TGF-在多细胞动物的发育和体内功能平衡方面发挥着重要的作用,TGF-1在机体内有促进和抑制细胞增殖生长的双重生物学作用。小剂量的TGF-1具有促使机体发生炎症反应以及抑制体内淋巴细胞激活的作用,因此其对机体具有免疫抑制特性;在高浓度时,TGF-具有促进机体创伤愈合和纤维化过程。他导致纤维母细胞向创伤部位迁移,并且抑制机体内的胶原酶和其它金属蛋白酶的活性,从而增加胶原产生,降低胶原降解,促进细胞基质大量沉积,最终引起移植器官纤维化及动脉粥样硬化等[14-15]。因为TGF-1在机体内具有较强的免疫抑制作用,在器官移植术后前6个月内,机体内TGF-1的增加对移植物的生存是非常重要的,其能使移植物发生急性排斥反应的概率大大降低。近来研究也证实了TGF-1是环孢素肾毒性所致CAN的重要介质。环孢素可刺激机体TGF-1的合成与表达,引起细胞外基质沉积及纤维化过程[16]。在体外实验中,雷帕霉素同样可增加淋巴细胞和其它细胞株 TGF-的表达,Viklicky等[17]研究证实,在用Fisher和Lewis大鼠建立的CAN模型中,40-氧-2-羟乙基-雷帕霉素(SDZ-RAD)治疗能明显减少TGF-1、碱性成纤维细胞生长因子(bFGF)和血小板源性生长因子(PDGF)基因表达,从而明显减轻CAN病理进程。大量体内外实验研究都已证明TGF-参与CAN的纤维化过程,介导成纤维细胞增生和基质蛋白合成。
3.3 TGF-/Smad信号通路在肾纤维化中的作用 肾小球硬化和肾间质纤维化(肾脏纤维化)是各种原因所致肾疾病进展到终末期的共同病理表现,也是决定肾脏疾病进展的主要因素。虽然TGF-、自介素-a及 、血小板衍生长因子(PDGF)和肿瘤坏死因子a(TNF-a)等多种细胞因子在机体内都具有致纤维化作用。但其中TGF-是最主要的一种致纤维化的细胞因子,其在肾小球硬化和肾间质纤维化形成的各个环节都起到非常重要的作用。Li等[18]通过动物实验发现,在正常大鼠肾小管上皮细胞系(NRK52E)中,TGF-可随着剂量的增加和时间延长会逐步诱导Smad2磷酸化。从而增加I、Ⅲ和Ⅳ型胶原的表达。使肾小管上皮细胞逐渐(TEC)向肌成纤维细胞(MFB)表型转化。Lan等[19]研究发现,UU0模型大鼠与正常大鼠相比,其肾脏内Smad2和Smad3的表达升高6倍,并伴随明显的肾小管间质和肾小球的纤维化,而Smad7的表达则显著降低,提示TGF-/Smad信号转导通路具有促使组织器官发生纤维化的作用。
4 针对TGF-/Smad信号通路的CAN治疗和展望
目前研究认为CAN与组织纤维化过程有着密切的关联,TGF-/Smad信号通路在复杂的纤维化发病机制中发挥着中枢和主导作用,所以该通路在CAN的发病中具有重要作用,故可以通过控制该传导通路的激活因素,阻断该信号通路中的关键步骤,使其信号不能下传以及上调负反馈调节机制等多方来面来延缓或阻止CAN的发生发展。在器官移植后发生的各种急慢性排斥反应中,研究发现其中Smads蛋白与TGF-的信号转导关系密切,结合 Smads,尤其是Smad4,怎样通过调节Smads对TGF-的水平进行调节,是今后研究的方向[20]。在各种动物模型中已经证实给予重组的TGF-l,会导致其肾小球硬化和肾间质纤维化,而给予其TGF-l拮抗剂则可阻止或改善纤维化进程。在啮齿动物中,发现用腺病毒转染 Smad7可阻止肺和肾纤维化的进展,这表明可以通过上调患者体内 Smad7的表达来延缓或阻止纤维化,这可能是将来一种治疗纤维化的有效手段[21]。在器官移植领域,有关Smads在CAN中的研究才刚刚起步。鉴于TGF-在CAN中修复各种危险因素引起损伤中的重要调控作用,加强对Smads的研究,将有助于从细胞内信号转导和基因表达调控水平阐明TGF-在CAN中作用的分子机制和CAN的发病机制,并为开辟防治慢性移植性肾肾病的新途径提供理论和实验依据。
[1] Ponticelli C,Villa M,Cesana B,et al.Risk factors for late kidney allograft failure[J]. Kidney Int,2002,62(5):1848-1854.
[2] Schnaper HW,Hayashida T,Poncelet AC. It's a Smad word:regulation of TGF-signaling in the kidney[J].J Am SocNephrol, 2002,13(4):1126-1128.
[3] Javelaud D,M auvie A.Transforming gro-wth factor-betas Smad signaling and roles in physiopathology[J].PatholBiol,2004, 52(4):50-54.
[4] Itman C,Loveland KL.SMAD expression in the testis:an insight into BMP regulation of spermatogenesis[J].Dev Dyn,2008,237 (1):97-111.
[5]Lee MY,Lim HW,Lee SH,eta1.Smad,Pl3K/ Akt,and Wnt-dependent signaling pathways are involved in BMP-4-induced ESC self-renewal[J].Stem Cells,2009,27(8):1858-1868.
[6] Ohta S,Mansour SL,Schoenwolf GC.B MP/SMAD signaling regulates the cell beha-viors that drive the initial dorsal-specific regi-onal morphogenesis of the otocyst[J].Dev Biol, 2010,347(2):369-381.
[7] Guannan Wang,Jianyin Long.The Smad3 linker region contains a transcriptional ac-tivation domain[J].BiochemJ,2005,386(PT1): 29-34.
[8] Runyan CE,Schnaper HW,Poncelet AC. Smad3 and PKC delta mediate TGF-betal induced collage I expression in human mes-angial cells[J].Am J Physiol Renal Physioh,2003,285(3):F413-422.
[9] OgunjinI A A,Briant D J.Pece-Barbarav N, et a1.Regulation of Smurf2 ubiquitin liga-se activity by anchoringthe E2 to cheHECTdo-main[J].MolCell,2005,19(3):297-308.
[10]Seo SR,Lallem F,Ferrand N,et al.The nov-el E3 ubiquitin ligase T iull associates with TG I F totarget Smad2 fordegradation[J]. EMBOJ,2004,23(19):3780-3792.
[11]Sankaran D,Asderakis A,Ashraf S,et al. Cytokine gene polymorphisms predict ac-ute graft rejection following renal transplantation[J].Kinney Int,1999,56(1):218-288.
[12]Densem CG,Hutchinson IV,Cooper A,et al. Polymorphism of the transforming growth factor beta1 gene correlates with the develop-ment of coronary vasculopathy following car-diac transplantation[J].J Heart Lung Trans plant,2000,19(6):551-556.
[13]Arkwright PD,Lanie S,Super M,et al.Hu-tchinsonIV(2000)TGF-1genotype and ac-celerated decline in lung function of patients with cystic fibrosis[J].Thorax,2000,55(6): 459-462.
[14]薛爱民,吴慧娟,张志刚,等.r-干扰素对大鼠肾系膜细胞转化生长因子 、Smad信号通路和基质金属蛋白酶2及其组织抑制因子2表达的影响[J].中华病理学杂志,2007,36(6):405-409.
[15]Ruiz OM,Rodriguez VJ,Sanchez LE,et a1. TGF-signaling in vascular fibrosis[J]. Cardiovasc Res,2007,74(2):196-206.
[16]Akool ES,Doller A,Babelova A,et a1.Molecular mechanisms of TGF beta receptor-triggered signaling cascades rapidly induced by the calcineurin inhibitors eyclosporin A and FKS06[J].J Imm unol,2008,181(4): 2831-2845.
[17]Viklicky O,Zou H,Muller V,et a1.SDZRAD prevents manifestation of chronic re-jection in a rat renal allografts[J].Transplantation,2000,69(4):497-503.
[18]Li JH,Zhu HJ,Huang XR,et a1.Smad7 inhibits fibrotic effect of TGF-on renal tubular epithelial cells by blocking Smad2 activation[J].J Am Soc Nephrol,2002,13 (6):1464-1472.
[19]Lan HY,Mu W,Tomita N,et a1.Inhibition of renal fibrosis by gen e transfer of inducible Smad7using ultrasound-micro-bubble system in rat UU0 model[J].J Am Soc Nephrol,2003,14(6):1535-1548.
[20]徐新保,何振平.TGF-,Smad家族与器官移植免疫和器官纤维化[J].国外医学生理、病理科学与临床分册,2001,21(5): 403-404.
[21]Teruda Y,Hanada S,Nakao A,et al.Gene transfer of Smad7 using lectroporation of adenovirus prevents renal fibrosis in post-obstructed kidney[J].Kidney Int,2002,61 (Supp1):94-98.
徐曙光,吴宏成,吴仕波,等.硅酮支架及T管治疗气道瘢痕性狭窄5例分析(见正文第13页)
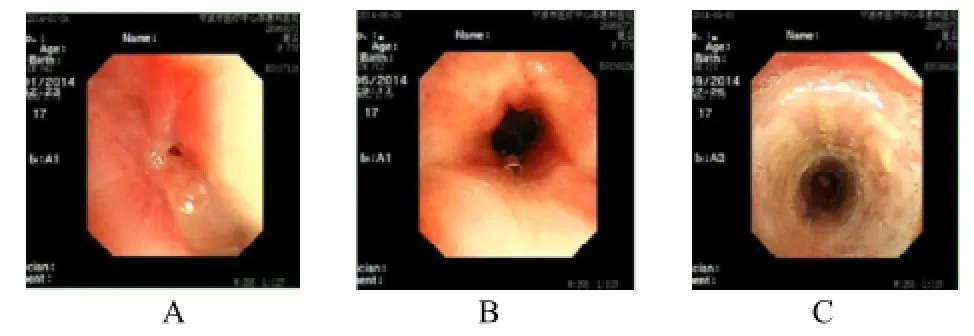
图1 女,77岁,气管瘢痕性狭窄。

图2 ~4 男,36岁,气管瘢痕性狭窄。
张可静,李桃红,金雨虹,等.肺上皮细胞钙超载在急性呼吸窘迫综合征发生中的机制研究(见正文第20页)
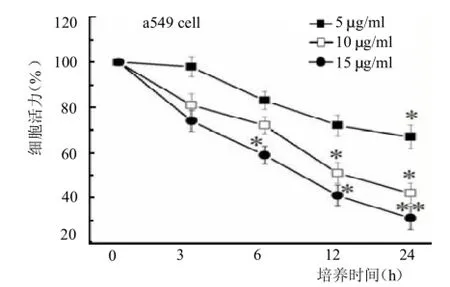
图5 LPS对肺泡上皮细胞增殖的影响

图6 LPS对细胞钙离子内流的影响
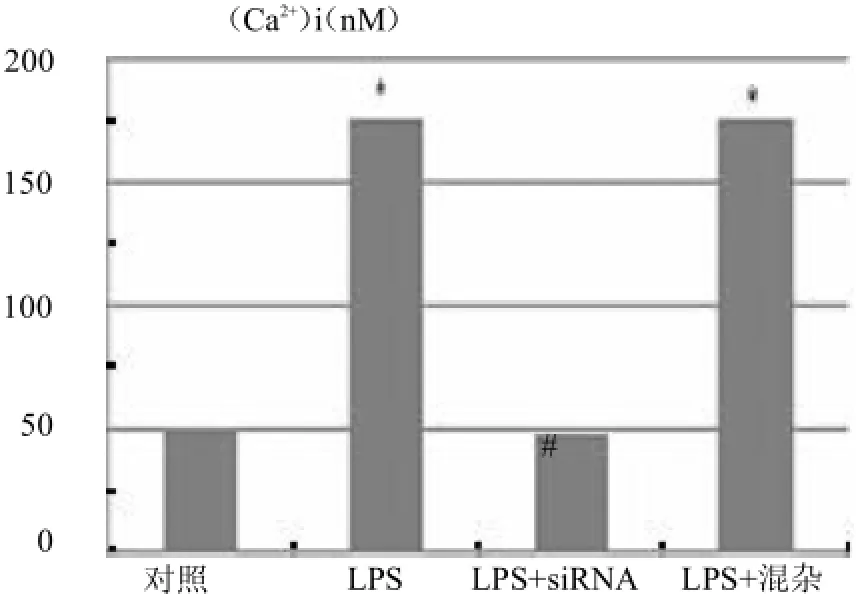
图7 CaSR活化与钙之间的关系

图8 CaSR活化与细胞增殖间的联系
朱晔晶,彭宁,凌杰,等.高温诱导人ECV304的凋亡及其信号传导通路(见正文第26页)

图9 不同温度处理诱导的人ECV304细胞凋亡核形态学比较(Hoechst33342/PI荧光染色)
蔡艳,汪期明,黄勇.子宫切除术同时切除双侧输卵管对卵巢功能中远期影响的系统评价(见正文第78页)

图1 (a) 术后6个月FSH水平

图1 (b) 术后12个月FSH水平

图2 (a) 术后6个月LH水平

图2 (b) 术后12个月LH水平
10.3969/j.issn.1671-0800.2015.01.074
R692
C
1671-0800(2015)01-0137-04
2015-07-10(本文编辑:吴迪汉)
315100宁波,宁波市鄞州区第二医院
翁国斌,Email:wgb@ nbyzyy.com
