不同实验室ELISA检测系统对HCV抗体测定的可比性研究*
2016-09-16曾艳华卢香云张朝霞
曾艳华,卢香云,张 丽,张朝霞△,程 江
(1.新疆医科大学第一附属医院医学检验中心,乌鲁木齐 830054;2.石河子大学第一附属医院检验科,新疆石河子 832000)
不同实验室ELISA检测系统对HCV抗体测定的可比性研究*
曾艳华1,卢香云2#,张丽1,张朝霞1△,程江2▲
(1.新疆医科大学第一附属医院医学检验中心,乌鲁木齐 830054;2.石河子大学第一附属医院检验科,新疆石河子 832000)
目的探讨不同实验室酶联免疫吸附试验(ELISA)对丙型肝炎病毒抗体(HCV抗体)测定结果的可比性,为不同实验室之间检验结果的互认提供实验依据。 方法参照美国临床实验室标准化协会(CLSI) EP12-A2文件,收集100例新鲜血清标本,其中50例HCV抗体初筛阳性,50例HCV抗体初筛阴性,两家医院均采用国产addcare ELISA 1100全自动酶免分析系统(简称addcare ELISA 1100)随机盲法检测HCV抗体,同时用重组免疫印迹试验(RIBA)和聚合酶链反应(PCR)进行确认,通过比较两家医院的符合率,判断测定结果的可比性。 结果两家医院实验室间检测临床标本HCV抗体的敏感度和特异度均相同,分别为100%和96%;阳性符合率100%,阴性符合率100%,总符合率100%,差异无统计学意义(P>0.05)。 结论不同医院实验室采用不同检测系统检测HCV抗体,在仪器性能良好的情况下,根据自建Cut-off值判断检测结果,其测定结果具有可比性,达到检验结果的互认。
丙型肝炎抗体;酶联免疫吸附测定;重组免疫印迹法;聚合酶链反应;符合率
丙型肝炎病毒(hepatitis C virus,HCV)感染被认为是全球公共卫生安全的主要威胁之一,并可以导致急、慢性肝脏疾病[1]。前瞻性研究结果显示,80%的急性丙型肝炎患者将发展为慢性感染,10%~20%的感染者将出现慢性肝脏疾病并发症,且在20~30年内出现临床症状如肝硬化,1%~5%的患者将发展为肝细胞癌[2]。HCV感染所致的病死率将在未来20年呈持续上升趋势[3]。因此,准确、及时地对丙型肝炎患者进行早期诊断、治疗,是防止疾病慢性化,从而控制并治愈疾病的关键。
随着检验医学的发展,检测系统逐渐多样化、规模化,不同实验室拥有多种品牌或同一品牌多台仪器的情况十分普遍。由于不同检测系统的检测结果可能存在不可比性,因此,医学实验室认可的两个国际标准ISO/IEC 17025(检测和校准实验室能力的通用要求)和ISO/15189(医学实验室质量和能力的专用要求)都对检验结果的溯源性和可比性提出了明确要求,强调方法学比较试验(比对试验)是实现准确度溯源和患者标本检验结果可比性的重要途径[4]。本研究参考美国临床实验室标准化协会(CLSI)的EP12-A2文件,对不同医院实验室HCV抗体测定结果进行分析,通过比较符合率,判断结果的可比性。
1 材料与方法
1.1标本收集2014年6月至2014年7月新疆医科大学第一附属医院医学检验中心门诊和住院患者血清标本共100例,其中酶联免疫吸附试验(ELISA)初筛HCV抗体 50例阳性,50例阴性,各分离两份血清置于-80 ℃冰箱保存待测。
1.2仪器与试剂医院1(新疆医科大学第一附属医院)使用仪器:国产addcare ELISA 1100全自动酶免分析系统(简称addcare ELISA 1100,烟台生物科技有限公司);BIO-RAD iCycler 扩增仪;使用试剂:抗HCV诊断试剂盒ELISA,由北京万泰生物药业股份有限公司提供(批号C20140408);HCV抗体确证试剂盒重组免疫印迹法(recombinant immunoblot assay,RIBA)由北京万泰生物药业股份有限公司提供(批号RC20130101);HCV-RNA检测采用中山大学达安基因股份有限公司生产的HCV基因分型检测试剂盒(批号2014003)。医院2(石河子大学第一附属医院)所用酶免仪及型号与医院1相同,试剂由上海科华生物工程股份有限公司提供(批号201404011)。所有试剂均在有效期内使用,并严格按照试剂盒说明书进行实验操作。
1.3方法
1.3.1仪器准备2台仪器在实验前均进行日常维护保养,确定其处于良好状态。
1.3.2精密度验证批内精密度:分别取高、中、低3个浓度的样本,在一批检测内,重复检测20次(孔),计算所得吸光度(A)值的均值和标准差,计算批内变异系数(CV)。批间精密度:在10 d以上时间内单次(孔或管)重复进行20批检测,计算所得A值的均值和标准差,计算批间CV。批内精密度可接受范围为CV≤10%,批间精密度可接受范围为CV≤15%。
1.3.3临界值(Cut-off值)验证准备具有Cut-off值浓度和浓度在Cut-off值±20%的样本,重复测定每个样本20次,计算出样本的阴性和阳性百分比。Cut-off值浓度的样本重复测定应有50%阳性和50%阴性结果,Cut-off值+20%浓度的标本检测阳性率大于或等于95%,且Cut-off值-20%浓度的标本检测阴性率大于或等于95%,此时,标本浓度在Cut-off值±20%浓度范围之外就能得到稳定的检测结果。
1.3.4灰区的确定方法:CO±2S,其中CO是检测仪器的Cut-off值,S为实验室做室内质控ROC的S。
1.3.5标本检测对-80 ℃保存待测的100份(初筛50例阳性,50例阴性)血清标本根据随机数字表进行随机编号,用HCV抗体诊断试剂ELISA盲法分10 d进行检测,同时用RIBA进行确认,RIBA检测不确定的标本用聚合酶链反应(PCR)检测,记录A值及确认结果。
1.3.6PCR及RIBA结果判断标准PCR判断标准:当样本的HCV-RNA浓度小于1×103IU/mL为阴性,≥1×103IU/mL为阳性。对于RIBA检测为阳性及阴性的样本,直接报告为HCV抗体阳性或阴性;对于RIBA检测不确定的标本,用PCR进行检测,当PCR检测为阳性时,报告为阳性,当PCR检测为阴性时,报告为不确定。
1.3.7质量控制HCV抗体诊断试剂盒每一批分别设定1个空白对照、2个阴性对照、2个阳性对照和一个质控孔,其中阴性对照孔A≤0.08,阳性对照孔A≥0.50,否则实验无效;质控孔S/CO值为2.39~4.96。HCV抗体确证试剂盒每一批分别设定1个阴性对照和1个阳性对照,其中阴性对照出现对照线-1和对照线-2,阳性对照出现Core、NS3、NS4-1、NS4-2、NS5、对照线-1和对照线-2,且每条试验结果中对照线-1和对照线-2均必须出现,如果对照线-1和对照线-2均不出现或仅出现1条,则此条的检测结果无效。该试验的整个过程均有良好的质量控制。
1.4统计学处理采用SPSS16.0软件进行统计分析,用配对四格表χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1精密度验证结果见表1。
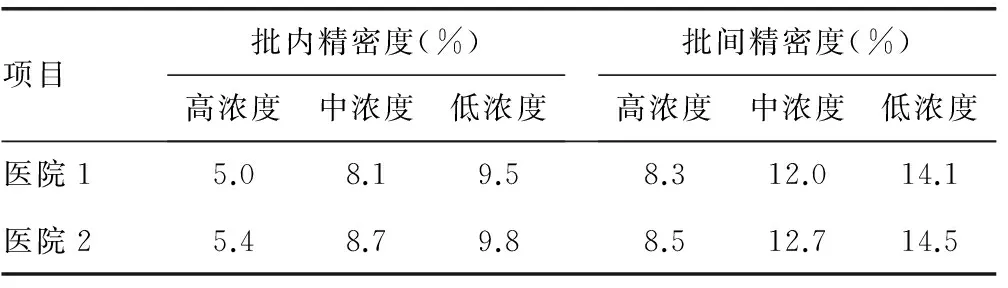
表1 两家医院精密度验证结果
2.2Cut-off值验证医院1的自建Cut-off值为0.448,该浓度与其上下20%浓度的标本经验证后与唐婧等[5]研究结果相符,医院2的自建Cut-off值为0.550,经验证后与之相符。
2.3灰区范围及结果医院1的灰区范围是0.317~0.579,医院2的灰区范围是0.406~0.694。研究100例标本中共收集10例初筛浓度在0.361~0.683的灰区标本,结果显示,两家医院ELISA对10例灰区标本均检测出阳性7例,阴性3例,RIBA及PCR联合检出阳性5例,阴性5例。
2.4ELISA检测结果两家医院实验室各自按照验证后的Cut-off值判断HCV抗体检测结果,医院1及医院2均检测出阳性47例,阴性53例。
2.5RIBA及PCR确证结果RIBA及PCR联合检出阳性45例,阴性55例。其中RIBA检测不确定的标本HCV抗体特异条带的分布情况分别是:Core蛋白强度为2+的有5例(5/9),强度为1+的有2例(2/9);NS3蛋白强度为1+的有2例(2/9)。
2.6灵敏度和特异度根据ELISA检测HCV抗体结果及RIBA和PCR确证结果分析,医院1及医院2的灵敏度和特异度相同,分别为100%、96%。见表2。

表2 两家医院检测HCV抗体的结果
2.7符合率两家医院实验室间检测临床标本HCV抗体的阳性符合率100%,阴性符合率100%,总符合率100%,差异无统计学意义(P=1.000),见表3。
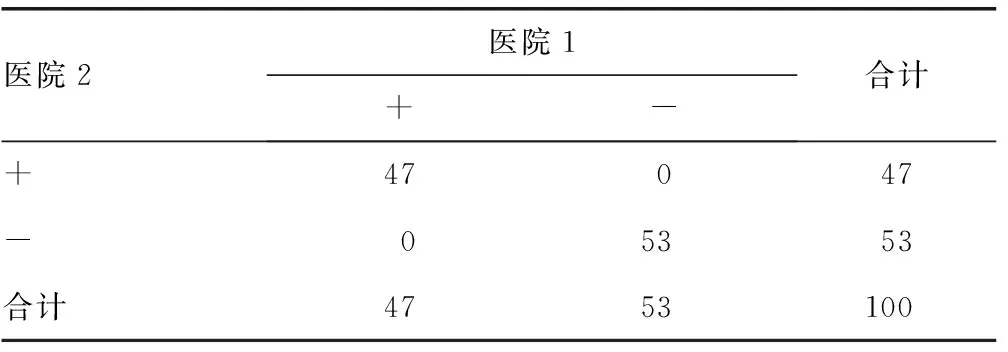
表3 两家医院实验室间检测HCV抗体的符合率结果
3 讨 论
本研究中两家医院实验室所用仪器型号相同,均为国产addcare ELISA 1100全自动酶免分析系统,但试剂不同。研究目的在于分析不同国产仪器和试剂在不同环境下检测HCV抗体结果的可比性,从而为不同实验室之间检验结果的互认提供实验依据。
精密度是检验方法评估中最基本的评价指标,主要评价测定结果的重复性,一般采用CV来反映精密度的好坏,本研究精密度结果显示,两家医院的批内CV<10%,批间CV<15%,符合比对实验的要求,说明这两家医院的检测系统均稳定可靠且重复性较好。
对定性试验来讲,Cut-off值是惟一的医学决定水平,而Cut-off值的确定缺乏统一的标准,使得在测定中对同一份标本的检测结果有可能出现很大的差异,尤其是对弱阳性标本及仅出现针对HCV单个蛋白成分抗体的标本[6],因此定性试验Cut-off值的高低,直接关系到试验结果的正确与否,而验证Cut-off值是否正确对试验结果的确定显得尤为重要。本研究经验证后结果显示与医院1和医院2的自建Cut-off值相符,但彼此略有不同,分别是0.448和0.550,经分析后可能存在的原因是两家医院使用的试剂不同,不同的试剂盒其抗原的来源及包被量有所差异,因此可能出现检测结果的差异而导致Cut-off值设定结果不同。
此外,ELISA测定技术本身在Cut-off值的设置上具有一定模糊性,即所谓的灰区,也就是说在Cut-off值周围一定区域内,测定结果难以明确判断是阴性还是阳性,但是目前国内所应用的传染性病原体抗原或抗体检测的ELISA试剂盒基本上都没有涉及灰区问题,而仅仅是以Cut-off值来判断阴阳性结果,这就会造成处于Cut-off值附近的样品易检测为假阳性或假阴性[7],而检测系统对灰区标本的检出能力更能反映其性能。因此,灰区的设置对提高HCV抗体的检出率,最大限度地降低误检,防止漏检同样具有重要的意义。本研究中灰区标本的HCV抗体检测结果显示两家医院均有两份血清标本ELISA检测为HCV抗体阳性,但金标准确认结果为HCV抗体阴性,即出现假阳性结果。在排除标本溶血、脂血及黄疸的情况下,分析其可能的原因有:(1)高免疫球蛋白G血症、类风湿因子、超氧化物歧化酶、异嗜性抗体及某些自身抗体等[8];(2)用于试剂固相包被的基因工程抗原不纯[9];(3)操作过程中洗板不彻底而导致结果偏高。由于灰区标本易出现假阳性和假阴性结果,建议对灰区标本经金标准确认后再发检验报告。
由于定性试验的结果不同于生化试验的比对,需要用临床资料或确诊试验所证实,所以通常用灵敏度和特异度来评价定性试验的性能[10]。若根据试剂说明书给定的Cut-off值(医院1为0.14,医院2为0.25)判断检测结果,医院1的灵敏度和特异度分别为100%和80%,医院2的灵敏度和特异度分别为100%和89%,虽然灵敏度都很高,但其特异度均较低,更容易出现假阳性结果而导致误诊率较高。本研究中两家实验室根据各自建立的Cut-off值判断检测结果,研究显示两台仪器的灵敏度和特异度相同且均较高,分别为100%和96%,表明不同实验室以自建Cut-off值为判断标准,可以在不降低灵敏度的情况下显著提高其特异度,不仅对HCV敏感且检出率高、漏检率低,为实现丙型肝炎患者的早发现、早诊断、早治疗从而控制并治愈疾病发挥重要作用,同时也减少了因误诊而带来的不便和血液资源的浪费。
对于定性试验,在诊断未知的情况下,比较不同医院间检测结果的准确性及可比性,可以选用阴性、阳性符合率指标。本研究结果显示,两家医院的阳性符合率100%,阴性符合率100%,总符合率100%,差异无统计学意义(P=1.000),表明两家医院实验室的检测结果互认可比。
综上所述,定期对实验室同一项目不同检测系统进行比对分析,是保证测定结果准确可比的重要手段,也是实验室内质量控制的一个良好补充,为实现实验室间检测结果的互认打下基础。
[1]Williams R.Global challenges in liver disease[J].Hepatology,2006,44(3):521-526.
[2]Global burden of Hepatitis C working Group.Global burden of disease (GBD) for hepatitis C[J].J Clin Pharmacol,2004,44(1):20-29.
[3]Deuffic-Burban S,Poynard T,Sulkowski MS,et al.Estimating the future health burden of chronic hepatitis C and human immunodeficiency virus infections in the United States[J].J Viral Hepat,2007,14(2):107-115.
[4]魏昊,丛玉隆.医学实验室质量管理与认可指南[M].北京:中国计量出版社,2004:72-74.
[5]唐婧,包建玲,孟存仁,等.ROC曲线对ELISA检测丙型肝炎抗体阳性判断值的确定和分析[J].检验医学,2014,29(8):826-830.
[6]江涛,李军,王昌富,等.基于ISO15189要求的免疫学定性试验性能验证方法的探讨[J].国际检验医学杂志,2014,35(3):332-333.
[7]邓巍,王露楠,李金明.丙型肝炎病毒抗体酶联免疫吸附试验阳性判断值在献血员血液筛检中的意义[J].中华检验医学杂志,2004,27(10):39-41.
[8]Mimms L,Vallari D,Ducharme L,et al.Specificity of anti-HCV ELISA assessed by reactivity to three immunodominant HCV regions[J].Lancet,1991,336(8730):1590-1591.
[9]黄秀琳,李维,程颖,等.HIV酶免试剂在献血标本中检测效果评价[J].国际检验医学杂志,2013,34(10):1297-1298.
[10]国家药典委员会.中华人民共和国药典-三部[M].北京:化学工业出版社,2005:335.
The comparative study of the determination of hepatitis C antibody by ELISA detection system in different laboratories*
Zeng Yanhua1,Lu Xiangyun2#,Zhang Li1,Zhang Zhaoxia1△,Cheng Jiang2▲
(1.Laboratory Medicine Center,the First Affiliated Hospital of Xinjiang Medical University, Urumqi,Xinjiang 830054,China;2.Department of Clinical Laboratory,the First Affiliated Hospital of Shihezi University,Shihezi,Xinjiang 832000,China)
ObjectiveTo investigate the comparability of the determination of hepatitis C antibody(anti-HCV) by ELISA detection system in different laboratories,in order to provide the experimental basis for the mutual recognition of test results between different laboratories.MethodsIn accordance with EP12-A2 files from the American association of Clinical Laboratory Standards Institute (CLSI),a total of 100 patients were recruited,including 50 cases of anti-HCV screening positive and 50 negative.The domestic addcare ELISA 1100 full autokinetic enzyme analysis system(addcare ELISA 1100) was used to test HCV antibody under randomized blind method in different labs,and recombinant immunoblot assay (RIBA) and polymerase chain reaction (PCR) were also carried out to provide a evidence of true positive for HCV antibody tests.Further,we compared the coincidence rate of HCV antibody tests,estimated the comparability of test results.ResultsThe sensitivity and specificity of the two laboratories were 100% and 96% respectively.The positive coincidence rate was 100%,negative coincidence rate was 100% and total coincidence rate was 100%,the difference was not statistically significant(P>0.05).ConclusionThe test results has a better comparability and recognition between the two laboratories when use the self-built cut-off value under the good condition of the instruments,the determination results are comparable.
hepatitis C antibody;enzyme linked immunosorbent assay;recombinant immunoblotting;polymerase chain reaction;coincidence rate
卫生部医药卫生科技发展研究中心专项课题(28-1-13)。作者简介:曾艳华(1988-),在读硕士,主要从事丙型肝炎的免疫学新进展研究。#并列第一作者。△
,E-mail:285715300@qq.com。▲通讯作者,E-mail:jyk6857@vip.163.com。
·技术与方法·10.3969/j.issn.1671-8348.2016.22.027
R392
A
1671-8348(2016)22-3104-03
2016-03-18
2016-05-06)
