人心房成纤维细胞的体外培养与鉴定*
2016-09-15周伟李妙龄范学慧李涛王笑宇于风旭
周伟,李妙龄,范学慧,李涛,王笑宇,于风旭
(西南医科大学:1附属医院胸心外科;2心肌电生理学研究室,四川泸州646000)
人心房成纤维细胞的体外培养与鉴定*
周伟1,李妙龄2,范学慧2,李涛2,王笑宇2,于风旭1
(西南医科大学:1附属医院胸心外科;2心肌电生理学研究室,四川泸州646000)
目的:探索和建立适用于人心房成纤维细胞体外培养及鉴定的可靠的技术方法。方法:采用组织块贴壁法对人心房成纤维细胞进行体外细胞培养及传代。并在倒置相差显微镜下观察成纤维细胞的生长情况,利用波形蛋白免疫荧光染色进行细胞鉴定。结果:在倒置相差显微镜下人心房成纤维细胞呈长梭形、多角形,胞质透明,胞核2~3个,无自发性搏动,细胞免疫荧光检测波形蛋白表达阳性。结论:建立了稳定培养人心房成纤维细胞的方法,为研究心肌纤维化相关疾病的发病机理提供了充足的种子细胞。
成纤维细胞;细胞培养;细胞鉴定
心房颤动是临床实践中最为常见的心律失常之一。目前研究表明,心房颤动的病理生理机制主要包括结构重构和电重构,而心房纤维化导致的结构重构是永久性房颤发生及持续的底物,在临床中也发现心房纤维化是房颤发生结构重构的重要特点[1]。由于对心房纤维化的在体研究受诸多条件的限制,因此,建立一种便捷、安全的人心房成纤维细胞体外培养方法,对研究心房纤维化的特点及与房颤发生关系有重要意义。目前,国内外实验室在进行人心房成纤维细胞体外培养时方法不一,主要包括组织块贴壁法和酶消化法[2]。酶消化法主要是使用胰蛋白酶与胶原蛋白酶联合消化组织块后采用差速贴壁法分离得到心房成纤维细胞,此法虽获取细胞时间短,但是步骤多,过程复杂,操作中易污染,且该法比组织块贴壁培养法技术要求高,费用昂贵,同时还存在对细胞的机械损伤和化学污染[3]。因此,本研究以心脏手术患者右心耳组织为材料,通过优化组织块贴壁法培养人心房成纤维细胞,且已获得成功。现报道如下。
1 材料和方法
1.1 材料
1.1.1 心房肌标本来源
经伦理委员会批准,患者知情同意后,实验所获人心房肌取自于西南医科大学附属医院心胸外科体外循环手术患者。
1.1.2 主要试剂
DME/F-12 1∶1(1x)高糖培养基(hyclone公司),胎牛血清(FBS,美国GIBCO公司),胶原酶Ⅱ(worthington公司),山羊抗兔波形蛋白(vimentin),兔抗山羊IgG及DaPi(Sigma公司),平衡盐溶液(PBS),青链霉素(100X)。
1.2 实验方法
1.2.1 原代细胞分离培养
从西南医科大学附属医院胸心外科体外循环心脏手术患者获取右心耳组织约40 mg,置于盛有无菌PBS的EP管中,将EP管移入装有冰的保温杯中迅速送往实验室进行细胞分离培养。在超净操作台上,将右心耳组织块移入装有PBS的3 cm培养皿中。用无菌眼科剪和镊子去除外膜和脂肪,将组织块剪成约1 mm3大小均匀小块。PBS反复冲洗组织块,至无血色为止,去除多余的PBS。将剪成小块的组织块移入装有1 mL DMEM培养基的EP管中,用眼科剪尽量剪碎组织块,然后将组织碎块吸入到无菌玻璃瓶。用DMEM配制0.1%胶原酶Ⅱ溶液10 mL,过滤后备用。取5 mL酶液于有组织块的玻璃瓶中,37℃水浴箱中消化10 min,然后去除上清液。再加入剩下的5 mL酶溶液,继续37℃水浴箱中消化10 min后离心(1 000 r/m,5 min),去除上清液。加入10 mL含20%胎牛血清的DMEM高糖培养基,吹打混匀后用吸管将组织碎块悬浮液吸入到10 cm的培养皿,放置于37℃、5%CO2培养箱中培养生长。前4 d避免大幅度移动培养皿,以免影响组织块贴壁。如若培养基变浑浊,说明可能存在细菌污染,要将培养皿及时拿出培养箱,防止继续污染其他细胞。4 d后可以在倒置显微镜下观察到组织块周边爬出少许成纤维细胞,此后,需每天观察培养基颜色变化,如若变黄,要及时更换培养基。
1.2.2 传代培养
在原代培养2周左右,在倒置显微镜下可观察到成纤维细胞几乎已长满培养皿的90%以上,此时可进行传代培养。去除原培养基,加入5 mL PBS清洗两次后,加2 mL 0.1%胰蛋白酶于37℃培养箱消化约2 min后,在倒置显微镜下观察,待细胞收缩变圆后,立即加入3 mL含20%胎牛血清的DMEM培养基终止消化。轻轻吹打细胞,制成细胞悬液,然后离心(1 000 r/m,5 min),去除上清液,加含20%胎牛血清的DMEM,按1:2的比例分别接种到一新的10 cm培养皿,再将其放置于37℃、5%CO2培养箱中。
1.3 成纤维细胞的鉴定
1.3.1 形态学观察
可直接在倒置显微镜下观察细胞的形态。
1.3.2 细胞免疫荧光染色鉴定
在传代培养时,取稀释后的细胞悬液接种到3 cm培养皿的载玻片上,加入含20%胎牛血清的DMEM培养1~2 d取出玻片,用0.01 mol/L PBS液清洗3次,每次3~5 min。去除PBS液,再加入1 mL 40 g/L多聚甲醛(4%)固定5~10 min,PBS液清洗3次,每次5~10 min。去除液体后加入1 mL 0.5%Triton×100室温封闭30 min,PBS液清洗3次,每次5~10 min,洗涤时可用摇床轻微摇动。去除液体后加入1 mL 1%BSA室温封闭1 h,尽量去除多余液体,取1 mL 1∶300的稀释一抗(兔波形蛋白vimentin)加入到接种有成纤维细胞的载玻片上,对照组滴加PBS,4℃过夜。第二天用PBS液清洗3次,每次5~10 min,去除液体后加1 mL 1∶100稀释二抗(抗兔)室温避光孵育1 h,PBS液清洗3次,每次5~10 min。加入500 uL DAPI染细胞核,室温避光孵育5 min,PBS液清洗3次,每次5~10 min。滴一滴抗荧光淬灭封片于载玻片上,盖上贴有细胞的玻片,使细胞接触封片液封片,便可于荧光显微镜下观察。
2 结果
2.1 细胞形态学特征
心房成纤维细胞原代培养时可见黑色组织块,4~5 d细胞开始从组织块边缘爬出,呈放射状,排列较紊乱,有重叠现象,此后细胞数明显增多,14 d左右可长满培养皿(图1),可见细胞体积较大,呈梭形,细胞质透明,胞体较大,胞核明显,呈扁圆形,常含2~3个核,传代细胞排列紧密,细胞呈长梭形、多角形,无搏动(图2)。

图1 不同倍数下的原代成纤维细胞(A:4×B:10×C:20×D:40×)

图2 不同倍数下传代成纤维细胞(A:4×B:10×C:20×D:40×)
2.2 细胞免疫荧光染色
将传代培养贴壁于盖玻片上的人心房成纤维细胞行波形蛋白荧光染色和DAPI细胞核染色后,在荧光显微镜下可观察到成纤维细胞波形蛋白抗原表达阳性,在蓝色细胞核边缘可见红色的细胞浆呈丝状改变,纯度大于95%(图3A),对照组用PBS代替一抗,仅加二抗,荧光显微镜下细胞仅能见蓝色细胞核(图3B)。
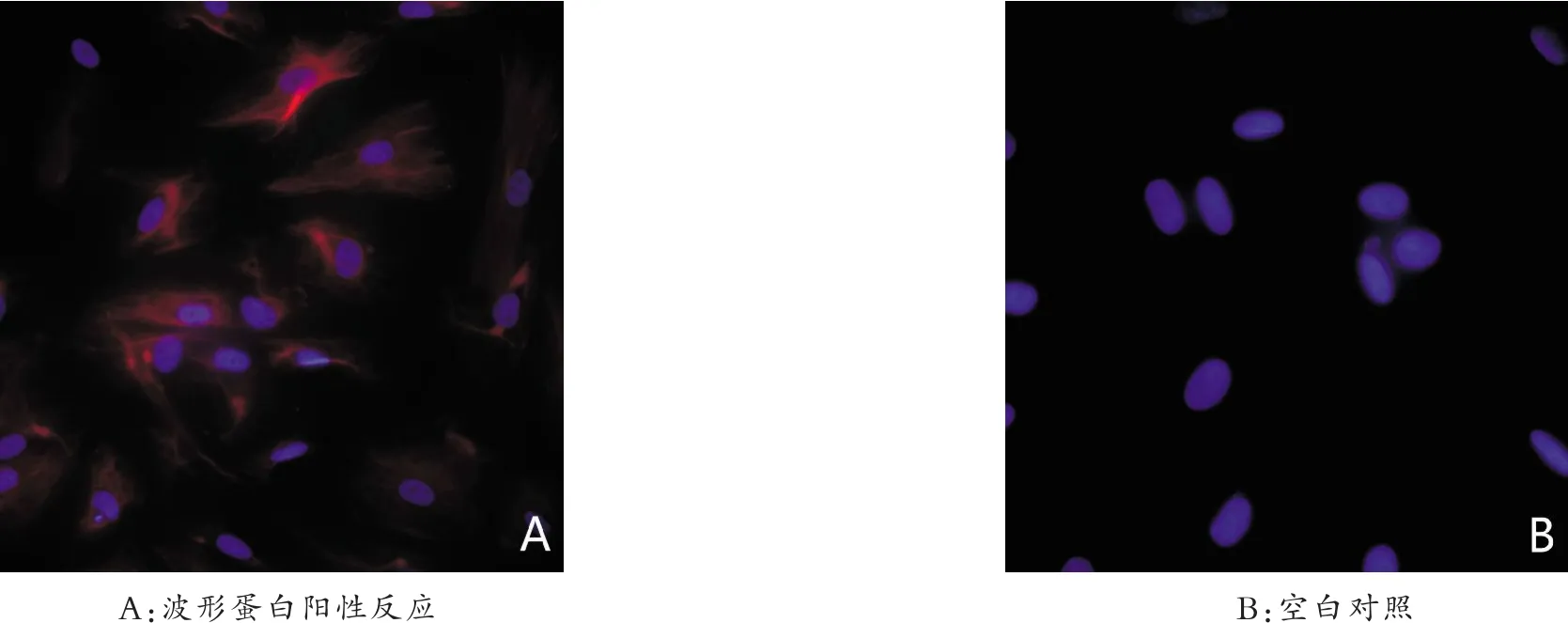
图3 成纤维细胞波形蛋白免疫反应(20×)
3 讨论
心房颤动是临床上最为常见的心律失常之一。研究表明,心房纤维化导致的心房重构是心房颤动发生和持续的重要生理病理机制之一。纤维化表现为心肌成纤维型细胞合成的大量的细胞外基质蛋白的堆积(主要为Ⅰ型胶原和Ⅲ型胶原),从而引起心脏的结构重构[4]。心肌成纤维细胞的增殖与转化是心房发生纤维化的基础,直接从人心房中获取的成纤维细胞在研究房颤与心肌纤维化的关系与在动物模型上的研究相比,其临床价值更高。
目前国内外实验室体外培养成纤维细胞的技术方法主要包括酶消化法和组织块贴壁法,前者由于过程复杂,操作繁琐,且易受胰蛋白酶的浓度,作用时间及温度等多方面的影响,分离得到的成纤维细胞也易受到心肌细胞的影响,纯度不高。传统的组织块培养法,未经酶消化,组织块贴壁困难,心肌成纤维细胞的存活率不高,细胞生长极其缓慢,原代培养耗时长,易引起污染,且细胞生长密度低,不易传代培养。因此,本研究从多个环节优化组织块贴壁培养法,贴壁较快,体外培养的成纤维细胞存活率在90%以上,细胞生长密度较高,容易传代培养。本培养方法的优势表现在:①为避免组织块或细胞受到细菌与真菌的污染,在培养基中添加青链霉素和两性霉素B,提高了细胞的存活率;②在前期培养阶段,发现普通的DMEM配制的10%胎牛血清,细胞生长缓慢,后将其换成DME/F-12 1∶1(1X),并提高胎牛血清的浓度到20%,细胞生长速度明显增快,大大缩短了原代培养时间;③优化了组织块贴壁,Ⅱ型胶原酶特异作用于结缔组织的胶原,对胶原和细胞外基质有很好的消化作用,减轻了对细胞的损伤程度[5]。本研究使用0.1%Ⅱ型胶原酶消化组织块,第一次消化后静置2 min去除上清液,即将消化下来的胶原蛋白及结缔组织去除,使组织块更易贴壁,培养过程中成纤维细胞更易于从组织块内迁出。
本研究方法可获得纯度较高的成纤维细胞,该类细胞从形态学特征上看,成纤维细胞呈有突起的梭形或多角形细胞,平行排列或放射状伸开,界限清楚,与张建成[6]等人培养的人心房成纤维细胞形态相似。波形蛋白(vimentin)是存在于成纤维细胞和胚胎间充质细胞中间丝的主要结构蛋白,主要对细胞核起支持作用,稳定核的位置,与心肌细胞的桥连蛋白有明显差异,波形蛋白为成纤维细胞的相对特异性标志[7-8]。本实验中细胞免疫荧光染色显示波形蛋白强阳性,且纯度大于95%,可证实其为成纤维细胞。
本实验以心脏手术患者右心耳为材料来源,从形态学及细胞免疫荧光检测波形蛋白两方面证实了所培养的为心房成纤维细胞,建立了安全、稳定、便捷的人心房成纤维细胞的体外培养方法,为进一步研究心肌纤维化的特点奠定了基础。
1.Kostin S,Klein G,Szalay Z,et al.Structural correlate of atrial fibrillation in human patients[J].Cardiovasc Res, 2002,54(2):361-379.
2.Torre C,Jeusette I,Serra M,et al.Bovine colostrum increases proliferation of canine skin fibroblasts[J].J Nutr, 2006,136(7 Suppl):2058-2060.
3.陈瑞华,赵自刚,牛春雨,等.大鼠肺微血管内皮细胞的培养[J].中国微循环,2007,(01):16-19.
4.Manabe I,Shindo T,Nagai R.Gene expression in fibroblasts and fibrosis:involvement in cardiac hypertrophy [J].Circ Res,2002,91(12):1103-13.
5.刘爱军,靳俊峰.人皮肤成纤维细胞的高效分离培养及鉴定[J].广东医学,2008,(12):1969-1970.
6.张建成,程显禄,黄宇坚,等.采用组织块法培养心房颤动患者心房成纤维细胞[J].中国心脏起搏与心电生理杂志,2009,(06):506-508.
7.Han ZM,Chen DY,Li JS,et al.Flow cytometric cellcycle analysis of cultured fibroblasts from the giant panda, Ailuropoda melanoleuca L[J].Cell Biol Int,2003,27(4): 349-353.
8.Lyle S,Christofidou-Solomidou M,Liu Y,et al.Human hair follicle bulge cells are biochemically distinct and possess an epithelial stem cell phenotype[J].J Investig Dermatol Symp Proc,1999,4(3):296-301.
(2016-01-08收稿)
Isolation and culture of human atrial fibroblasts cells in vitro
Zhou Wei1,Li Miao ling2,Fan Xuehui2,Li Tao2,Wang Xiaoyu2,Yu Fengxu11Department of Thoracic Surgery,the Affiliated Hospital of Southwest Medical University;2Kgy Laboratory of Medical Electrophysioloy of Southwest Medical University,Luzhou,Sichuan Province,646000,China
Objective:To establish a reliable method for isolation and culturing of human atrial fibroblasts. Methods:Hu man atrial fibroblasts were cultured by tissue block method in vitro,an inverted phase contrast microscope was used to observe the morphology,and vimentin was immuno-fluorescence stained to identify the fibroblasts.Results:Human atrial fibroblasts were long spindle shaped or polygonal with transparent cytoplasm,2~3 nucleuses,and no spontaneous beating;immuno-fluorescence staining showed positive for vimentin.Conclusion:A stable method of fibroblasts isolation and culturing was established,which provides a reliable source of cells for studying myocardial fibrosis related diseases.
Fibroblast;Cell culture;Cell identification
R541.7+5
A
10.3969/j.issn.1000-2669.2016.06.008
*医学电生理学教育部重点实验室开放基金(KeyME-2014-02);四川省科技厅基金(2011JY0065)资助;泸州市-西南医科大学联合课题(2015LZCYD-S03(3/7)
周伟(1992-),男,硕士生
于风旭(1976-),男,博士,副教授。E-mail:yuluchuan@163.com
