筋骨草提取物抗运动疲劳的作用*
2016-09-15皮建辉胡朝暾向德标
文 婷,皮建辉,谭 娟,胡朝暾,向德标
筋骨草提取物抗运动疲劳的作用*
文 婷1,2,皮建辉1,3Δ,谭 娟1,3,胡朝暾1,3,向德标1,3
(1.怀化学院生命科学系 ,湖南怀化418008;2.贵州师范大学生命科学学院 ,贵阳550001;3.怀化学院民族药用植物资源研究与利用湖南省重点实验室 ,怀化418008)
目的:探讨筋骨草的抗运动性疲劳作用。方法:将120只雄性昆明种小鼠随机平均分成安静组、运动组、阳性对照组和筋骨草低、中、高剂量组(n=10)。其中低、中、高剂量组小鼠分别按100mg/kg、200mg/kg、400mg/kg体重连续灌胃筋骨草提取物30 d,阳性对照组小鼠按200mg/kg体重灌胃西洋参胶囊颗粒,安静组和运动组小鼠以等体积生理盐水灌胃。动物试验结束后,分析各组小鼠运动力竭时间、血清生理生化指标(包括血乳酸、血尿素氮、血糖、总胆固醇、甘油三酯含量)、肝糖原与肌糖原含量,以及股四头肌、肝脏和心脏组织的抗氧化指标(包括谷胱甘肽过氧化物酶、超氧化物歧化酶、过氧化氢酶和丙二醛)。结果:中、高剂量组小鼠的运动力竭时间、红细胞数量、血红蛋白含量、血糖浓度、肝糖原与肌糖原含量,以及器官组织中谷胱甘肽过氧化物酶、超氧化物歧化酶和过氧化氢酶活力均明显高于运动对照组,而血清乳酸含量、血清尿素氮、血清甘油三酯与总胆固醇含量,以及器官组织中丙二醛含量明显低于运动对照组,中剂量的筋骨草提取物的作用效果优于同剂量的西洋参胶囊颗粒。结论:筋骨草通过提高机体的抗氧化功能而达到抗运动性疲劳作用。
筋骨草;抗疲劳;抗氧化;小鼠
【DOI】10.13459/j.cnki.cjap.2016.03.015
运动性疲劳不但与体内内源性物质的消耗有关,而且也涉及到神经、内分泌以及免疫系统的平衡调节。目前有关疲劳产生的中枢疲劳学说、能源物质耗竭学说、内分泌系统失调理论、自由基学说等从不同角度揭示疲劳发生机制[1],而且人们试图通过服用体外抗疲劳制剂来减轻或消除疲劳。近年来,研究发现一些中草药制剂能通过清除体内自由基、促进组织对能源物质的利用、减少组织内乳酸堆积、保护中枢神经系统等作用达到抗运动疲劳的效果[2-4]。筋骨草是唇形科植物金疮小草(Ajuga decumbens Thunb),性味苦寒,按中医药理论,苦能燥湿解毒、寒能清热泻火,其对多种细菌具有抑制功能,且筋骨草具有明显的抗脂、抗氧化、清除代谢中产物等功能[5]。本研究通过考察筋骨草提取物对小鼠运动力竭时间、生理生化指标、肌/肝糖元含量影响,及其对器官组织抗氧化损伤作用,初步探讨筋骨草的抗运动疲劳及其作用机制。
1 材料与方法
1.1 材料、试剂与设备
筋骨草采自怀化黄岩山林,经专业人员鉴定为唇形科植物金疮小草(Ajuga decumbens Thunb);试验动物120只清洁级雄性昆明种小鼠,体重20~25 g,购自湖南斯莱克景达实验动物有限公司;谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、丙二醛(malondialdehyde,MDA)、血乳酸(lactic acid,LD)、血尿素氮(blood urea nitrogen,BUN)、血糖(blood sugar,BG)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、肌糖原(muscle glycogen,MG)、肝糖原(liver glycogen,LG)试剂盒均购自南京建成生物工程研究所,其他试剂均为国产分析纯。
主要仪器:Beckman DU800型紫外/可见分光光度计(美国Beckman公司)、KT-6180型自动血细胞分析仪(深圳市锦瑞电子有限公司)。
1.2 筋骨草全药成分的提取
新鲜筋骨草经洗净、风干、粉碎后,80℃水浸提3 h,收集并抽滤浸提液,重复操作3次后合并浸提液、减压浓缩、真空冷冻干燥成粉末、封存备用。
1.3 动物实验
昆明小鼠适应性游泳训练1周后,选择游泳能力相近的雄性小鼠120只,随机分成6组(n=20):即安静对照组、运动对照组、阳性对照组,以及低剂量筋骨草提取物+运动组(简称低剂量药物干预组)、中剂量筋骨草提取物+运动组(简称中剂量药物干预组)、高剂量筋骨草提取物+运动组(简称高剂量药物干预组),每组分笼饲养,自由饮食。其中除安静对照组的小鼠,每天游泳训练20min,游泳水深28~30 cm,水温25℃;低、中、高剂量药物干预组小鼠分别按100mg/kg、200mg/kg、400mg/kg体重连续灌胃筋骨草提取物30 d,阳性对照组小鼠按200 mg/kg体重连续灌胃西洋参胶囊内颗粒,安静对照组和运动对照组以等体积生理盐水替代筋骨草提取物溶液灌胃,给药时间与游泳时间相差4 h以上,一般每天8∶00左右给药,16∶00左右游泳。各研究项目均在对应试验动物分组中随机取10只小鼠进行。
1.4 小鼠运动力竭时间与生理生化指标测定
小鼠于末次灌胃后30min称取体重,并于水深28~30 cm,水温25℃的环境中进行尾部负重5%体重的铅片游泳,用小鼠入水游泳开始至力竭所用时间表示运动力竭时间,力竭标准以小鼠头没入水中10 s不能返回水面为度。力竭后的小鼠从水中捞起迅速擦干身体,摘眼球采血滴入事先用肝素处理过的干燥离心管中,迅速用血细胞分析仪测定红细胞(red blood cell,RBC)数量与血红蛋白(hemoglobin,Hb)含量,余血4 000 r/min离心10min,取上清液用试剂盒检测LD、BUN、BG、TC和TG等血清生理生化指标。小鼠采血后即引颈处死,迅速解剖取其双腿股四头肌、肝脏和心脏,将组织置于0℃条件下的生理盐水中漂洗,除去血渍,滤纸拭干,分别与适量冷藏生理盐水混合于冰上研磨制得10%的组织匀浆,经3 000 r/min离心10min,取上清用试剂盒分别检测股四头肌与肝脏中MG、LG的含量及各器官组织中的GSH-Px、SOD、CAT活力和MDA含量。具体测试方法严格按试剂盒的使用说明进行操作。
1.5 统计学处理
2 结果
2.1 运动力竭时间
运动对照组与安静对照组相比,小鼠运动力竭时间极显著增长(P<0.01),而阳性对照组小鼠运动力竭时间明显长于运动对照组(P<0.05);筋骨草干预组小鼠运动力竭时间都比运动对照组延长,且中剂量药物干预组与高剂量药物干预组小鼠的运动力竭时间增长极显著(P<0.01,表1)。各剂量药物干预组之间仅低剂量药物干预组与高剂量药物干预组小鼠的运动力竭时间存在显著差异(P<0.05)。
2.2 血清生理生化指标
运动对照组小鼠相对安静对照组而言,除血清LD含量存在明显差异(P<0.05)外,其他各项生理指标都存在极显著差异(P<0.01),而阳性对照组与运动对照组相比,除BUN含量存在明显差异(P <0.05)外,其他各项生理指标也都存在极显著差异(P<0.01);筋骨草干预组相对运动对照组除血清TC含量只有高剂量药物干预组存在明显差异(P<0.05)外,其他各项指标在中、高剂量药物干预组都存在显著或极显著差异(P<0.05,P<0.01),且低剂量药物干预组的LD、Hb、RBC和BG相对运动对照组都存在极显著差异(P<0.01);筋骨草干预组与阳性对照组比较,中剂量药物干预组的各项指标整体优于阳性对照组,且Hb、RBC和TC还具有极显著差异(P<0.01,表2)。筋骨草干预组中,低剂量药物干预组与中剂量药物干预组之间LD、TC、TG没有明显的统计学差异(P>0.05),BUN和BG存在显著差异(P<0.05),Hb和RBC存在极显著差异(P <0.01);低剂量药物干预组与高剂量药物干预组之间除LD和TG没有明显的统计学差异(P>0.05)外,其他各项均存在极显著差异(P<0.01);而中剂量药物干预组与高剂量药物干预组之间各项指标均存在极显著差异(P<0.01)。
Tab.1 Effectof extracts from Ajuga decumbens on the exhausting time inmice(±s,n=10)
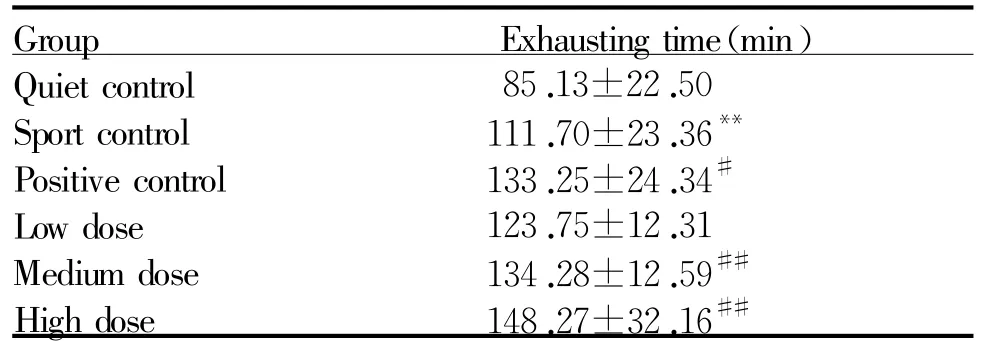
Tab.1 Effectof extracts from Ajuga decumbens on the exhausting time inmice(±s,n=10)
**P<0.01 vs quiet control group;#P<0.05,##P<0.01 vs sport controlgroup
Group Exhausting time(min)Quiet control 85.13±22.50 Sport control 111.70±23.36**Positive control 133.25±24.34#Low dose 123.75±12.31 Medium dose 134.28±12.59##High dose 148.27±32.16##
Tab.2 Effectof extracts from Ajuga decumbens on the Physio-biochemical indexes inmice(±s,n=10)

Tab.2 Effectof extracts from Ajuga decumbens on the Physio-biochemical indexes inmice(±s,n=10)
LD:Lactic acid;BUN:Blood urea nitrogen;Hb:Hemoglobin;RBC:Red blood cell;BG:Blood sugar;TC:Total cholesterol;TG: Triglyceride*P<0.05,**P<0.01 vs quiet controlgroup;#P<0.05,##P<0.01 vs sport control group
Group LD(mmol/L) BUN(mmol/L) Hb(g/L) RBC(×1012/L) BG(mmol/L) TC(mmol/L) TG(mmol/L)Quiet control 4.67±1.03 4.23±1.03 114.3±2.08 8.50±0.47 14.06±0.50 4.19±0.34 4.34±0.20 Sport control 5.57±0.96* 5.52±1.11** 93.0±3.56**6.26±0.32** 11.88±0.25** 3.49±0.47** 4.01±0.09**Positive control 3.68±1.24## 4.72±0.16# 120.35±4.17##7.32±0.35## 12.94±0.63##4.12±0.25## 3.55±0.24##Low dose 4.15±0.86## 5.15±0.82 109.73±4.18##6.93±0.25## 12.48±0.62##3.93±0.63 3.86±0.73 Medium dose 3.64±0.13## 4.26±1.09# 115.2±2.69##8.17±0.40## 12.96±0.39##3.49±0.48 3.49±0.37##High dose 3.47±0.83## 3.68±0.17## 114.27±2.61##8.06±0.61## 13.47±0.37##3.08±0.26# 3.36±0.56##
2.3 肌糖原和肝糖原含量
运动对照组小鼠相对安静对照组,LG和MG含量有所下降,其中LG含量下降极显著(P<0.01),而阳性对照组小鼠的LG和MG含量相对运动对照组均有所回升,且 LG含量有极显著差异(P<0.01);筋骨草干预组相对运动对照组来说,各剂量药物干预组均能提高LG和MG含量,且中剂量药物干预组小鼠LG和MG明显高于运动对照组(P<0.05),而高剂量药物干预组小鼠LG和MG极显著高于运动对照组(P<0.01,表3)。各药物干预组之间比较,低剂量药物干预组的肌糖原含量明显低于中、高剂量药物干预组(P<0.05,P<0.01),但低剂量药物干预组的肝糖原含量只明显低于高剂量药物干预组(P<0.01);中剂量药物干预组的肝糖原含量明显低于高剂量药物干预组(P<0.01),其肌糖原含量与高剂量药物干预组没有明显的统计学差异。
Tab.3 Effect of extracts from Ajuga decumbens onmuscle and liver glycogen inmice(mg/g,±s,n =10)

Tab.3 Effect of extracts from Ajuga decumbens onmuscle and liver glycogen inmice(mg/g,±s,n =10)
*P<0.05,**P<0.01 vs quiet controlgroup;#P<0.05,##P<0.01 vs sport controlgroup
Muscle glycogen Quiet control 14.42±1.50 4.19±0.55 Sport control 11.40±1.40** 3.78±0.47 Positive control 13.68±1.35## 3.97±0.53 Low dose 12.04±1.01 3.89±0.53 Medium dose 12.47±0.69# 4.68±0.83#High dose 13.37±0.81## 4.53±0.37 Group Liver glycogen ##
2.4 器官组织的抗氧化指标
运动对照组小鼠各器官组织中GSH-Px、SOD、CAT活力相对安静对照组均明显降低(P<0.05,P <0.01),而MDA生成量却极显著升高(P<0.01),但阳性对照组小鼠器官组织中的GSH-Px、SOD、CAT活力相对运动对照组均显著升高(P<0.05,P<0.01),MDA生成量却极显著降低(P<0.01);相对运动对照组,筋骨草各剂量干预组的器官组织中GSH-Px、SOD、CAT活力提高,MDA的生成量减少,且除心脏SOD外,中、高剂量药物干预组均表现出明显的差异(P<0.05,P<0.01),同时低剂量药物干预能极显著降低股四头肌组织中MDA含量(P<0.01),而中、高剂量药物干预均能极显著降低三种组织中MDA含量(P<0.01,表4)。
药物干预对股四头肌、肝脏和心脏抗氧化指标的影响总体呈现出明显的量效关系。低剂量药物干预组股四头肌抗氧化指标除相对于高剂量药物干预组的MDA没有明显的统计学差异(P>0.05)外,其相对低、中、高剂量药物干预组的其他各项指标均存在极显著差异(P<0.01);而中、高剂量药物干预组之间的SOD、MDA没有明显的统计学差异,GSH-Px、CAT却有极显著的差异(P<0.01)。低剂量药物干预组肝脏组织抗氧化指标GSH-Px、SOD、CAT、MDA相对低、中、高低剂量药物干预组均存在显著的差异(P<0.05,P<0.01);而低、中、高低剂量药物干预组之间仅有MDA有显著的差异(P<0.05)。低剂量药物干预组心脏组织抗氧化指标GSH-Px、MDA与中剂量药物干预组间存在极显著差异(P<0.01),而与高剂量药物干预组间除CAT外存在极显著差异(P<0.01);但中、高剂量药物干预组间仅SOD存在极显著差异(P<0.01)。
Tab.4 Effectof extracts from Ajuga decumbenson on the activity of antioxidase(U/mg)and the contentofMDA(nmol/mg)of different tissue inmice(±s,n=10)
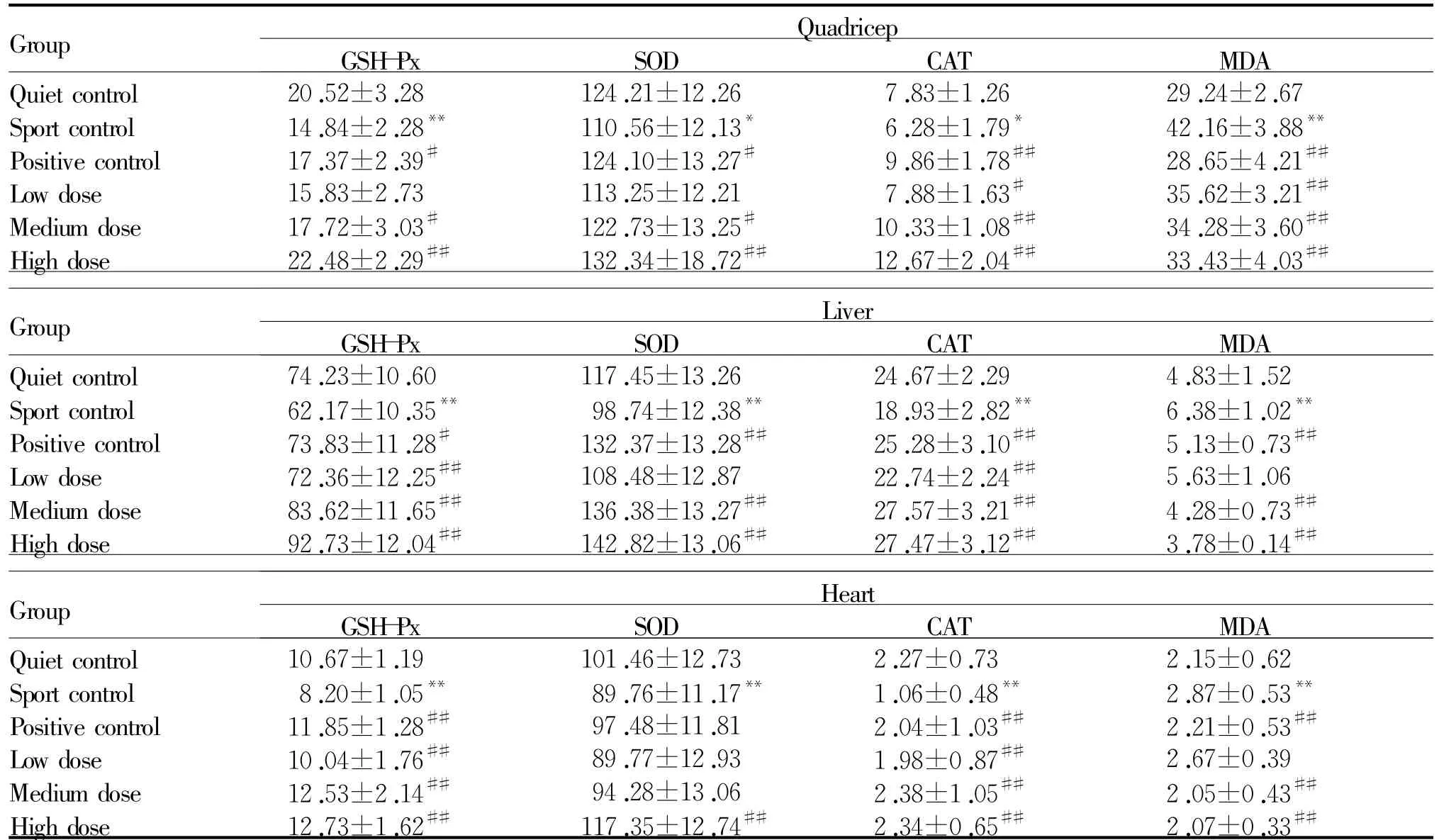
Tab.4 Effectof extracts from Ajuga decumbenson on the activity of antioxidase(U/mg)and the contentofMDA(nmol/mg)of different tissue inmice(±s,n=10)
GSH-Px:Glutathione peroxidase;SOD:Superoxide dismutase;CAT:Catalase;MDA:Malondialdehyde*P<0.05,**P<0.01 vs quiet controlgroup;#P<0.05,##P<0.01 vs sport controlgroup
MDA Quiet control 20.52±3.28 124.21±12.26 7.83±1.26 29.24±2.67 Sport control 14.84±2.28** 110.56±12.13* 6.28±1.79* 42.16±3.88**Positive control 17.37±2.39# 124.10±13.27# 9.86±1.78## 28.65±4.21##Low dose 15.83±2.73 113.25±12.21 7.88±1.63# 35.62±3.21##Medium dose 17.72±3.03# 122.73±13.25# 10.33±1.08## 34.28±3.60##High dose 22.48±2.29## 132.34±18.72## 12.67±2.04## 33.43±4.03 Group Quadricep GSH-Px SOD CAT ## MDA Quiet control 74.23±10.60 117.45±13.26 24.67±2.29 4.83±1.52 Sport control 62.17±10.35** 98.74±12.38** 18.93±2.82** 6.38±1.02**Positive control 73.83±11.28# 132.37±13.28## 25.28±3.10## 5.13±0.73##Low dose 72.36±12.25## 108.48±12.87 22.74±2.24## 5.63±1.06 Medium dose 83.62±11.65## 136.38±13.27## 27.57±3.21## 4.28±0.73##High dose 92.73±12.04## 142.82±13.06## 27.47±3.12## 3.78±0.14 Group Liver GSH-Px SOD CAT ## MDA Quiet control 10.67±1.19 101.46±12.73 2.27±0.73 2.15±0.62 Sport control 8.20±1.05** 89.76±11.17** 1.06±0.48** 2.87±0.53**Positive control 11.85±1.28## 97.48±11.81 2.04±1.03## 2.21±0.53##Low dose 10.04±1.76## 89.77±12.93 1.98±0.87## 2.67±0.39 Medium dose 12.53±2.14## 94.28±13.06 2.38±1.05## 2.05±0.43##High dose 12.73±1.62## 117.35±12.74## 2.34±0.65## 2.07±0.33 Group Heart GSH-Px SOD CAT ##
3 讨论
运动性疲劳是引起机体运动能力下降的主要原因,运动力竭是运动疲劳发展的最后阶段。运动力竭时间是机体抗应激、抗疲劳能力的综合体现,是反应机体疲劳最直接、最客观的指标,运动力竭时间的延长是抗疲劳能力加强最有力的宏观表现[6,7]。筋骨草提取物能延长小鼠的运动力竭时间,特别是中、高剂量具有极显著的作用,表明其能有效延缓运动疲劳。
运动性疲劳的发生与能量消耗、代谢产物堆积和内环境变化等因素有着密切的关系[1]。长时间的运动可造成机体相对缺氧,糖酵解加快,能量利用不充分,从而使组织中乳酸堆积增加,糖原大量消耗和血糖浓度降低,同时加快脂肪与蛋白质、氨基酸的分解,使血脂浓度降低、血清蛋白氮增加。LD是反映机体疲劳程度的一个重要指标[7,8],BUN反映整体蛋白代谢情况,与运动强度和持续时间有关[9]。筋骨草提取物能显著降低血清LD与BUN,表明筋骨草一方面能促进糖的有氧代谢,提高能源物质利用率,另方面能有效地提高乳酸脱氢酶(LDH)活力,促进LD脱氢生成丙酮酸,降低小鼠运动后LD的积累或产生,调节内环境的pH,维持内环境稳定,同时减少因补充糖酵解供能不足而进行的蛋白分解代谢所产生的BUN,从而延缓机体疲劳的发生和降低机体的疲劳程度[7,8];糖是肌肉组织的重要能源物质,肌/肝糖原和血糖的含量是反映疲劳程度的一项敏感指标[3,4]。一定剂量的筋骨草提取物能显著提高BG、MG和LG,表明筋骨草能通过提高血糖有氧代谢的能量利用率,减少小鼠LG和MG的运动损耗,维持BG水平,也有可能同时通过糖的异生作用增加糖的合成与转化[10],为机体运动提供较好的能量储备,增加机体的运动能力;长时间游泳运动可引起糖原储备的耗竭,致使脂肪动员加快,使释放到血浆中的游离脂肪酸(FFA)增加,有效提高运动中的脂肪氧化代谢,一方面可节约糖原的耗损,另一方面可抑制血浆中FFA浓度过高。若血浆FFA显著增高,肌细胞膜的Na+-ATP酶及肌质网的Ca2+-ATP酶活性被抑制,肌肉兴奋-收缩耦联作用减弱,这也是形成机体运动性疲劳的重要原因[10]。一定剂量的筋骨草提取物能明显降低TC和TG含量,特别是对TG影响更为显著,表明筋骨草能提高小鼠对脂肪的清除与利用。
RBC和Hb含量与耐力运动有着密切的关系,是衡量机体耐力运动和耐缺氧的重要指标[11,12]。本研究表明,筋骨草提取物能极显著地对抗运动疲劳诱发的RBC和Hb降低,增强血液运输氧能力,提高机体运动耐力,进而起到抗疲劳作用。
在运动过程中,机体抗氧化酶系SOD、GSH-Px、CAT等含量显著降低,抗氧化能力下降,内源性氧自由基堆积,脂质过氧化反应产物MDA增加,对细胞膜系统造成严重损害,这是运动性疲劳产生的重要机制之一[8,10]。本研究显示,长期游泳运动能显著降低运动器官股四头肌、供能器官肝脏和供血(氧)器官心脏组织中SOD、GSH-Px和CAT的活性,增加MDA含量,表明运动会造成器官组织的氧化损伤,促进小鼠的运动疲劳。一定剂量的筋骨草提取物能显著提高器官组织中抗氧化酶活性,降低MDA含量,说明筋骨草有明显的抗氧化功能,可有效阻止细胞膜的脂质过氧化,进而提高小鼠的运动能力[8]。
综上所述,筋骨草具有良好的抗运动疲劳作用,这一作用主要是通过筋骨草促进运动器官和供能器官提高能源物质的利用率,增强其抗氧化损伤能力,维持肌体组织内环境稳定来实现的。同时,本研究结果丰富了中草药抗运动疲劳研究的成果,也为中草药抗运动疲劳研究提供了新的研究思路。
[1]EvansWJ,Lambert CP.Physiological basis of fatigue[J]. Am JPhysMed Rehabil,2007,86(1 Suppl):S29-46.
[2]Tan S,Zhou F,LiN.Anti-fatigue effectof ginsenoside Rb1 on postoperative fatigue syndrome induced bymajor small intestinal resection in rat[J].Biol Pharm Bull,2013,36 (10):1634-1639.
[3]裴素萍,崔 征,彭 程 ,等.参杞制剂对小鼠抗疲劳和抗氧化作用研究[J].中国应用生理学杂志,2014,30(2):132-135.
[4]马 力.高原红景天抗疲劳作用的研究[J].中国应用生理学杂志,2014,30(1):42-43,47.
[5]罗 会.筋骨草研究进展[J].广东化工,2011,38 (11):68-69.
[6]高占友,周海涛,林 强 .肉苁蓉对大鼠抗运动性疲劳能力及脑自由基的影响[J].安徽农业科学,2011,39(16):9592-9593,9595.
[7]宋昕恬,张晶莹,孟令仪,等.人参三醇组皂苷对运动疲劳大鼠血糖、血乳酸、血尿素氮的影响[J].中国卫生工程学,2013,12(5):359-361.
[8]苏成虎,陈晓农,杨新波,等.水芹提取物抗运动性疲劳作用及初步机制分析[J].解放军药学学报,2011,27(2):103-106.
[9]齐 阳,蔡东联 .抗运动性疲劳作用进展[J].氨基酸与生物资源,2011,33(4):58-62.
[10]黎明华 ,汤长发,欧阳江琼,等.红景天苷对运动后自由基和能量代谢改变的影响[J].中国应用生理学杂志,2012,28(1):53-56.
[11]刘 斌,石任兵,葛小侠.筋骨草属植物化学成分与药理活性[J].国外医药·植物药分册,2001,16(3): 96-98.
[12]冯连世,李开刚.运动员机能评定常用生理生化指标测试方法及应用[M].北京:人民体育出版社 ,2002: 44.
Effects of the extracts from Ajuga decumbens on anti-fatigue in mice
WEN Ting1,2,PIJian-hui1,3Δ,TAN Juan1,3,HU Zhao-tun1,3,XIANG De-biao1,3
(1.Department of Life Science,Huaihua University,Huaihua 418008;2.College of Life Science,Guizhou Namoral University,Guiyang 550001;3.Laboratory of Hunan Province for Study and Utilization of Ethnic Medicinal Plant Resources,Huaihua University,Huaihua 418008,China)
【ABSTRACT】Objective:To investigate the effects of extracts from Ajuga decumbens on anti-fatigue inmice.Methods:One hundred and twenty female Kunming(KM)micewere randomly divided into quiet controlgroup,sport controlgroup,positive control group and 3 experimentalgroupswhichwere the low,medium and high dose group given the extracts from Ajuga decumbens.The low,medium and high dose group were given the extractswith 100mg/kg,200mg/kg,400mg/kg by bodyweightofmice for 30 d,respectively,but the positive control group wasgiven American ginseng granules,while the quiet controlgroup and the sport controlgroupswere treatedwith saline.After this,the exhausting time,the physio-biochemical indexes(including lactic acid,blood urea nitrogen,blood sugar,total cholesterol and triglyceride)in serum,the contentsofmuscle and liverglycogen,and the antioxidative indexes(including glutathione peroxidase,superoxide dismutase,catalase andmalondialdehyde)of organs inmicewere investigated.Results:The exhausting time,the number of red blood cell,the contents of hemoglobin and blood sugar,the contentsofmuscle and liverglycogen,and the activitiesofglutathione peroxidase,superoxide dismutase and catalase in organs ofmice in themedium dose group and the high dose groupwere significantlymore than those of the sport controlgroup,but the contentsofblood lactic acid,blood ureanitrogen and thatof triglyceride and total cholesterol in serum,and the contentofmalondialdehyde in organs ofmice in themedium dose group and the high dose groupwere significantly lower than those of the sport controlgroup.And the effectofmedium dose extracts from Ajuga decumbens on anti-fatiguewas better than thatof American ginseng granules.Conclusion:The extracts from Ajuga decumbens has significant anti-fatigue effect inmice.
Ajuga decumbens Thunb(Traditional ChineseMedicine); anti-fatigue effect; anti-oxidant; rat
G804.5;R284.1
A
1000-6834(2016)03-245-05
“民族药用植物资源研究与利用”湖南省重点实验室委托研究项目(YYZW201404);湖南省重点学科建设项目(湘教发[2011]42号)
2015-03-25
2015-10-15
Tel:13574578248;E-mail:pijh817@126.com
