激活SUR2B/Kir6.1通道扩张肺微动脉的分子机制*
2016-09-15崔文玉龙超良张雁芳
陈 筠,王 尚,崔文玉,龙超良,张雁芳,张 浩,汪 海,△
激活SUR2B/Kir6.1通道扩张肺微动脉的分子机制*
陈 筠1,王 尚1,崔文玉2,龙超良1,张雁芳1,张 浩1,汪 海1,2△
(1.军事医学科学院卫生学环境医学研究所 心血管药物研究中心,北京100850;2.北京赛德维康医药研究院心血管药物研究中心 ,北京100039)
目的:以ATP敏感性钾通道(KATP)SUR2B/Kir6.1亚型开放剂埃他卡林(Ipt)为工具药,研究激活SUR2B/ Kir6.1通道扩张肺微动脉作用特征,并探讨其可能的分子机制。方法:利用离体微血管压力-直径监测灌流技术,检测Ipt对大鼠四级肺微动脉的舒张效应(n=6~8),观察内皮损伤后或用KATP通道拮抗剂格列苯脲(Gli)、环氧合酶(COX)抑制剂吲哚美辛(Indo)、一氧化氮合酶(NOS)抑制剂L-Nω-硝基精氨酸甲酯(L-NAME)预孵后肺微动脉舒张率的变化。结果:Ipt能够扩张肺微动脉,最大舒张率为(60.53±2.08)%。内皮细胞损伤后,Ipt扩张肺微动脉作用明显减弱,最大舒张率为(9.47±1.56)%,与对照组相比存在显著性差异(P<0.01)。预孵Gli、Indo、L-NAME后,最大舒张率分别下降为(17.49±1.47)%、(37.00±3.88)%、(24.91±2.30)%,与对照组相比均存在显著性差异(P<0.01)。结论:其选择性开放KATP通道SUR2B/Kir6.1扩张肺微动脉作用具有内皮细胞依赖性,与其促进内皮细胞释放一氧化氮(NO)和前列环素(PGI2)相关。
肺微动脉;埃他卡林;内皮细胞;ATP敏感性钾通道;大鼠
【DOI】10.13459/j.cnki.cjap.2016.03.013
肺动脉高压是一类严重危害人类生命健康的慢性疾病,其中位生存时间仅为2.8年,因此寻找有效的针对新靶点治疗肺动脉高压的药物至关重要。本实验室研究发现,KATP通道是调节阻力血管舒缩功能的重要靶标之一,肺动脉高压的形成与KATP通道功能的下降有关;本室自行设计合成的新型KATP通道SUR2B/Kir6.1亚型开放剂埃他卡林(Iptakalim,Ipt)能够在不影响体循环的情况下,选择性降低肺动脉高压。Ipt可显著抑制长期低氧所致的肺动脉高压,可防治野百合碱诱发的大鼠肺动脉高压及右心衰竭,也可显著拮抗和逆转内皮素1(endothelial-1,ET-1)诱导的肺动脉高压和离体大鼠肺动脉环的收缩反应。但其扩张肺微动脉作用的分子机制尚不十分清楚。本文利用DMT120CP微血管压力-直径灌流监测系统平台研究Ipt扩张肺微动脉的作用特征及其分子机制,为Ipt作为新型药物治疗肺动脉高压临床研究提供理论依据。
1 材料与方法
1.1 试剂与仪器
乙酰胆碱(acetylcholine,ACh)、内皮素1(endothelial-1,ET-1)、格列苯脲(glibenclamide,Gli)、LNω-硝基精氨酸甲酯(L-Nω-Nitro-argininemethyl ester,L-NAME)、吲哚美辛(indomethacin,Indo)、Triton-X均购自美国Sigma公司。埃他卡林(Iptakalim,Ipt)由北京赛德维康医药研究院提供,纯度>99.5%。营养缓冲液(PSS),成分(mmol/L):NaCl 118.3,KCl 4.7,CaCl22.5,KH2 PO41.2,NaHCO311.0,MgSO4 1.2,Glucose 11.1,pH 7.4。采用丹麦DMT公司生产的DMT120CP微血管压力-直径灌流监测系统记录血管管径变化。
1.2 实验动物
雄性Wistar大鼠,体重(180~200)g,由军事医学科学院实验动物中心提供,合格证号:SCXK-(军)2014-004。饲养环境温度(18~25)℃,日光灯照明,每12 h黑暗交替。自由摄食、饮水。
1.3 离体肺动脉环的制备
大鼠断颈处死后,打开胸腔,迅速取出肺组织置于4℃通以95%O2和5%CO2的PSS液中。在体视显微镜下,选取4~5级肺微动脉(管径约180~220 μm),用维纳斯剪小心剥离干净血管周围粘连组织,剪取约2mm的血管环固定在DMT120CP微血管压力-直径灌流监测系统浴槽内的玻璃电极上,两端分别用尼龙绳结系紧。两端的中空玻璃电极同时加压灌流,模拟血管生理状态。给予血管一定的预灌注压(10mmHg),以每5分钟升高10mmHg的速度,将灌注压升至40mmHg,恒温37℃,每20分钟换一次液,平衡1 h左右。采用1 nmol/L ET-1预收缩,收缩后血管给予ACh(10-5mol/L)检验内皮完整性。从中选取ET-1收缩幅度达到60%以上,ACh舒张幅度达到80%以上的内皮完整、活性良好的血管进行实验(n=6~8)。
1.4 Ipt内皮依赖性扩张肺微动脉作用特征的观察
用0.1%Triton X-100灌流肺微动脉5S以去除内皮(n=8),给予肺微动脉40 mmHg灌注压,ACh (10-5mol/L)不再引起血管舒张反应表示内皮去除成功,采用1 nmol/L ET-1预收缩造成血管收缩模型,模型稳定后,累积性加入不同浓度的Ipt(10-11~ 10-4mol/L),记录不同浓度药物对血管管径变化的影响。

1.5 Gli、L-NAME、Indo对Ipt扩张肺微动脉作用的影响的测定
给予肺微动脉40 mmHg灌注压,血管平衡后,分别加入10-5mol/L的Gli(n=7)、10-4mol/L的indo (n=8)、10-4mol/L的L-NAME(n=6)预孵育30min,采用1 nmol/L ET-1预收缩造成血管收缩模型,模型稳定后,再累积性加入不同浓度的Ipt(10-11~10-4mol/L),记录不同浓度药物对血管管径变化的影响。
1.6 统计学处理
所有实验数据采用SAS 9.1软件进行统计学分析,实验数据采用均数±标准差(±s)表示,采用单因素方差分析(One-way ANOVA)进行数据处理。
2 结果
2.1 Ipt内皮依赖性扩张肺微动脉作用
在10-11~10-4mol/L浓度范围内,Ipt对1 nmol/L ET-1预收缩的内皮完整的肺微动脉具有一定的扩张作用(图1A),其最大舒张率为(60.53±2.08)%;内皮损伤后的肺微动脉,Ipt的舒张作用明显减弱,最大舒张率仅为(9.47±1.56)%。与内皮完整组相比存在显著性差异(P<0.05,P<0.01)。
2.2 Gli对Ipt扩张肺微动脉作用的影响
KATP通道拮抗剂Gli(10-5mol/L)能显著抑制Ipt (10-11~10-4mol/L)扩张肺微动脉的作用,最大舒张率仅为(17.49±1.47)%,与对照组(60.53±2.08)%相比存在显著性差异(P<0.05,P<0.01,图1B)。
2.3 Indo对Ipt扩张肺微动脉作用的影响
在10-11~10-4mol/L范围内,预孵COX阻断剂Indo(10-4mol/L)后,Ipt的扩血管作用减弱,但仍保留一定的舒张作用,最大舒张率为(37.00±3. 88)%,与对照组(60.53±2.08)%相比存在显著性差异(P<0.05,P<0.01,图1C)。
2.4 L-NAME对Ipt扩张肺微动脉作用的影响
在10-11~10-4mol/L范围内,预孵NOS抑制剂L-NAME(10-4mol/L)后,Ipt的扩血管作用减弱,但仍保留一定的舒张作用,最大舒张率为(24.91±2. 30)%,与对照组(60.53±2.08)%相比存在显著性差异(P<0.05,P<0.01,图1D)。
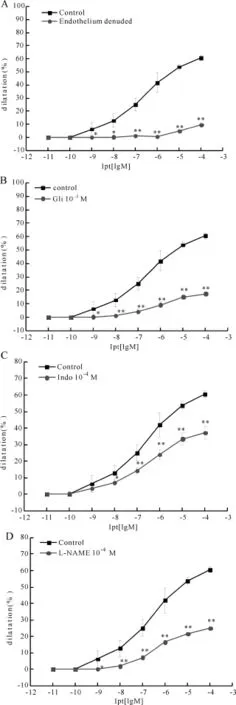
Fig.1 Effects of pulmonary arterial rings responses to iptakalim (±s,n=8)A:Endothelium denuded;B:Pretreatment with Gli(10-5mol/L);C:Pretreatmentwith Indo(10-4mol/L);D:Pretreatmentwith L-NAME(10-4mol/L)
3 讨论
本实验室前期研究证明,Ipt能够在不影响体循环的情况下选择性降低肺动脉高压。本研究对Ipt扩张肺微动脉的分子途径进行了初步探究,结果发现:Ipt能够扩张ET-1预收缩的肺微动脉,该作用能被特异性KATP通道拮抗剂Gli拮抗。Ipt扩张肺微动脉作用具有内皮依赖性,NOS抑制剂L-NAME、COX抑制剂Indo均能抑制Ipt的扩血管作用。
KATP是由内向整流型亚单位kir6.x与磺酰脲受体SUR组成的八聚体复合物[1]。近年来研究发现,钾离子通道的活性降低在肺动脉高压的发生发展中发挥十分重要的作用[2]。肺动脉高压发生发展过程中,K+通道功能下降,K+通道关闭,胞内K+外流减少,引起细胞膜去极化,电压依赖性Ca2+通道开放,胞内Ca2+浓度增加,导致肺血管平滑肌收缩,增殖、肺血管重构[3]。所以,人们认为KATP通道是治疗肺动脉高压药物的一类重要分子靶标[4]。本研究发现Ipt的扩血管作用能被特异性KATP通道拮抗剂Gli拮抗,提示Ipt扩血管作用的分子靶标是KATP。其机制可能是Ipt选择性作用于Kir6.1/SUR2B[5],开放细胞KATP通道,引起胞内K+外流,血管平滑肌细胞膜上的电压依赖性钙离子通道关闭,胞内Ca2+浓度下降,血管平滑肌松弛,血管舒张、血压下降[6]。
肺血管内皮是多种血管活性物质合成和代谢的主要场所。内皮细胞能合成和释放如TXA2、ET等缩血管物质,也能合成和释放NO、PGI2、EDHF等舒血管物质。许多血管活性物质和药物在调节血管张力中的作用具有内皮依赖性[7,8]。本文研究新型抗肺动脉高压药物Ipt发现,其扩张肺微动脉作用与内皮细胞有关,内皮损伤后,Ipt扩血管作用显著降低,提示Ipt主要依赖功能完整的内皮发挥其舒血管效应。NO是目前报道的一类重要的内皮依赖性血管舒张因子。内皮细胞激活NOS,将底物L-精氨酸(L-arginine,L-Arg)转化生成NO,通过NO-sGC-cGMP通路减少胞内钙离子浓度,引起血管平滑肌舒张[9]。Ipt的内皮依赖性扩张肺微动脉作用可能与NO有关。为了进一步验证该分子途径,本研究用NOS抑制剂L-NAME(10-4mol/L)预处理后观察Ipt的扩张肺微动脉作用,发现Ipt扩血管作用被L-NAME部分阻断。提示Ipt可能激活NO途径引发血管舒张效应。结合前期研究,Ipt可能作用于内皮细胞KATP通道,引起细胞膜超极化[10],激活TRPV1通道开放,Ca2+内流,胞内Ca2+浓度升高,通过钙离子-钙调素增强NOS活性,释放NO增加,引起血管舒张。
PGI2是另一类重要的内皮依赖性血管舒张因子,花生四烯酸在COX的作用下生成环内过氧化物,在前列环素酶的催化下进一步生成PGI2。PGI2与膜受体结合,激活GC,cAMP升高,引起胞内钙离子浓度下降 ,血管平滑肌松弛,血管舒张[11]。本研究用COX抑制剂Indo(10-4mol/L)预处理后观察Ipt的扩张肺微动脉作用,发现Ipt的扩血管作用被Indo部分阻断,提示Ipt可能激活环氧合酶途径引发血管舒张效应。前期Ipt在大鼠肠系膜微动脉上的研究表明,Ipt的舒血管作用与环氧合酶途径无关,肺微动脉与肠系膜动脉研究结果存在差异,其原因可能与不同组织的信号通路途径不同有关,具体机制有待进一步研究。
综上所述,Ipt是极具前景的肺动脉高压新治疗药物。它能够舒张ET-1预收缩的肺微动脉,其机制是激活KATP通道SUR2B/Kir6.1亚型开放,引起胞内K+外流,Ca2+浓度下降,血管平滑肌松弛达到降低肺动脉压的作用;Ipt的内皮依赖性舒张肺微动脉作用与内皮细胞释放NO和PGI2有关。
[1]Seino S.ATP-sensitive potassium channels:amodel of hetero-multimeric potassium channcl/releptor asernbbies[J]. Annu Rev Physiol,1999,61:337-362.
[2]Liu SF,Crawley DE,Barnes PJ,et al.Endothelium-derived relaxing factor inhibits pulmonary vasoconstriction in rats[J]. Am Rev Respir Dis,1991,143(1):32~37.
[3]Heurteaux C,Bertaina V,Widmann C,et al.K+channel openers preventglobal ischemia-induced expression of C-fos,C-jun,heatshock protein,and amyloid beta-protein precursor genes and neuronal death in rathippo-campus[J].Proc NatlAcad SciUSA,1993,90(20):9431~9435.
[4]Wickenden A.K+channels as therapeutic drug targets[J]. Pharmacol Ther,2002,94(1-2):157-182.
[5]Seino S,MikiT.Physiologicaland pathophysiological rolesof ATP-sensitive K+channels[J].Pro Biophysic Mol Biol,2003,81(2):133-176.
[6]Irwin RS,Curley FJ,French CL.Chronic cough.The spectrum and frequency of causes,key componentsof the diagnostic evaluation,and outcome of specific therapy[J].Am Rev Respir Dis,1991,141(3):640~647.
[7]Hasunma K,Yamaguchi T,Rodman DM,et al.Effects of inhibitorsof EDRFand EDHFon vasoreactivity of perfused rat lugs[J].Am JPhysiol,1991,260(2Ptl):L97~104.
[8]黄 萍,范小芳,龚永生,等.Apelin对大鼠离体肺动脉环的舒张作用及与一氧化氮的关系[J].中国应用生理学杂志,2011,27(1):1-5.
[9]Wang H,Long C,Duan Z,et al.An new ATP-sensitive potassium channelopener protects endothelial function in cultured aortic endothelial cells[J].Cardiovasc Res,2007,73 (3):497-503.
[10]黄景慧,韩文志,汪 海,等.埃他卡林对间歇性低氧暴露肺微动脉的选择性扩张作用[J].中国应用生理学杂志,2013,29(4):333-336.
[11]Wise H,Jones RL.Focus on prostacylin and its novel mimetics[J].Trends Pharmacol Sci,1996,17(1):17-21.
Molecular mechanism of pulmonary arterioles relaxation through SUR2B/Kir6.1 channel opening
CHEN Jun1,WANG Shang1,CUIWen-yu2,LONG Chao-liang1,ZHANG Yan-fang1,ZHANG Hao1,WANG Hai1,2△
(1.Cardiovascular Drug Research Center,Institute of Health and Environmental Medicine,Academy of Military Medical Sciences,Beijing 100850;2.Cardivascular Drug Research Center,Thadweik Academy of Medicine,Beijing 100039,China)
【ABSTRACT】Objective:To study the dilatation characteristicsof ATP-sensitive potassium channel(KATP)SUR2B/Kir6.1 subtype opener iptakalim(Ipt)in pulmonary arterioles,and to explore its possiblemechanism.Methods:Vessels pressure-diametermonitoring perfusion techniquewas used to observe the dilatation effects of Ipt in rats fourth pulmonary arterioles(n=6~8).After the pulmonary arterioleswere pre-treated with removing endothelium or pre-incubated with KATPchannel blocker glibenclamide(Gli),cyclo-oxygenase(COX)inhibitor indomethacin(Indo)and nitric oxide synthase(NOS)inhibitor L-Nω-Nitro-argininemethyl ester(L-NAME),the dilatation effects of Iptwere observed.Results:Pulmonary arterioles could be relaxed by Ipt,themaximal relaxation ratewas(60.53±2.08)%.Compairedwith control group,the effects of Ipt in endothelium denuded arterioleswere significantly decreased,themaximal relaxation ratewas(9.47±1.56)%(P <0.01).Themaximal relaxation ratewere decreased to(17.49±1.47)%,(37.00±3.88)%and(24.91±2.30)%respectively afterGli,Indo,L-NAMEwere pre-incubated(P<0.01).Conclusion:Pulmonary arterioles can be relaxed by Ipt.The selective activation of KATPSUR2B/Kir6.1 subtype by Iptwas involved in itsmechanisms.The endothelium-dependently dilatation of Iptwas related to nitric oxide(NO)and prostacyclin(PGI2)released by endothelial cells.
pulmonary arterioles; Iptakalim; endothelial cells; ATP-sensitive potassium channel; rats
R331;R972.4
A
1000-6834(2016)03-238-04
军队医药卫生 “十二五”重大专项(AWS11J003);国家973项目(2012CB518200)
2015-10-28
2016-01-18
Tel:010-66932651;E-mail:wh9588@sina.com
