乳清蛋白乳液界面性质及其物理稳定性和氧化稳定性的研究
2016-09-14陈先鑫马晓雨朱雯婷汤小明朱雪梅白春清南昌大学食品科学与技术国家重点实验室江西南昌330047江西科技师范大学生命科学学院江西南昌33003
陈先鑫,马晓雨,朱雯婷,汤小明,朱雪梅,*,熊 华,白春清(.南昌大学食品科学与技术国家重点实验室,江西南昌330047;.江西科技师范大学生命科学学院,江西南昌33003)
乳清蛋白乳液界面性质及其物理稳定性和氧化稳定性的研究
陈先鑫1,马晓雨1,朱雯婷1,汤小明1,朱雪梅1,*,熊华1,白春清2
(1.南昌大学食品科学与技术国家重点实验室,江西南昌330047;
2.江西科技师范大学生命科学学院,江西南昌330013)
以乳清蛋白与玉米油为原料,采用高压均质技术制备水包油型(O/W)乳液。探究乳清蛋白浓度(0.45%~3.60%)、离子强度(250 mmol/L NaCl)对乳清蛋白乳液界面特性及其物理稳定性和氧化稳定性的影响。结果表明:随着乳清蛋白浓度的增加,乳液的粒径、乳析指数、过氧化值(POV)和丙二醛生成物(TBARS)都呈现降低的趋势,而乳液的界面蛋白浓度、电位随着蛋白浓度的增加而增加。乳液中加入250 mmol/L NaCl能够增加乳液的粒径、乳析指数、界面蛋白含量、电位值、POV和TBARS值。上述结果表明乳液界面蛋白浓度增多,乳液的物理稳定性和氧化稳定性得到增强,而乳液中加入NaCl后能够减弱乳液的物理稳定性和氧化稳定性。
乳液,乳清蛋白,物理稳定性,氧化稳定性
乳液通常是指一相以液滴形式均匀分散在另一种与其不相混溶的液体中形成的热力学不稳定分散体系[1]。日常生活中人们所接触到的各种食品如调味品、蛋黄酱、汤、牛奶、饮料等[2]均属于这一体系。由于乳液是热力学不稳定体系,存储过程中经常会出现聚结、奥氏熟化、絮凝和相转化[3-4]等物理失稳现象,除此之外,还会产生乳化剂的水解和油脂氧化衰败等化学失稳现象[5]。上述物理失稳现象会导致乳液液滴平均粒径尺寸增加,并形成大颗粒的聚集,最后导致乳液相分离[6]。
为了解决上述问题,通常的方法是向乳液里添加表面活性剂、抗氧化剂等稳定剂。相比于吐温类、司盘类、阴离子型等普通的小分子类乳化剂,乳清蛋白因为其较高的营养价值、安全性及良好的表面活性和部分抗氧化效能而广泛地应用在食品乳液中[7]。
近年的研究表明,乳液由于具有较大的表面积,其稳定性与界面特性有着紧密的关系。虽然最近有许多关于乳清蛋白乳液稳定性的研究,但是多集中于研究其物理稳定性,如Kulmyrzaev等[7]只是片面研究了pH及KCl对乳清蛋白乳液物理稳定性的影响,没有深刻分析其物理稳定性和氧化稳定性与乳液界面特性的关系。此外由于乳液的稳定性受蛋白质浓度、温度、pH、离子强度等多种因素的影响[5],关于不同乳清蛋白浓度和NaCl对乳液物理稳定性和氧化稳定性的研究更是未见报道。因此本文以乳清分离蛋白与玉米油为原料,系统地研究不同乳清蛋白浓度和NaCl对乳液物理稳定性和氧化稳定性的影响,并揭示了乳液界面蛋白浓度与乳液物理化学稳定性之间的关系,以期为该类型乳清蛋白乳液的工业化生产提供理论依据和技术支持。
1 材料与方法
1.1材料与仪器
玉米油当地超市;乳清分离蛋白蛋白含量91%~92%,Glanbia公司;氯化钠、盐酸、甲醇、正丁醇、异辛烷、异丙醇、硫代巴比妥酸、三氯乙酸等试剂分析纯。
BS 224S型电子天平北京赛多利斯科学仪器有限公司;GYB 30-6S高压均质机上海东华高压均质机厂;NICOMP 380/ZLS激光纳米粒度仪美国PSS公司;JB-3型磁力搅拌器、PHS-3精密pH计上海雷磁新径仪器有限公司;荧光倒置显微镜重庆光学仪器厂;T6紫外可见分光光度计北京普析通用仪器有限公司;Ultra Turrax T25高速分散机德国IKA公司。
1.2实验方法
1.2.1乳液的制备乳液的制备参考Shao等[8]的方法。具体步骤为:将准确称量的乳清蛋白溶于10 mmol/L磷酸缓冲液中,配制两组不同浓度(0.45%、0.90%、1.80%、3.60%,w/v)的乳清蛋白分散液,然后于室温下磁力搅拌5 h,并添加0.02%(w/v)叠氮化钠充当抗菌剂,溶解充分后在4℃的冰箱中水化12 h,使乳清蛋白充分的溶解。
将预先溶解的乳清蛋白溶液从冰箱取出,室温下放置。一组乳清蛋白分散液不进行任何预处理,作为空白;另外一组乳清蛋白分散液,待其恢复到室温后,加入250 mmol/L的NaCl后调至pH为7.0,待用。然后分别向上述两组乳清蛋白分散液中加入10%(v/v)玉米油,用高速分散机在12000 r/min条件下分散2 min,再用高压均质机于40 MPa均质三个循环,即得新鲜制备乳液,均质温度控制在25℃。
1.2.2乳液微观结构的观察采用荧光倒置显微镜观察乳液的微观结构。具体方法为:将50 μL乳液样品和5 μL的1%尼罗红染液均匀混合于载玻片上,然后将载玻片置于载物台上,目镜放大10倍,物镜放大10倍进行观察,CCD照相机连接电脑显示样品的显微图片。
1.2.3平均粒度和Zeta电位的测定用去离子水将新制备的乳液稀释100倍,采用激光纳米粒度仪对新制备的各组乳液粒度和Zeta电位进行测定。
1.2.4界面蛋白含量的测定乳液界面吸附蛋白含量的测定根据Shao等[8]的方法。
1.2.5乳液的储存稳定性将乳液置于室温下储藏,于0、20、30 d测量其粒径,观察其储存稳定性。
1.2.6乳析指数的测定将乳液置于室温下储藏,乳液在储存期间内乳析指数的测定参考王金梅等[9]的方法。
1.2.7乳液过氧化值(POV)的测定将制备的新鲜乳液,立即分装到50 mL的玻璃试管中,于45℃电热恒温培养箱中放置以促进氧化反应,并于1、3、6、11、13、15、19、22 d拿出分装小样进行氧化实验的测定。过氧化值的测定,采用硫氰化铁法,测定方法参考Wan等[10]的方法。
1.2.8次级氧化产物-丙二醛生成物(TBARS)的测定TBARS生成量的测定由Zhao等[11]的方法略微改动而成。具体步骤:TBA(硫代巴比妥酸)试剂的配制:将0.375 g硫代巴比妥酸,15 g三氯乙酸,1.76 mL 12 mol/L HCl,82.9 mL去离子水均匀混合。将1 mL去离子水,2 mL TBA试剂混合于15 mL试管中,漩涡30 s。将试管在沸水中加热25 min后在室温下冷却20 min,随后2500 r/min离心20 min,室温条件放置15 min后,将上层清液用0.22 μm的水系微孔滤膜进行过滤,532 nm下测定滤液的吸光度。根据1,1,3,3-四乙氧基丙烷标准曲线计算乳液中TBARS的浓度。
1.3数据分析
所有实验均重复3次,采用Origin 8.0和SPSS 16.0对实验数据进行统计分析,样品平均值之间的差异性通过Duncan法比较(p<0.05)。
2 结果与分析
2.1新鲜乳液微观结构的观察
由图1可以看出乳液颗粒分散得比较均匀,粒径较小,液滴之间没有出现明显聚结。对比图1A~D和图1E~H,可以发现无论乳液是否加入NaCl,含有0.45%乳清蛋白的乳液的粒径最大,随着乳清蛋白含量的不断增加,乳液粒径不断减小,这主要是因为随着乳清蛋白浓度的升高,它的乳化能力不断增强,更多的乳清蛋白吸附到界面维持乳液稳定,最终形成粒径较小的液滴[8]。此外,当乳液中加入了250 mmol/L NaCl后,可以看出乳液出现了部分的聚集现象,这一特点在0.45%乳清蛋白含量的乳液中表现得较为明显,如图1E所示;对比图1A、B和图1E、F可以发现,加入250 mmol/L NaCl后乳液的粒径比没有加入NaCl的乳液的粒径大,这是因为静电屏蔽作用使得液滴间静电排斥力减小,进一步增大了液滴间的相互吸引作用,增大了乳液的聚集程度,使得乳液的平均粒径有所增加;而对比图1C、D和图1G、H可以发现,当乳清蛋白含量在1.80%以上时,和空白组相比,NaCl仅轻微增加了液滴的平均粒径,进一步说明乳液在较高浓度蛋白含量时较为稳定。

图1 新鲜乳液的荧光倒置显微图Fig.1 Inverted fluorescence micrographs of fresh emulsions
2.2乳液的粒径分布分析
图2A和图2B分别为不加NaCl和加入250 mmol/L NaCl的乳液粒径分布图,可以看出各乳液都呈现较好的单分散性,表明各乳液都形成了均一稳定的体系;此外可以看出随着乳清蛋白含量的增加,乳液粒度分布的峰值均倾向于往较小粒径方向移动,说明乳液的平均粒径逐渐降低[9],与上述新鲜乳液微观结构的观察结果一致。这是由于随着乳清蛋白浓度的升高,它的乳化能力不断增强,乳清蛋白逐渐吸附到界面维持乳液稳定,最终形成粒径较小的液滴[8]。对比图2A和图2B还可以发现,当乳液加入250 mmol/L NaCl后,乳液粒度分布的峰值均倾向于往较大粒径方向移动,说明乳液的平均粒径逐渐增加[9],与上述新鲜乳液微观结构的观察结果一致。这是因为盐离子存在条件下乳液界面的静电屏蔽作用使得乳液的电位绝对值降低,导致液滴间的排斥力下降,液滴间发生部分聚结[8]。对比图2A和图2B可以发现,图2A中各乳液峰值强度分布都集中在10%~12%之间,图2B中除了0.90%蛋白含量的乳液外,其他的乳液峰值强度分布都集中在18%~20%之间,表明乳液加入NaCl后较大粒径的液滴数量增加,具体表现为乳液的平均粒径增加,与上述结果吻合;而图2B中0.90%蛋白含量的乳液峰值强度突然降低至10%,分布开始变宽,出现该现象的原因有待于进一步的研究。
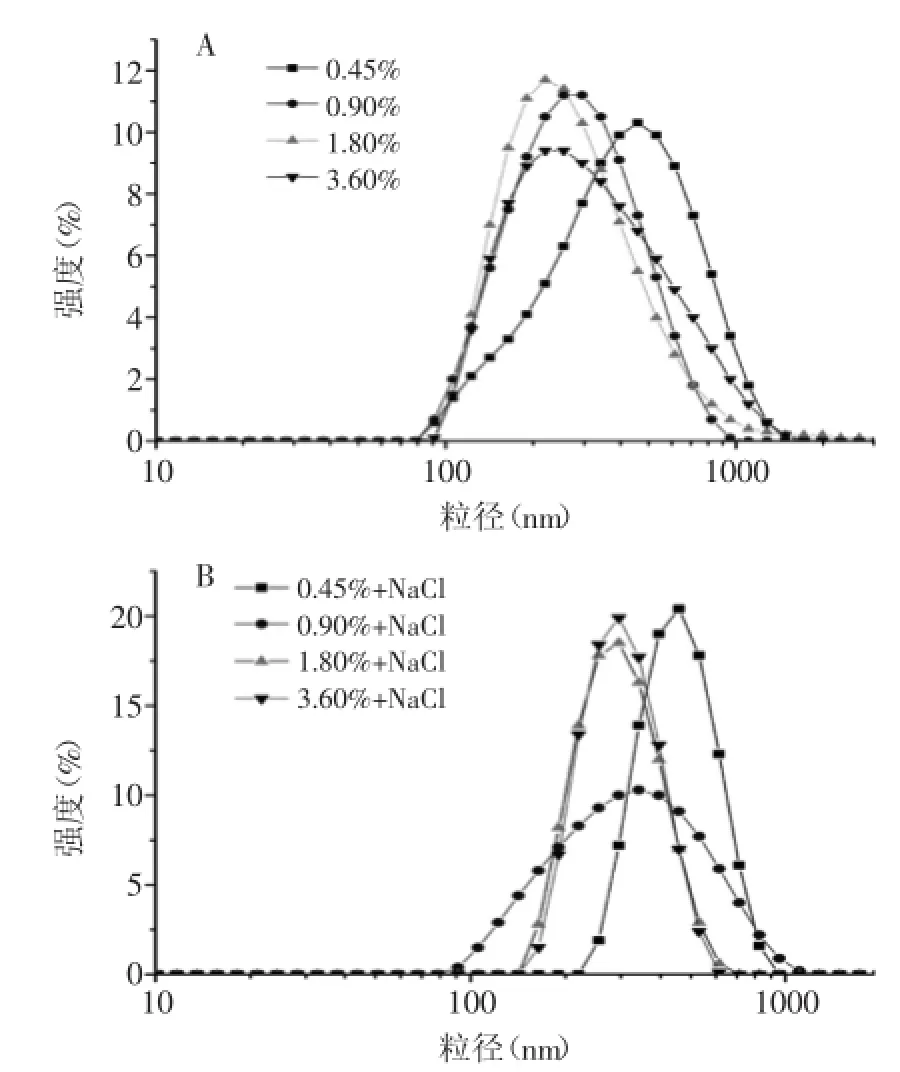
图2 新鲜乳液的粒径分布图Fig.2 Droplet size distribution of fresh emulsions
2.3乳液的电位分析
油滴的表面电荷量决定油滴间排斥作用力的大小,一般可以通过Zeta-电位来体现液滴表面电荷量[8]。其中静电排斥对稳定乳液,阻止液滴聚合有着非常重要的作用[11]。通过图3可以发现所有乳液的电位都呈现负值,这是因为乳液的pH在7.0左右,高于蛋白质的等电点。一般而言,当乳液中Zeta电位的绝对值大于30 mV时,乳液较稳定[5]。由图3可以看出所有乳液的电位值介于-30~-50 mV之间,表明乳液系统较稳定。除了0.45%乳清蛋白含量的乳液外,对于所有乳液来说随着乳清蛋白浓度的增加,电位值增加,即Zeta-电位绝对值均显著降低(p<0.05),而上述新鲜乳液微观结构的观察和粒径分布的结果表明随着乳清蛋白浓度的增加,乳液平均粒径逐渐降低,这说明蛋白乳液的物理稳定性除了和乳液界面的电位相关外,蛋白质在油相和水相之间形成的空间位阻同样对稳定乳液有重要作用[9]。当乳液中加入了250 mmol/L NaCl后,乳液的电位值均增加,以0.90%和1.80%乳清蛋白含量的乳液为例,没有加入NaCl之前,其电位值分别为-48.40 mV和-45.11 mV,加入NaCl后其电位值分别增加到-41.11 mV和-37.72 mV,即电位绝对值都降低了,产生这种现象的主要原因是盐离子加入后在乳液界面产生了静电屏蔽现象。

图3 新鲜乳液的电位图Fig.3 Zeta potential of fresh emulsions
2.4乳液的界面蛋白含量的测定
界面蛋白浓度是表征乳液稳定性的重要参数之一,一般而言,界面蛋白浓度越高,乳液就越稳定[8]。图4揭示了不同蛋白浓度和盐处理对于乳液的界面蛋白浓度的影响。由图4可知,随着蛋白含量的不断增加,乳液中吸附至液滴界面的蛋白含量越多,这一变化规律与乳液微观结构的观察结果和粒径分布的变化趋势一致,这表明乳液界面蛋白浓度和蛋白质的乳化能力之间存在关联性。当乳液中加入了250 mmol/L NaCl后,乳液中界面吸附的蛋白含量也有所增加,与粒径等结果有差异,表明尽管静电屏蔽作用有利于蛋白质吸附至液滴界面,但是乳液的稳定性是受多种因素共同影响的[8]。此外,分析发现本文中高浓度蛋白含量时乳液的界面蛋白浓度明显高于邵云等[8]的结果,如本文中乳清蛋白含量为3.60%时,其界面吸附量接近13 mg/m2,远高于邵云等的3.84 mg/m2的最高界面蛋白浓度,这可能是蛋白质和油的种类不同造成的。

图4 乳液的界面蛋白含量Fig.4 Interfacial protein concentration of emulsions
2.5乳液的物理储存稳定性
乳液置于室温环境下储存一个月的粒径变化趋势见表1。从表1可以看出乳液置于室温下时,0.45%乳清蛋白含量的乳液的粒径最大,随着乳清蛋白含量的不断增加,粒径不断减小,这一结果与前面的粒径分布图等结果一致。加入250 mmol/L NaCl后,乳液的粒径显著增加(p<0.05)。随着储存时间的不断延长,乳液的粒径都有不同程度的增加,0.45%乳清蛋白含量的乳液的粒径增长速度最快,未加入NaCl和加入NaCl的0.45%乳清蛋白含量的乳液的最初平均粒径分别为332.11 nm和415.12 nm,30 d后其粒径分别增加至480.89 nm和859.95 nm,再次证明该乳液的物理稳定性最差;0.90%乳清蛋白含量的乳液的粒径增长速度仅次于0.45%乳清蛋白含量的乳液,未加入NaCl和加入NaCl的0.90%乳清蛋白含量的乳液的最初平均粒径分别为249.20 nm和286.19 nm,30 d后其粒径分别增加至321.58 nm和374.46 nm;1.80%乳清蛋白含量的乳液的粒径增长速度较缓慢,最初平均粒径为243.72 nm,30 d后其粒径仅增加至299.54 nm,该乳液加入250 mmol/L NaCl后,粒径增长速度增加,最初平均粒径为291.16 nm,30 d后其粒径增加至369.67 nm;未加入NaCl和加入NaCl的3.60%乳清蛋白含量的乳液的最初平均粒径分别为240.27 nm和293.37 nm,一个月后其粒径分别增加至289.27 nm和310.14 nm,其增长速度最缓慢。上述结果表明随着乳液中乳清蛋白浓度的增加,乳液中界面蛋白浓度逐渐增加,更多的的乳清蛋白吸附到乳液界面维持乳液稳定,乳液的储存稳定性逐渐增强,而乳液加入NaCl后,由于盐离子条件下乳液界面的静电屏蔽作用使得乳液的电位绝对值下降,导致液滴间的排斥力降低,液滴间发生部分聚集,使得乳液平均粒径增加,储存稳定性变差。
2.6乳液乳析指数的测定
乳液的乳析指数是关于乳液中油相和连续相之间平衡稳定状态的指标,是评价乳液物理稳定性的一个非常重要的参数[12]。表2反映了乳液储存120 d内乳析指数的变化情况。分析发现,储存60 d后,未加入NaCl和加NaCl的0.45%蛋白含量的乳液的乳析指数分别增加到7.69%和20.51%,乳液经过盐处理后,其乳析指数显著增加(p<0.05),这是因为盐离子存在条件下乳液油滴界面的静电屏蔽作用使得液滴间发生聚结,造成了乳液失稳,从而加快了乳液油、水两相的分层[8];其他乳液都未发现乳液分层的情况。乳液储存120 d后,所有乳液都出现分层的情况,且随着蛋白浓度的增加,乳液的乳析指数不断降低。乳液加入NaCl后,与空白组相比0.45%蛋白含量的乳液中乳析指数增加较为显著,而其他较高蛋白浓度乳液的乳析指数虽有所增加,但是幅度不大,说明乳清蛋白浓度较高时对乳液脂肪上浮有抑制作用。这些结论和前面的粒径等结果一致,并与邵云等[8]的研究发现基本一致。
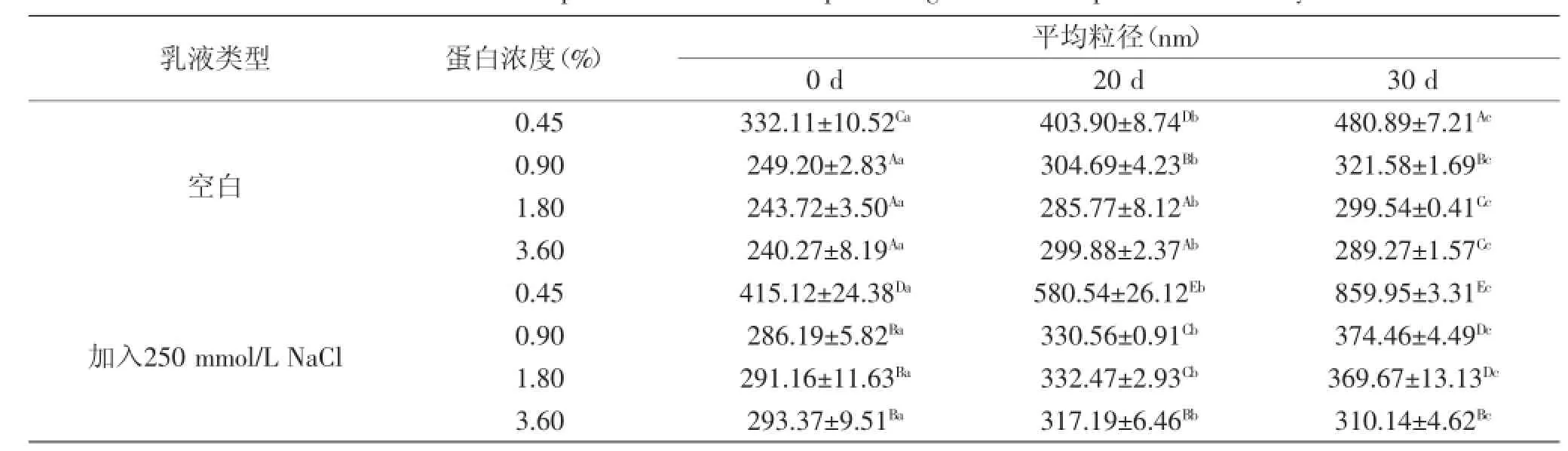
表1 乳液室温储存30 d的粒径变化趋势Table 1 Evolution of droplet size of emulsions upon storage at room temperature for 30 days

表2 乳液室温储存120 d内乳析指数的变化趋势Table 2 Evolution of creaming index percentage of the emulsions upon storage at room temperature for 120 days
2.7乳液的氧化稳定性的测定
图5揭示了不同乳清蛋白浓度和NaCl对乳液POV值的影响。由图5可以看出所有乳液的POV值随着储存时间的增加而增大,而且蛋白浓度为0.45%的乳液中油脂的氧化速度最快,22 d后乳液中POV值达到了60.58 mmol/kg oil,而22 d后蛋白含量为0.90%~3.60%的乳液POV值分别为22.29、17.76、17.55 mmol/kg oil。上述结果表明一定范围内,随着乳液中乳清蛋白含量的增加,更多的蛋白质吸附到界面维持乳液稳定,在水相和油相之间形成空间位阻,此外,乳液中的蛋白质吸附在油滴表面后形成一层粘弹性蛋白膜,该蛋白膜可以螯合金属离子和清除自由基,可以起到抑制油脂氧化的作用[8],所以乳液的氧化稳定性得到提高;当蛋白含量超过1.80%时,POV值降低趋势不明显。乳液中加入了NaCl后,其POV变化趋势与未加入NaCl的基本一致,22 d后,蛋白含量为0.45%~ 3.60%的乳液POV值分别为65.47、27.24、25.17、23.66 mmol/kg oil,表明乳液中加入NaCl后,乳液的氢过氧化物生成量增加,氧化稳定性降低,与前述乳液物理稳定性的结果一致。

图5 乳液的POV变化趋势图Fig.5 Evolution of POV of emulsions
TBARS值是表征脂质次级氧化程度的指标之一,一般将TBARS值与POV值相结合,来共同分析油脂的氧化进程。由图6可以看出,乳液储存22 d后,0.45%蛋白含量的乳液中TBARS含量仍然是最高的,随着蛋白含量增加,TBARS值先降低再逐渐升高,与POV的结果稍有不同,表明蛋白质抑制油脂初级氧化的原理和抑制次级氧化的原理稍有差异。此外,乳液中加入NaCl后,TBARS都显著增加(p<0.05),这一结果和POV的结论一致。

图6 乳液的TBARS变化趋势图Fig.6 Evolution of TBARS of emulsions
综合乳液POV和TBARS的分析结果,可以看出0.45%蛋白含量的乳液氧化稳定性最差,增加蛋白质浓度后,更多的蛋白质吸附到界面维持乳液稳定,POV和TBARS减少,乳液的氧化稳定性得到提高。乳液中加入NaCl后POV和TBARS都增加,表明乳液的氧化稳定性降低,与粒径、乳析指数等结果吻合。
3 结论
本文究了不同乳清蛋白浓度和NaCl对于乳液界面性质和物理化学稳定性的影响。结果表明:增加乳清蛋白的浓度,乳液的粒径、Zeta-电位绝对值、乳析指数、POV值和TBARS值都呈现降低的趋势,而乳液的界面蛋白浓度呈现增加的趋势。加入250 mmol/L NaCl到乳液后能够增加乳液的粒径、乳析指数、界面蛋白含量、POV和TBARS值,但降低了乳液的Zeta-电位绝对值。以上实验结果说明一定范围内增加乳液中乳清蛋白浓度后,更多的蛋白质吸附到乳液的界面,形成一种天然屏障,空间位阻增强,从而减少水相和油相间,液滴与液滴间的接触,抑制了乳液的氧化速率和液滴间的聚集,所以乳液的物理稳定性和氧化稳定性得到提高。而NaCl加入乳液后,由于静电屏蔽作用使得静电排斥力减小,进一步增强了液滴间的相互吸引作用,增大了乳液的失稳程度,使得乳液的物理稳定性和氧化稳定性降低。
[1]Falkeborg M,Guo Z.Dodecenyl succinylated alginate(DSA)as a novel dual-function emulsifier for improved fish oil-inwater emulsions[J].Food Hydrocolloids,2015(46):10-18.
[2]Huck-Iriart C,Rincón-Cardona J A,Herrera M L.Stability of whey protein concentrate/sunflower oil emulsions as affected by sucrose and xanthan Gum[J].Food and Bioprocess Technology,2014,7(9):2646-2656.
[3]Liang Y,Gillies G,Patel H,et al.Physical stability,microstructure and rheology of sodium-caseinate-stabilized emulsions as influenced by protein concentration and nonadsorbing polysaccharides[J].Food Hydrocolloids,2013,36(2):245-255.
[4]Cui Z,Kong X,Chen Y,et al.Effects of rutin incorporation on the physical and oxidative stability of soy protein-stabilized emulsions[J].Food Hydrocolloids,2014,41(20):1-9.
[5]卢锦丽.食品级纯胶O/W乳液稳定性及流变特性研究[D].杭州:浙江工商大学,2013.
[6]田大志.柠檬精油乳液的物理化学稳定性研究[D].武汉:湖北工业大学,2014.
[7]Kulmyrzaev A A,Schubert H.Influence of KCl on the physicochemical properties of whey protein stabilized emulsions [J].Food Hydrocolloids,2004,18(1):13-19.
[8]Shao Y,Tang C H.Characteristics and oxidative stability of soy protein-stabilized oil-in-water emulsions:Influence of ionic strength and heat pretreatment[J].Food Hydrocolloids,2014,37 (2):149-158.
[9]王金梅.大豆蛋白热聚集行为及界面、乳化性质研究[D].广州:华南理工大学,2012.
[10]Wan Z L,Wang J M,Wang L Y,et al.Complexation of resveratrol with soy protein and its improvement on oxidative stability of corn oil/water emulsions[J].Food Chemistry,2014,161(6):324-331.
[11]Zhao Q,Selomulya C,Wang S,et al.Enhancing the oxidative stability of food emulsions with rice dreg protein hydrolysate[J]. Food Research International,2012,48(2):876-884.
[12]李薇.米渣蛋白酶解物壁材特性及其微胶囊化研究[D].南昌:南昌大学,2011.
Study on the interfacial property,physical and oxidative stability of emulsions stabilized by whey protein
CHEN Xian-xin1,MA Xiao-yu1,ZHU Wen-ting1,TANG Xiao-ming1,ZHU Xue-mei1,*,XIONG Hua1,BAI Chun-qing2
(1.State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China;2.College of Life Science,Jiangxi Science and Technology Normal University,Nanchang 330013,China)
In this study,whey protein and corn oil were used to prepare oil-in-water(O/W)emulsions using high-pressure homogenization.The effects of whey protein concentration(0.45%~3.60%)and ionic strength (250 mmol/L NaCl)on the interfacial property,physical and oxidative stability of emulsions were investigated. The results showed that increasing whey protein concentration lead to decrease in the particle size,creaming index,peroxide value(POV)and thiobarbituric acid reactive substances(TBARS),and increase in interfacial protein concentration and potential.Addition of 250 mmol/L NaCl contributed to increase in the particle size,creaming index,interfacial protein concentration,potential,POV and TBARS values of the emulsions.These findings indicated that the physical and oxidative stability of the emulsions could be improved by increasing the interfacial protein concentration or decreasing ionic strength.
emulsion;whey protein;physical stability;oxidative stability
TS201.1
A
1002-0306(2016)04-0155-06
10.13386/j.issn1002-0306.2016.04.022
2015-07-06
陈先鑫(1990-),男,硕士研究生,研究方向:食品营养,E-mail:994821760@qq.com。
朱雪梅(1982-),女,博士,副教授,主要从事功能性油脂和油脂化学方面的研究,E-mail:zhuxuemei@ncu.edu.cn。
南昌大学科研训练(创新学分)项目(14001748);国家“十二五”农村领域科技计划项目(2013AA102203-05)。
