多重破壁技术提取葡萄酒泥废酵母β-葡聚糖研究
2016-09-14张宏海盛文军韩舜愈甘肃农业大学食品科学与工程学院甘肃兰州730070甘肃省葡萄与葡萄酒工程学重点实验室甘肃兰州730070
程 超,张宏海,2,盛文军,2,韩舜愈,2,王 婧,2,*(.甘肃农业大学食品科学与工程学院,甘肃兰州730070;2.甘肃省葡萄与葡萄酒工程学重点实验室,甘肃兰州730070)
多重破壁技术提取葡萄酒泥废酵母β-葡聚糖研究
程超1,张宏海1,2,盛文军1,2,韩舜愈1,2,王婧1,2,*
(1.甘肃农业大学食品科学与工程学院,甘肃兰州730070;2.甘肃省葡萄与葡萄酒工程学重点实验室,甘肃兰州730070)
以葡萄酒泥废酵母为试材,采用高压均质法和冻融法协同破碎酵母细胞壁,并辅以复合蛋白酶和脂肪酶酶解技术,研究多重破壁技术对β-葡聚糖纯度的影响。在单因素实验基础上,利用Box-Behnken实验设计原理,以酵母浓度、均质时间和冻融加水量为实验因素,以β-葡聚糖纯度为响应值,优化葡萄酒泥酵母β-葡聚糖提取工艺。结果表明:葡萄酒泥酵母β-葡聚糖最优提取工艺为均质压力70 MPa,酵母浓度13%,均质时间34 min,冻融加水量25%,在此条件下提取所得酵母β-葡聚糖纯度为91.69%,得率为13.23%,该方法为酵母葡聚糖的开发利用提供了参考依据。
葡萄酒泥废酵母,工业化破壁,复合酶解,β-葡聚糖
近几年多项研究表明,酵母β-葡聚糖是目前生物活性较强的一类免疫多糖,具有增强免疫力、抗氧化、抗肿瘤、抗病毒、降低胆固醇、防辐射、治愈伤口等诸多生物活性作用,可以参与生物细胞的多种生命调节[1-4]。因此,备受国内外学者的关注。
葡萄酒泥废酵母是葡萄酒酿造过程中的主要副产物之一,其生成量约占葡萄酒产量的4%~5%[5-6]。因此,利用葡萄酒泥废酵母开发β-葡聚糖,变废为宝,不仅可以大幅度降低原料的生产成本,而且能够有效减轻企业的环保压力,获得社会效益。
酵母β-葡聚糖属于细胞壁结构多糖,位于细胞壁的最内层,占细胞壁干重的30%~60%[7]。因此通过大规模破碎酵母细胞壁可分离提取酵母葡聚糖。目前常用的破壁方法较多,主要有酶法、机械破壁法、冻溶法、有机溶剂法等,但各种破壁方法都有各自的优缺点。郭卫芸等[8]对反复冻融法破碎啤酒酵母细胞壁的研究发现,该方法对酵母内部的有效成分损害较小,但存在得率和产品纯度低等缺点;Chema B等[9]研究发现蛋白酶和脂肪酶处理能够从酿酒酵母细胞壁中提取β-葡聚糖,但这种单一方法酶解时间较长,细胞破壁率较低,导致产品纯度低。张莉弘等[10]利用超声波处理使啤酒酵母破壁,但该方法处理量小,只适用于实验室研究。高压均质法利用机械破壁原理,方法简单,成本低廉,处理量大,但戴宁等[11]利用该方法对酵母破壁的研究发现,这种单一破壁方法也存在产品得率低的缺点。因此,利用多重复合破壁技术工业化制备酵母β-葡聚糖具有重要的研究价值。
本研究以葡萄酒泥废酵母为原料,采用适合工业化生产的高压均质法和冻融法协同破碎酵母细胞壁,并辅以复合蛋白酶和脂肪酶酶解技术;以β-葡聚糖纯度为评价指标,在单因素实验设计的基础之上,通过响应面设计优化提取工艺,以期建立较为高效的工艺路线,旨在为开发利用葡萄酒泥酵母β-葡聚糖提供理论依据和技术支撑。
1 材料与方法
1.1材料与仪器
葡萄酒废酵母泥甘肃紫轩酒业有限公司;D-葡萄糖标准品Sigma公司,纯度≥98%;木瓜蛋白酶(80万U/g)、中性蛋白酶(20万U/g)、脂肪酶(2万U/g)上海源叶生物科技有限公司;酵母抽提酶(40万U/g)
南宁庞博生物工程有限公司;其他试剂均为分析纯。
Genesis 10s紫外可见分光光度计美国Thermo Scientific公司;TD5A-WS型台式低速离心机长沙湘仪离心机仪器有限公司;GYB 60-6S高压均质机(功率3 kW,额定流量60 L/h)上海东华高压均质机厂;海尔冰箱青岛海尔股份有限公司;电热恒温鼓风干燥箱上海跃进医疗器械有限公司;LDZX-50KBS立式压力蒸汽灭菌器上海申安医疗器械厂。
1.2实验方法
1.2.1葡萄酒泥废酵母β-葡聚糖提取工艺
1.2.1.1工艺流程葡萄酒泥预处理→诱导自溶→高温浸提→高压均质→冻融→复合蛋白酶→脂肪酶→沉淀(乙醇洗涤)→烘干(65℃至恒重)→β-葡聚糖。
1.2.1.2操作要点a.葡萄酒泥预处理[12]:收集葡萄酒泥,加等体积蒸馏水混匀,过80目筛,反复洗涤(4000 r/min,10 min),直至酒泥沉淀呈白色,上清液澄清为止,收集湿酵母细胞备用。
b.诱导自溶:取10 g湿酵母细胞悬浮于100 mL乙酸-乙酸钠缓冲液(pH4.4)中,并添加2.2%的NaCl,50℃自溶27 h。
c.甘露糖蛋白的去除[9]:取自溶后酵母细胞沉淀10 g悬浮于100 mL 50 mmol/L磷酸缓冲液(pH7.0)中,121℃高温浸提5 h。
d.高压均质[13]:将高温浸提后酵母细胞沉淀加水配成悬浮液,利用高压均质机进行破壁,设定均质压力(70 MPa)和不同均质时间。
e.冻融[14-15]:取高压均质后酵母细胞沉淀,添加不同量蒸馏水,反复冻融。
f.复合蛋白酶处理:将酵母抽提酶、木瓜蛋白酶和中性蛋白酶进行复配。其中,三种酶添加量分别为0.5%;酶解时间50 min、温度55℃、pH7.0、料液比1∶5 (g/mL)。
g.脂肪酶处理[9]:控制脂肪酶添加量为0.1%,酶解时间3 h、温度40℃、pH7.0、料液比1∶10(g/mL)。1.2.2单因素实验
1.2.2.1酵母浓度对β-葡聚糖纯度的影响将高温浸提后的酵母细胞沉淀加水配成5.0%、7.5%、10.0%、12.5%、15.0%的悬浮液,控制每次处理的菌液体积为500 mL,设定均质压力(70 MPa)和均质时间(30 min);加蒸馏水反复洗涤3次,离心收集沉淀,并测定β-葡聚糖的纯度。
1.2.2.2均质时间对β-葡聚糖纯度的影响将高温浸提后的酵母细胞沉淀加水配制成7.5%的悬浮液,控制菌液体积,设定均质压力(70 MPa)和不同均质时间(10、20、30、40、50 min);加蒸馏水反复洗涤3次,离心收集沉淀,并测定β-葡聚糖的纯度。
1.2.2.3冻融加水量对β-葡聚糖纯度的影响称取适量经高压均质后的酵母细胞沉淀,分别添加不同量的蒸馏水(10%、15%、20%、25%、30%),在-18℃冻结2 h,反复冻融3次,沸水浴中解冻30 min;加蒸馏水反复洗涤3次,离心收集沉淀,并测定β-葡聚糖的纯度。
1.2.2.4冻融次数对β-葡聚糖纯度的影响称取适量经高压均质后的酵母细胞沉淀,添加20%的蒸馏水,在-18℃冻结2 h,分别反复冻融1、2、3、4、5次,并在沸水浴中解冻时间为30 min;加蒸馏水反复洗涤3次,离心收集沉淀,并测定β-葡聚糖的纯度。
1.2.3响应面优化实验在单因素实验的基础上,借助Design-Expert 8.0软件,运用Box-Behnken实验设计原理,以均质时间(A)、冻融加水量(B)、酵母浓度(C)为自变量,以β-葡聚糖纯度为响应值,设计3因素3水平的响应面分析实验,优化提取条件。

表1 响应面优化实验因素水平表Table 1 Levels and factors for the response surface optimization test
1.2.4β-葡聚糖含量测定方法采用紫外分光光度法
1.2.4.1标准曲线的制作[16]准确配制葡萄糖质量浓度分别为32、48、64、80、96、112、128 μg/mL的系列溶液绘制标准曲线。
1.2.4.2样品处理[17]准确称取酵母β-葡聚糖样品0.4 g(精确至0.1 mg)至20 mL具塞试管中,加入6 mL 浓HCl(37%,v/v)混匀。在30℃下水浴45 min(每15 min混合振荡1次)。然后将悬浮物定量转移到200 mL杜氏瓶中,将杜氏瓶放入高压灭菌锅,121℃,60 min。取出后冷却,用NaOH溶液调溶液pH到6~7,然后定容至200 mL,过滤备用。
1.2.4.3β-葡聚糖含量测定[18]取稀释的样品液1 mL(相当于45 μg左右的葡萄糖),按1.2.4.1步骤操作,测定OD490,以标准曲线计算成品中β-葡聚糖含量。

式中,C为样品溶液中葡萄糖的浓度(mg/mL);D为样品溶液的稀释倍数;W为相应的样品质量(mg)。
1.2.5β-葡聚糖纯度和得率的计算[19]β-葡聚糖纯度(%)=提取物中β-葡聚糖含量/提取物总重量×100
β-葡聚糖得率(%)=最终β-葡聚糖产品重量/原料总重量×100
1.2.6蛋白质和脂肪的测定参照GB 5009.5-2003[20]和GB/T 5009.6-2003[21]的方法。
1.2.7统计分析采用SPSS 18.0软件进行实验数据分析。
2 结果与讨论
2.1葡萄糖标准曲线的绘制
以D-葡萄糖为标准样品,紫外分光光度法制作标准曲线如图1所示。标准曲线方程为:y=0.0085x-0.0142,相关系数R2=0.9986,吸光度值和葡萄糖浓度呈现良好的线性关系。
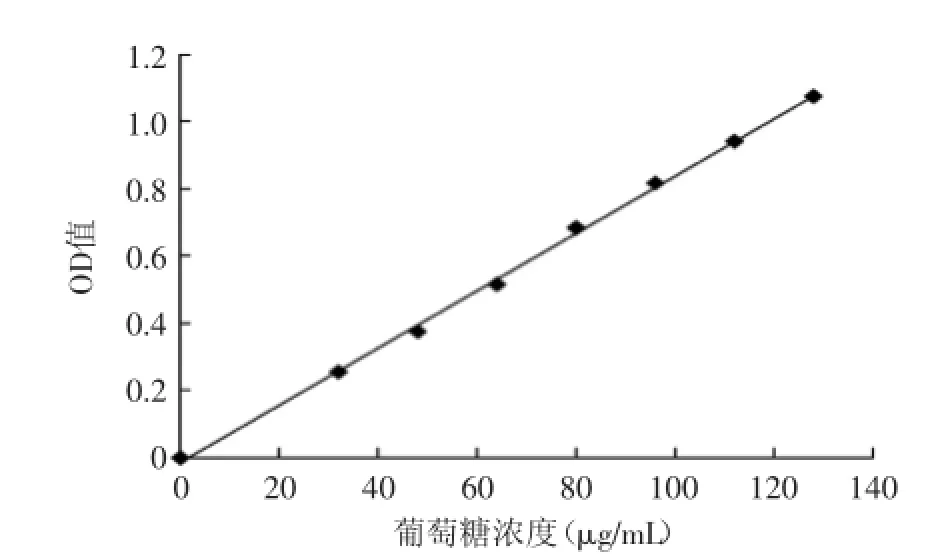
图1 葡萄糖标准曲线Fig.1 Standard curve of Glucose
2.2单因素结果与分析
2.2.1酵母浓度对β-葡聚糖纯度的影响由图2可知,在高压均质过程中,酵母浓度在5.0%~12.5%范围内,β-葡聚糖纯度呈缓慢上升趋势;当酵母浓度为12.5%时,β-葡聚糖纯度达到最大值67%,并显著高于其他浓度,说明12.5%为高压均质较适的酵母浓度;而酵母浓度超过12.5%后,随着浓度增加,β-葡聚糖纯度呈下降趋势,可能是由于酵母浓度增加使表观粘度增加,而粘度会影响高压均质的作用效果,因此酵母浓度增加会使高压均质的破碎效率下降,故而影响β-葡聚糖的纯度。
2.2.2均质时间对β-葡聚糖纯度的影响由图3可知,在均质压力70 MPa下,均质时间对β-葡聚糖纯度有显著影响。随着均质时间增加,β-葡聚糖纯度呈现先显著上升后逐渐稳定的趋势,当均质时间为30、40、50 min时β-葡聚糖纯度变化不大。原因在于高压
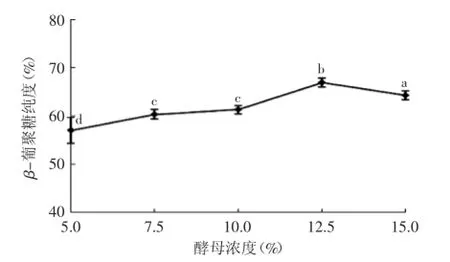
图2 酵母浓度对β-葡聚糖纯度的影响Fig.2 Effect of different yeast concentration on the purity of β-Glucan

图3 均质时间对β-葡聚糖纯度的影响Fig.3 Effect of different homogeneous time on the purity of β-Glucan均质时间为30 min时,酵母细胞破壁效果较好,随着均质时间增加,破壁率的上升梯度开始减小,可以预测破壁率会逐渐趋于一个特定水平而不再变化,因而β-葡聚糖纯度变化不大。
2.2.3冻融加水量对β-葡聚糖纯度的影响由图4可知,冻融加水量对β-葡聚糖纯度有显著影响。随着加水量的增加,β-葡聚糖纯度呈现先显著上升后逐渐平稳的趋势,当加水量为25%时,β-葡聚糖纯度显著高于加水量为20%时的β-葡聚糖纯度,达到了76.14%;而后随着加水量的增加,β-葡聚糖纯度变化不大,逐渐趋于稳定水平。原因在于酵母细胞内部间隙在加水量25%时被水分几乎完全填充,致使在反复冻融(冻结-解冻)过程中冰晶体对酵母细胞的机械作用发挥到最大。

图4 冻融加水量对β-葡聚糖纯度的影响Fig.4 Effect of different freezing-thawing water content on the purity of β-Glucan
2.2.4冻融次数对β-葡聚糖纯度的影响由图5可知,冻融次数对β-葡聚糖纯度有显著影响。随着冻融次数的增加,β-葡聚糖纯度呈现先显著上升后逐渐平稳的趋势,当冻融次数为3次时,β-葡聚糖纯度达到了74.41%;而后随着冻融次数的增加,纯度变化幅度不大,逐渐趋于稳定水平。原因在于当冻融次数达到一定限度后,酵母细胞大部分已被破碎,破碎率趋于较大值,因而β-葡聚糖纯度不会再有较大幅度的变化。
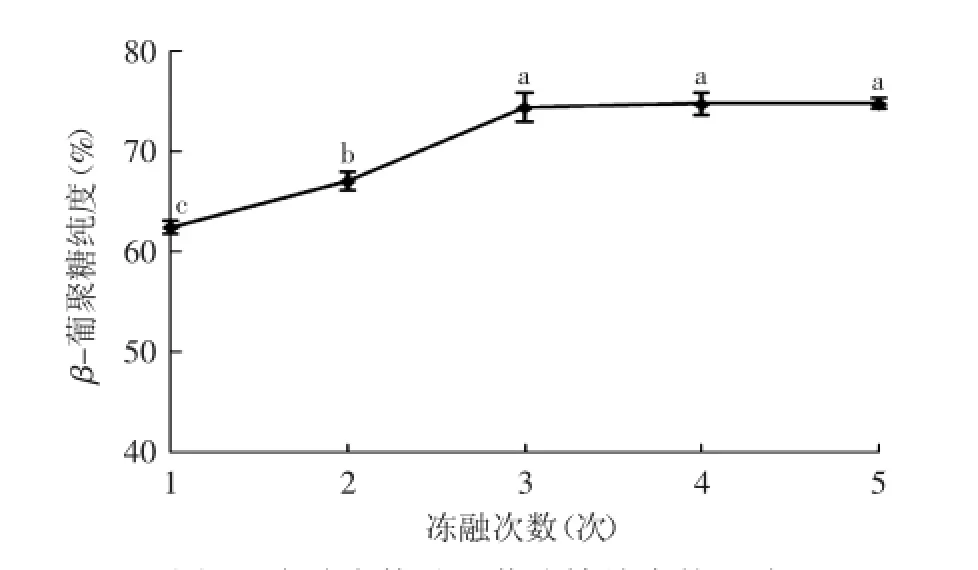
图5 冻融次数对β-葡聚糖纯度的影响Fig.5 Effect of different freezing-thawing number on the purity of β-Glucan
2.3响应面实验设计及结果
2.3.1回归模型的确定实验设计及结果见表2。将表2实验数据用Design-Expert软件进行多元回归分析,得到β-葡聚糖纯度与各因素变量的二次方程模型为:

该方程复相关系数R2为0.9850,响应变量R2为0.9658,因此,可以充分描述独立变量对葡萄酒泥酵母中β-葡聚糖纯度的影响。该模型Prob(p)>F值为0.0001,模型极显著,模型拟合程度良好。
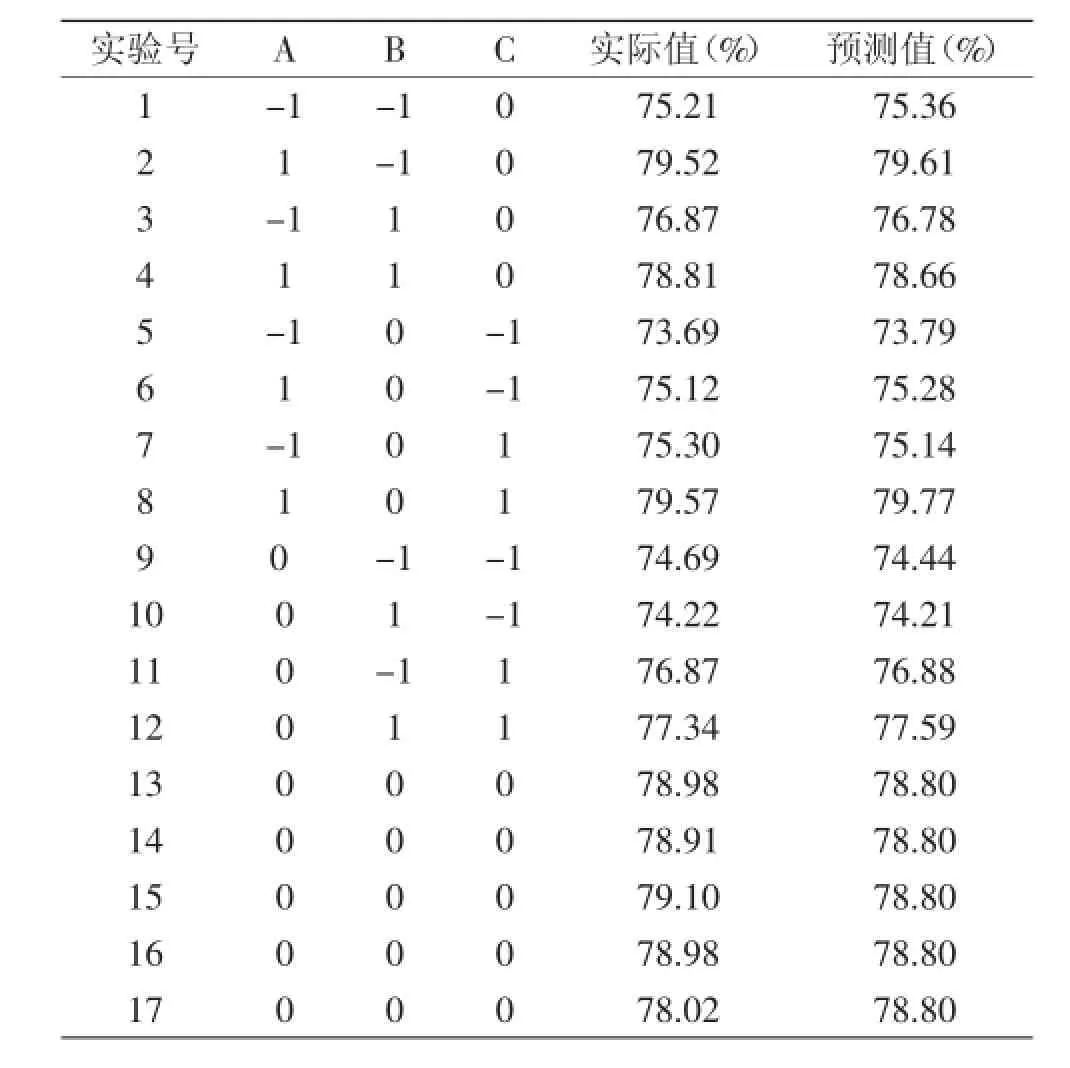
表2 Box-Behneken响应面实验结果Table 2 Results of Box-Behnken response surface experiments
2.3.2回归方程的方差分析由表3可以看出,回归方程的一次项(除B外)和二次项(除A2外)极显著,说明各具体因素对响应值的影响不是简单线性关系。交互项AB显著,AC极显著,说明A和B,A和C之间交互作用很好。另外,模型的变异系数CV为0.49%,证明回归方程拟合程度较好,说明实验具有很高的可信性和准确性。失拟项不显著,说明实验误差很小。
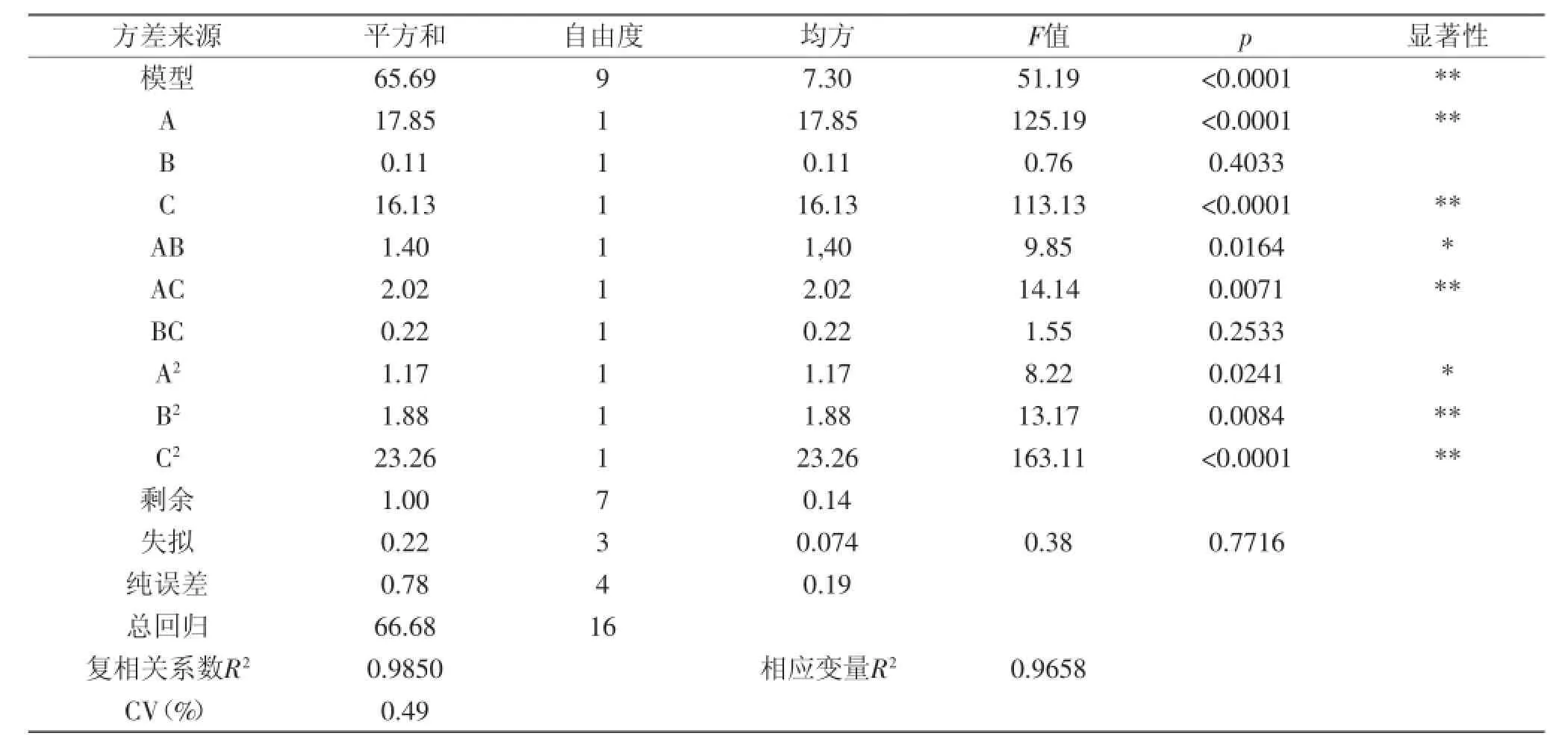
表3 回归模型的方差分析Table 3 Variance analysis for the regression equation
各因素的影响程度分析,各因素的F值可以反映各因素对实验指标的重要性,F值越大,表明对实验指标影响越大。从方差分析表可知各因素对β-葡聚糖纯度的影响程度大小顺序为:均质时间>酵母浓度>冻融加水量。
2.3.3各因素之间的交互作用根据回归方程做出响应面分析图,考察所拟合的响应曲面的形状,反映均质时间、冻融加水量、酵母浓度对响应值的影响。观察响应曲面所对应的等高线图来确定两因素对响应值的影响程度,等高线为椭圆,则说明两者交互作用显著。
由图6和方差分析可知,因素A与B,A与C交互作用显著,而B与C之间的交互作用不显著。

图6 A(均质时间)、B(冻融加水量)和C(酵母浓度)的交互响应面图Fig.6 Response surface figure of homogeneous time,freezingthawing water content and yeast concentration
2.3.4验证实验及结果分析由响应曲面及回归方程分析可知,葡萄酒泥废酵母β-葡聚糖的最佳提取工艺条件为:均质时间33.51 min,冻融加水量25.46%,酵母浓度12.74%。为检验响应曲面法所得结果的可靠性,采用上述优化条件提取酵母β-葡聚糖,考虑到实际操作的便利,将提取工艺参数修正为:均质时间34 min,冻融加水量25%,酵母浓度13%。按上述条件进行实验结果的验证,进行3次平行实验,测得β-葡聚糖的平均纯度为79.69%,与理论预测值(79.88%)相比,其相对误差约为0.19%,说明通过响应面优化得到的回归方程具有一定的实践指导意义。
2.4不同破壁工艺提取酵母β-葡聚糖纯度及得率分析
对葡萄酒泥废酵母β-葡聚糖提取过程中每步工艺所得产物的成分进行分析,结果见表4。在整个提取过程中,β-葡聚糖的纯度逐渐增加,特别是高压均质处理(S4)、冻融处理(S5)、复合蛋白酶酶解(S6)这三步工艺,对所得产物的β-葡聚糖纯度有显著影响,β-葡聚糖纯度由51.99%增加到89.05%。蛋白质的含量随各提取步骤而逐渐减小,由起始的58.27%降到3.07%。脂肪含量则在整个提取过程中由起始的5.10%降到了微量,尤其是脂肪酶处理对脂肪含量的降低有较大影响,这与Silke C J等[22]研究结果相仿。朱益波等[19]采用适合工业化生产的高速分散机并辅以酶法对废啤酒酵母进行破壁处理以获得β-葡聚糖,所得提取物中总糖质量百分含量为84.90%,得率为13.70%;Chema B等[9]采用复合酶处理从酿酒酵母细胞壁中提取β-葡聚糖,所得产品纯度为79%。本研究结果表明葡萄酒泥废酵母经过洗涤、诱导自溶、高温浸提、高压均质结合冻融法破壁、复合蛋白酶解、脂肪酶解后β-葡聚糖纯度可以达到91.69%,最终得率为13.23%。相比之下,本实验提取所得酵母β-葡聚糖纯度得到显著提高,而且该方法摒弃了传统的酸、碱及氧化剂的使用,且破壁工艺中采用机械法和反复冻融相结合,具有设备简单,处理量大、效率高等特点,不仅获得了较高的产品纯度,而且该方法运转成本较低,适合工业化生产,能够为葡萄酒泥酵母β-葡聚糖的开发利用提供参考。
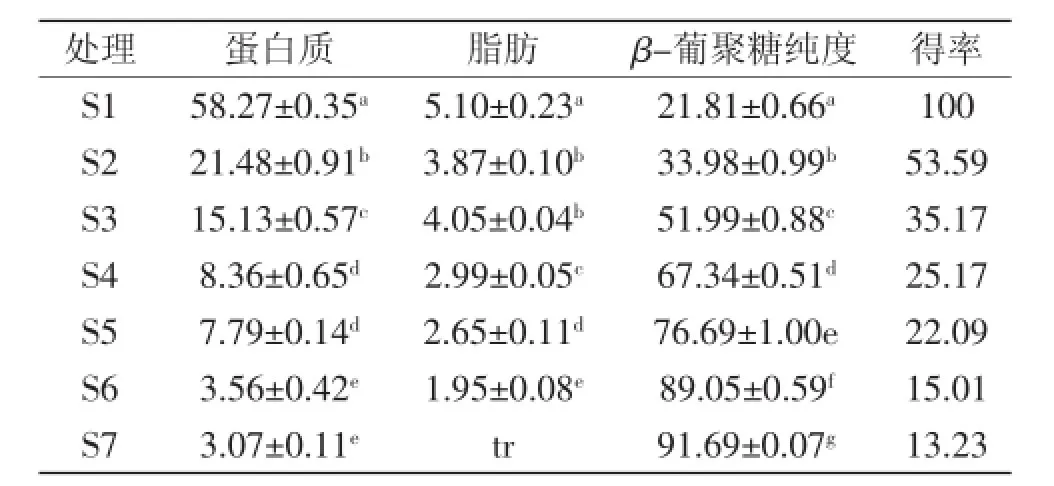
表4 每步处理后产物的成分分析Table 4 Composition analysis of each step treated dry products
3 结论
通过单因素实验,确定了各因素对葡萄酒泥废酵母β-葡聚糖纯度的影响规律。应用响应面分析法对各因素的最佳水平范围及其交互作用进行研究,建立了酵母β-葡聚糖提取工艺的二次多项式回归模型,得到最优提取工艺参数:均质压力70 MPa,酵母浓度13%,均质时间34 min,冻融加水量25%,在此条件下提取所得酵母β-葡聚糖纯度为91.69%,得率为13.23%,可为酵母β-葡聚糖的开发利用提供理论依据和技术支持。
[1]高洁.酵母β-葡聚糖制备、改性增溶和溶液构象研究[D].北京:中国农业科学院,2013.
[2]Graubaum H J,Busch R,Stier H,et al.A doubleblind randomized,placebo-controllednutritionalstudyusingan insoluble yeast β-glucan to improve the immune defense system [J].Food and Nutrition Sciences,2012,3:738-746.
[3]Eiboshy M E,Eiashram A M,Abdelhamid F M,et al. Immunomodulatory effect of dietary Saccharomyces cerevisiae,β-glucan and laminaran in mercuric chloride treated Nile tilapia(Oreochromisniloticus)andexperimentally infected with Aeromonashydrophila[J].Fish&Shellfish Immunology,2010,28:802-808.
[4]Kousik M,Surajit S,Sunil K B,et al.An immunostimulating water insoluble β-glucan of an edible hybrid mushroom:Isolation and characterization[J].Fitoterapia,2013,84:15-21.
[5]杜娜,杨雪山,韩舜愈,等.超声波辅助酶法分离提取葡萄酒泥酵母SOD工艺条件的优化[J].食品科学,2014,35(2):87-90.
[6]李双石,冀振红,李渤,等.葡萄酒废酵母胞壁多糖提取工艺的优化研究[J].酿酒科技,2014(12):85-87.
[7]刘晓永.酿酒酵母β-D-葡聚糖制备、构象及免疫功效研究[D].无锡:江南大学,2007.
[8]郭卫芸,杜冰,袁根良,等.反复冻融法破壁啤酒废酵母的研究[J].酿酒科技,2009(3):103-105.
[9]Chema B,Fabienne F,Guilhem J,et al.Enzymatic process for the fractionation of baker’s yeast cell wall(Saccharomyces cerevisiae)[J].Food Chemistry,2014,163:108-113.
[10]张莉弘,吴琼,高长城,等.废啤酒酵母细胞超声波破壁工艺优化[J].酿酒科技,2014(2):65-67.
[11]戴宁,张欲中,周东.超高压均质参数对酵母破壁率的影响[J].食品与发酵工业,2011,37(9):109-109.
[12]杜娜,杨学山,韩舜愈,等.葡萄酒泥酵母超氧化物歧化酶分离提取工艺条件优化[J].食品工业科技,2013,34(15):242-245.
[13]徐栋,王春维.高压均质与酶法破碎酵母细胞壁的工艺条件研究[J].饲料工业,2009,30(12):44-47.
[14]范华宁,黄冬云,张晖,等.反复冻融和超声协同作用破碎酵母细胞[J].食品与发酵工业,2013,39(12):62-62.
[15]王慧,程富胜,罗永江,等.响应面法优化酵母多糖的提取工艺[J].食品科学,2012,33(24):93-95.
[16]杨建梅.啤酒废酵母中β-1,3-D-葡聚糖的制备及性质研究[D].泰安:山东农业大学,2012.
[17]张海波,张蔚,张彦,等.QB/T 4572-2013酵母β-葡聚糖[S].中华人民共和国工业和信息化部,2013.
[18]于雅娟,戴军,朱松,等.酸酶水解—HPLC法检测香菇多糖中β-D-葡聚糖含量[J].食品与发酵工业,2012,38(7):148-151.
[19]朱益波,翟丽君,朱明,等.啤酒废酵母中β-D-葡聚糖非降解提取工艺[J].食品科学,2011,32(20):121-125.
[20]GB 5009.5-2003食品中蛋白质的测定[S].
[21]GB/T 5009.6-2003食品中脂肪的测定[S].
[22]Silke C J,Sascha R,Lother W K,et al.Antioxidative activity of(1→3),(1→6)-β-D-glucan from Saccharomyces cerevisiae grown on different media[J].Food Science and Technology,2008,41(5):868-877.
Extraction ofβ-Glucan from waste wine yeast by multiple cell-wall-broken technologies
CHENG Chao1,ZHANG Hong-hai1,2,SHENG Wen-jun1,2,HAN Shun-yu1,2,WANG Jing1,2,*
(1.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China;2.Gansu Key Lab of Viticulture and Enology,Lanzhou 730070,China)
The cell wall of wine yeast was broken by high pressure homogenization and freezing-thawing methods collaboratively.Combined with enzymatic hydrolysis of compound protease and lipase,the effect of multiple cell-wall-broken technologies on purity ofβ-Glucan was studied.On the basis of single factor experiment,the Box-Behnken design was adopted.The concentration of yeast,homogeneous time and freezing-thawing water content were factors,and the purity ofβ-Glucan was response value,the extraction process ofβ-Glucan from waste wine yeast was optimized.The results showed that the optimal extraction parameters were obtained as follows:homogeneous pressure 70 MPa,concentration of yeast 13%,homogeneous time 34 min and freezingthawing water content 25%,while extraction purity ofβ-Glucan content was 91.69%and yield was 13.23% under these conditions.The process provided a reference basis for the development and utilization of Glucan from yeast.
waste wine yeast;industrialized cell-wall-broken technologies;compound enzyme hydrolysis;β-Glucan
TS201.1
A
1002-0306(2016)04-0111-06
10.13386/j.issn1002-0306.2016.04.013
2015-07-27
程超(1991-),女,硕士研究生,研究方向:葡萄酒微生物,E-mail:nmcgg349245322@163.com。
王婧(1969-),女,副教授,研究方向:食品安全与发酵微生物,E-mail:wangjing@gsau.edu.cn。
甘肃省农牧厅生物技术专项(GNSW-2014-11)。
