漂洗液中氯化镁浓度对鲢鱼鱼糜凝胶特性的影响
2016-09-12余永名李晓丽刘宇彤仪淑敏李钰金李学鹏徐永霞励建荣
余永名,李晓丽,刘宇彤,仪淑敏,*,李钰金,李学鹏,徐永霞,励建荣,*
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013;2.泰祥集团荣成泰祥食品股份有限公司,山东荣成 264309;3.中国海洋大学食品科学与工程学院,山东青岛 266003)
漂洗液中氯化镁浓度对鲢鱼鱼糜凝胶特性的影响
余永名1,李晓丽1,刘宇彤1,仪淑敏1,*,李钰金2,3,李学鹏1,徐永霞1,励建荣1,*
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013;2.泰祥集团荣成泰祥食品股份有限公司,山东荣成 264309;3.中国海洋大学食品科学与工程学院,山东青岛 266003)
本文为研究漂洗液中氯化镁对鲢鱼鱼糜凝胶特性的影响,通过测定凝胶强度、质构特性、持水性、蒸煮损失、白度的测定,并采用低场核磁、电泳技术和电镜扫描综合分析了其变化规律。结果表明,经含氯化镁的漂洗液漂洗鱼糜后,硬度和白度随氯化镁浓度的增加逐渐增大,其凝胶特性较用清水和0.15% NaCl漂洗的鱼糜凝胶得到不同程度的提高。当氯化镁浓度为2.5 mmol/L时凝胶特性最佳,其中凝胶破断力、凹陷距离、凝胶强度、弹性、咀嚼度和持水性较清水和0.15% NaCl漂洗分别提高了55.90%、42.55%、123.12%、4.59%、51.40%、20.07%和13.77%、12.64%、28.09%、1.33%、22.26%、8.19%;蒸煮损失分别降低了32.54%和22.24%;水分横向弛豫时间T23分别缩短了56.18 ms和26.02 ms,且形成了致密的凝胶网络结构,说明肌球蛋白重链(MHC)发生交联,大分子聚集体形成,SDS-PAGE结果显示进入凝胶中MHC更少,条带更细窄。综合各项指标,浓度为2.5 mmol/L氯化镁漂洗液对鲢鱼鱼糜凝胶性能提升最大。
鲢鱼,鱼糜,漂洗,氯化镁,凝胶特性
我国淡水鱼资源丰富,鲢鱼为我国主要的淡水养殖鱼类之一,2014年年产422.60万吨[1]。由于风味、口感等因素制约其鲜销,导致鱼糜的加工成为鲢鱼的重要加工途径之一。但其凝胶性能较差,严重影响了鲢鱼鱼糜制品的品质,限制了鲢鱼鱼糜制品的开发,改善其凝胶性能迫在眉睫。漂洗是鱼糜生产过程中重要的环节之一,通过漂洗可以去除水溶性蛋白、脂肪、有色物质和腥味物质等,并且提高肌原纤维蛋白的相对含量,从而提高鱼糜的凝胶特性和白度。而漂洗条件对鱼糜凝胶特性起到重要作用,如漂洗溶液成分组成等。有研究表明漂洗液中钙离子会对鱼糜的凝胶特性产生一定的影响,如漂洗液中乳酸钙和氯化钙在适当浓度下可以改善秘鲁鱿鱼的凝胶强度[2]。也有研究发现在漂洗液中加入适量的氯化钙可提高白鲢鱼糜的凝胶强度[3]。适量的金属离子尤其是钙离子和镁离子等主要是通过促进肌球蛋白重链交联起到改善鱼糜凝胶特性的作用,经浓度为15 mmol/L氯化镁漂洗后,鳕鱼鱼糜的储藏稳定性得到提高,其凝胶特性明显高于对照组[4],高浓度的离子强度会降低漂洗过程中鱼肉蛋白的热稳定性还会导致鱼肉蛋白在冻藏中变性从而降低鱼糜的凝胶能力[5]。
根据适当浓度的金属离子可以起到改善鱼糜凝胶特性的作用,本研究以鲢鱼为原料,研究不同浓度氯化镁漂洗液对其凝胶特性的影响,为改善鲢鱼鱼糜凝胶性能提供思路。
1 材料与方法
1.1材料与仪器
白鲢鱼规格1.0~1.5 kg,购于锦州市水产市场;氯化钠和氯化镁天津市致远化学试剂有限公司,分析纯;食盐锦州市大润发超市,食品级。
YC200采肉机诸城市凯成良才食品机械厂;ZB-20型斩拌机诸城市瑞恒食品机械厂;TA.XT.PLUS型质构仪英国Stale Micro System公司;SORVALL Stratos型冷冻高速离心机德国;CR-400色彩色差计日本Minolta公司;NMI20型核磁共振成像仪上海纽迈电子科技有限公司;FreeZone2.5真空冷冻干燥机美国Labconco公司;Scimitar 2000傅里叶变换红外光谱仪美国安捷伦公司;Bio-Rad电泳仪美国。
1.2实验方法
1.2.1白鲢鱼糜加工工艺白鲢→前处理(去头、去鳞、去内脏)→采肉→漂洗→脱水→空斩3 min→备用。
1.2.2漂洗工艺清水漂洗:取新鲜采集的鲢鱼鱼糜10 kg,清水漂洗3次。
NaCl漂洗:取新鲜采集的鲢鱼鱼糜10 kg,漂洗3次,前2次用3倍清水漂洗,第3次用5倍0.15%的NaCl溶液漂洗。
实验组:取新鲜采集的鲢鱼鱼糜10 kg,漂洗3次,前2次用3倍清水漂洗,第3次分别用3倍浓度为0.5、1.5、2.5、3.5、4.5 mmol/L的氯化镁溶液漂洗。
1.2.3凝胶制备凝胶制备参考仪淑敏等[6]的文献,并稍作修改。
鱼糜→空斩3 min→2.5% NaCl擂溃3 min→调节水分含量为80%后继续斩拌15 min→成型→两段加热形成凝胶(40℃水浴加热30 min,90℃水浴加热20 min)。
所有样品均于4℃贮藏备用。
1.2.4凝胶强度的测定凝胶强度为破断力与凹陷距离的乘积,凝胶强度(g·mm)=破断力(g)×凹陷距离(mm)。测定前将凝胶样品于室温放置30 min,切成2.5 cm×2.5 cm×2.5 cm的圆柱体。凝胶强度通过质构仪进行测定。每组样品测6份平行;参数设定:探头型号为P/5S;测前速度为1 mm/s;测试速度为1 mm/s;测后速度为1 mm/s;压缩距离为15 mm;触发力为10 g[7]。
1.2.5TPA测定样品处理同上,采用TA-XT-PLUS(SMS)型质构仪进行鱼糜凝胶的弹性分析。参数设定:探头型号P/50;测前速度1 mm/s;测试速度1 mm/s;测后速度1 mm/s;压缩比40%;触发力:5 g。每组样品平行6次。
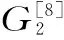
持水性(%)=G2÷G1× 100
1.2.7蒸煮损失的测定测定方法根据Yang[9]的方法稍作修改。将鱼糜凝胶制成直径为10 mm,高为20 mm的圆柱体,并准确称重M1后放入8 cm×9 cm小型蒸煮袋中封口,90℃水浴下蒸煮20 min后迅速取出,轻轻将表面液体擦干后再次称重M2。每组样品测3份平行。蒸煮损失的计算公式如下。
蒸煮损失(%)=(M1-M2)÷M1×100
1.2.8白度的测定采用CR-400色差计测定鱼糜凝胶的亮度值L*,其值从0到100变化,0表示黑色,100表示白色;红绿值a*表示从红到绿的值,正代表红色程度,负代表绿色程度;黄蓝值b*,正表示黄色程度,负表示蓝色程度。每组样品测3份平行。白度的计算公式如下[10]。
白度=100-[(100-L*)2+a*2+b*2]1/2
1.2.9低场核磁共振分析凝胶样品在室温下放置平衡30 min后,制成直径为10 mm,高为20 mm的圆柱体并装入核磁管,采用Carr-Purcell-Meiboom-Gill(CPMG)脉冲序列进行自旋-自旋弛豫时间T2的测定。参数设定:SFI(MHz)=22,P90(μs)=14,SW(kHz)=100,TR(ms)=2000,NS=8,τ(μs)=150,Echocnt=4000。
1.2.10鱼糜凝胶蛋白质微观结构的测定参照Oujifard[11]的方法并稍作修改。鱼糜凝胶→切块(3 mm×3 mm×2 mm)→体积分数2.5%戊二醛溶液(含50% 浓度为0.2 mol/L,pH7.2磷酸缓冲液)固定24 h→去除固定液→磷酸盐缓冲液(0.2 mol/L,pH7.2)漂洗三次,15 min/次→去离子水漂洗1 h→50%、70%、90%的乙醇溶液梯度各脱水1次,15 min/次→无水乙醇脱水3次,10 min/次→真空冷冻干燥→离子溅射镀金→扫描电镜观察(×10000)。
1.2.11SDS-PAGE凝胶电泳参考Laemmli[12]的方法并稍作修改。称取鱼糜凝胶3.0 g,绞碎后加入 27 mL加热到85℃的5% SDS溶液,用高速匀浆机均质4 min后85℃水浴加热1 h,冷却后将匀浆液在26~28℃、11000 r/min 条件下离心5 min,取上清液。调节上清液浓度为6 mg/mL,与上样缓冲液按1∶2(v/v)比例混合,沸水浴5 min。制胶后上样10 μL,其中浓缩胶浓度4%,分离胶浓度10%。在52 mA恒流下进行凝胶电泳。电泳完成后进行染色和脱色,染色液:0.25%的考马斯亮蓝R-250、50%甲醇和10%冰醋酸;脱色液:含50%甲醇和10%冰醋酸,脱色至背景基本无色,在凝胶成像仪上成像。
1.2.12统计分析实验数据采用SPSS 19.0软件进行分析处理,利用Origin 8.0作图。
2 结果与分析
2.1漂洗液处理后鲢鱼鱼糜凝胶凝胶强度的变化
凝胶凹陷距离是指凝胶在外力作用下即将断裂时所发生的形变量,破断力是指凝胶即将破裂或崩裂时所受的力,凝胶强度是指凝胶破断力在迫使凝胶断裂过程中所做的功。凝胶强度是凝胶硬度和弹性的综合体,是衡量鱼糜制品凝胶特性的重要指标。凝胶破断力和凹陷距离的改善可以有效地提高鱼糜制品的凝胶特性。
由图1可知,经清水漂洗和0.15% NaCl漂洗后鲢鱼鱼糜凝胶的凹陷距离、破断力和凝胶强度分别为4.23 mm,239.00 g,1006.05 g·mm和5.30 mm,330.81 g,1752.42 g·mm,而经不同浓度氯化镁漂洗液处理后,鲢鱼鱼糜凝胶的凹陷距离、破断力和凝胶强度随浓度的增加呈现先增大后减小的趋势,清水漂洗后鱼糜凝胶的凹陷距离、破断力和凝胶强度较其他处理组都要低,当氯化镁浓度为2.5 mmol/L时,均处于最大值,分别为6.03 mm、372.61 g和2244.72 g·mm,较清水漂洗和0.15% NaCl漂洗分别提高了42.55%,55.90%,123.12%和13.77%、12.64%、28.09%。可能是鱼糜中存在类似于转谷氨酰胺转酶的酶类,镁离子与类转谷氨酰胺转酶之间相互作用,并且能促进肌球蛋白重链之间的共价交联,镁离子也可以和蛋白质侧链-COOH形成盐桥,从而对鲢鱼鱼糜的凝胶特性起到改善作用[4]。随着浓度的增加,凝胶强度出现下降,可能是因为镁离子浓度过大,导致鱼肉蛋白在漂洗过程中的热稳定性的降低从而降低鱼糜的凝胶能力[5]。

图1 不同浓度漂洗处理后鲢鱼鱼糜凝胶凹陷距离(A)、破断力(B)和凝胶强度(C)的变化Fig.1 Change of deformation(A),breaking force(B)and gel strength(C)of silver carp surimi gels treated with different concentrations of washing water注:在相同的参数下,同一指标中字母不同表示显著差异(p<0.05),表1、表2、图2同。
2.2漂洗液处理后鲢鱼鱼糜凝胶质构特性的变化
凝胶质构(TPA)主要通过模拟人口腔的两次咀嚼动作,对测试样品进行两次压缩,获得与人感官评定相对应的参数。由表1可知清水漂洗和0.15% NaCl漂洗后凝胶的弹性和咀嚼度分别为0.871,1881.82 g·mm和0.899,2330.34 g·mm;看出随着氯化镁浓度的增加;鱼糜凝胶的硬度呈现逐渐增大的趋势,弹性和咀嚼度均呈现先升高后降低的趋势,当浓度为2.5 mmol/L时均达到最大值,较清水漂洗和0.15% NaCl漂洗分别提高了4.59%、51.40%和1.33%,22.26%,此浓度下能形成稳定的具有较高凝胶强度的凝胶,进而可以增加鱼糜凝胶的弹性和咀嚼度。
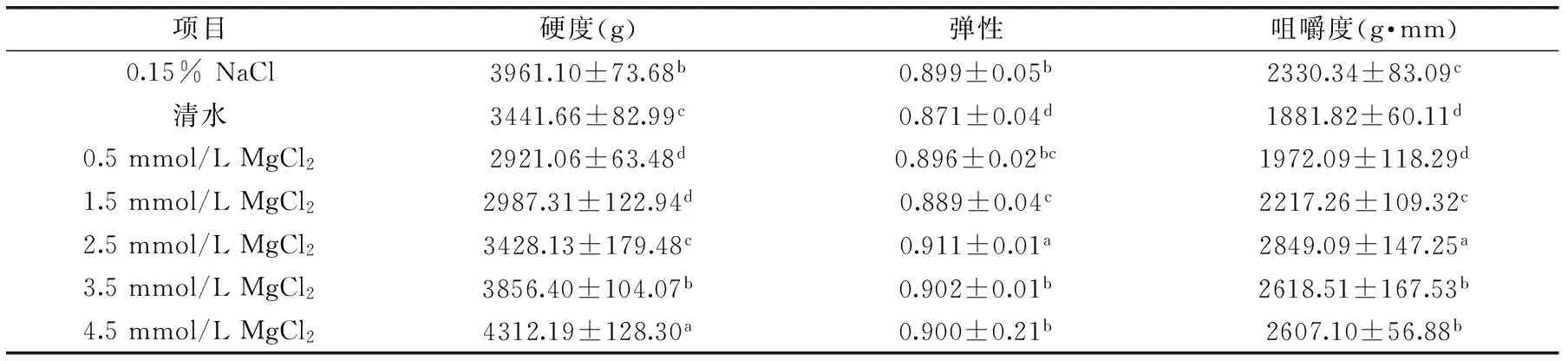
表1 不同浓度漂洗处理后鲢鱼鱼糜凝胶硬度、弹性和咀嚼度的变化

表2 不同浓度漂洗处理后鲢鱼鱼糜凝胶L*值、a*值、b*值和白度的变化
2.3漂洗液处理后鲢鱼鱼糜凝胶持水性和蒸煮损失的变化
持水性反映了蛋白凝胶保留水分的能力,蒸煮损失是指凝胶在蒸煮过程中的水分等易流失物因渗出所造成的质量减少。持水性和蒸煮损失主要取决于肌球蛋白与肌动蛋白交联形成的三维网络结构[13],持水性和蒸煮损失与鱼糜凝胶的凝胶强度成一定的相关性[14],共同反映了鱼糜凝胶微观网络结构的致密程度。持水性越高,蒸煮损失越低,表明鱼糜凝胶的网络结构对水分的束缚能力越强,即凝胶的空间网络结构越致密,凝胶强度越高。由图2可知,清水漂洗和0.15% NaCl漂洗后凝胶的持水性和蒸煮损失分别为71.71%,13.37%和79.58%,11.60%,而氯化镁漂洗组随着浓度的增加,持水性呈现先增大后降低的趋势,浓度为2.5 mmol/L时达到最大值,为86.10%,较清水漂洗和0.15% NaCl漂洗后鱼糜凝胶的持水性分别提高了20.07%和8.19%,有研究表明镁离子能降低生牛肉和熟牛肉的水分损失[15],主要原因可能是由于镁离子能够提高肌球蛋白的提取量[16]。蒸煮损失呈现先降低后增加的趋势,在浓度为2.5 mmol/L时达到最小值,为9.02%,比清水漂洗和0.15% NaCl漂洗后的鱼糜凝胶的蒸煮损失分别降低了32.54%和22.24%。持水性和蒸煮损失的改善情况与凝胶强度的结果基本一致,凝胶的滞留水分的能力在2.5 mmol/L达到最佳。

图2 不同浓度漂洗处理后鲢鱼鱼糜凝胶持水性和蒸煮损失的变化Fig.2 Change of water holding capacity and cooking loss of silver carp surimi gels treated with different concentrations of washing water
2.4漂洗液处理后鲢鱼鱼糜凝胶白度的变化
白度作为鱼糜制品重要的指标之一,决定了鱼糜制品在感官上被消费者接受的程度。白度与光在鱼糜凝胶中的散色有关,而这也是由凝胶结构、肌原纤维蛋白质以及散色粒子的大小所决定的[17]。从表2中可以看出,当漂洗液中加入氯化镁后,随着浓度的增大,L*值和b*值均逐渐增大,但均小于清水漂洗和0.15% NaCl漂洗的L*值和b*值,其中b*值较清水漂洗和0.15% NaCl漂洗两组下降幅度较大;而a*值大致呈现减小的趋势,且均小于经清水漂洗和0.15% NaCl漂洗后凝胶的a*值。加入氯化镁之后,白度值随着浓度的增大而增大,当浓度超过1.5 mmol/L时白度值大于经清水漂洗和0.15% NaCl漂洗后的白度值,2.5 mmol/L时出现小范围内的最大值。
随着漂洗液中氯化镁浓度的增加,L*值增加和a*值减小可能与氯化镁对肌红蛋白的去除程度有关,因为漂洗液中氯化镁可以选择性的去除鱼糜中除肌原纤维蛋白以外的蛋白质[18],肌红蛋白被去除后,含量的减少,从而受热过程中肌红蛋白发生氧化形成高铁肌红蛋白的量减少,高铁肌红蛋白越少,白度值越高[19]。随着漂洗液中氯化镁浓度的增加,鲢鱼鱼糜凝胶的白度值逐渐增大,可能与蛋白质变性聚合程度有关系,蛋白的聚集程度增大,可形成高强度凝胶和致密三维网络结构,Kang等报道了致密的凝胶三维网络结构会反射更多的光,使凝胶白度增加[17]。
2.5漂洗液处理后鲢鱼鱼糜凝胶T2水分的变化
弛豫时间是指系统受到外界瞬时扰动后,重新回复到原来的平衡态时所经历的时间。凝胶系统中的水分特性通常用横向弛豫时间T2(又称自旋-自旋弛豫时间)来表征[20]。T2值的大小反映了水分流动性的强弱[21]。从图3可知,鲢鱼鱼糜凝胶存在4种状态的水,弛豫时间T2分布在1~1000 ms范围内,分别为T21(0.1~1 ms),是指与蛋白质等大分子在氢键的作用下,氨基和羰基紧密结合形成的单分子层水,以及位于大分子固有结构上的质子,即结合最紧密的水分[22];T22(1~10 ms),是指与蛋白质中的酰胺基形成键能较小的氢键的那部分水,与单分子层水相比,它的结合强度较低,称为半结合水。T21和T22所代表的水分共同称为结合水。T23(20~160 ms),由组织中的显微和亚显微结构及膜所阻留的水,即束缚在凝胶微观网络结构中的水分,称为可移动水,是鱼糜凝胶中最主要的水分,占鱼糜凝胶总水分的90%左右。T24(150 ms以上),表示的是自由水,是存在于细胞外的水。

图3 鲢鱼鱼糜凝胶T2横向弛豫时间的分布变化Fig.3 Change of distributed T2 transverse relaxation time of silver carp surimi gel
由图4可知,随着漂洗液中氯化镁浓度的增大,鱼糜凝胶中可移动水的弛豫时间T23的先减小再增大,当浓度为2.5 mmol/L时最短,分别比清水组和0.15% NaCl缩短了56.18 ms和26.02 ms,说明此时凝胶对水分的滞留束缚能力最强,这可能与此浓度漂洗液漂洗后鱼糜凝胶凝胶强度增大有关,结果与持水性和蒸煮损失基本一致,凝胶保水能力与凝胶强度常被作为衡量鱼糜凝胶好坏的主要指标。凝胶对水分的滞留的能力的增强,还可能与致密三维网络结构的形成有关,更多的水被滞留在网络中,水的流动性降低,其持水性增强,凝胶强度增大。

图4 不同浓度漂洗处理后鲢鱼鱼糜凝胶T23横向弛豫时间的分布变化Fig.4 Change of distributed T23 transverse relaxation time of silver carp surimi gelstreated with different concentrations of washing water
2.6漂洗液处理后鲢鱼鱼糜凝胶微观结构的变化
鱼糜凝胶的微观结构主要是凝胶网络结构,结构的致密程度,孔径的大小与鱼糜凝胶的凝胶强度、持水性和蒸煮损失等呈现一定的相关性。由图5可以看出,经含氯化镁的溶液漂洗后鱼糜凝胶形成的凝胶网络结构与清水漂洗的鱼糜凝胶网络结构存在明显的差异,浓度为2.5、3.5、4.5 mmol/L的溶液漂洗后凝胶微观结构更加明显,凝胶网络致密均一,结果与持水性和蒸煮损失结果相一致,拥有较强束缚水的能力,说明一定浓度的氯化镁可以加强鲢鱼鱼糜凝胶网络结构的形成,使得其凝胶强度和持水性等显著提高[23],蒸煮损失显著下降。清水漂洗后凝胶微观结构不平整,颗粒感强,网络结构粗糙,而对照组的凝胶网络结构较均匀,平整致密。

图5 不同浓度漂洗处理后鲢鱼鱼糜凝胶微观结构的变化Fig.5 Change of micostructure of silver carp surimi gels treated with different concentrations of washing water
2.7漂洗液处理后鲢鱼鱼糜凝胶肌原纤维蛋白的变化
肌球蛋白重链(MHC)是肌原纤维蛋白中主要贡献凝胶能力的蛋白质,MHC含量越高,鱼糜凝胶能力越高[24],由图6看出当随着漂洗液中氯化镁浓度的增加,肌球蛋白重链(MHC)条带粗细和颜色深浅呈现先变细变淡,浓度为2.5 mmol/L时条带最细颜色最浅,随后变粗颜色加深。主要是因为凝胶能力好的鱼糜凝凝胶中MHC通过盐桥产生交联,形成较大的聚集体,大的聚集体未能进入分离胶中,从而显示出,氯化镁浓度2.5 mmol/L漂洗后凝胶的MHC条带较浅,且清水漂洗后的条带最粗且颜色最深。氯化镁能改善鱼糜凝胶形成能力可能与其降解肌球蛋白,使其通过盐桥重组成肌球蛋白重链有关[25]。除此之外,肌动蛋白(AC)的含量也呈现相同的趋势。可能是肌动蛋白也参与凝胶交联。

图6 不同浓度漂洗处理后鲢鱼鱼糜凝胶SDS-PAGE图Fig.6 SDS-PAGE pattern of silver carp surimi gels treated with different concentrations of washing water注:M:Marker;1:0.15% NaCl;2:清水;3:0.5 mmol/L MgCl2;4:1.5 mmol/L MgCl2;5:2.5 mmol/L MgCl2;6:3.5 mmol/L MgCl2;7:4.5 mmol/L MgCl2。
3 结论
鲢鱼鱼糜经含氯化镁的漂洗液漂洗后凝胶性能较用清水漂洗和0.15%NaCl漂洗有较大改善,其中当氯化镁浓度为2.5 mmol/L时凝胶性能最好,较清水和0.15%NaCl漂洗凝胶强度分别提高了123.12%和28.09%,咀嚼度分别提高了51.40%和22.26%;凝胶对水的束缚能力增强,其中持水性分别提高了20.07%和8.19%,蒸煮损失分别降低了32.54%和22.24%,横向弛豫时间T23最短;且能形成致密的凝胶网络结构。凝胶电泳结果显示在氯化镁的作用下,MHC聚集成较大聚集体,形成的条带较细颜色较浅。综上所述,一定浓度的氯化镁的漂洗液对鲢鱼鱼糜凝胶有改善作用,其中2.5 mmol/L时效果最佳。
[1]农业部渔业局.中国渔业统计年鉴[M].北京:中国农业出版社,2014:36.
[2]陆海霞,傅玉颖,李学鹏,等.漂洗工艺对秘鲁鱿鱼鱼糜凝胶特性的影响[J].食品研究与开发,2010,31(9):1-5.
[3]王玉凤,李八方,张朝辉.漂洗对鲢鱼鱼糜凝胶和质构特性的影响[J].食品科学,2013,34(14):122-125.
[4]Ofstad R,Grahl-Madsen E,Gundersen B,et al.Stability of cod(Gadus morhua L.)surimi processed with CaCl2and MgCl2added to the wash water[J].International Journal of Food Science & Technology,1993,28(5):419-427.
[5]Saeki H,Ozaki H,Nonaka M,et al.Effect of CaCl2in frozen surimi of Alaska Pollock on cross-linking of myosin heavy chain in salted paste from the material[J].Nippon Suisan Gakkaishi,1988,54(2):259-264.
[6]仪淑敏,马兴胜,励建荣,等.超高压对金线鱼鱼肉肠凝胶特性的影响[J].食品工业科技,2014,35(10):129-133.
[7]Chaijan M,Panpipat W,Benjakul S.Physicochemical properties and gel-forming ability of surimi from three species of mackerel caught in Southern Thailand[J].Food Chemistry,2010,121(1):85-92.
[8]Sánchez-gonzález I,Carmona P,Moreno P,et al.Protein and water structural changes in fish surimi during gelation as revealed by isotopic H/D exchange and Raman spectroscopy[J].Food Chemistry,2008,106(1):56-64.
[9]Yang Z,Wei W,Hai-yan W,et al.Effects of a highly resistant rice starch and pre-incubation temperatures on the physicochemical properties of surimi gel from grass carp(Ctenopharyn Odon Idellus)[J].Food Chemistry,2014,145(4):212-219.
[10]Qian L,Bao-hua K,Jian-kun H,et al.Effects of superchilling and cryoprotectants on the quality of common carp(Cyprinus carpio)surimi:Microbial growth,oxidation,and physiochemical properties[J].LWT-Food Science and Technology,2014,57(1):165-171.
[11]Oujifard A,Benjakul S,Ahmad M,et al.Effect of bambara groundnut protein isolate on autolysis and gel properties of surimi from threadfin bream(Nemipterus bleekeri)[J].LWT-Food Science and Technology,2012,47(2):261-266.
[12]Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227(5259):680-685.
[13]Ru L,Si-ming Z,Shan-bo X,et al.Role of secondary structures in the gelation of porcine myosin at different pH values[J].Meat Science,2008,80(3):632-639.
[14]孙静静.转谷氨酰胺酶对草鱼糜凝胶性的影响[D].杭州:浙江大学,2012.
[15]Terrell R N,Ming C G,Jacobs J A,et al.Effect of chloride salts,acid phosphate and electrical-stimulation on ph and moisture loss from beef clod muscles[J].Journal of Animalence,1981,53(3):658-662.
[16]Nayak R,Kenney P B,Slider S.Protein Extractability of Turkey Breast and Thigh Muscle with Varying Sodium Chloride Solutions as Affected by Calcium,Magnesium and Zinc Chloride[J].Journal of Food Science,1996,61(6):1149-1154.
[17]Kang G,Yang K,Jeong J,et al.Gel color and texture of surimi-like pork from muscles at different rigor states post-mortem[J].Asian Australasian Journal of Animal Sciences,2007,20(7):11-27.
[18]Martinez I,Solberg C,Lauritzen K,et al.Two-dimensional electrophoretic analyses of cod(Gadus morhua,L.)whole muscle proteins,water-soluble fraction and surimi.Effect of the addition of CaCl2and MgCl2during the washing procedure.[J].Appl Theor Electrophor,1992,2:201-206.
[19]Chaijan M,Benjakul S,Visessanguan W,et al.The effect of freezing and aldehydes on the interaction between fish myoglobin and myofibrillar proteins[J].Journal of Agricultural and Food Chemistry,2007,55(11):4562-4568.
[20]Goh K S,Bhat R,Karim A A.Probing the sol-gel transition of egg white proteins by pulsed-NMR method[J].European Food Research and Technology,2009,228(3):367-371.
[21]Ducel V,Pouliquen D,Richard J,et al.1H-NMR relaxation studies of protein-polysaccharide mixtures[J].International
Journal of Biological Macromolecules,2008,43(4):359-366.
[22]Pitombo R N M,Lima G A M R.Nuclear magnetic resonance and water activity in measuring the water mobility in Pintado(Pseudoplatystoma corruscans)fish[J].Journal of Food Engineering,2003,58(1):59-66.
[23]Lertwittayanon K,Benjakul S,Maqsood S,et al.Effect of different salts on dewatering and properties of yellowtail barracuda surimi[J].International Aquatic Research,2013,5(1):10-21.
[24]钱娟.罗非鱼低盐鱼糜的凝胶特性及其制品的研究[D].上海:上海海洋大学,2013.
[25]Konno K.Suppression of Thermal Denaturation of Myosin Subfragment-1 of Alaska Pollack(Theragra chalcogramma)by Sorbitol and Accelerated Inactivation by Pyrophosphate[J].Journal of food science,1992,57(2):261-264.
Effect of magnesium chloride concentration in washing water on the gel properties of silver carp surimi
YU Yong-ming1,LI Xiao-li1,LIU Yu-tong1,YI Shu-min1,*, LI Yu-jin2,3,LI Xue-peng1,XU Yong-xia1,LI Jian-rong1,*
(1.College of Food Science and Technology,Bohai University;Food Safety Key Lab of Liaoning Province; National & Local Joint Engineering Research Center of Storage,Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products;Jinzhou 121013,China; 2.Taixiang Group,Rongcheng Taixing Food co.,LTD,Rongcheng 264309,China; 3.College of Food Science and Technology,Ocean University of China,Qingdao 266003,China)
In order to study the effect of magnesium chloride concentration on the washing water on the gel properties of silver carp surimi,the gel strength,texture properties,water holding capacity,cooking loss,whiteness were investigated,and the change rule were comprehensively analyzed by low field NMR,gel electrophoresis and scanning electron microscope(SEM).The results showed that after washing by water containing magnesium chloride,hardness and whiteness were increased gradually with the increase of concentration,and gel properties were increased in different degrees in comparison to gels washed by clear water and 0.15% NaCl.Gel properties of silver carp that washed by water containing 2.5 mmol/L magnesium chloride were the best,the breaking force,deformation,gel strength,elasticity,chewiness and water holding capacity were increased by 55.90%,42.55%,123.12%,4.59%,51.40%,20.07% and 13.77%,12.64%,28.09%,1.33%,22.26%,8.19%,respectively,while cooking loss and transverse relaxation time of T23were decreased by 32.54%,56.18 ms and 22.24%,26.02 ms,respectively.The dense and apparent network structure of gel was formed,myosin heavy chain(MHC)cross-linked and formed large molecular weight aggregates,less MHC entered the gel and the strip was more narrow.To integrated indicators,washing water of 2.5 mmol/L magnesium chloride was to maximize gel properties of silver carp surimi.
silver carp;surimi;washing;magnesium chloride;gel properties
2015-08-27
余永名(1990-),男,在读研究生,主要从事水产品贮藏加工及质量安全控制方面的研究,E-mail:yym1144@163.com。
仪淑敏(1980-),女,博士,副教授,主要从事水产品贮藏加工及质量安全控制方面的研究,E-mail:yishumin@163.com。
励建荣(1964-),男,博士,教授,主要从事水产品贮藏加工及质量安全控制方面的研究,E-mail:lijr6491@163.com。
国家自然基金(31571868;31301418);“十二五”国家科技支撑计划课题(2012BAD29B06);辽宁省高校重大科技平台,辽宁省教育厅重点实验室基础研究项目(LZ2015002;20131003);山东省泰山学者蓝色产业计划。
TS254.4
A
1002-0306(2016)07-0322-07
10.13386/j.issn1002-0306.2016.07.053
