紫粒小麦麸皮花色苷提取工艺优化及抗氧化活性研究
2016-09-12傅虹飞刘雪梅孙婧茹黄行健潘思轶
傅虹飞,刘雪梅,孙婧茹,黄行健,*,潘思轶
(1.西北农林科技大学食品科学与工程学院,陕西杨凌 712100;2.华中农业大学食品科技学院,湖北武汉 430070;3.环境食品学教育部重点实验室,湖北武汉 430070)
紫粒小麦麸皮花色苷提取工艺优化及抗氧化活性研究
傅虹飞1,刘雪梅2,3,孙婧茹1,黄行健2,3,*,潘思轶2,3
(1.西北农林科技大学食品科学与工程学院,陕西杨凌 712100;2.华中农业大学食品科技学院,湖北武汉 430070;3.环境食品学教育部重点实验室,湖北武汉 430070)
以紫粒小麦麸皮为原料,研究其花色苷超声波辅助提取工艺及其体外抗氧化活性。选取超声辅助提取功率、提取温度、提取时间、料液比和乙醇浓度等为考察因素进行了提取工艺的单因素及正交实验。实验结果表明,乙醇浓度为60%、料液比1∶10(g/mL)、提取时间10 min、提取温度60 ℃、超声波功率160 W。在此条件下,花色苷得率为1.82±0.23 mg/g,是普通浸提法的2.09倍。体外抗氧化实验显示:紫小麦麸皮花色苷提取物具有一定的清除DPPH自由基和ABTS自由基能力以及铁还原力,其花色苷含量与DPPH自由基、ABTS自由基清除率、铁还原力有显著的相关性(相关系数R2分别为0.9938,0.9737和0.9985),IC50值分别为7.81、12.20和5.18 mg/L。这一结果将为以紫小麦麸皮花色苷为原料的功能性食品的开发提供有益提示和理论基础。
紫粒小麦,麸皮花色苷,超声波辅助提取,抗氧化性
小麦(TriticumaestivumL.)属禾本科小麦属,是我国最重要的粮食作物之一,其籽粒呈白、红、紫、蓝、蓝紫、紫黑等色泽[1]。紫粒小麦已被证实富含蛋白质、氨基酸和对人体有益的微量元素和矿物质,具有较高的营养价值和良好的保健作用[2-4],其糊粉层与种皮中的天然色素以花色苷为主[5-10],花色苷是一类水溶性色素,具有抗氧化,维持血管正常渗透压,改善心肌营养,抗突变,减轻肝功能障碍和抗癌等多种保健功能[11]。普通的面粉加工方法使种皮与糊粉层多存于麸皮中而造成花色苷资源浪费,因此开发紫粒小麦麸皮资源,具有较高的研究价值和开发潜力[1]。
目前,文献对黑粒小麦麸皮的提取条件有初步研究[5],而对其进行提取工艺优化和抗氧化活性评价等方面仍待深入。超声波辅助提取技术已广泛应用于天然产物有效成分的提取[12-14]。本实验采用超声波辅助提取的方法对紫粒小麦麸皮花色苷的提取工艺进行探讨,并采用体外抗氧化体系评价其活性,这将为紫粒小麦麸皮花色苷开发成为抗氧化功能性食品或作为功能因子添加剂提供重要的理论依据。
1 材料与方法
1.1试剂与仪器
紫粒小麦麸皮市售,粉碎后过60目筛备用;1,1-二苯基-2-三硝基苯肼(DPPH·)、水溶性维生素E(Trolox)、2,2′-联氮-双(3-乙基苯并噻吡咯啉-6-磺酸)(ABTS)、TPTZ(2.4.6-Tri(2-pyridyl)-s-triazine)Sigma公司;FeSO4、无水乙醇、盐酸、冰乙酸、无水乙醇、过硫酸钾、氯化铁西陇化工股份有限公司。KQ5200DE超声波清洗器昆山舒美超声仪器有限公司;KDC-40低速离心机安徽中科中佳科学仪器有限公司;UV2550紫外-可见分光光度计岛津公司;JYL-C012/C013九阳料理机山东九阳小家电有限公司;pH计奥豪斯仪器(上海)有限公司;电子分析天平赛多利斯科学仪器(北京)有限公司;超纯水机成都超纯优普仪器设备公司;DK-8D数显恒温水浴锅金坛市医疗仪器厂。
1.2紫粒小麦麸皮花色苷超声波辅助提取条件的优化
1.2.1单因素实验选择料液比(1∶10,1∶15,1∶20,1∶25和1∶30 g/mL)、超声功率(120,140,160,180和200 W)、超声时间(5,10,15,20和25 min)、超声提取温度(30,40,50,60和70 ℃)、乙醇浓度(体积分数分别为40%,50%,60%,70%和80%,用盐酸调pH为1.0)作为考察因素,以紫粒小麦麸皮花色苷得率为指标进行实验设计。
1.2.2正交实验在单因素实验的基础上,采用超声波功率为160 W,超声辅助提取时间为10 min,其余提取条件通过正交实验进一步优化。选用L9(34)正交实验设计表,以料液比(A)、超声辅助提取温度(B)、乙醇浓度(C)为考察因素,以花色苷含量为评价指标,以筛选出最佳的工艺参数,因素水平见表1。
1.3紫粒小麦麸皮花色苷浸提
方法[10],提取条件为采用乙醇与1N盐酸(85∶15,v/v),料液比为1∶20,室温下300 r/min振荡提取1 h,得花色苷提取液并测定含量,进行三次平行实验取平均值。

表1 正交实验因素水平表
1.4花色苷含量测定
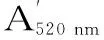
式(1)
式中,C为浓度值(单位为mg/L),449.38是矢车菊-3-葡萄糖苷的相对分子量;26900是矢车菊-3-葡萄糖苷在pH1.0的缓冲液中520 nm下的摩尔吸光系数;DF为稀释度,此实验中稀释度即为12.5。
进一步采用式(2)计算紫小麦麸皮花色苷含量:
m=(C×V)/M
式(2)
式中:m单位为mg/g,C为按公式(1)计算得到(mg/L),V为定容体积(L),M为黑小麦麸皮重量(g)。
1.5麸皮花色苷体外清除自由基能力的测定
1.5.1麸皮花色苷对DPPH+清除能力的测定参考文献方法[10],略有改动。以DPPH+为清除对象,分别取麸皮花色苷提取液、Trolox(参考文献方法[10],选择Trolox为抗氧化剂对照)进行实验:依次取花色苷含量在1.86~18.39 mg/L范围内的提取液1 mL,与4.5 mL DPPH+乙醇溶液混合,于室温避光放置30 min后,以无水乙醇调零,测定520 nm波长处的吸光度(A样品)。测定样品待测稀释液1.0 mL与无水乙醇4.5 mL混合液在520 nm处的吸光度(A对照),再测定1.0 mL无水乙醇与4.5 mL DPPH+溶液在520 nm波长处的吸光度(A空白),各组平行3次测定。按式(3)计算样品和Trolox对DPPH+的清除率。以Trolox浓度为横坐标、对DPPH+的清除率为纵坐标,绘制标准曲线,其回归方程为y=0.1483x+3.3816,x的单位为mg/L,相关系数R2=0.9997,根据此标准曲线计算紫色小麦麸皮花色苷铁还原力的清除DPPH+的Trolox当量(Trolox equivalent and oxidant capacity,TEAC)[15-16]。
DPPH+清除率(%)=[1-(A样品-A对照)/A空白]×100
式(3)
1.5.2麸皮花色苷对ABTS+·清除能力的测定参考文献方法[17],略有改动。以ABTS+·为清除对象,分别取紫粒小麦麸皮花色苷提取液、Trolox进行实验:依次取花色苷含量在4.86~27.84 mg/L范围内的提取液1.0 mL,与4.5 mL ABTS+·溶液(将ABTS+·储备液,使用前用无水乙醇稀释成工作液,在734 nm波长处的吸光度为0.70±0.02)混匀,避光室温放置6 min,于波长734 nm处测吸光度(A样品)。对照组以4.5 mL无水乙醇代替ABTS+·工作液(A对照),空白组以1 mL蒸馏水代替样品液(A空白)。各组平行3次测定,按式(4)计算紫小麦麸皮花色苷和Trolox对ABTS+·的清除率。以Trolox浓度为横坐标、对ABTS+·的清除率为纵坐标,绘制标准曲线,得到回归方程:y=0.2118x-1.8244,x的单位为mg/L,相关系数R2=0.9991,根据此标准曲线计算紫色小麦麸皮花色苷清除ABTS+·的Trolox当量(TEAC)。
ABTS+·清除率(%)=[1-(A样品-A对照)/A空白]×100
式(4)
1.5.3铁还原力参考文献方法[20],以FRAP(Ferric reducing activity ability,FRAP)试剂为反应体系,分别取麸皮花色苷提取液、Trolox进行实验:依次取花色苷含量在0.93~9.28 mg/L范围内的1.0 mL样液于试管,各加入相应体积蒸馏水,使其稀释至1.0 mL,与3.8 mL FRAP试剂(分别配制:30 mmol/L醋酸-醋酸钠缓冲液,10 mmol/LTPTZ溶液,20 mmol/L的三氯化铁溶液,使用时以10∶1∶1的体积比混匀使用)混匀,避光放置37 ℃水浴0.5 h,于593 nm测吸光度值A样品。对照组以3.8 mL蒸馏水代替FRAP试剂,测吸光度值A对照,空白组以1.0 mL蒸馏水代替样品液,测吸光度值A空白,各组平行测定三次。按式(5)计算铁还原力。以Trolox浓度为横坐标、铁还原力为纵坐标,绘制标准曲线,得到回归方程为y=0.0022x-0.1662,x的单位为mg/L,相关系数R2=0.9925,根据此标准曲线计算紫色小麦麸皮花色苷铁还原力当量(TEAC)。
铁还原力=A样品-A对照-A空白
式(5)
1.5.4提取方法对麸皮花色苷体外抗氧化活性的影响准确称取紫粒小麦麸皮1.00 g,采用超声波辅助提取优化工艺和普通浸提法[10]分别提取,比较二者的清除自由基和铁还原力活性差异。
1.6统计分析
用正交设计助手和DPS 7.55统计软件进行方差分析(p<0.05)以及Excel 2010分析实验数据。
2 结果与分析
2.1超声波辅助提取紫粒小麦麸皮花色苷优化实验
2.1.1单因素实验
2.1.1.1料液比对得率的影响紫粒小麦麸皮花色苷含量是按照矢车菊-3-葡萄糖苷来计算[10]。由图1可以看出,随着料液比的增加,紫粒小麦麸皮花色苷含量逐步增加,达到料液比为1∶20(g/mL)后,花色苷得率为0.88±0.03 mg/g。比较料液比分别为1∶20(g/mL),1∶25(g/mL)和1∶30(g/mL)的花色苷得率,差异不显著(p<0.05)。考虑单因素实验的结果和提取液的经济原则,后续实验选择料液比(1∶10,1∶15,1∶20,g/mL)作为正交实验因素进一步优化。
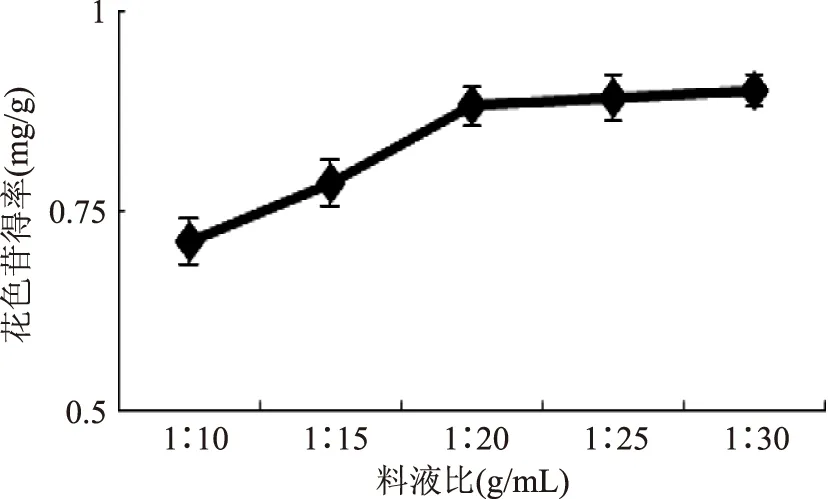
图1 料液比对紫粒小麦麸皮花色苷得率的影响Fig.1 Effect of material-to-liquid ratio on the yields of anthocyanins from purple wheat bran
2.1.1.2超声辅助提取功率对得率的影响由图2可以看出,随着超声功率的增加,紫粒小麦麸皮花色苷得率先增大后减少,在实验选取的120~200 W的功率范围内,差异不显著(p<0.05),花色苷得率在超声功率为160 W时为1.44±0.08 mg/g,所以选择提取功率160 W为最佳提取超声功率。

图2 超声辅助提取功率对紫粒小麦麸皮花色苷得率的影响Fig.2 Effect of ultrasonic power on the yields of anthocyanins from purple wheat bran
2.1.1.3提取时间对得率的影响由图3可以看出,花色苷得率随着提取时间的延长而增加,但是增加趋势不显著(p<0.05),超声辅助提取时间为10 min时,花色苷得率为1.44±0.08 mg/g,因此选择10 min为超声提取时间。

图3 不同超声波辅助提取时间对紫粒小麦麸皮花色苷得率的影响Fig.3 Effect of ultrasonic assisted extract time on the yields of anthocyanins from purple wheat bran
2.1.1.4提取温度对得率的影响由图4可看出,随着提取温度升高,紫粒小麦麸皮花色苷得率不断增加,60 ℃达到1.69±0.09 mg/g,随后下降,可能是因为温度过高,使热不稳定成分或挥发性成分分解、变质或挥发[5],对天然活性物质的得率有影响。后续实验选择超声提取温度(50,60和70 ℃)作为正交实验因素进一步优化。

表3 方差分析结果

图4 超声波辅助提取温度对紫粒小麦麸皮花色苷得率的影响Fig.4 Effect of ultrasonic assisted extract temperature on the yields of anthocyanins from purple wheat bran
注:*表示显著(置信度95%水平),**表示非常显著(置信度99%水平)。
2.1.1.5乙醇浓度对得率的影响由图5中可看出,随着乙醇浓度的增大,紫粒小麦麸皮花色苷得率增加,到70%时达到最大。随着乙醇浓度的增大,花色苷得率反而下降,可能是在合适的溶剂极性环境下,花色苷得率才会较高[5]。后续实验选择乙醇浓度(体积分数分别为50%,60%和70%)作为正交实验因素进一步优化。

图5 不同乙醇浓度对紫粒小麦麸皮花色苷得率的影响Fig.5 Effect of ethanol concentration on the yields of anthocyanins
2.1.2正交实验在单因素实验基础上,选用L9(34)正交实验设计表,对影响紫粒小麦麸皮花色苷提取的各种参数进行优化,得到实验结果见表2,方差分析见表3。由表3可知,三个因素中乙醇浓度对紫粒小麦麸皮花色苷的得率影响极显著(p<0.01),提取温度影响显著(p<0.05),三个因素影响的主次顺序为C>B>A,即乙醇浓度>提取温度>料液比。实验所得到的最佳优化工艺组合为A1B3C2,即在超声波功率为160 W以及提取时间为10 min的提取条件下选择料液比为1∶10(g/mL)、提取温度60 ℃、乙醇浓度60%。由于得到的优化组合不在此正交实验设计表内,故以该优化组合的参数进行了四次重复验证实验,验证实验结果为花色苷得率为1.82±0.23 mg/g。

表2 正交实验结果
2.1.3与普通浸提法得率比较参考文献方法[5],采用酸化乙醇浸提法提取紫粒小麦花色苷得率仅为0.87±0.21 mg/g,说明超声波辅助提取法优于普通浸提法。Li,Pickardb和Trust[10]采用乙醇与1N盐酸(85∶15,v/v),料液比为1∶20,300 r/min振荡提取1 h,花色苷得率为1.155 mg/g。
2.2紫粒小麦麸皮花色苷体外抗氧化性评价
2.2.1清除DPPH自由基文献报道显示[10],紫粒小麦麸皮花色苷提取液对DPPH+的清除率在30 min后趋于稳定,因此实验中采用30 min为反应时间。由图6可知,随着样品浓度的增加,紫小麦麸皮花色苷对DPPH+的清除能力逐渐增大,花色苷含量在1.86~18.39 mg/L的范围内时,对DPPH+的清除率范围为16.91%~93.96%,计算Trolox当量,相当于Trolox浓度为5.70~22.66 mg/L,花色苷含量与DPPH自由基清除率呈现显著的正相关性(R2=0.9938),其IC50值为7.81 mg/L,表明紫粒小麦麸皮花色苷对DPPH自由基有较强的清除效果。文献报道采用乙醇:盐酸(1N)(85∶15,v/v)的麸皮花色苷提取液用于DPPH+的清除率分析,清除率为63.17%[10],未对其ABTS+·的清除率和铁还原力进行分析。

表4 两种提取方法获得紫粒小麦麸皮花色苷提取液抗氧化活性比较

图6 紫粒小麦麸皮花色苷对DPPH+的清除率Fig.6 The effect of anthocyaninsfrom purple wheat bran on DPPH+ scavenging
2.2.2清除ABTS自由基从图7可看出,当紫粒小麦麸皮花色苷含量在4.86~27.84 mg/L范围内,对ABTS+·的清除率为13.27%~89.58%,计算TEAC当量,相当于Trolox浓度为4.45~26.97 mg/L。紫小麦麸皮花色苷含量与ABTS+·自由基的清除率两者间有显著的正相关性(R2=0.9737)。紫粒小麦花色苷清除ABTS+·的IC50值为12.20 mg/L,表明其对ABTS+·有较强的清除效果。

图7 紫粒小麦麸皮花色苷对ABTS+·自由基的清除率Fig.7 The effect of anthocyaninsfrom purple wheat bran on ABTS+· scavenging
2.2.3铁还原力Benzie和Strain建立的FRAP法是用于评价总抗氧化能力常用的方法之一[20],原理明确,操作简便,不需特殊仪器,易于标准化,已用于测定不同抗氧化物质、食物与生物样品的抗氧化活性[19]。紫粒小麦花色苷铁还原力分析结果见图8。由图8可知,紫粒小麦麸皮花色苷含量在0.93~9.28 mg/L范围内,还原力为0.11~0.87,相当于Trolox的浓度为7.76~29.11 mg/L。花色苷含量与还原力呈现显著的正相关(R2=0.9985),表明其具有较强的铁还原力。

图8 紫粒小麦麸皮花色苷的还原力Fig.8 The concentration dependentferric reducing antioxidant power of anthocyanins from purple wheat bran
2.2.4与普通浸提法花色苷提取液抗氧化活性比较采用正交优化获得的工艺参数获得紫粒小麦麸皮花色苷提取液,以及与参考文献[5]获得普通浸提提取液,比较二者的其体外抗氧化活性,差异显著(p<0.05),结果见表4,通过超声波辅助提取的麸皮花色苷提取液的体外抗氧化活性较高,可能与其提取液中花色苷含量高于普通浸提法有关。
3 结论
超声波辅助提取法具有提取时间短、提取含量高、操作方便等优点,正交实验结果表明对紫粒小麦麸皮花色苷提取得率的影响顺序为乙醇浓度>提取温度>料液比,其中乙醇浓度对得率影响极显著(p<0.01),提取温度对得率影响显著(p<0.05),料液比对得率影响均不显著。综合单因素实验和正交实验确定的最佳提取工艺条件为:料液比1∶10(g/mL)、乙醇浓度60%、提取温度为60 ℃、超声波辅助提取时间10 min、超声波输出功率160 W,在此条件下得到的紫粒小麦麸皮花色苷得率为1.82±0.23 mg/g,是普通浸法的2.09倍。
紫粒小麦麸皮花色苷提取液对DPPH+、ABTS+·的清除能力较强,浓度为18.39 mg/L和27.84 mg/L时清除率分别达93.96%和89.58%,且FRAP分析显示其具有较强的铁还原力。这些研究结果均表明紫粒小麦麸皮花色苷提取液具有良好的体外抗氧化活性,具有广阔的市场前景和科学研究价值。
参考文献
[1]王金亭,天然黑小麦色素研究进展[J]. 粮食与油脂. 2013,26(3):45-48.
[2]自云凤,李文德,孙善澄,等.黑粒小麦76号的营养品质及其几个理化特性[J].中国粮油学报,2000,15(2):6-9.
[3]刘慧芳,张名位.黑色食品新资源河东乌麦营养成分的评价[J].中国粮油学报,1999,14(2):1-3.
[4]李杏普,兰素缺,刘玉平.蓝、紫粒小麦籽粒色素及其相关生理生化特性的研究[J].作物学报,2003,29(1):157-158.
[5]李伟,唐晓珍,姜媛,等.黑粒小麦麸皮中花色苷的提取及性质研究[J].中国粮油学报,2011,26(10):12-16.
[6]时玉晴,苏东民,苏东海,等.超声波辅助法提取黑色小麦麸皮花色苷工艺优化[J].粮食与油脂,2015,28(4):15-18.
[7]赵善仓,刘宾,赵领军,等.蓝、紫粒小麦籽粒花色苷组成分析[J].中国农业科学,2010,43(19):4072-4080.
[8]Al-Farsi M,Alasalvar C,Morris A,et al. Comparison of antioxidant activity,anthocyanins,carotenoids,and phenolic of three native fresh and sun-dried date(PhoenixdactyliferaL.)varieties grown in Oman[J]. Journal of Agricultural and Food Chemistry,2005,53(19):7592-7599.
[9]Hosseinian FS,Li W,Beta T. Measurement of anthocyanins and other phytochemicals in purple wheat[J]. Food Chemistry,2008,109(4):916-924.
[10]Li W,Pickard M,Beta T. Effect of thermal processing on antioxidant properties of purple wheat bran[J]. Food Chemistry,2007,104(3):1080-1086.
[11]刘荣,姜元松,辛越,等.山桃稠李果实花色苷对Nrf2/Keap1通路的影响[J].食品工业科技,2014,35(6):116-118,124.
[12]李金星,胡志和,马立志,等.超声波辅助提取蓝莓果渣中花色苷的条件研究[J].食品工业科技,2013,34(20):255-259.
[13]李双石,李浡,张虎成,等.超声波提取条件对酿酒葡萄皮渣花色苷的影响[J].食品工业科技,2013,34(18):294-297.
[14]焦彩凤,俞超,吴月燕.响应面法优化超声波辅助提取葡萄悬浮细胞花色苷[J].食品工业科技,2014,35(11):220-224,229.
[15]Arts M,Dalling S,Voss H,et al. A new approach to assess the total antioxidant capacity using the TEAC[J]. Food Chemistry,2004,88:567-570.
[16]Om P.Sharma,Tej K Bhat. DPPH antioxidant assay revisited[J]. Food Chemistry,2009,113(4):1202-1205.
[17]Pellegrini N,Serafini M,Colombi B. Total antioxidant capacity of plant foods,beverages and oils consumed in Italy assessed by three differentinvitroassays[J]. Journal of Nurtition,2003,133(9):2812-2819.
[18]BenzieI F,Strain J. The ferric reducing ability of plasma(FRAP)as a measure of “antioxidant power”:the FRAP assay[J]. Analytical Biochemistry,1996,239:70-76.
[19]郭长江,杨继军. FRAP 法测定水果不同部分抗氧化活性[J].中国公共卫生,2003,19(7):841-843.
Extraction and antioxidant activities of anthocyanins from purple wheat bran
FU Hong-fei1,LIU Xue-mei2,3,SUN Jing-ru1,HUANG Xing-jian2,3,*,PAN Si-yi2,3
(1.College of Food Science and Engineering,Northwest A&F University,Yangling 712100,China;2.Colloge of Food Science and Technology,Huazhong Agricultural University,Wuhan 430070,China;3.MOE Key Laboratory of Environment Correlative Dietology,Huazhong Agricultural University,Wuhan 430070,China)
Purple wheat bran is rich in anthocyanins,which has attracted attention for its health benefits. The aim of this paper was to optimize the yield parameters for the ultrasonic-assisted extraction of anthocyanins from purple wheat bran using the single factor experiments and the orthogonal experiment,and the antioxidant activities of anthocyanins extracted from purple wheat bran were detected by DPPH free radical scavenging assay,ABTS+· assay,and FRAP assayinvitro. The results implied that the best process parameters of ultrasonic assisted extraction of black wheat bran anthocyanins were 60% ethanol,solid-liquid ratio was 1∶10(g/mL),extraction time 10 min,extraction temperature 60 ℃,ultrasonic power 160 W,and the yield was 1.82±0.23 mg/g. Moreover,the results of antioxidant experiments showed that the anthocyanins from purple wheat bran purple had very strong scavenging capabilities for DPPH free radical and ABTS free radical as well as ferric reducing power,and the antioxidants activities were in a linear concentration dependent manner with corresponding correlation coefficients(R2)of 0.9938,0.9737 and 0.9985,respectively,with the IC50values were 7.81 mg/L,12.20 mg/L and 5.18 mg/L,respectively. All the results will provide theoretical basis for the functional food development based on the anthocyanins from purple wheat bran.
Purple wheat bran;anthocyanin;ultrasonic-assisted extraction;antioxidant activities
2015-05-19
傅虹飞(1983-),女,博士,研究方向:天然产物化学,E-mail:fuhongfei@nwsuaf.edu.cn。
黄行健(1979-),男,副研究员,研究方向:食品加工化学,E-mail:xueshu2007@aliyun.com。
国家863项目(2013AA102206);教育部博士点基金新教师类(13JJ4086);西北农林科技大学博士科研启动基金(2010bsJJ052)。
TS201.1
B
1002-0306(2016)01-0000-00
10.13386/j.issn1002-0306.2016.01.000
