葡聚糖凝胶Sephadex LH20柱层析分离纯化蓝莓花色苷的研究
2016-09-12申芮萌张海平孙爱东
申芮萌,杨 岚,于 宁,朱 月,朱 宁,张海平,张 鑫,孙爱东
(1.北京林业大学生物科学与技术学院食品科学与工程系,北京 100083;2.北京林业大学林业食品加工与安全北京市重点实验室,北京 100083)
申芮萌,杨岚,于宁,朱月,朱宁,张海平,张鑫,孙爱东*
(1.北京林业大学生物科学与技术学院食品科学与工程系,北京 100083;2.北京林业大学林业食品加工与安全北京市重点实验室,北京 100083)
本论文初步探讨了采用Sephadex LH-20凝胶柱层析分离纯化蓝莓花色苷的工艺条件,比较了花色苷在不同缓冲液浓度、不同流速和不同上样量条件下的分离效果,并将最佳分离条件下得到的组分进行紫外可见波长扫描,对其中的花色苷组分进行HPLC检测。结果表明,当以30%的酸化甲醇为洗脱液,采用混合流速进行洗脱,进样量为20 mg时,蓝莓花色苷的分离效果最好,共收集到七个峰组分。经紫外-可见光谱扫描,可确定组分Ⅰ、Ⅱ、Ⅲ为非花色苷类物质;组分Ⅳ、Ⅴ、Ⅵ、Ⅶ为花色苷类物质。由HPLC检测可知:组分Ⅳ中只含一种蓝莓花色苷;组分Ⅵ、Ⅶ均以一种花色苷为主,且其峰面积比例达到85%以上;组分Ⅴ中主要含两种花色苷。
蓝莓花色苷,Sephadex LH-20,HPLC
蓝莓(Blueberry)又称越橘、蓝浆果,为多年生落叶或常绿灌木,果实为浆果,近圆形,呈蓝色,酸甜适度,果肉细腻[1-2]。蓝莓营养成分丰富,除含常规的有机酸、糖、维生素和矿物质外,还富含大量的花色苷类物质[3-4]。近几年的国内外研究表明,花色苷具有多种生理功能,比如:清除自由基[5]、延缓衰老[6]、抗菌消炎[7]、预防癌症[8-9]、降低胆固醇[10]、防止动脉粥样硬化[10-11]、增强人体免疫力[12]、改善和强化视力[12-14]等。而蓝莓花色苷作为一种天然色素,具有资源丰富、安全无毒的特点,在食品、药品和化妆品领域都有着广阔的应用前景和消费市场。因此,如何制备高纯度的蓝莓花色苷一直是该领域研究的热点。
目前蓝莓花色苷分离纯化的方法主要有大孔树脂法、高效液相色谱法、超滤法、高速逆流色谱法等[15],其中大孔树脂法以成本低且操作简单、易行等特点成为当前分离纯化花色苷的主要方法。郑红岩[16]等以蓝莓果提取液为原料,研究了12种大孔树脂对花色苷的静态吸附与解析效果,并优化了大孔树脂分离纯化蓝莓花色苷的工艺技术参数。李颖畅[17]等研究了AB-8型大孔树脂对蓝莓花色苷的吸附与解吸条件。但是经大孔树脂纯化精制得到的花色苷纯度并不高[18-19],还远达不到人们的要求。本文旨在大孔树脂纯化的基础上,利用葡聚糖凝胶技术进一步探讨蓝莓花色苷分离纯化工艺,以期为提高花色苷纯度,扩大应用范围提供技术参考。
1 材料与方法
1.1材料与仪器
实验用蓝莓鲜果(爱国者)产于大兴安岭林区,使用前在零下80 ℃冷冻保存;Amberlite XAD-7大孔树脂购自Sigma公司,使用前经过活化预处理;Sephadex LH-20填料购自GE公司;无水甲醇、甲酸、乙酸乙酯均为分析纯,购自国药集团化学试剂有限公司;色谱级甲醇购自赛默飞世尔科技有限公司;色谱级甲酸购自阿拉丁有限公司。
LQ-A 30002电子天平瑞安市乐祺贸易有限公司;pH计上海精密科学有限公司;超声波中药处理机济宁奥波超生电气有限公司;循环水真空泵、L3660D低速离心机上海知信实验仪器技术有限公司;RE-52旋转蒸发器上海亚荣生化仪器厂;HL-2S恒流泵、BSZ-100自动部分收集器上海青浦沪西仪器厂;FD-18冷冻干燥机北京天佑科技发展有限公司;UV-2500PC Series、LC-20AD高分离度快速液相色谱系统配有在线脱气机、高压二元泵、柱温箱及二极管阵列紫外检测检测器(PDA)SHIMADZU公司产品。
1.2实验方法
1.2.1蓝莓花色苷的制备称取100 g蓝莓鲜果,破碎打浆后加入700 mL 60%甲醇溶液(用甲酸调pH至2.2左右),超声辅助提取30 min(功率400 W,温度30 ℃)。提取液于4000 r/min离心20 min,剩余果渣用200 mL提取剂再次超声提取,合并两次上清液,用60%甲醇溶液定容至1000 mL。减压浓缩后用乙酸乙酯以1∶1(v∶v)在室温避光条件下萃取三次。水层部分通过XAD-7大孔树脂柱吸附后,先用5倍柱体积的酸化去离子水淋洗,以除去有机酸、蛋白质和多糖等杂质。再用60%酸化甲醇进行洗脱,收集洗脱液,减压浓缩后经冷冻干燥制得紫黑色蓝莓花色苷纯化粉末。低温贮存,备用。
1.2.2葡聚糖凝胶柱的处理
1.2.2.1凝胶预处理称取25 g Sephadex LH-20填料,室温下置于无水甲醇中溶胀过夜,脱气后装柱。
1.2.2.2装柱与平衡先向Φ16 mm×50 cm的层析柱中加入4~5 cm高度的无水甲醇,然后尽量一次性将搅拌均匀的葡聚糖凝胶通过玻璃棒引流的方式全部缓慢倒入层析柱中,并以自下而上的方式不断敲击层析柱外壁,以排出气泡,在此过程中保持下方出水口水流通畅,但应控制水流速度使之低于凝胶自然沉降速度,以免柱体流干。最终得到柱高46 cm,柱体积约92 mL 的凝胶柱。先用无水甲醇平衡2~3个柱体积。在每次上样前,再用2~3个柱体积的缓冲液平衡凝胶柱,使基线稳定[20-21]。
1.2.3凝胶层析分离条件的优化
1.2.3.1绘制曲线取一定量蓝莓花色苷纯化粉末溶解于缓冲液(即为不同浓度的酸化甲醇溶液,实验中溶解液与洗脱液必须一致并统称之为缓冲液),当样品渗入胶床后用相应的缓冲液进行洗脱,每3 mL收集1管,并测定其在530 nm下的吸光度值,以管数为横坐标,吸光度值为纵坐标,绘制曲线。
1.2.3.2不同工艺条件下Sephadex LH-20凝胶柱的分离效果的比较缓冲液浓度的筛选:在Sephadex LH-20凝胶上,以30%酸化甲醇为洗脱液,浓度分别设定为20%、30%、40%(pH均调至2.2左右),流速为0.5 mL/min,上样量为10 mg。
流速的筛选:在Sephadex LH-20凝胶上,将pH2.2的30%酸化甲醇作为洗脱液,流速分别设定为0.5、1.0、2 mL/min,上样量为10 mg 。
上样量的筛选:在Sephadex LH-20凝胶上,将30%酸化甲醇作为洗脱液,采用混合流速进行洗脱,上样量分别为10、20、30 mg。
1.2.4紫外-可见光谱扫描在凝胶层析的最佳条件下,收集Sephadex LH-20分离的目标物峰尖部分并合并,对各部分进行稀释或浓缩后进行紫外-可见波长全扫描,进行初步的分析鉴定。
1.2.5HPLC对蓝莓花色苷组分的检测与分析对紫外-可见光谱扫描鉴定的蓝莓花色苷组分用高效液相色谱进行分析。色谱条件:Agilent TC-C18色谱柱(4.6 mm×250 mm,5 μm);流动相A:色谱级甲醇,流动相B:3%甲酸水溶液;采用二元梯度洗脱,洗脱程序如下:0~20 min,15%~20%A;20~30 min,20%~22%A;30~45 min,22%~45%A;45~55 min,45%A。检测波长:530 nm;柱温35 ℃;流速0.5 mL/min;进样体积:20 μL。
1.3数据统计分析
采用Microsoft Excel 2016;LabSolutions Version 5.54 SP5统计软件进行数据分析。
2 结果与分析
2.1凝胶层析分离条件的优化
2.1.1缓冲液浓度的筛选20%、30%、40%甲醇对蓝莓花色苷的洗脱效果如图1~图3所示,可以看出上样量为10 mg,洗脱速度为0.5 mL/min 时,随着甲醇浓度的增大,洗脱能力的增强,蓝莓花色苷的洗脱速度也逐渐加快,但分离效果变差。用20%、30%甲醇进行洗脱时,均可观察到5个峰组分,而用40%甲醇进行洗脱时,仅可观察到4个峰组分,且峰扭曲变形、较为尖锐变差。分析原因可能是虽不同蓝莓花色苷极性存在差异,但在40%甲醇溶液中,均有较高的溶解度,因此极性相近的花色苷易同时被洗脱出来。从峰型上来说,20%和30%甲醇的洗脱效果相差并不大,但随着洗脱液浓度的降低,蓝莓花色苷的出峰时间将延长,用30%甲醇进行洗脱,到115管时5个样品组分已全部被洗脱出来,而用20%甲醇洗脱时,到140管仍没有洗脱完全,并且有拖尾现象。因此低浓度的洗脱液会降低洗脱效率,使溶剂消耗增多,洗脱时间延长。综上,本实验选择30%甲醇作为缓冲液。

图1 20%甲醇浓度对洗脱效果的影响Fig.1 Influence of 20% methanol on the elution effect
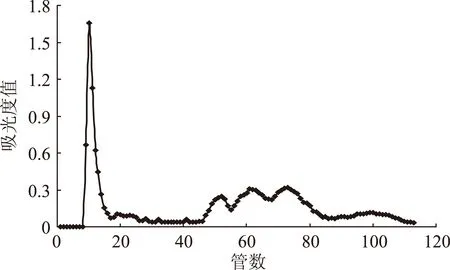
图2 30%甲醇浓度对洗脱效果的影响Fig.2 Influence of 30% methanol on the elution effect
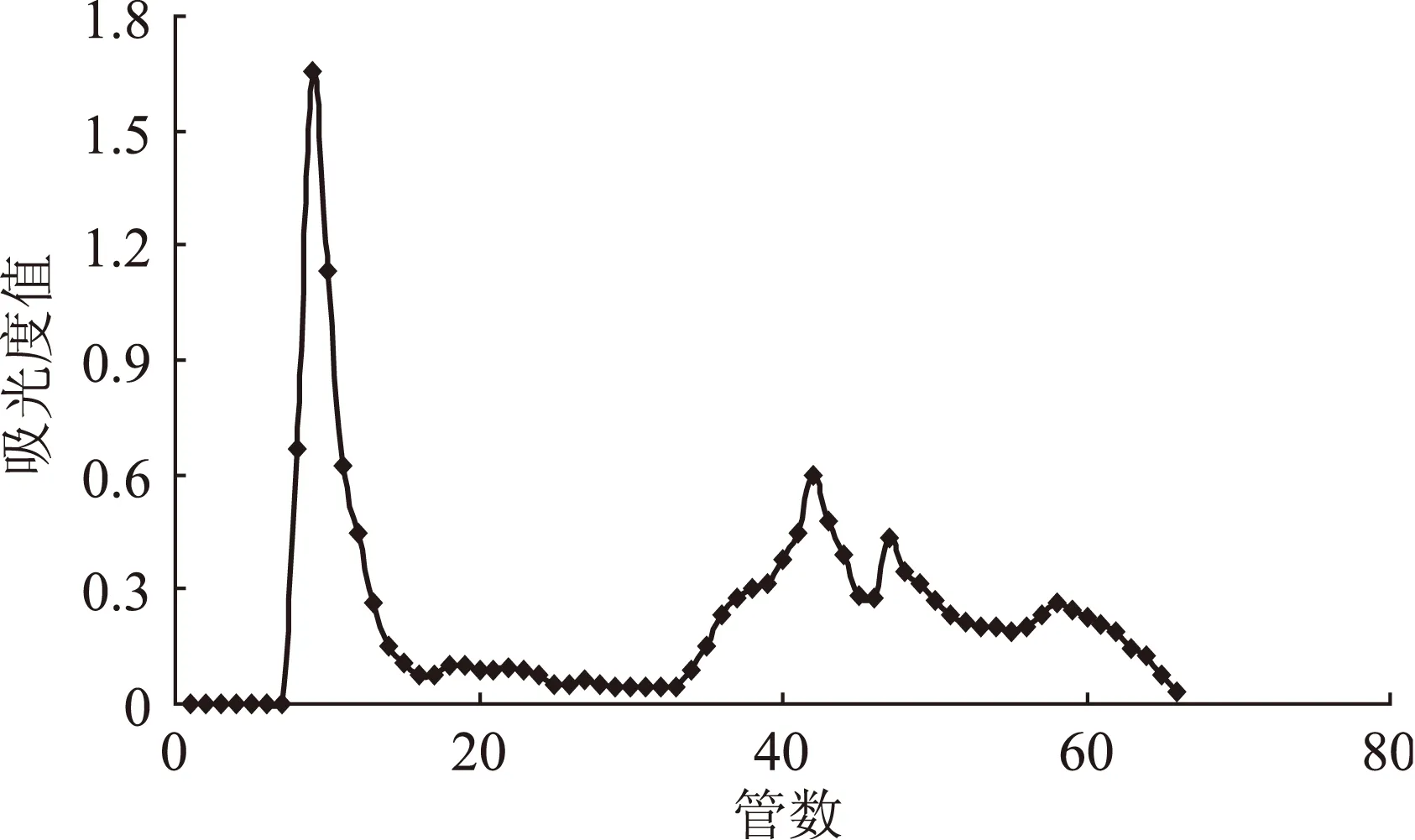
图3 40%甲醇浓度对洗脱效果的影响Fig.3 Influence of 40% methanol on the elution effect
2.1.2流速的筛选洗脱流速1.0 mL/min时蓝莓花色苷的洗脱效果如图4所示,洗脱流速0.5 mL/min时蓝莓花色苷的洗脱效果如图2所示。结合图2和图4可以看出,以30%甲醇为洗脱剂,上样量为10 mg时,在0.5 mL/min的流速下洗脱效果最好,当流速为1.0 mL/min时,虽然洗脱时间缩短,但洗脱峰的分离度明显降低,分析原因可能为洗脱速度加快使分辨率降低,从而导致分离效果变差,由此可推断洗脱流速为2 mL/min时,由于速度的加快,蓝莓花色苷更难以被分离,所以在实际实验中省略了这步操作。但如果流速过慢,则会导致样品在凝胶中的停留时间延长,扩散加剧,条带变宽,反而会使分辨率降低。所以洗脱流速应不低于0.5 mL/min。
实验中,通过观察葡聚糖凝胶柱颜色变化可发现:在洗脱后不久,样品会分成两条色带Ⅰ、Ⅱ,下方暗紫红色条带Ⅰ下降速度很快,且与上方条带Ⅱ保持一定距离,将首先被洗脱收集;随着洗脱时间的增加,上方色带Ⅱ则会逐渐分成四个色带。结合0.5、1.0 mL/min流速下洗脱图谱的特点,我们对洗脱流速进行了优化,即采用混合流速对蓝莓花色苷进行洗脱:1~30管,流速为1.0 mL/min;31~70管,流速为0.5 mL/min;71~100管,流速为2.0 mL/min。洗脱效果如图5所示,从峰型来看,采用混合流速洗脱能够将这五种组分较好的分离,且与0.5 mL/min洗脱流速下的分离效果相差不大。但从时间上来看,当流速为0.5 mL/min时,蓝莓花色苷组分洗脱完全需耗时690 min;而采用混合流速时,洗脱完全仅需要375 min,洗脱效率大大提高。综上,混合流速下的洗脱效果优于单一流速条件下的洗脱效果,因此,最终选择混合流速进行洗脱。
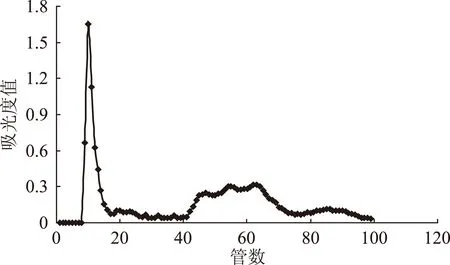
图4 1 mL/min的洗脱流速对洗脱效果的影响Fig.4 Influence of flow rate of 1 mL/min on eluting effect
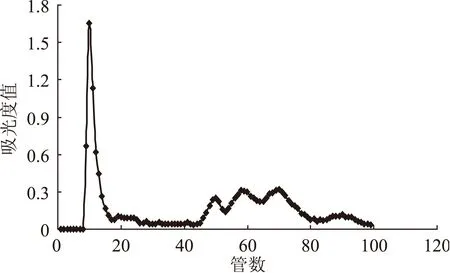
图5 混合洗脱流速对洗脱效果的影响Fig.5 Influence of mixed flow rate on eluting effect
2.1.3上样量的筛选首先探究不同上样浓度对分离效果的影响。称取两份10 mg蓝莓花色苷粉末分别溶于1、2 mL 30%甲醇溶液中,在Sephadex LH-20凝胶上,以30%酸化甲醇为洗脱液,采用混合流速进行洗脱。实验结果表明当进样浓度分别为10、5 mg/mL时的洗脱图谱一致,因此凝胶色谱分离与上样浓度无关。
为研究不同上样量对葡聚糖凝胶分离效果的影响,同时为进一步验证采用混合流速进行洗脱效果的重现性与可行性,实验在其它条件不变的基础上,继续对上样量为20、30 mg的蓝莓花色苷纯化粉末进行了凝胶分离实验,分离效果如图6、图7所示。从图6可以看出当上样量为20 mg时,采用混合流速进行洗脱,蓝莓花色苷也具有较好的分离效果。通过对比上样量10(图5)、20 mg的洗脱曲线,发现对于已经在10 mg的洗脱图谱中出现的5个峰组分,随着上样量的增加,对应的同一洗脱组分的吸光度值也随之增大。但在20 mg的图谱上20~40管之间的位置,又出现了两个峰组分,在10 mg的图谱中并不明显,可能是由于浓度太低而被忽略。当上样量为30 mg时,蓝莓花色苷的分离效果变差。
综上,当进样量为20 mg,洗脱液浓度为30%酸化甲醇且采用混合流速进行洗脱时,蓝莓花色苷的分离效果最好,收集此条件下经凝胶分离得到的7个峰组分Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ,进行进一步的分析与鉴定。
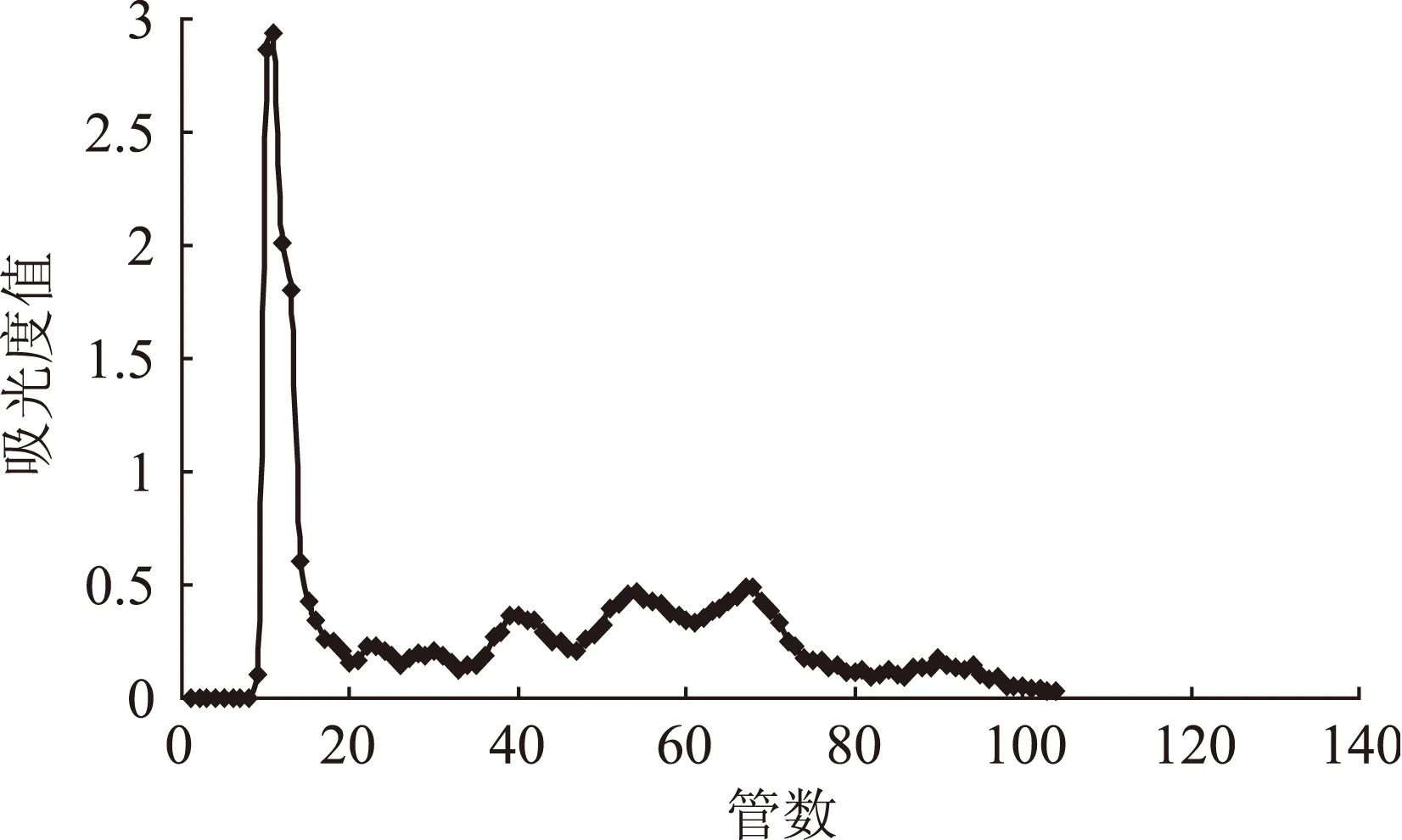
图6 上样量20 mg时对洗脱效果的影响Fig.6 Influence of 20 mg sample amount on eluting effect

图7 上样量30 mg对洗脱效果的影响Fig.7 Influence of 30 mg sample amount on eluting effect
2.2紫外-可见光谱分析
花色苷的最大吸收波长一个在可见光区的500~540 nm附近,另一个在紫外区275 nm附近,通过测定色素的最大吸收波长即可判断是否为花色苷类色素。由各组分的光谱图可知,组分Ⅰ、Ⅱ、Ⅲ在500~540 nm内没有特征吸收峰,因此可以确定其为非花色苷类物质。而组分Ⅳ在527 nm处有最大吸收峰,组分Ⅴ在522 nm处有最大吸收峰,组分Ⅵ在518 nm处有最大吸收峰,组分Ⅶ在525 nm处有最大吸收峰,且各组分均在275 nm附近有吸收,均符合花色苷类物质的特征,确定其为蓝莓花色苷类物质,并对Ⅳ、Ⅴ、Ⅵ、Ⅶ做进一步的分析研究。
2.3HPLC对蓝莓花色苷组分的检测与分析
蓝莓花色苷的甲醇粗提液经HPLC的检测结果如图9所示。
SephadexLH-20柱层析分离得到的四种蓝莓花色苷组分Ⅳ、Ⅴ、Ⅵ、Ⅶ经HPLC的检测结果如图10所示。图A为组分Ⅳ的检测结果,在530 nm的波长下仅出现了一个色谱峰,说明其只含一种花色苷且纯度较高。出峰时间为48.758 min,与甲醇提取液的HPLC图谱(图9)进行比较,由表1可知,48.7 min左右为8号峰的位置,因此可以初步鉴定组分Ⅳ主要为8号峰。图B为组分Ⅴ的检测结果,可以看出组分Ⅴ含四种蓝莓花色苷,由峰面积的比例可知,含量最丰富的为42.693 min峰(69.71%),其次为34.887 min峰(23.05%)。与图9进行比较,由表1可知,分别对应的为4号峰和2号峰。图C为组分Ⅵ的检测结果,可知组分Ⅵ中保留时间为27.335 min的峰含量最丰富,占总峰面积的94.31%,与图9进行比较,由表1对应的为1号峰。说明组分Ⅵ中主要是1号峰蓝莓花色苷。组分Ⅶ的检测结果如图D所示,组分Ⅶ中含有的蓝莓花色苷种类较丰富,但以两种为主,其中含量最丰富的为36.812 min峰(86.43%),其次为27.442 min峰(7.51%)。与图9进行比较,由表1可知分别对应的为3号峰和1号峰。
综上,组分Ⅳ的分离效果最佳,纯度最高。组分Ⅵ和Ⅶ虽然含花色苷种类较多,但都以一种花色苷单体物质为主,其占峰面积比例达到85%以上。组分Ⅴ主要包括两种花色苷单体。说明蓝莓花色苷经过大孔树脂纯化富集,Sephadex LH-20层析后得到了很好的分离,能够得到纯度较高的花色苷单体物质。
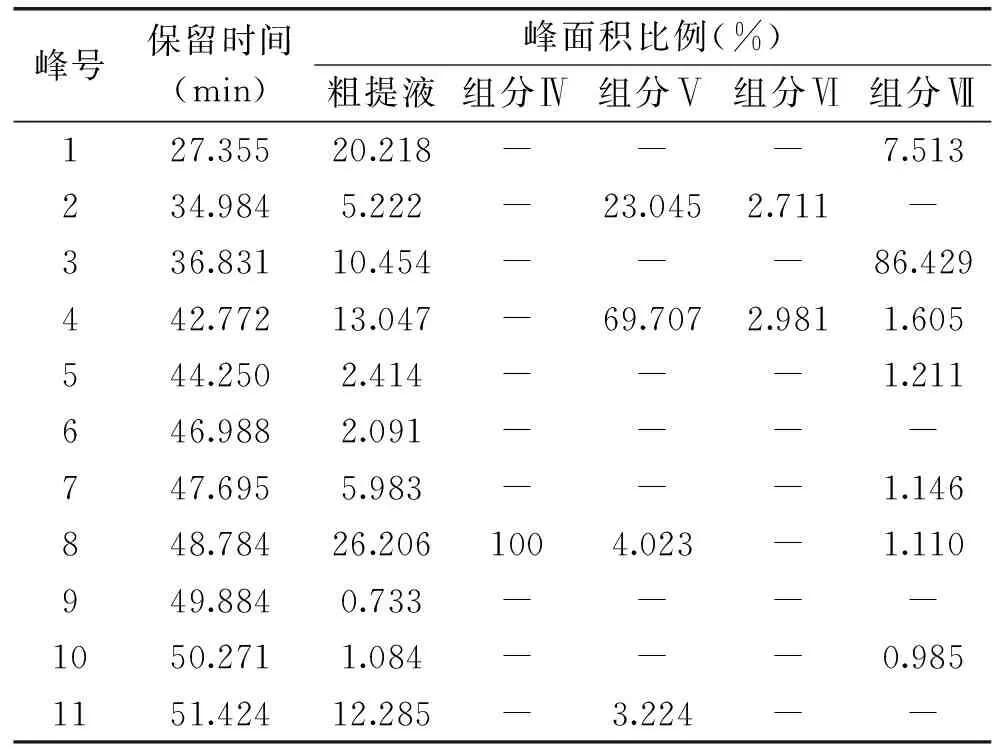
表1 蓝莓花色苷粗提液与组分Ⅳ、Ⅴ、Ⅵ、Ⅶ的 峰面积比较结果Table 1 Comparison of peak area ratio between crude anthocyanins extracts and 35% ethonal eulate
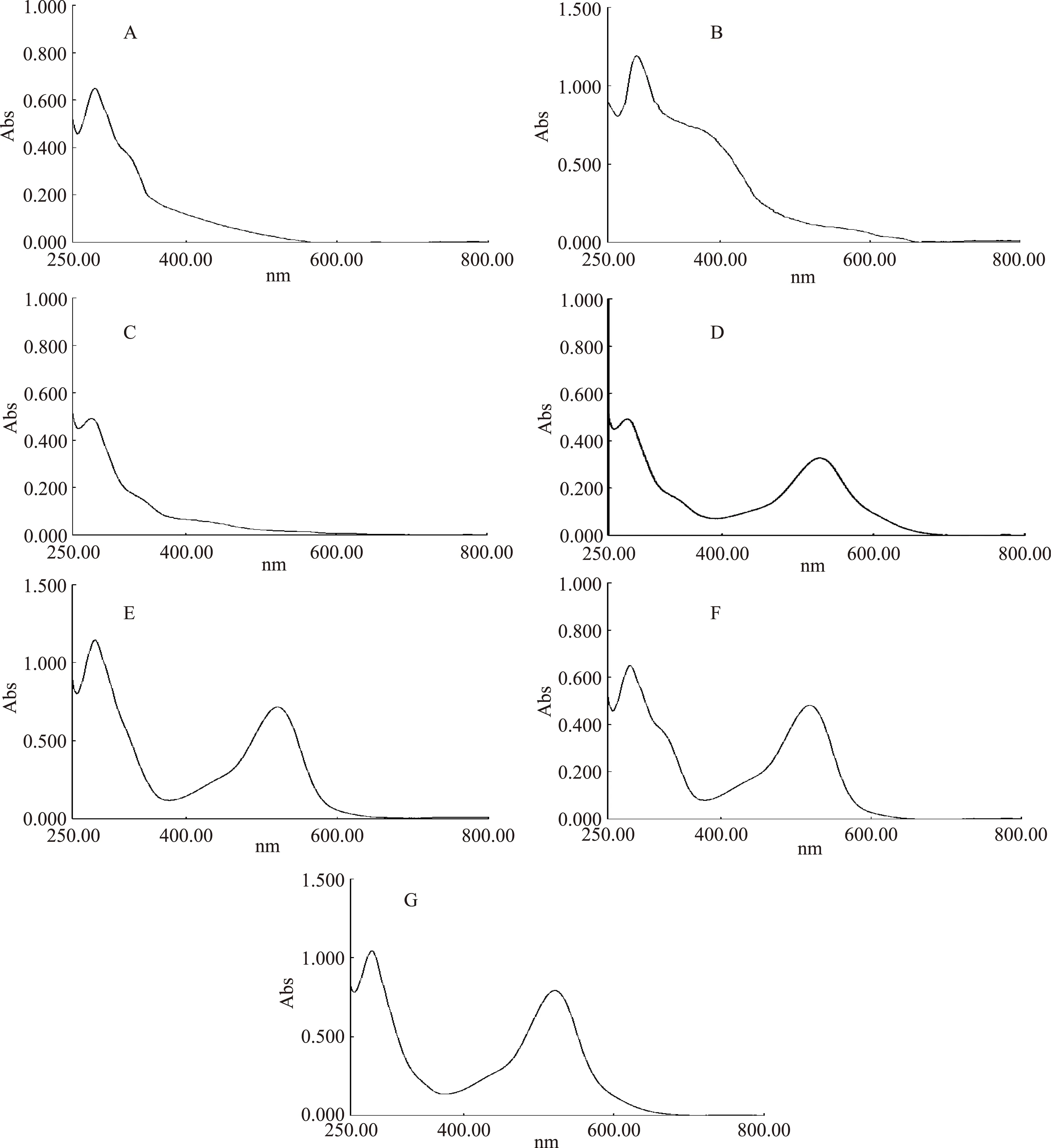
图8 LH-20 制备出的七种组分的紫外-可见光谱扫描图Fig.8 The UV-Vis spectrum scan profile of seven segments obtained from Sephadex LH-20 column注:A-组分Ⅰ;B-组分Ⅱ;C-组分Ⅲ;D-组分Ⅳ;E-组分Ⅴ;F-组分Ⅵ;G-组分Ⅶ。
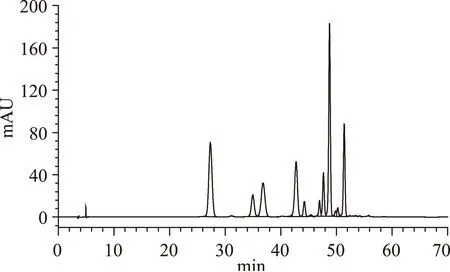
图9 蓝莓花色苷的甲醇粗提液的HPLC图谱Fig.9 HPLC profile of anthocyanin crude extracts
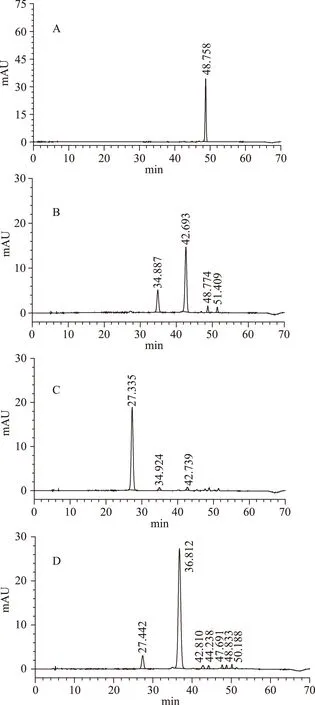
图10 利用LH-20制备出的 四种蓝莓花色苷组分的HPLC图谱Fig.10 HPLC profile of four anthocyanin segments obtained from Sephadex LH-20 column注:A-组分Ⅳ;B-组分Ⅴ;C-组分Ⅵ;D-组分Ⅶ。
3 结论
大孔树脂纯化后的蓝莓花色苷冻干粉末,在Sephadex LH-20凝胶层析柱分离的最佳工艺条件为:上样量20 mg,30%甲醇为洗脱液,采用混合流速进行洗脱且上样浓度不影响分离效果。在此条件下得到的7个花色苷组分,通过紫外-可见全波长扫描初步判定,首先洗脱出的为非花色苷组分Ⅰ、Ⅱ、Ⅲ,随后洗脱出的Ⅳ、Ⅴ、Ⅵ、Ⅶ为花色苷类物质。经HPLC检测,组分Ⅳ的分离效果最佳,仅含一种花色苷单体,组分Ⅵ和Ⅶ中主要花色苷的峰面积比例达到85%,而组分Ⅴ则主要包含两种花色苷单体。说明利用Sephadex LH-20特有的分子筛和吸附层析作用,可以将蓝莓花色苷单体进行有效的分离纯化,为后期大规模地制备花色苷产品提供技术参数,为蓝莓高附加值产品在食品、药品领域的应用奠定基础。
[1]解利利,张慜,孙金才.化学吸附法脱除蓝莓汁中单宁的研究[J].食品与生物技术学报,2010,6:847-853.
[2]马艳萍.蓝莓的生物学特性、栽培技术与营养保健功能[J].中国水土保持,2006,2:47-49.
[3]李咏梅.越橘的开发利用价值[J].特种经济动植物,2002,6:23.
[4]杨秀松.蓝莓汁生产热烫工艺对多酚氧化酶及多酚类化合物的影响[J].化学工程师,2012,5:54-59.
[5]吕春茂,王新现,包静,等.越橘果实花色苷的体外抗氧化性[J].食品科学,2010,23:27-31.
[6]Takanori T,Mie W,Katsumi O,et al. Antioxidative Activity of the Anthocyanin Pigments Cyanidin 3-O-.beta.-D-Glucoside and Cyanidin[J]. Journal of Agricultural and Food Chemistry,1994,42:2407-2410.
[7]Taverniti V,Fracassetti D,DelBo C,et al. Immunomodulatory Effect of a Wild Blueberry Anthocyanin-Rich Extract in Human Caco-2 Intestinal Cells[J]. Journal of Agricultural and Food Chemistry,2014,62(33):8346-8351.
[8]Yun J W,Lee W S,Kim M J,et al. Characterization of a profile of the anthocyanins isolated from Vitis coignetiae Pulliat and their anti-invasive activity on HT-29 human colon cancer cells[J]. Food and Chemical Toxicology,2010,48(3):903-909.
[9]Cai H,Marczylo T H,Teller N,et al. Anthocyanin-rich red grape extract impedes adenoma development in the ApcMin mouse:Pharmacodynamic changes and anthocyanin levels in the murine biophase[J]. European Journal of Cancer,2010,46(4):811-817.
[10]Cassidy A,Kenneth J M,Lydia L,et al. High Anthocyanin Intake Is Associated With a Reduced Risk of Myocardial Infarction in Young and Middle-Aged Women[J]. Circulation,2013,127(2):188-196.
[11]Roopchand D E,Kuhn P,Rojo L E,et al. Blueberry polyphenol-enriched soybean flour reduces hyperglycemia,body weight gain and serum cholesterol in mice[J]. Pharmacological Research,2013,68(1):59-67.
[12]陈介甫,李亚东,徐哲.蓝莓的主要化学成分及生物活性[J].药学学报,2010,4:422-429.
[13]Seiji Me,Noriko T,Mariko S,et al. Vision preservation during retinal inflammation by anthocyanin-rich bilberry extract:cellular and molecular mechanism[J]. Laboratory Investigation,2012,92(1):102-109.
[14]Canter P H,Enst E.Anthocyanosides of Vaccinium myrtillus(bilberry)for night vision:A systematic review of placebo-controlled trials[J]. Survey of Ophthalmology,2004,49(1):38-50.
[15]吕春茂,包静,孟宪军,等.HPD-700型大孔树脂对野生越橘花色苷分离的研究[J].食品科学,2012,10:78-83
[16]郑红岩,于华忠,刘建兰,等.大孔吸附树脂对蓝莓花色苷的分离工艺[J].林产化学与工业,2014,4:59-65.
[17]李颖畅,郑凤娥,孟宪军.大孔树脂纯化蓝莓果中花色苷的研究[J].食品与生物技术学报,2009,4:496-500.
[18]刘玮,钱慧碧,辛秀兰,等.蓝莓果渣中总黄酮的提取纯化及抗氧化性能的研究[J].食品科技,2011,2:216-219.
[19]Wang E,Yin Y,Xu C,et al. Isolation of high-purity anthocyanin mixtures and monomers from blueberries using combined chromatographic techniques[J]. Journal of Chromatography A,2014,1327(31):39-48.
[20]朱振宝,吴园芳,易建华.紫甘蓝花色苷的分离纯化[J].食品科技,2012,6:239-243.
[21]田瑶.蓝莓中黄酮类物质的提取、分离纯化及生物活性研究[D].东北农业大学,2012.
[22]孙建霞,张燕,孙志健,等.花色苷的资源分布以及定性定量分析方法研究进展[J].食品科学,2009,5:263-268.
Study on isolation and purification optimization of blueberry anthocyanins by Sephadex LH-20
SHEN Rui-meng,YANG Lan,YU Ning,ZHU Yue,ZHU Ning,ZHANG Hai-ping,ZHANG Xin,SUN Ai-dong*
(1.Department of Food Science,College of Biological Sciences and Biotechnology,Beijing Forestry University,Beijing 100083,China;2.Beijing Foresty University,Key Laboratory of Forestry Food Processing and Security,Beijing 100083,China)
The extraction and purification of blueberry anthocyanins by Sephadex LH-20 were preliminarily disscussed. The respective separating effects of different buffer concentration,flow velocity and sample loading volume were compared and the optimization of the purification condition were selected. The sample components which separated by the optimal condition were scanned on UV-Visible wavelength and identified by HPLC analysis. The results showed that optimal extraction of blueberry anthocyanins conditions were as following:eluant was 30% ethanol,eluting method was mixture velocity elution,sample loading volume was 20 mg,and seven segments can be collected. Based on the scanning of UV-Visible wavelength,segment Ⅰ,Ⅱ,Ⅲ were not anthocyains and segment Ⅳ,Ⅴ,Ⅵ,Ⅶ were anthocyains. HPLC analysis results showed that segment Ⅳcontained one anthocyanin,segment Ⅵ,Ⅶ mainly contained one anthocyanin respectively and the peak area ratio reached over 85%,segment Ⅴ mainly contained two anthocyanins.
blueberry anthocyanins;Sephadex LH-20;HPLC
2015-09-21
申芮萌(1992-),女,硕士研究生,研究方向:天然产物生理活性的开发与利用,E-mail:997429368@qq.com。
孙爱东(1968-),女,博士,教授,研究方向:天然产物生理活性的开发与利用,E-mail:602310136@qq.com。
国家自然基金资助项目(31271981);国家自然科学基金资助项目(31471593)。
TS255.1
A
1002-0306(2016)09-0058-06
10.13386/j.issn1002-0306.2016.09.003
