响应面法优化嗜热链球菌产胞外多糖的发酵条件
2016-09-12张卫兵
陈 亚,梁 琪,*,杨 敏,2,张卫兵,张 炎
(1.甘肃农业大学食品科学与工程学院,甘肃兰州 730070;2.甘肃农业大学理工学院,甘肃兰州 730070)
响应面法优化嗜热链球菌产胞外多糖的发酵条件
陈亚1,梁琪1,*,杨敏1,2,张卫兵1,张炎1
(1.甘肃农业大学食品科学与工程学院,甘肃兰州 730070;2.甘肃农业大学理工学院,甘肃兰州 730070)
本实验采用响应面法(RSM)对影响嗜热链球菌(Q4)产胞外多糖(EPS)的发酵条件进行了优化。以EPS含量为指标,通过单因素实验初步得到Q4产EPS的发酵条件;采用Placket-Burman(PB)设计法从以上单因素中筛选出显著因素,对显著因素进行Box-Behnken(BB)中心组合实验设计优化,建立EPS含量与各影响因素的回归方程,获得Q4产胞外多糖的最佳发酵条件为:初始pH6.8、发酵时间33 h、发酵温度41 ℃。验证实验结果表明,在此条件下胞外多糖的产量可达268.42 mg/L,比优化前的EPS含量(89.43 mg/L)提高了3倍。
响应面法,嗜热链球菌,胞外多糖,培养条件
嗜热链球菌(Streptococcusthermophilus)是乳酸菌的一种,它能利用碳水化合物并产生大量乳酸,常被用来制作乳酸菌种,也可和保加利亚乳酸杆菌共生于脱脂乳中以生产酸乳及酸乳饮品。其产黏性对提高酸奶的组织状态及研制高效的直投式酸奶发酵剂具有非常重要的指导意义。因此,它的开发利用一直得到国内外乳品界的高度重视[1]。
近几十年来,由于微生物胞外多糖在产品结构、性能及生产方面所具有的特别优势而得到大力研究和开发,尤其是微生物胞外多糖的开发已成为工业微生物研究的热点之一。乳酸菌是公认的安全的食品级微生物,其次级代谢产物胞外多糖与其他多糖比较,对人类的安全性更为可靠[2-3],其中嗜热链球菌具有很好的产黏特性,是链球菌属中唯一的益生菌,其产生的胞外多糖具有多种生理功能,能够增强人体免疫,可用于食品工业和医药领域,具有潜在的开发价值,因而受到人们关注[4]。大量研究表明[5],乳酸菌胞外多糖不仅可以用做增稠剂、凝胶剂和稳定剂,对人体健康也有促进作用,如:能降低胆固醇,抗癌,抗溃疡,改善肠道微生态环境,增强人体免疫力或作为益生元等。但是由于乳酸菌胞外多糖产量低,菌株稳定性差,并且培养过程中降解率高,这是限制其在工业领域中大规模生产的主导因素。为了解决这个问题,在发酵工业中,提高微生物代谢产量的方法有很多种,乳酸菌EPS生物合成除受遗传因素即菌株自身因素的影响外,还受培养基的组成、pH、培养温度和发酵时间等培养条件的影响[6-7]。因此,本实验开发具有生产能力的嗜热链球菌Q4菌株,并对其产胞外多糖的发酵条件进行系统地研究具有重要科学价值,特别是高产EPS发酵乳制品的开发以及新型发酵多糖的功能特性的研究等。本研究在影响Q4高产EPS单因素实验的基础上,采用响应面分析法进一步优化Q4产EPS的发酵条件。
1 材料与方法
1.1材料与仪器
嗜热链球菌Q4,从甘肃部分藏区自然发酵牦牛乳中分离筛选所得(实验室冰箱-80 ℃保存),三氯乙酸、95%乙醇、浓硫酸、苯酚等均为分析纯;改良M17培养基,按文献进行配制[8]。
TGL-20高速台式冷冻离心机长沙湘仪离心机仪器有限公司;SW-CJ-2FD型双人单面净化工作台苏州净化设备有限公司;电热恒温培养箱上海-恒科仪器有限公司;PHS-3CpH计上海仪电科学仪器股份有限公司;54PG型紫外可见光分光光度计上海仪谱仪器有限公司;旋转蒸发器RE-52AA上海亚荣生化仪器厂。
1.2实验方法
1.2.1菌种的活化与传代用10%(w/v)脱脂乳作为培养基在115 ℃条件下灭菌15 min。在灭菌完的超净工作台中,按接种量5%吸取菌液,接种到脱脂乳中,震荡均匀后放于37 ℃生化培养箱,培养12 h。然后将发酵脱脂乳传代培养于新的脱脂乳中,培养12 h。如此传代培养2~3代,使菌株活力恢复。获得足够量的脱脂乳培养物进行下一步实验。
1.2.2母发酵液的制备按4%(V/V)的接种量,将活化后的脱脂乳接于30 mL的M17液体培养基中,37 ℃恒温培养24 h后,得发酵母液。
1.2.3发酵液的制备将母发酵液按4%(V/V)的量,接入装有100 mL M17液体培养基的250 mL三角瓶中,转速为180 r/min,37 ℃恒温培养24 h后,得发酵液。
1.2.4EPS的提取参照李全阳[9]的方法将发酵液在沸水浴中加热10 min,冷却后离心(4 ℃,10000 r/min)15 min,收集上清液,菌体沉淀用PBS洗涤三次,合并上清液;将上清液浓缩至原来体积的1/5,并加入15%的TCA溶液,室温下搅拌2 h后,离心(4 ℃,10000 r/min)30 min以除去蛋白沉淀;取上清液加入3倍体积的95%乙醇,4 ℃冷藏过夜,多糖呈絮状沉淀析出,离心(4 ℃,10000 r/min)10 min后,收集沉淀,用蒸馏水溶解(重复以上操作3~4次),并移入透析袋中用蒸馏水透析2 d,每8 h换一次水,将透析液称量、稀释、定容。
1.2.5ESP的测定采用苯酚硫酸法测定透析后的EPS含量,参照萨如拉[10]的方法。
1.2.5.1葡萄糖标准曲线的绘制准确称取经105 ℃干燥至恒重的无水葡萄糖25 mg,用蒸馏水溶解并定容于250 mL容量瓶中,制成浓度为0.1 mg/L的葡萄糖标准溶液。分别吸取标准液0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8和2.0 mL置于9支干燥具塞的试管中,并加蒸馏水至2 mL,然后向各试管分别加6%苯酚溶液(新制)1 mL,摇匀,然后迅速加入浓硫酸5.0 mL,立即摇匀,室温下静置30 min,于490 nm波长处测定各溶液的吸光度,蒸馏水为空白对照组,以葡萄糖稀释液的浓度为横坐标,吸光度为纵坐标,绘制葡萄糖标准曲线。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose cocentration
1.2.5.2EPS的含量测定准确吸取1 mL上述EPS溶液,加入6%苯酚溶液(新制)1 mL和5 mL浓硫酸,静置10 min并摇匀,室温放置30 min后,于490 nm波长处测定各溶液的吸光度,蒸馏水为空白对照组,在标准曲线上查找对应的EPS含量,即得嗜热链球菌Q4的胞外多糖产量。
1.2.6单因素实验
1.2.6.1初始pH对EPS含量的影响将含Q4的M17一次发酵液按4%的接种量接种至起始pH分别为5.5、6.0、6.5、7.0、7.5的M17液体培养基中,于37 ℃恒温培养24 h后,测定其EPS含量,设3次重复。
1.2.6.2发酵时间对EPS含量的影响将含Q4的M17一次发酵液按4%的接种量接种至起始pH7.0液体培养基中,于37 ℃下分别培养8、16、24、32、40 h后,测定其EPS含量,设3次重复。
1.2.6.3发酵温度对EPS含量的影响将含Q4的M17一次发酵液按4%的接种量接种至起始pH7.0的M17液体培养基中,分别在37、39、41、43、45 ℃下培养24 h后,测定其EPS含量,设3次重复。
1.2.6.4接种量对EPS含量的影响取接种量分别为1%、2%、3%、4%、5%的含Q4的M17一次发酵液接种至起始pH7.0的M17液体培养基中,于37 ℃恒温培养24 h后,测定其胞外多糖含量,设3次重复。
1.2.6.5摇床转速对EPS含量的影响将含Q4的M17一次发酵液按4%种量接种起始pH7.0的M17液体培养基中,选择转速分别为0、80、160、240、320 r/min,于37 ℃恒温培养24 h后,测定其胞外多糖含量,设3次重复。
1.2.7响应面法优化Q4发酵产EPS的培养条件
1.2.7.1Placket-Burman(PB)实验设计优化在单因素实验的基础上,根据Plackett-Burman(PB)实验设计原理,对初始pH(A)、发酵时间(B)、发酵温度(C)、接种量(D)、旋转速度(E)5个因素,以EPS含量为响应值进行二级水平实验,筛选出对EPS含量有显著性影响的因素,其水平编码表见表1。

表1 Plackett-Burman(PB)实验设计因素及水平表Table 1 Factors and levels of Plackett-Burman(PB)design
1.2.7.2Box-Behnken(BB)实验设计根据BB实验设计原理,以PB实验筛选出的三个显著因素,即初始pH、发酵温度和发酵时间为实验因素,EPS含量为实验指标,每个因素选三个水平,设计三因素三水平包括5个中心点共17个实验点的响应面分析水平表见表2。

表2 响应面因素水平表Table 2 Actors and levels of Box-Behnken(BB)design
1.2.8数据分析实验结果采用三次重复并取平均值±标准差表示;采用Origin8.0软件作图,Design Expert 8.0.6统计分析软件进行响应面设计与分析。
2 结果与分析
2.1单因素实验结果
2.1.1初始pH对EPS含量的影响在液体发酵过程中,发酵液的初始pH与微生物的生命活动有着密切联系,微生物的生长及代谢产物的形成必须通过各种的酶催化反应来完成,pH的变化会影响酶的活性,进而影响菌体的生长和代谢产物的合成。不同初始pH下Q4产生EPS的情况如图2所示。
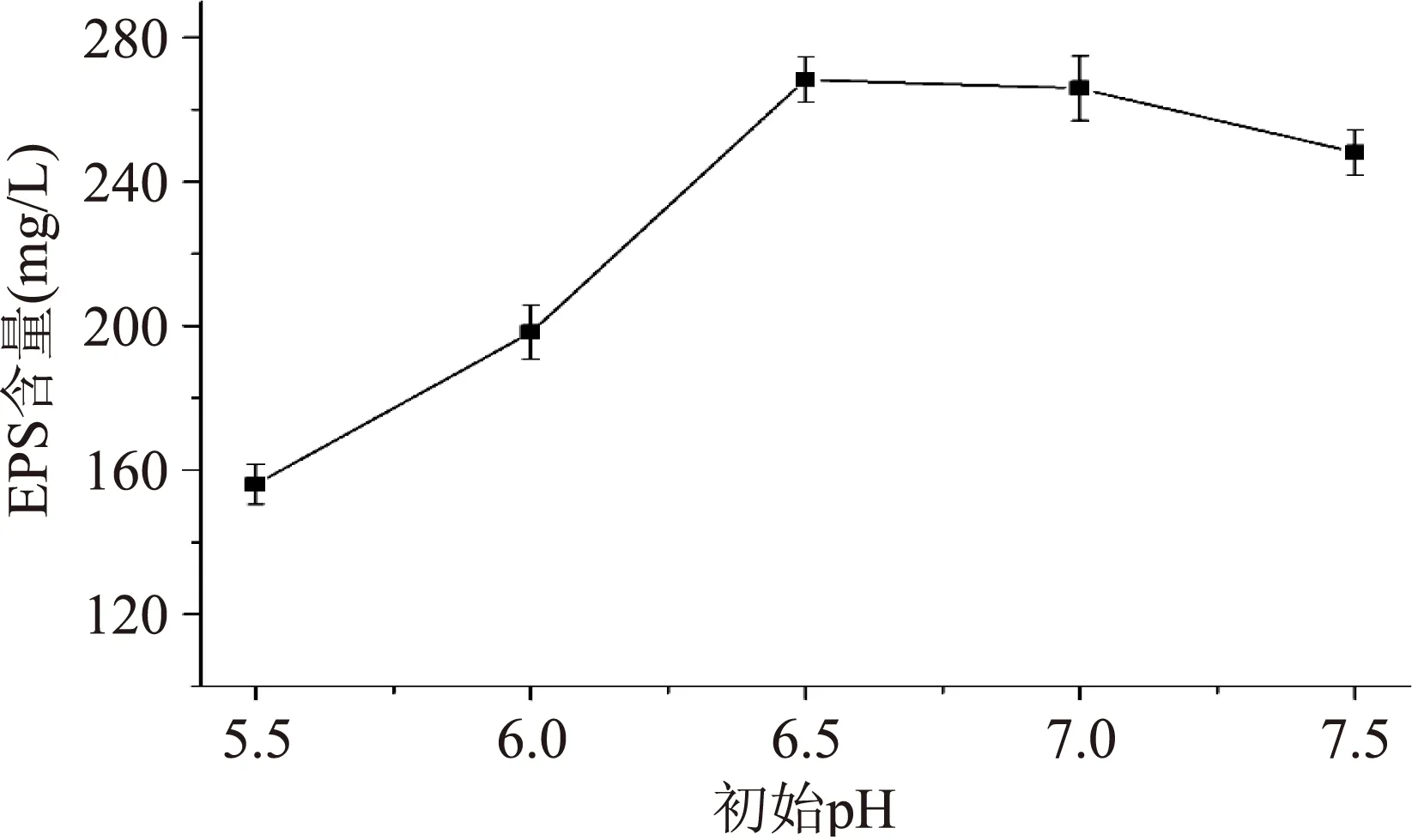
图2 初始pH对EPS含量的影响Fig.2 Effects of intial pH on the content of EPS
由图2可知,EPS含量随初始pH的增大呈先上升后下降的趋势,当pH为6.5时EPS的含量达到最高,为268.41 mg/L,之后随pH的增大而缓慢下降,因此确定嗜热链球菌Q4产胞外多糖的最适pH为6.5。这和大多数研究发现微生物产EPS的最适pH在中性偏酸的结果相一致[11];而初始pH较小时,EPS含量也较低,其原因可能是由于低pH抑制了菌体的生长进而影响EPS的分泌[12-13]。该结果说明发酵液的初始pH对EPS的含量影响较大,故选择pH6.5。
2.1.2发酵时间对EPS含量的影响不同种乳酸菌产EPS的时间差异很大,即使同一种乳酸菌同一品系间产EPS的时间差异也会很大。有些菌体在对数期产生EPS,而有一些在对数期并不产生却在稳定期才产生EPS[14]。因此时间也是影响EPS产量的重要因素之一。该菌株在不同发酵时间对Q4产EPS的影响如图3所示。

图3 发酵时间对EPS含量的影响Fig.3 Effects of fermentation time on the content of EPS
由图3可知,EPS含量随着发酵时间的延长先逐渐增大后缓慢减小,当发酵时间达32 h时,EPS含量达到最大268.04 mg/L,此时刚好处于菌体生长稳定期的后期,因为一般EPS在菌体的对数生长末期和稳定期产生,因此延长发酵时间有助于EPS的积累,这与贾建波等人的研究结果一致[15];进一步延长发酵时间,EPS含量呈逐渐下降趋势,可能是因为培养基中营养成分减少,无法继续提供菌体细胞生长及EPS的分泌,也可能是发酵后期细菌产生降解多糖的酶所致[16]。因此选择发酵时间32 h。
2.1.3发酵温度对EPS含量的影响发酵温度也是影响细胞生长繁殖和EPS合成的重要因素。发酵温度不同,菌株的生长速度及其合成EPS的产量也有明显的区别。不同发酵温度对EPS产量的影响如图4所示。

图4 发酵温度对EPS含量的影响Fig.4 Effects of fermentation temperature on the content of EPS
由图4可知,EPS含量随着发酵温度的升高先增大后减小,当发酵温度为41 ℃时EPS含量达到最高,为267.98 mg/L,这可能是由于嗜热链球菌的最适发酵温度在40 ℃左右,其菌体生长最旺盛;发酵温度过低或过高都不利于Q4菌株合成EPS,其原因可能是是发酵温度过低,菌体生长缓慢,菌体浓度不高,使类异戊二烯脂质载体发生钝化现象,EPS的产量则较低[17];发酵温度过高,会使稳定期提前到来,菌体在发酵后期容易衰老而自溶,菌体浓度也不高,同时会使类异戊二烯脂质载体失活,多糖的产量也会明显的降低[18-19]。因此,选择41 ℃作为发酵温度。
2.1.4接种量对EPS含量的影响接种量可以通过影响发酵液中的最初活菌数,进而影响菌体在生长代谢过程中代谢产物的产量。因此,本实验寻找最适的接种量对于提高Q4菌株在发酵过程中产生的EPS含量具有重要意义。接种量对EPS产量的影响如图5所示。

图5 接种量对EPS含量的影响Fig.5 Effects of inoculum dosage on the content of EPS
由图5可知,随着接种量的增大,起初EPS含量也随之增大,当接种量达到3%时,EPS含量达最大262.47 mg/L,进一步增大接种量时,EPS产量反而降低,研究表明[20],这可能是由于接种量过大,发酵前期会使菌体生长过快、菌体浓度过高,中后期会因营养物质消耗殆尽而导致合成胞外多糖的前体物质减少,从而降低EPS的含量;而接种量过小,菌体生长缓慢,生长延滞期则过长,营养物质无法得到有效利用,会向周围环境发生过多的扩散而导致严重损失而降低细胞活性,不利于EPS的代谢。因此,选择接种量为3%。
2.1.5摇床转速对EPS产量和菌体生长的影响不同菌株、不同氧需求量对微生物代谢产物的合成产量有较大的影响,嗜热链球菌是一种兼性厌氧型细菌,因此菌体的生长发育需要一定的氧气供给,而氧的供给又是调节摇床转速和通气量来实现的。因此本实验选用5种不同的摇床转速对Q4耐氧性能进行了考察,其不同搅拌速度下EPS的合成量如图6所示。

图6 旋转速度对EPS含量的影响Fig.6 Effects of rotational speed on the content of EPS
由图6可知,随着摇床转速的提高,发酵液中EPS含量逐渐增大当转速为160 r/min时,EPS含量达到最大值253.85 mg/L,之后随之逐渐减小,可见转速过低时,由于溶氧量不均匀,通气不好,导致菌体生长不良,产生EPS含量较低;当提高摇床转速,虽然有利于菌体生长,但营养成分消耗也较大,造成营养成分不足,且转速过高,对菌体产生机械性损伤,引起菌体自溶,从而抑制EPS的合成[21]。因此,选择旋转速度160 r/min。
2.2PB实验设计及结果
根据乳酸菌生长及其代谢产物EPS含量的一般规律,选用n=11的PB设计表,其中5个为影响因素(变量),预留6个空项作为误差分析,利用Design-Expert 8.0.6 Trial软件设计出15组实验,响应值R1为EPS含量(mg/L),结果见表3。

表3 PB实验设计及结果Table 3 Results of Plackett-Burman(PB)design
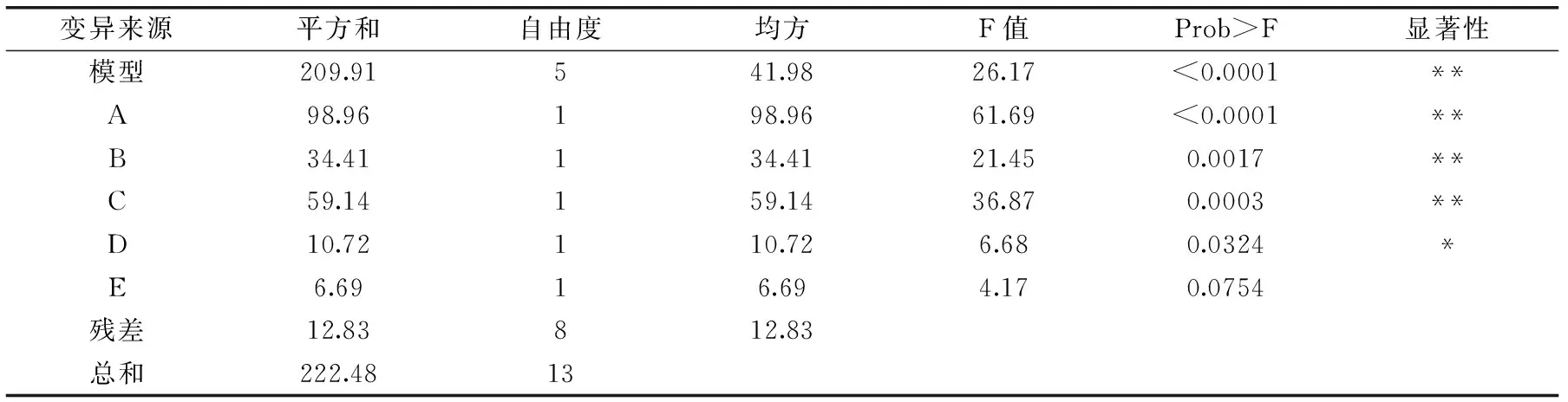
表4 PB实验设计回归方程方差分析Table 4 Analysis results of regression and variance of PB design
注:p<0.05表示显著,用*表示;p<0.01表示极显著,用**表示。
PB实验设计的回归方程方差分析结果见表4,拟合出的二项式模型的适合度由回归系数R2来表示,R2=0.9424,结果显示该模型与实际数据的拟合程度较高,且与实际预测值(0.9775)间的误差较小;统计的显著性由F检验来决定,模型的p值远远小于0.01,说明该模型高度显著;失拟项(0.2264)>0.05,不显著,说明该模型可用。而且由相关系数分析可得:离散系数C.V.=0.52%,表示数据离散度正常,信噪比Adeq Precision等于42.95,远大于4,说明该模型选择正确,能够合适地反映实验结果。同时可根据F值得大小确定影响EPS含量的因素的次序依次是:A>C>B>D>E,即初始pH>发酵温度>发酵时间>旋转速度>接种量,其中初始pH、发酵温度和发酵时间对EPS含量有极显著的影响,接种量对EPS含量有显著的影响。因此确定通过BB中心组合实验对以上三个因素进行响应面优化。
2.3响应面分析
2.3.1Box-Behnken设计和响应面分析结果根据BB实验设计的原理,利用Design-Expert 8.0.6软件设计了3个因素3水平包括5个中心点共17个实验点的响应面分析实验(中心实验用来估计实验误差,其余为析因实验点)对其结果进行回归分析,计算EPS含量的回归方程,并进行方差分析,见表5。
通过Design-Expert软件对表5的数据进行二次多项回归拟合,得到EPS含量对初始pH、发酵时间及发酵温度的二次多项式回归方程为:
Y=267.21+8.21A+1.92B+3.12C+0.64AB+1.18AC-3.72BC-7.86A2-11.96B2-9.23C2
式中,Y为预测响应值,A、B、C分别为初始pH、发酵时间及发酵温度的编码值。方程中各项系数绝对值大小直接反映各因素对响应值的影响程度,系数的正、负影响其方向。由方程的二次项系数为负值,推断方程代表的抛物面开口向下,具有极大值点,可以进行优化分析。对该模型进行方差分析,结果见表6。

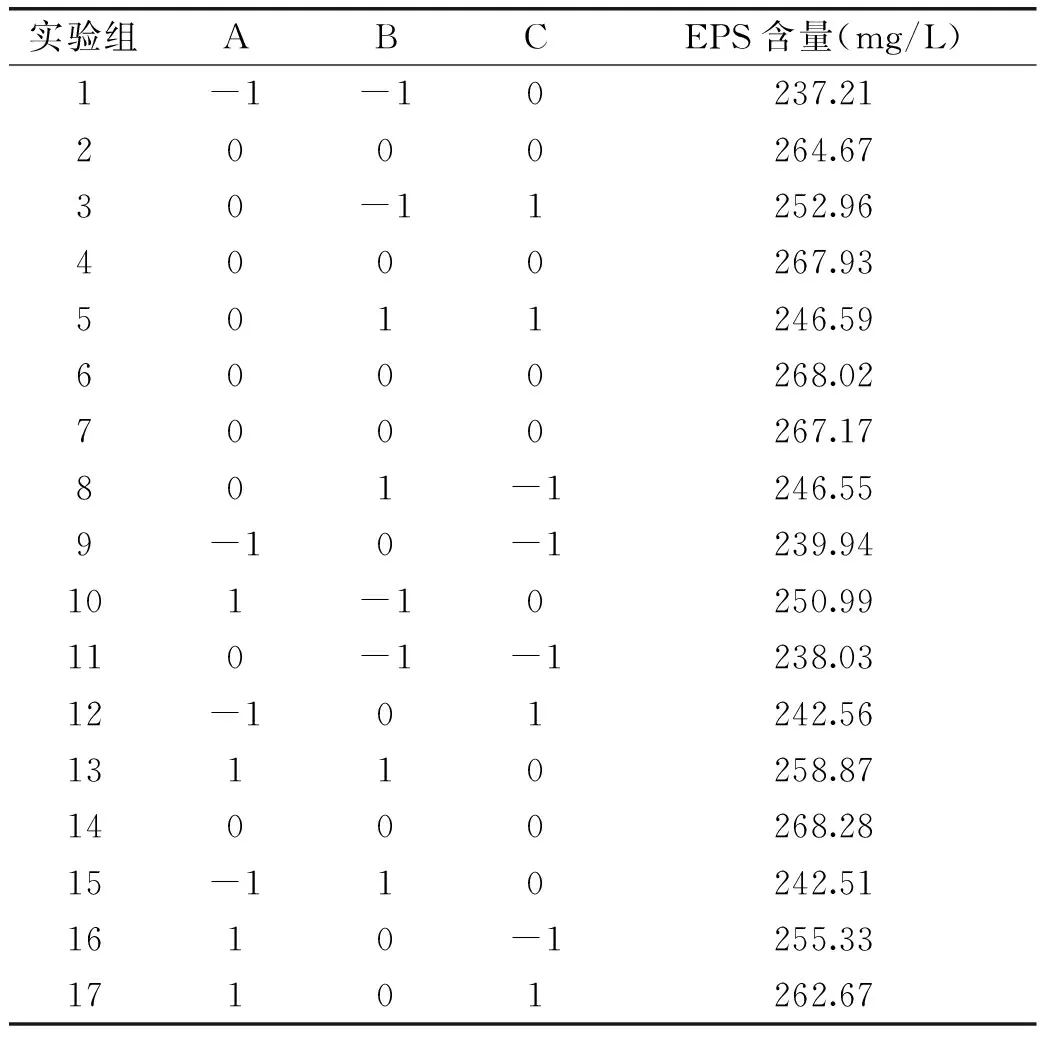
表5 响应面设计实验结果Table 5 Rresults of Box-Benhnken design
方程一次项中A和C因素均极显著(p<0.01),B因素显著(0.01
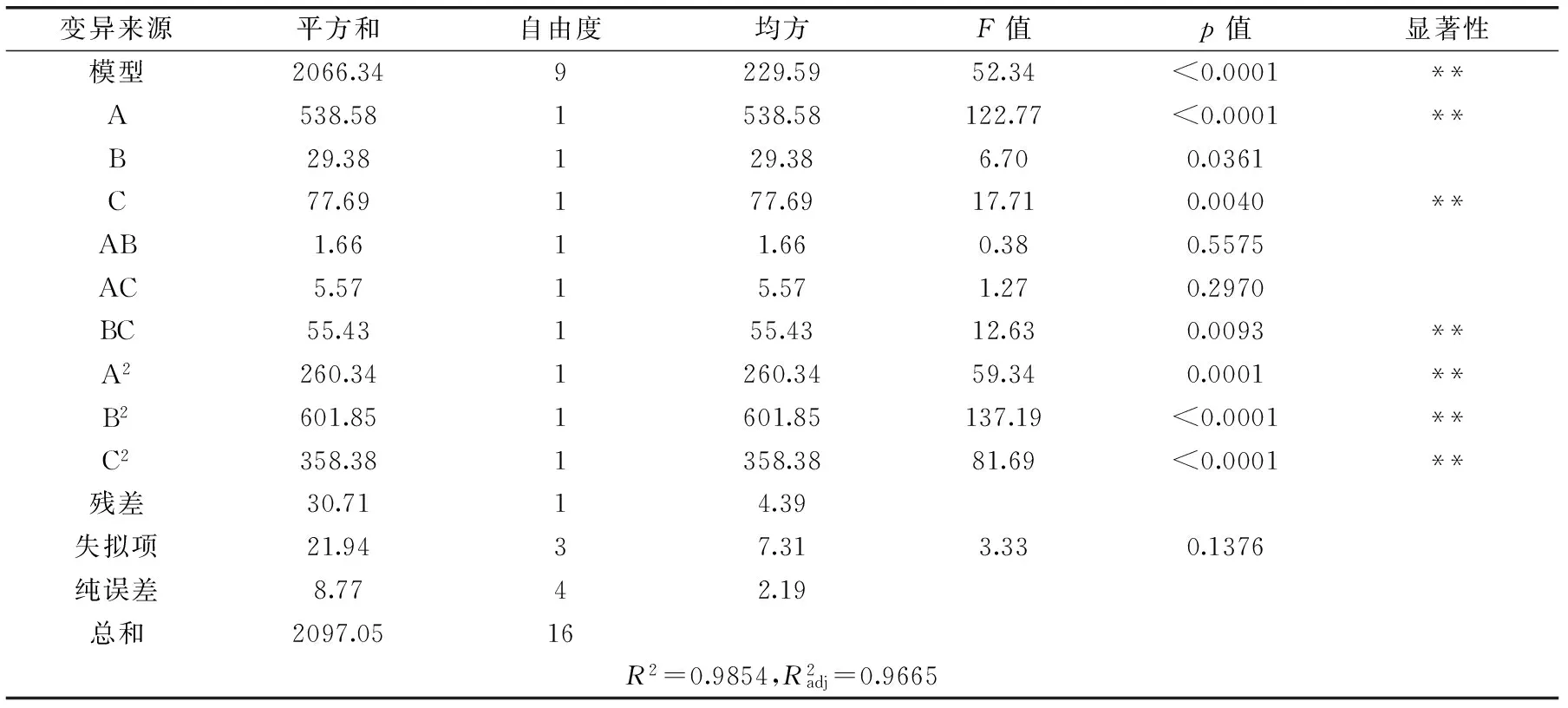
表6 BB实验设计的回归方程的方差分析Table 6 Analysis results of regression and variance of BB design
2.3.2各因素交互作用对EPS含量的响应面分析三维响应面图是回归方程的直观描述,通过它可以直观、高效地找到最佳参数、各参数之间的相互作用和最大响应值。曲面用于反映单因素对结果的影响情况。曲面越陡斜表明该因素对EPS产量的影响越显著;曲面平缓则相反。等高线表示在同一椭圆型的区域内,EPS含量是相同的。在椭圆形区域中心,EPS含量最高,由中心向边缘EPS含量逐渐减少。图中椭圆排列越密集,说明因素变化对EPS含量影响越大。同时等高线的形状可反映交互效应的强弱。椭圆形表示两因素交互作用显著,而圆形则相反[22],表示两因素交互作用可忽略。根据回归方程绘出初始pH、发酵时间和发酵温度对EPS含量影响的响应面图,分别见图7、图8、图9。

图7 初始pH和发酵时间对EPS含量的交互影响 Fig.7 Correlative effects of intial pH and fermentatime on the content of EPS

图8 初始pH和发酵温度对EPS含量的交互影响Fig.8 Correlative effects of intial pH and fermentation temperature on the content of EPS
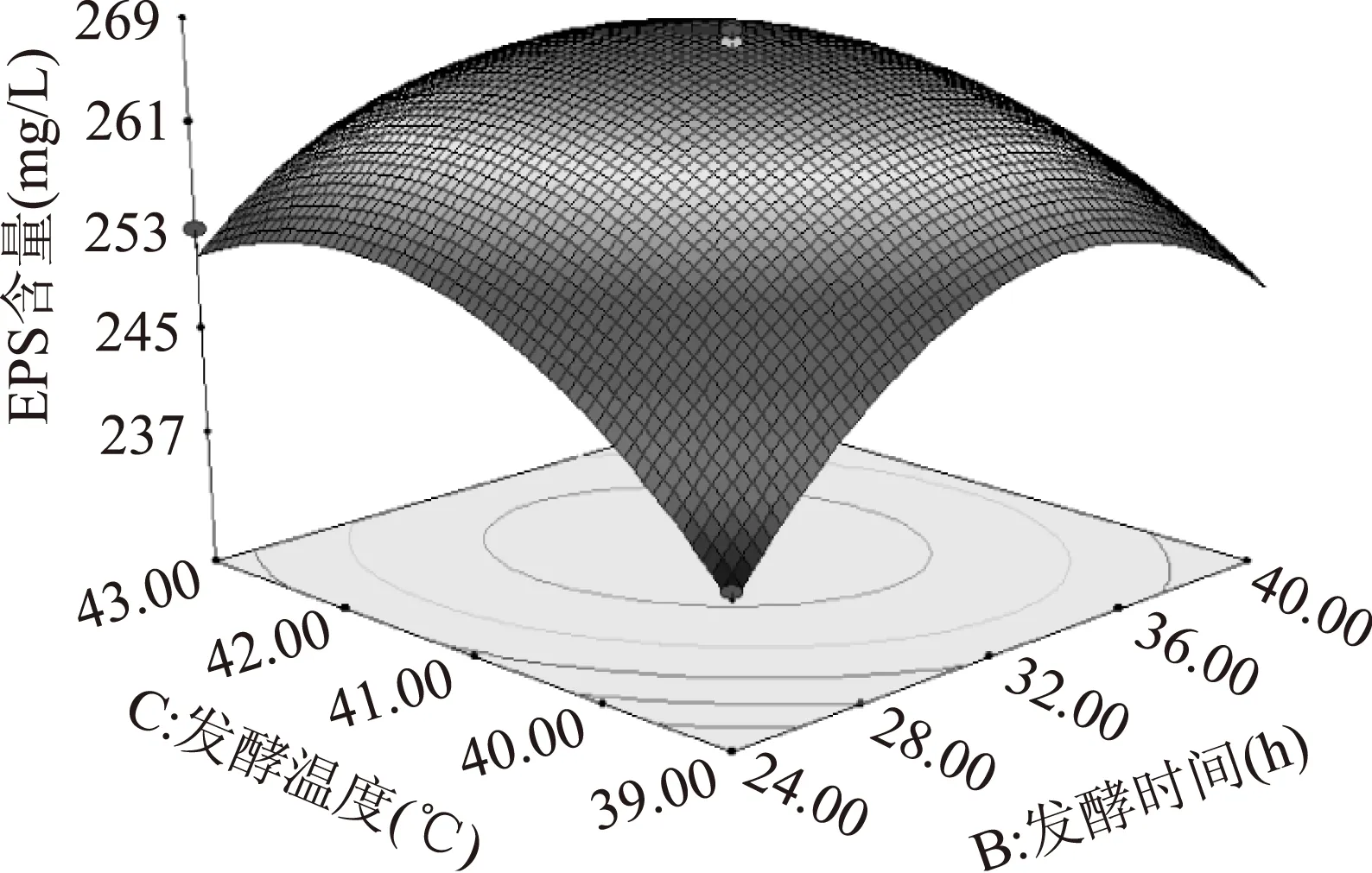
图9 发酵时间和发酵温度对EPS含量的交互影响Fig.9 Correlative effects of fermentation time and fermentation temperature on the content of EPS
图7为因素C取0水平时,A和B的交互作用对响应值EPS含量的影响,从响应曲面看,二者曲面均表现较陡斜,A曲面略大于B曲面,表明该二因素对EPS含量的影响均显著且A略显著于B。从等高线看,该形状明显趋于圆,表明AB之间的交互作用较弱。图8为因素B取0水平时,A和C的交互作用对响应值EPS含量的影响。二者曲面均较为陡斜,其中A曲面的陡斜程度大于C曲面,表明初始pH对EPS含量的影响比发酵温度更为显著。而等高线形状也趋于圆,但AC的交互作用强AB的交互作用。图8为因素A取0水平时,B和C的交互作用对响应值EPS含量的影响,对比二者的响应曲面发现:C曲面大于B曲面,表明发酵温度对EPS含量的影响最为显著。等高线较扁平,明显趋于椭圆,表明B和C之间的交互作用较强,即发酵时间和发酵温度之间存在明显的交互作用,说明这两个因素协同作用对EPS含量的影响较大。当发酵时间一定时,EPS含量随着发酵温度的升高先增大后减小;当发酵温度一定时,EPS含量随着发酵时间的延长而增加,达到一定时间时增加的幅度趋于平缓,并逐渐减小,最后EPS含量达到最大值268.68 mg/L。综上所述,3个因素对EPS产量的影响显著性顺序为:初始pH>发酵温度>发酵时间,与方差分析的结果保持一致。
2.4验证实验
通过响应面软件分析,优化后得到的最佳发酵条件为:初始pH为6.77、发酵时间为32.52 h、发酵温度为41.38 ℃,在此条件下,EPS含量可达269.78 mg/L。但为检验该法的可靠性,考虑到实验操作的局限性,将优化后的最佳发酵条件修正为:初始pH为6.8、发酵时间为33 h、发酵温度为41 ℃,在此条件下进行验证实验。经3次平行实验,实际EPS含量的平均值为268.42 mg/L,相对误差为1.36%。可见,实验结果与模型相符,说明该模型能较好地模拟和预测嗜热链球菌产EPS的发酵条件,且具有一定意义的实践指导意义。
3 结论
本实验先通过对M17发酵液的初始pH、发酵时间、发酵温度、接种量及旋转速度的单因素实验得出最佳发酵条件:初始pH6.5、发酵时间32 h、发酵温度41 ℃、接种量3%、旋转速度160 r/min;然后再通过Placket-Burman(PB)设计法从以上单因素中筛选出影响最显著的3个因素为:初始pH、发酵时间、发酵温度;最后在此基础上的通过响应面法建立了显著影响胞外多糖产量的二次多项数学模型,并利用统计学方法对该模型进行了显著性检验,探讨了各因素间的交互作用,最终得出嗜热链球菌Q4产EPS含量的最佳发酵条件为:初始pH为6.8、发酵时间为33 h、发酵温度为41 ℃,在此条件下通过模型预测的最大EPS含量为269.78 mg/L,与此条件下的验证实验结果的EPS含量(268.42 mg/L)间的相对误差仅为1.36%,说明该模型能较好地预测实际EPS含量。因此,利用响应面分析法得到的最优嗜热链球菌Q4产EPS含量的发酵条件真实可靠,具有实际意义。
[1]李志成,闫亚美,张连斌,等,保加利亚乳杆菌和嗜热链球菌产酸产黏特性研究[J].中国乳品工业,2006,05:8-10.
[2]Schellhaass S M,Morris H A.Rheological and scanning electron microscopic examination of skim milk gels obtained by fer-menting with ropy and non-ropy strains of lactic acid bacteria[J].Food Microstruct,1985,4(2):279-287.
[3]Yasui H,Shida K,Matsuzaki T,et al.Immunomodulatory function of lactic acid bacteria[J].Antonie Van Leeuwenhoek,1999,76(1):383-389.
[4]Lin,C-J,Pehkonen SO.HKONEN S Q.The chemistry of atnospheric mercury:A review[J].Atnospheric Enviroment 1991.33(13):2067-2079.
[5]Mende S,Peter M,Bartels K,et al.Addition of purified exopolysaccharide isolates from S.thermophilusto milk and their impact on the rheology of acid gels[J].Food Hydroeolloids,2013,32(1):178.
[6]黄云鹏,姜淑娟,钱方,等.高产胞外多糖嗜热链球菌的诱变育种研究[J].食品工业,2012,33(6):43-45.
[7]Patricia Ruas-Madiedo,C G de los Reyes-Gavilan.Invited Review:Methods for the Screening,Isolation,and Characterization of Exopolysaccharides Produced by Lactic Acid Bacteria[J]. Journal of Dairy Science,2005,88(3):843-856.
[8]曹文海,任国谱.嗜热链球菌的检验培养基(M17)的改良[J].中国乳业,2006,1:46-48.
[9]李全阳,夏文水,张进山,等.酸乳中乳酸菌胞外多糖的分离与纯化[J].食品与发酵工业,2005,31(10):139-141.
[10]萨如拉,芒来,赵娜,等.产胞外多糖乳杆菌的菌种鉴定及其发酵条件优化[J].食品科技,2014,39(8):69-72.
[11]唐血梅,李海英,赵芳,等. 新疆酸马奶中高产胞外多糖乳酸菌筛选鉴定及培养条件优化研究[J].新疆农业科学,2012,49(8):1540-1545.
[12]Jolly L,Stingele.Molecular organization and functionality of exopolysaccharide gene clusters in lactic acid bacteria.Int.Dairy[J].Current Opinion in Biotechnology,2001,11(9):733-746
[13]Cheirrsilp B,Shimizu H,Shioya S.Modeling and optimisation of environmental conditions for kefiran production by Lactobacillus kefn-anofaciens[J].Applied Microbiology and Biotechnology,2001,57:639-646.
[14]Ai L Z,Zhang H,Guo B H,et al.Optimization of Culture Conditions for Exopolysaccharide Production by Lactobacillus Casei Lc2w[J].Milchwissenschaft-Milk Science International,2006,61(4):374-7.
[15]贾建波,严学伟.产粘乳酸菌的筛选及其产粘多糖条件的研究[C].第三届中国乳业科技大会论文集,2006:185-192.
[16]Gorska-Fraczek S,Sandstrom C,Kenne L,et al.Structural studies of the exopolysaccharide consisting of a nonasaccharide repeating unit isolated from Lactobacillus rhamnosus KL37B[J].Carbohyd Res.2011,346:2926-2932.
[17]王辑,田政,赵笑,等.藏灵菇发酵产胞外多糖的影响因素及其应用研究[J].食品工业科技,2015,36(18):203-208.
[18]Salvador A,Fiszman S M.Textural and sensory characteristics of whole and skimmed flavored set-type yogurt
during long storage[J].Journal of Dairy Science,2004,87(12):4033-4041.
[19]刘慧,熊利霞,韩睿,等.藏灵菇源干酪乳杆菌KL1高产胞外多糖发酵条件的优化研究[J]l.中国农学通报,2008,24(11):117-121.
[20]王英,周剑忠,黄开红,等.益生菌干酪乳杆菌FM10-3产胞外多糖培养条件的优化[J].2014,2:9-12.
[21]宫宇飞,乔红萍.内生枯草芽抱杆菌EIR-J 发酵条件的优化[J].西北农业学报,2008.17(1):61-64.
[22]易周军,朱文学,马海乐,等.牡丹籽油超声波辅助提取工艺的响应面法优化[J].农业机械学报,2009,40(6):103-110.
Optimization of fermentation conditions for extracellular polysaccharide production bystreptococcusthermophiluswith response surface methodology
CHEN Ya1,LIANG Qi1,*,YANG Min1,2,ZHANG Wei-bing1,ZHANG Yan1
(1.Functional Dairy Engineering Laboratory in Gansu Province,College of Food science and engineering,Gansu Agricultural University,Lanzhou 730070 China;2.College of Science,Gansu Agricultural University,Lanzhou 730070 China)
The quantitative effects of fermentation conditions on the yield ofStreptococcusthermophilus(Q4)extracellular polysaccharide were optimized using response surface methodology(RSM).The EPS content as an index,fermentation conditions of EPS produced by Q4 was preliminary obtained by single factor experiment.Then significant factors were screened from the above the single factors according to the Placket-Burman(PB)design method and were optimized using Box-Behnken design.And the EPS content as the response values,obtaining the response surface figure,the optimal fermentation conditions on the yield of(Q4)extracellular polysaccharide were determined:initial pH6.8,fermentation time 33 h and fermentation temperature 41 ℃.Under the optimal conditions the corresponding response value for extracellular polysaccharide production was 268.42 mg/L,compared with the previous EPS content(89.43 mg/L),which was increased 3 times.
response surface methodology;streptococcusthermophilus;extracellular polysaccharide(EPS);fermentation conditions
2015-10-12
陈亚(1987-),女,硕士研究生,研究方向:乳品微生物,E-mail:chenya1224@126.com。
梁琪(1969-),女,博士,教授,研究方向:食品品质、乳品科学,E-mail:liangqi@gsau.edu.cn。
兰州市研政产合作项目(2012-2-87);兰州市科技创新人才团队培育计划项目(2011-1-144)。
TS201.3
A
1002-0306(2016)09-0195-07
10.13386/j.issn1002-0306.2016.09.030
