利用虾头内源酶模拟胃肠道消化制备短肽的研究
2016-09-12李贻杰曹文红祝亚辉章超桦
田 申,李贻杰,曹文红,3,*,祝亚辉,章超桦,3
(1.广东海洋大学食品科技学院,广东湛江 524088;2.广东省水产品加工与安全重点实验室,广东湛江 524088;3.水产品深加工广东普通高等学校重点实验室,广东湛江 524088)
利用虾头内源酶模拟胃肠道消化制备短肽的研究
田申1,2,李贻杰1,曹文红1,2,3,*,祝亚辉1,章超桦1,2,3
(1.广东海洋大学食品科技学院,广东湛江 524088;2.广东省水产品加工与安全重点实验室,广东湛江 524088;3.水产品深加工广东普通高等学校重点实验室,广东湛江 524088)
本文利用虾头内源性蛋白酶构建模拟胃肠道的消化系统,酶解虾头蛋白制备短肽。结果表明,在模拟消化过程中,虾头蛋白释放量、水解度和水解产物低于3000 u分子量的组分呈现出两次显著增加趋势,显示虾头内源性类胃蛋白酶和类胰蛋白酶在模拟消化不同阶段起到的酶解作用。在模拟胃部消化条件下制备的产物其分子质量集中在2000~3000 u左右;在模拟肠道消化条件下制备的产物其分子量主要集中在1000 u以下。以上结果表明,利用虾头内源性蛋白酶模拟胃肠道消化可制备高附加值的短肽产物,实现虾头蛋白的高效回收。
凡纳滨对虾,虾头,内源酶,模拟消化,短肽
食源性短肽是以食品蛋白为原料,通过酶解或发酵制得的蛋白水解产品。食源性短肽不仅安全性极高,而且还具有很多生理调节功能特性[1-2],如参与机体的降血压[3]、抗氧化[4]、抗血栓[5]、免疫调节[6]等,是当前食品科技界热门的研究课题。目前具有特殊生理活性的食源性短肽不断被发现并应用于食品配方、功能食品以及食品添加剂等。但其口服后,容易被胃肠道消化系统酶系降解而失去原有的生理活性,这是制约食源性短肽研究开发与应用的瓶颈问题。有研究表明:食源性蛋白由消化系统酶水解制备的短肽有良好的抗消化酶降解能力[7],并且比相同组成的游离氨基酸更容易被机体吸收[8]。因此目前国内外食品科技界主要采用商业蛋白酶模拟消化进行制备短肽[9-10]。但使用商品酶制备短肽存在着成本高的问题。
在对虾加工过程中,占虾体质量30%~40%的虾头常被剔除成为加工废弃物。对虾生理结构非常独特,大部分消化器官集中在虾头,因此虾头含有丰富的内源性蛋白酶[11]。有研究者从虾头中检测出类胰蛋白酶[12]和类胃蛋白酶[13]两种主要蛋白酶。利用虾头内源性蛋白酶对虾头蛋白进行降解,制备成短肽、氨基酸等小分子物质,将能实现虾头蛋白质的回收。本课题组前期研究证实紫外辐射能显著提高虾头内源蛋白酶活性[14-15]。本文拟采用紫外辐射的方法充分激活虾头内源酶酶活,在此基础上利用虾头内源性蛋白酶对虾头蛋白进行模拟消化降解制备短肽,以提高虾头蛋白质的利用价值,研究结果对水产品加工废弃物蛋白质的高值化利用具有重要的参考意义。
1 材料与方法
1.1材料与仪器
虾头:鲜活凡纳滨对虾购于广东省湛江市东风市场,取虾头,分装放置于-75 ℃冰箱备用。多肽分子质量标准品:N-Hippuryl-His-Leuhydrate(429.47 u)购自于美国Sigma公司,Triosephosphate isomerase(26625 u),Myoglobin(16950 u),α-Lactalbumin(14437 u),Aprotinin(6512 u),Insulin b chain oxidized(MW 3496 u)和Bacitracin(1423 u)购自于美国Biorad公司。其它分析试剂均为国产分析纯。
PHS-3C型精密pH计上海康仪仪器股份有限公司;HH-6型数显恒温水浴锅江苏金坛市佳美仪器有限公司;CR22G Ⅱ型高速冷冻离心机日本日立有限公司;UV-2550紫外可见分光光度计上海旦鼎国际贸易有限公司;LC-20AD高效液相色谱仪日本岛津公司;高效液相凝胶色谱柱Protein-PAK60(WAT085250)美国waters公司;BIFLEX Ⅲ型MALDI-TOF质谱仪美国Bruker Daltonics公司。
1.2实验方法
1.2.1虾头紫外辐射的方法紫外辐射虾头促进内源酶活力工艺参考Cao等[15]的方法,并作一定的改进。取适量凡纳滨对虾虾头匀浆,平铺于托盘上(虾浆厚度小于5 mm),置于紫外灯下辐射激活内源酶(紫外辐射条件为:紫外灯波长253.7 nm、功率30 W,紫外灯高于托盘20 cm,辐射时间为20 min)。
1.2.2虾头内源性蛋白酶模拟胃部消化紫外辐射后的虾浆分装30 g于广口瓶中,按固液比1∶3(m∶v)加入4 ℃蒸馏水,震荡混匀,调节pH为3,置于50 ℃恒温水浴中保温,每10 min震荡一次,并于0、0.5、1、2、3、4、5 h时间点取样,检测酶活。
1.2.3虾头内源性蛋白酶模拟肠道消化将凡纳滨对虾虾头匀浆,紫外辐射后,分装30 g于广口瓶中,固液比1∶3(m∶v)加入4 ℃蒸馏水,震荡混匀,调节pH为8.5,置于到55 ℃恒温水浴中保温,每10 min震荡一次,于0、0.5、1、2、3、4、5 h时间点取样,检测酶活。
1.2.4利用虾头内源酶模拟胃肠道消化模拟胃肠道消化参照John[16]的方法并加以改进。将凡纳滨对虾虾头匀浆,紫外辐射后,分装30 g于广口瓶中,固液比1∶3(m∶v)加入90 mL 4 ℃蒸馏水,震荡混匀,调节pH为3,置于到50 ℃恒温水浴中保温,每10 min震荡一次,根据类胃蛋白酶酶活变化规律,选择1.5 h后转入模拟肠道消化条件,调节样品pH为8.5,水浴温度调整为55 ℃继续自降解。于0、0.5、1、1.5、2、3、4、5 h时间点取样,沸水浴15 min灭酶,冷却后离心(9000 r/min、4 ℃、20 min),上清液收集于广口瓶中备用。
1.2.5酶活的检测方法将每个时间点取的样品高速离心(9000 r/min、4 ℃、20 min),取上清液即粗酶液,采用福林酚试剂法[17]检测酶活,平行检测三次。
1.2.6蛋白含量检测微量凯氏定氮法[18]。
1.2.7自降解水解度(DH)的检测采用甲醛滴定法测定酶解前后体系中α-氨基态氮的含量[19];原料总氮和非蛋白氮含量采用微量凯氏定氮法[18]测定,计算公式[20]如下:
式中:A为原料中总氮量;B为水解液中的氨基氮量;C为原料中游离的氨基氮量;D为原料中的非蛋白氮量。
1.2.8虾头模拟消化酶解产物分子质量分布的测定采取高效体积排阻色谱法检测虾头模拟消化酶解产物的分子质量分布。以0.05 mol/L Tris-HCl(pH7.2)缓冲溶液作为流动相,流动相流速为0.7 mL/min,检测波长为214 nm,柱温25 ℃。将自降解产物的上清液配制成可溶性蛋白含量为5 mg/mL的溶液,经针头式滤头过滤后,上样20 μL至Waters-Protein-Pak 60柱进行洗脱。利用由蛋白标品建立的分子质量回归方程考察紫外胁迫下虾头自降解产物的分子质量分布。回归方程为log M=-0.2448t+6.4433,决定系数为0.99。
1.2.9虾头模拟消化酶解产物的肽质谱分析将样品液与适量的基质溶液混合后,取约1 μL溶液,滴加在样品靶上,待溶剂挥发,样品结晶后,送入质谱仪,进行质谱分析:激光波长为337 nm,采用延时引出(Delayed extraction)和反射(Reflection)的工作方式,加速电压 19.5 kV,反射电压 20 kV,延时引出电压14.5~16.5 kV,延时时间为50~200 ns,正离子检测。累加10~50次单次扫描信号得到肽质谱图。
1.3数据统计分析
实验结果用“平均值+标准偏差”表示,重复三次。显著性采用SPSS20.0软件统计分析,p<0.05为显著差异。
2 结果与讨论
2.1模拟胃部消化和肠道消化过程中虾头内源性蛋白酶酶活变化
由图1与图2可得,凡纳滨对虾虾头在模拟胃部消化和肠道消化的条件下,内源性蛋白酶均显示酶活。图1显示,在模拟胃部条件消化过程中,类胃蛋白酶酶活在1~2 h内下降较快,因此模拟胃部消化可在较短的时间内进行。图2显示,在模拟肠道条件消化过程中,类胰蛋白酶酶活在1~3 h内下降较快,但在3~5 h仍保持400~600 U/g虾头的较高酶活。因此利用虾头内源性蛋白酶模拟胃肠道消化制备短肽的过程设计为:模拟胃部条件消化1.5 h,随后转入模拟肠道条件消化1.5~5 h制备短肽。
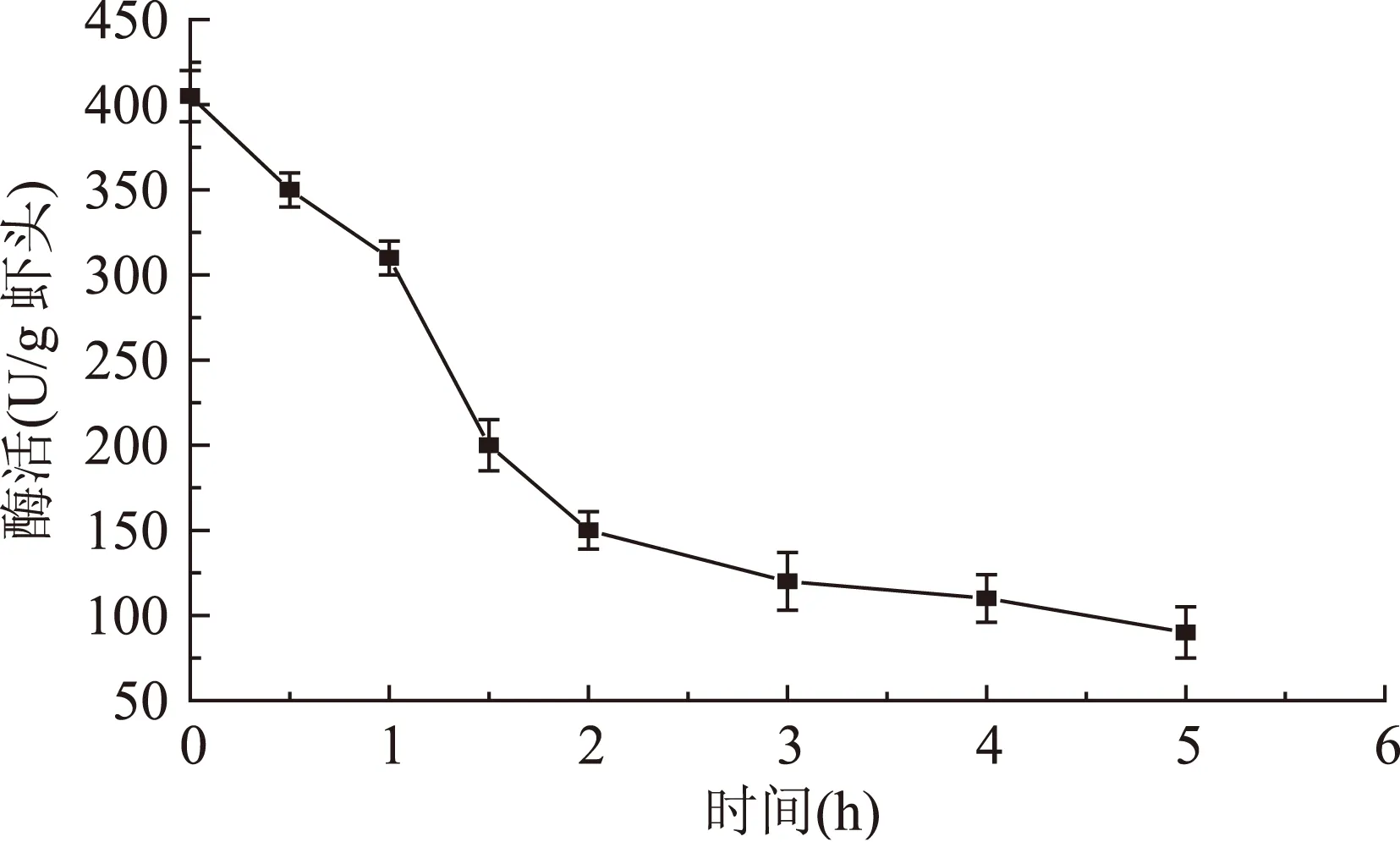
图1 模拟胃部消化过程中虾头类胃蛋白酶酶活变化Fig.1 Activity change of pepsin-like protease during the simulated gastro digestion of shrimp head
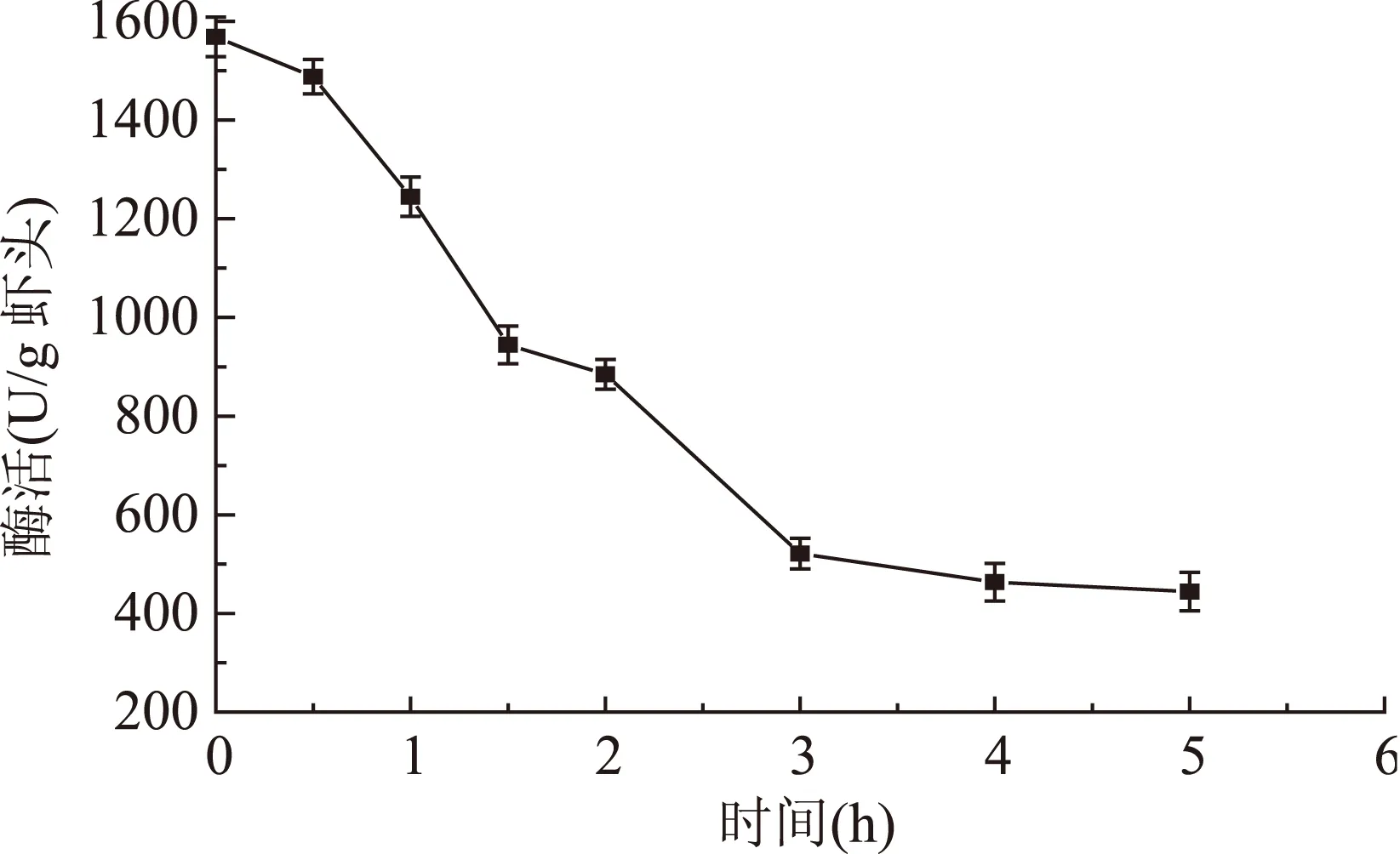
图2 模拟肠道消化过程中类胰蛋白酶酶活变化Fig.2 Activity change of trypsin-like protease during the simulated intestinal digestion of shrimp head
2.2利用虾头内源蛋白酶模拟消化制备短肽
2.2.1模拟消化过程中虾头蛋白质的释放规律在内源蛋白酶的催化作用下,虾头中的蛋白质被降解,以蛋白质、肽和氨基酸的形式释放出来。图3是虾头在模拟胃肠道消化过程中在不同时间释放的蛋白质量。由图3可以看出虾头蛋白释放量在0~1 h的模拟消化降解中迅速增加,每克虾头的蛋白质释放量达103.4 mg,此时起作用的是以类胃蛋白酶活性为主体的酸性蛋白酶。在消化系统中,胃蛋白酶对蛋白质的专一性较宽,主要将蛋白质水解成分子量较大的肽类产物,供后续肠道酶系的进一步水解。随后转入模拟肠道消化条件,从图3可以看出1.5~4 h内虾头释放蛋白量仍有明显上升趋势,这是因为在模拟肠道消化阶段中,虾头内源性类胰蛋白酶处于最适条件,酶活力达到最大值,对酸性条件下溶出的蛋白质和肽进行酶解,也继续分解残渣中蛋白。但上升趋势明显减缓,这可能是由于蛋白酶具有专一性,此时残渣中蛋白已经残留不多,并且内源性类胰蛋白酶酶活已经有所降低。模拟消化进行到4 h后,虾头释放的总蛋白含量增加趋势趋于平缓,表明酶促降解反应结束。
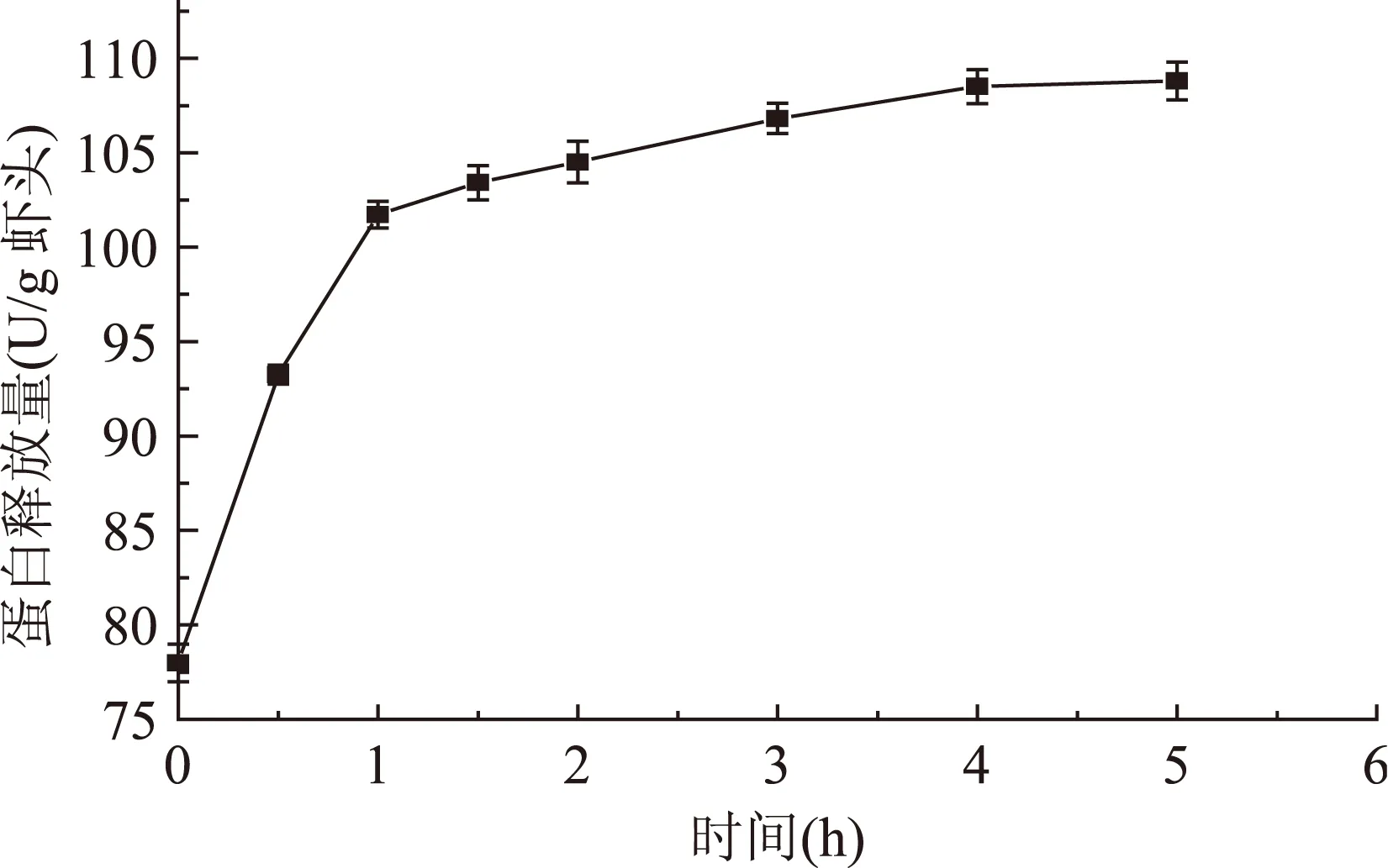
图3 模拟消化过程中虾头蛋白释放量的变化Fig.3 Protein released during the simulated digestion of shrimp head
2.2.2模拟消化过程中虾头蛋白水解度的变化蛋白质被酶水解时的水解度能体现酶解产物的大致组成,水解度越高,则酶解产物中低分子组分越多。如图4所示,在模拟消化的0~1 h内,虾头内源性类胃蛋白酶酶活处于较高值,此时水解度上升很快,随后1~1.5 h水解度增加趋势变缓,原因可能是虾头内源性类胃蛋白酶的作用底物变少并且酶活降低导致。随后调整到模拟肠道消化条件,虾头内源性类胰蛋白酶被激活,开始分解蛋白、多肽等,水解度增加速度随之变大。在模拟肠道消化阶段3~5 h内水解度增加趋势逐渐变缓,这可能是由于内源酶专一性作用底物已经残余较少,酶活有所降低。利用内源酶模拟胃肠道消化降解虾头蛋白制备短肽基本进行完成,水解度达到35.2%,与戴程程等[21]研究南极磷虾自溶酶解结果接近。
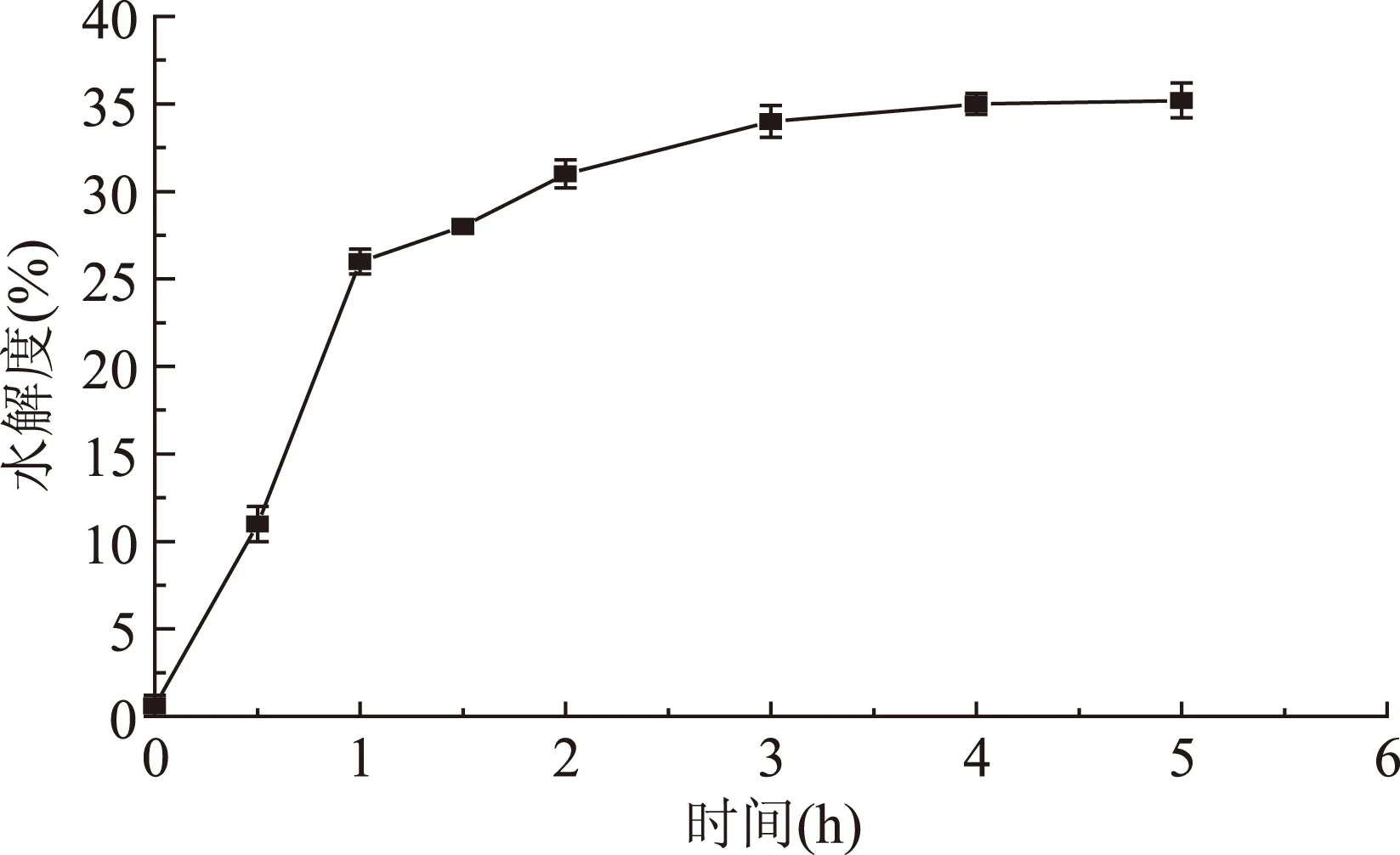
图4 模拟消化过程中虾头蛋白水解度的变化Fig.4 Degree of hydrolysis during the simulated digestion of shrimp head
2.2.3虾头模拟消化过程中产物的分子质量分布在利用虾头内源蛋白酶模拟胃肠道消化制备短肽的过程中,虾头蛋白经历了内源性类胃蛋白酶以及类胰蛋白酶的先后作用,最终生成肽和氨基酸产物。图5为虾头模拟胃肠道消化过程中产物的高效体积排阻色谱图。从图5中可以看出,在0~5 h模拟消化过程中大分子峰明显减小,小分子峰则逐步增大。低于3000 u以下酶解产物在模拟胃部消化和肠道消化两个阶段均呈现出增加趋势,说明在两个阶段初期,内源性类胃蛋白酶和类胰蛋白酶分别被激活,分解大分子物质速率快。3~5 h增加趋势变缓,可能是因为此阶段作为底物的大分子蛋白质已被大部分分解,并且虾头内源性蛋白酶在长时间处于较高温度下逐渐失活。模拟消化5 h后3000 u以下组分含量占酶解产物的78.51%(图6)。与朱国萍等[22]仅在碱性条件下利用自溶酶酶解凡纳滨对虾虾头相比,效果较好。

图5 虾头模拟消化过程中酶解产物的高效液相色谱图Fig.5 HPSEC of the enzymatic hydrolysis products during the simulated digestion of shrimp head

图6 虾头模拟消化过程中3000 U 以下组分在酶解产物中的比例Fig.6 Proportion of the components under 3000 U in the enzymatic hydrolysis products during the simulated digestion of shrimp head
2.2.4虾头模拟消化过程中产物的肽质谱分析图7为虾头模拟消化过程中产物的飞行时间质谱。从质谱图中可以看出,在利用虾头内源性蛋白酶模拟胃肠道消化制备短肽的过程中,0~1.5 h是模拟胃部条件自降解阶段,模拟消化开始时分子质量0~5000 u范围内各种肽分布较平均,0~1 h内分子质量2000~4000 u左右肽迅速增加,并且5000 u以上多肽也有所增加,这是由于此过程中残渣中固体蛋白被内源性类胃蛋白酶分解成水溶性的多肽和氨基酸等,1~1.5 h自降解过程,5000 u以上多肽含量减少,分子量2000~3000 u范围肽含量增多;1.5~5 h是模拟肠部消化过程,在此模拟消化过程中可以发现分子质量1000 u左右肽含量增加比较迅速,说明此时内源性类胰蛋白酶被激活,分解多肽,使小分子质量的短肽增加,与此同时分子质量在5000 u的多肽含量有微量增加,这是由于内源性类胰蛋白酶被激活,继续分解残渣蛋白所致。肽质谱图变化与模拟消化产物分子量分布变化相吻合。

图7 虾头模拟消化酶解产物的飞行时间质谱图Fig.7 TOF-MS of the enzymatic hydrolysis products during the simulated digestion of shrimp head
3 结论
利用虾头内源性蛋白酶可模拟胃肠道对虾头蛋白质的消化作用,实现虾头蛋白质的高值化回收利用。在模拟胃肠道消化过程中,虾头蛋白释放量、水解度和低于3000 u以下水解产物含量均有两次增加趋势。虾头蛋白经过模拟消化1.5 h,生成产物大部分分子量集中在2000~3000 u左右,经过模拟消化4~5 h后,3000 u以下组分占酶解产物的比重达78.51%,且多集中在分子质量1000 u左右。利用虾头内源酶构建模拟胃肠道消化体系降解虾头蛋白制备短肽,进而进一步开发肽类保健品或营养品,可极大提高虾头蛋白质的利用价值。
[1]Aneiros A,Garateix A. Bioactive peptides from marine sources:pharmacological properties and isolation procedures[J]. Journal of Chromatography B,2004,803(1):41-53.
[2]Möller N P,Scholz-Ahrens K E,Roos N,et al. Bioactive peptides and proteins from foods:indication for health effects [J]. European Journal of Nutrition,2008,47(4):171-182.
[3]Kapel R,Rahhou E,Lecouturier D,et al. Characterization of an antihypertensive peptide from an Alfalfa white protein hydrolysate produced by a continuous enzymatic membrane reactor[J]. Process Biochemistry,2006,41(9):1961-1966.
[4]Je J Y,Qian Z J,Byun H G,et al. Purification and characterization of an antioxidant peptide obtained from tuna backbone protein by enzymatic hydrolysis[J]. Process Biochemistry,2007,42(5):840-846.
[5]Jollès P,Caen J P. Parallels between milk clotting and blood clotting:opportunities for milk-derived products[J]. Trends in Food Science & Technology,1991,2:42-43.
[6]Gauthier S F,Pouliot Y,Saint-Sauveur D. Immunomodulatory peptides obtained by the enzymatic hydrolysis of whey proteins[J].International Dairy Journal,2006,16(11):1315-1323.
[7]Zhang C,Cao W,Hong P,et al. Angiotensin I-converting enzyme inhibitory activity of Acetes chinensis peptic hydrolysate and its antihypertensive effect in spontaneously hypertensive rats[J]. International Journal of Food Science & Technology,2009,44(10):2042-2048.
[8]曹文红,章超桦. 生物活性肽的吸收机制[J]. 药物生物技术,2006,13(5):384-388.
[9]宋茹,汪东风,谢超,等. 黄鲫胃蛋白酶酶解液体外抗氧化,抑菌作用研究[J]. 食品科学,2010(3):127-131.
[10]Je J Y,Qian Z J,Byun H G,et al. Purification and characterization of an antioxidant peptide obtained from tuna backbone protein by enzymatic hydrolysis[J]. Process Biochemistry,2007,42(5):840-846.
[11]Meunpol O,Hall M R,Kapoor V. Partial characterisation and distribution of kynurenine aminotransferase activity in the Black Tiger prawn(Penaeus monodon)[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,1998,120(1):139-143.
[12]Osnes K K,Mohr V. On the purification and characterization of three anionic,serine-type peptide hydrolases from Antarctic krill,Euphausia superba[J]. Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1985,82(4):607-619.
[13]庄志凯,杜嵇华,吉宏武,等. 南美白对虾虾头内源酸性蛋白酶的分离纯化及其酶学特性研究[J]. 食品工业科技,2012,33(18):116-120.
[14]章超桦,邓尚贵,洪鹏志,等.刀额新对虾的快速自溶技术[J].水产学报,1991,23(4):387-391.
[15]Cao W,Tan C,Zhan X,et al. Ultraviolet irradiation and gradient temperature assisted autolysis for protein recovery from shrimp head waste[J]. Food Chemistry,2014,164:136-141.
[16]Johns P,Cheng L,Dowlati L. Analytical method for the determination of infant formula protein digestibility in vitro:U.S. Patent Application 10/464,052[P]. 2003-6-18.
[17]李建武,余瑞元,袁明秀,等.生物化学实验原理和方法[M].北京:北京大学出版社,1994
[18]AOAC(1990).Official methods of analysis(16th ed.). Washington,DC:Association of Official Analytical,Chemists.
[19]赵谋明,刘洋,孙为正,等. 草鱼抗氧化肽的美拉德反应特性研究[J]. 现代食品科技,2013,29(12):2805-2809.
[20]姚玉静,崔春,邱礼平,等. pH-stat法和甲醛滴定法测定大豆蛋白水解度准确性比较[J]. 食品工业科技,2008,29(9):269-270.
[21]戴程程,汪秋宽,任丹丹,等. 南极磷虾自溶酶解工艺的研究[J]. 食品科技,2012(7):145-149.
[22]朱国萍,曹文红,章超桦,等. 凡纳滨对虾虾头自溶动力学[J]. 水产学报,2010,34(3):395-403.
Preparation for short peptides from shrimp head in a simulated gastrointestinal tract digestion system based on its endogenous enzymes
TIAN Shen1,2,LI Yi-jie1,CAO Wen-hong1,2,3,*,ZHU Ya-hui1,ZHANG Chao-hua1,2,3
(1.College of Food Science and Technology,Guangdong Ocean University,Zhanjiang 524088,China;2.Guangdong Provincial Key Laboratory of Aquatic Product Processing and Safety,Zhanjiang 524088,China;3.Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution,Zhanjiang 524088,China)
Gastrointestinal tract digestion system was simulated,in which endogenous protease from shrimp head was used to obtain short peptides by degrading protein in shrimp head.The results demonstrated that the release amount of shrimp head protein,the degree of hydrolysis and the proportion of the components under 3000 u in the hydrolysate showed all significantly increase twice during the process of simulated digestion,which meant that endogenous pepsin-like protease and trypsin-like protease worked in different stages of simulated digestion process,respectively.In simulated gastric digestion process,the molecular weight of the autolysis in shrimp head mainly focused on 2000~3000 u,and in simulated intestinal digestion process it focused on 1000 u or less.The results suggested that short peptides with high added values can be obtained by using endogenous proteases in shrimp head to simulate gastrointestinal digestion and in this way,proteins in shrimp head can be retrieved efficiently.
Litopenaeus vannamei;shrimp head;endogenous enzymes;simulated digestion;peptides
2015-09-24
田申(1991-),男,硕士研究生,研究方向:水产品深加工及贮藏工程,E-mail:tianshen9103@163.com。
曹文红(1977-),男,博士,教授,主要从事海洋生物活性物质研究, E-mail:cchunlin@163.com。
国家自然科学基金(41576151);广东省自然科学基金(S2013010012459);广东海洋大学创新创业训练计划项目(CXXL2014029)。
TS254.1
A
1002-0306(2016)09-0092-05
10.13386/j.issn1002-0306.2016.09.010
