产乳酸菌素菌株的筛选鉴定及其特性分析
2016-09-12张君超谢远红金君华段慧霞张红星
张君超,谢远红,金君华,段慧霞,刘 慧,张红星
(农产品有害微生物及农残安全检测与控制北京市重点实验室 食品质量与安全北京实验室 北京农学院食品科学与工程学院,北京 102206)
产乳酸菌素菌株的筛选鉴定及其特性分析
张君超,谢远红,金君华,段慧霞,刘慧,张红星*
(农产品有害微生物及农残安全检测与控制北京市重点实验室 食品质量与安全北京实验室 北京农学院食品科学与工程学院,北京 102206)
本实验对广西巴马村天然发酵米粉中的乳酸菌进行分离鉴定,筛选出一株具有抑菌活性的植物乳杆菌M44,并研究了其所产乳酸菌素的基本性质。采用微生物形态学和16S rDNA 序列分析法鉴定菌株M44为植物乳杆菌,其发酵上清液具有抑菌活性,抑菌物质确定为蛋白类。采用盐析法粗提所产乳酸菌素,确定最佳硫酸铵沉淀浓度为60%。由乳酸菌素产量与菌株生长的关系实验得出乳酸菌素的最佳收获时间为发酵培养12 h。管碟法抑菌实验表明,该乳酸菌素在pH范围 2~8时有良好的抑菌活性;121 ℃处理 15 min 后仍具有抑菌活性;胃蛋白酶、胰蛋白酶处理后抑菌性消失;对单核增生李斯特细菌、大肠杆菌、沙门氏菌,金黄色葡萄球菌均有抑制作用。该乳酸菌素为天然生物防腐剂的开发与应用提供了研究基础。
植物乳杆菌,细菌素,分离纯化,抑菌特性
食品中含有丰富的营养成分,在加工、贮藏、运输等过程中很容易被微生物侵染,从而发生腐败变质甚至引起食物中毒,危害消费者健康。目前食品防腐的方式有添加化学防腐剂和物理杀菌,但化学防腐剂对人体健康的影响以及物理杀菌成本高,影响食品品质的特点都使其应用受到限制[1]。这导致既能确保食品的微生物安全性也能赋予食品更高的营养价值的天然防腐剂逐渐成为食品防腐保鲜的研究热点[2]。
乳酸菌是广泛应用在肉制品、乳制品、蔬菜和葡萄酒发酵中的发酵剂[3]。这些菌株可以延长发酵食品保质期,也可以改善发酵食品的质地,风味和口感[4]。同时它对人是无毒副作用,可以改善人体肠道菌群,这在人体生理机能中起着重要作用。乳酸菌素是乳酸菌在代谢过程中产生的具有抑制其他微生物生长的一类细胞外蛋白质或多肽类物质[5]。从乳酸菌中分离纯化的乳酸菌素Nisin是一种天然生物防腐剂,作为在全球已批准应用的食品添加剂,它可以有效抑制食品中致病菌和腐败菌的生长[6]。除Nisin外,还有许多其他细菌素如片球菌素,链球菌素和植物乳杆菌素等被认为具有作为食品防腐剂的潜力,但由于某种乳酸菌素热稳定性、酸碱稳定性的局限性和抑菌谱窄的特点限制了其单独在食品工业中的应用[7]。因此开发抑菌谱广、适应食品工业生产的新型乳酸菌素具有良好的前景。
本文从具有长寿村之称的广西巴马村的天然发酵食品中分离纯化有抑菌活性的乳酸菌,并对所产抑菌物质的特性进行初步研究,旨在为开发天然的适应食品工业生产的生物防腐剂提供研究基础。
1 材料与方法
1.1材料与仪器
米粉广西巴马村天然发酵。
乳酸菌M44为分离纯化菌株;单核细胞增生李斯特氏菌(Listeriamonocytogenes)CMCC54003和CMCC54002、鼠伤寒沙门氏菌(Salmonellatyphimurium)ATCC 14028、伤寒沙门氏菌(Salmonellatyphosa)CMCC50071、金黄色葡萄球菌(Staphylococcusaureus)ATCC29213和CMCC26001、大肠杆菌(Escherichiacoli)CMCC44110、福氏志贺氏菌(Shigellaflexneri)CMCC51572、干酪乳杆菌(Lactobacilluscasei)、植物乳杆菌(Lactobacillusplantarum)、嗜酸乳杆菌(Lactobacillusacidophilus)、瑞士乳杆菌(Lactobacillushelveticus)、戊糖片球菌(Pediococcuspentosaceus)均为实验室保藏菌种。
碳酸钙-MRS固体培养基(3%碳酸钙),MRS液体、固体培养基,TSBYE液体、固体培养基,LB液体、固体培养基,BPY液体、固体培养基,GN液体、固体培养基,培养基所需试剂均为国产分析纯[8]。
革兰氏染色试剂盒北京陆桥技术股份有限公司;溶菌酶、过氧化氢酶生工生物工程(上海)股份有限公司;蛋白酶K、胃蛋白酶、胰蛋白酶Sigma-Aldrich公司;DL5000 DNA Marker、Ex Taq宝生物工程(大连)有限公司;细菌基因组 DNA 提取试剂盒天根生化科技(北京)有限公司;琼脂糖Biowest公司;其他试剂均为分析纯北京畅华志诚科技有限公司。
牛津杯(内径6 mm)北京畅华志诚科技有限公司;DL-CJ-1N 超净工作台北京东联哈尔仪器制造有限公司;PHS-3B 便携式酸度计上海雷磁仪器厂;UV-1800 微量紫外分光光度计日本岛津公司;MLS-3750高压蒸汽灭菌锅Sanyo Electric公司;LHS-100CH 恒温恒湿箱上海一恒科技有限公司;C1000 PCR仪美国Bio-Rad公司;JY 600C型稳压稳流电泳仪北京君意东方电泳设备有限公司;DYY-8C型电泳仪北京市六一仪器厂;凝胶成像系统美国Bio-Rad公司;BIOFUGE STRATOS台式冷冻离心机美国Thermo Scientific公司。
1.2实验方法
1.2.1乳酸菌初筛称取发酵米粉25 g,用225 mL无菌水均质混匀,使用倾注法接种在碳酸钙-MRS琼脂平板上,37 ℃培养48 h,选取有溶钙圈的菌落,然后在MRS琼脂平板上多次划线纯化,直至整个平板上的菌落形态一致,挑取单菌落到MRS液体培养基增菌培养24 h,使用冻存管将菌液和50%甘油1∶1混合,-80 ℃冰箱保藏[8]。
1.2.2菌株的培养将-80 ℃冷冻保藏的乳酸菌和单核细胞增生李斯特氏菌(简称单增李斯特)CMCC54002恢复到室温,分别接种到MRS和TSBYE液体培养基中,37 ℃振荡培养24 h和12 h,4 ℃保藏备用。
1.2.3乳酸菌发酵上清液的制备按2%的接种量将活化的乳酸菌转接到MRS液体培养基中,37 ℃恒温培养24 h。将培养液12000 r/min,4 ℃离心10 min,收集发酵上清液,4 ℃保藏备用。
1.2.4管碟法抑菌实验将活化好的指示菌,与加热融化的固体培养基混匀,使菌落终浓度至107cfu/mL,倾注约15 mL于无菌平皿中,待培养基凝固后,轻轻放上牛津杯,取100 μL实验样品加入牛津杯。4 ℃冰箱扩散4 h后,在相应指示菌的生长温度下培养相应的生长时间,观察抑菌圈的出现[9-10]。
1.2.5有抑菌活性乳酸菌的复筛将保藏的乳酸菌发酵上清液,用1 mol/L NaOH调pH至6.0,排除有机酸干扰,以单核细胞增生李斯特氏菌CMCC54002为指示菌,管碟法做抑菌实验[11]。
1.2.6抑菌物质的确定将pH6.0乳酸菌M44发酵上清液分为4份,分别用无菌水,过氧化氢酶(pH7.0、37 ℃)、胃蛋白酶(pH2.0、37 ℃)、胰蛋白酶(pH8.0、37 ℃)处理2 h,再调pH为6.0,用无菌水调至相同体积,以单核细胞增生李斯特氏菌CMCC54002为指示菌,管碟法做抑菌实验,未处理的发酵上清液为对照,各平行三次[12]。
1.2.716S rDNA序列鉴定乳酸菌M44发酵培养液12000 r/min,4 ℃离心10 min后取菌体沉淀,溶菌酶(30 mg/mL)37 ℃温浴1~2 h后用基因组DNA提取使用试剂盒提取。以提取的基因组DNA为模板,进行16S rDNA基因的PCR扩增,扩增引物使用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)/1492R(5′-TACGGCTACCTTGTTACGACTT-3′)(Weisburg,et al.1991)。PCR反应体系(25 μL):Pre-mix Ex Taq 12.5 μL,上游引物(10 μmol/L)1 μL,下游引物(10 μmol/L)1 μL,基因组DNA模板1 μL,超纯水9.5 μL。PCR扩增条件:95 ℃预变性 3 min;95 ℃变性30 s,55 ℃退火1 min,72 ℃延伸1 min,进行34个循环管,最后72 ℃延伸5 min。PCR产物经1%琼脂糖凝胶电泳分析后委托生工生物工程(上海)股份有限公司测序。PCR产物序列结果通过BLAST软件在NCBI网站基因库中进行同源性比对鉴定。
1.2.8乳酸菌素抑菌活力的测定乳酸菌素抑菌活力的测定采用二倍连续梯度稀释法[13]与管碟法,将待测样品用无菌水进行二倍梯度稀释,取100 μL样品进行抑菌实验,以观察不到抑菌圈出现的最高稀释度定义为一个活力单位(AU,arbitrary units),其倒数即为样品的效价值(AU/mL)[14]。
1.2.9盐析法分离乳酸菌素将乳酸菌发酵上清液pH调至6.0,分成八份,每份100 mL,边缓慢搅拌边分别缓慢添加经过研磨的硫酸铵粉末,直至八份样品的浓度分别为10%、20%、30%、40%、50%、60%、70%、80%。4 ℃磁力搅拌器搅拌沉淀过夜,10000 r/min离心10 min。每份样品得到的沉淀分别重悬于0.01 mol/L的磷酸缓冲液(pH6.0)中,做抑菌实验,比较抑菌圈有无及直径大小,以此确定硫酸铵最佳沉淀浓度;各硫酸铵浓度沉淀得到的上清液做抑菌实验,平行测三次[15]。
1.2.10乳酸菌素产量与菌株生长的关系乳酸菌M44按2%接种量接种,37 ℃连续培养24 h,每隔2 h测定发酵菌液OD600 nm值和乳酸菌素硫酸铵沉淀粗提物的效价。每组数据平行测3次[16]。
1.2.11乳酸菌素的特性实验热稳定性实验:将乳酸菌素粗提液pH调至6.0,分别做如下处理:60 ℃ 10 min,60 ℃ 30 min,60 ℃ 90 min,100 ℃ 10 min,100 ℃ 30 min,100 ℃ 90 min,121 ℃ 15 min,静置冷却后以单增李斯特为指示菌做抑菌实验,未经热处理的乳酸菌素粗提液为对照。各平行三次。酸碱稳定性实验:将乳酸菌素粗提液的pH分别调至2.0、4.0、6.0、7.0、8.0、10.0、12.0,37 ℃温箱处理2 h,再调回pH6.0,用无菌水调节液面至同一体积,以单增李斯特为指示菌做抑菌实验。各平行三次。抑菌谱的测定:将乳酸菌素粗提液pH调至6.0在不同指示菌的指示平板上采用管碟法做抑菌实验,绘制抑菌谱[9]。
2 结果与分析
2.1乳酸菌菌株的筛选
在碳酸钙-MRS培养基上选取有溶钙圈、乳白色、革兰氏染色阳性的单菌落50株划平板纯化,纯化后的菌株经MRS液体培养基37 ℃增培24 h,25%甘油-80 ℃保藏。
将上述分离纯化的菌株,用MRS液体培养基37 ℃发酵培养至稳定期,取发酵上清液调节pH为6.0后,以单增李斯特菌CMCC54002为指示菌,使用管碟法筛选出有抑菌效果的菌株M44。
2.2乳酸菌M44的鉴定
乳酸菌M44的菌落为乳白色圆形,表面光滑,中间凸起,不透明,边缘整齐,直径约2 mm;革兰氏染色显示个体形态呈短杆状,大小0.5×(1.33~2.0)μm,通常单生,成对或呈短链状排列,不生芽孢(图1),为革兰氏阳性菌。

图1 乳酸菌M44的菌体形态(×1000)Fig.1 Mycelial morphology of lactic acid bacteria M44(×1000)
用细菌基因组DNA提取试剂盒提取乳酸菌M44基因组,然后用1%琼脂糖凝胶电泳检测基因组DNA提取质量(图2)。以M44基因组DNA为模板,16S rDNA 通用引物27F/1492R进行PCR扩增,得到约1500 bp的特异性扩增产物(图3)。测序结果在NCBI网站用BLAST软件进行同源性比对分析,并与其它乳酸菌同源性比对做系统发育树(图4)。乳酸菌M44的16S rDNA PCR扩增产物的核心序列与植物乳杆菌Zhang-LL(GenBank:KF926687.1)的基因序列同源性达到 99%,同时系统发育树分析与乳酸杆菌中的植物乳杆菌相似性最高,故确定乳酸菌M44为植物乳杆菌。

图2 乳酸菌M44基因组DNA琼脂糖凝胶电泳图Fig.2 Agarose Gel Electrophoresis of Genomic DNA of strain M44注:M.DNA maker DL5000;1.乳酸菌M44基因组DNA
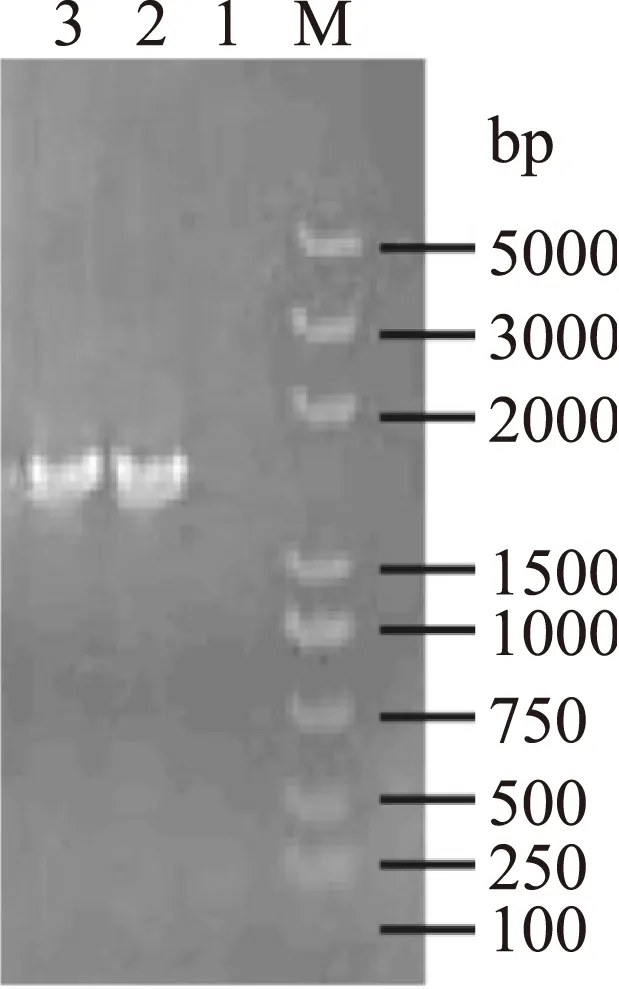
图3 乳酸菌M44 16S rDNA PCR扩增产物Fig.3 The 16S rDNA PCR products of strain M44注:M.DNA maker DL5000;1.阴性对照; 2.16S rDNA PCR扩增产物; 3.16S rDNA PCR扩增产物平行样本。

图4 乳酸菌M44的系统发育树Fig.4 The phylogenetic tree of strain M44
2.3抑菌物质的确定
抑菌实验显示将植物乳杆菌M44的发酵上清液pH调至中性后,抑菌效果仍然很明显,过氧化氢酶处理后抑菌圈几乎没有变化,胃蛋白酶和胰蛋白酶处理后抑菌性消失(图5)。说明发酵上清液中有机酸对单增李斯特菌没有明显的抑菌作用,过氧化氢也不是抑菌物质,发挥抑菌作用的主要为蛋白类物质,定义为乳酸菌素。

图5 抑菌物质的确定Fig.5 Determination of the antimicrobial substance注:牛津杯内直径6.0 mm。1.pH4.0;2.pH6.0; 3.pH6.0,过氧化氢酶处理;4.pH6.0,胃蛋白酶处理; 5.pH6.0,胰蛋白酶处理。实验 1、2是有机酸排除实验; 实验2、3是过氧化氢排除实验; 实验 2、3、4、5是证明蛋白质属性实验。
2.4乳酸菌素的初步纯化
乳酸菌素使用盐析的方法来提取,实验中采取硫酸铵分级沉淀的蛋白质的分离方法,分别得到10%、20%、30%、40%、50%、60%、70%硫酸铵饱和度的沉淀和上清,抑菌结果如表1所示。

表1 硫酸铵分级沉淀效果Table 1 Grade precipitation with different concentration of ammonium sulfate
由表1可知,在硫酸铵浓度在40%以下,硫酸铵沉淀没有显著的抑菌效果,硫酸铵沉淀上清抑菌效果没有明显下降,硫酸铵浓度达到40%以后硫酸铵沉淀抑菌效果逐渐增强,硫酸铵沉淀上清抑菌效果逐渐减弱,在60%达到硫酸铵沉淀抑菌效果达到最大值,硫酸铵沉淀上清达到最小值并在60%以后达到稳定。因此,硫酸铵沉淀法粗提细菌素时,先用40%的硫酸铵去除杂蛋白,然后继续添加硫酸铵至终浓度达到60%。将粗提的60%硫酸铵沉淀经过透析处理除盐,放置4 ℃冷藏备用。
2.5乳酸菌素M44产量与菌株生长的关系
在乳酸菌M44连续发酵24 h内,间隔2 h测定菌落总数,发酵液的OD600 nm值、pH及乳酸菌素粗提物的抑菌效价,结果见图6。随着乳酸菌M44菌数的增长,乳酸菌M44培养液的OD600 nm值和乳酸菌素的效价不断上升,同时发酵培养液的pH不断下降,在发酵培养12 h之后培养体系各项指标处于稳定状态,乳酸菌素的效价值也达到最大AU值160 AU/mL,因此,确定乳酸菌素的最佳收获期为发酵培养12 h。该实验结果说明乳酸菌素M44的产生与菌株生长具有正相关依懒关系。

图6 乳酸菌素M44产量与菌株生长的关系Fig.6 Production of the plantaricin during the growth of strain M44
2.6乳酸菌素M44特性
热稳定性:乳酸菌素M44粗提液经过不同热处理后,对单核细胞增生李斯特氏菌的抑菌效果如表2所示。乳酸菌素M44经121 ℃ 15 min热处理后仍具有抑菌活性,说明此乳酸菌素具有较好的热稳定性,在一般的食品热加工处理中,对其抑菌作用影响不大。

表2 乳酸菌素M44的热稳定性Table 2 The stability of the lactobacillin M44 to temperature
酸碱稳定性:调节乳酸菌素M44粗提液pH,抑菌结果(图7)显示乳酸菌素M44在pH2~8范围内抑菌性较好,随着pH的升高抑菌性急剧消失,说明此细菌素能耐受酸环境而不耐受碱环境。

表3 乳酸菌素对细菌的抑制作用Table 3 The inhibition of the lactobacillin to bacteria
注:a:ATCC,American Type Culture Collection;CMCC,National Center For Medicial Culture Collection;b:抑菌圈直径(mm):++,9-14 mm;+,1-8 mm;-,no inhibition。

图7 乳酸菌素的酸碱稳定性Fig.7 The pH stability of the lactobacillin注:牛津杯内直径 6.0 mm。图中标注为相应pH。
乳酸菌素M44的抑菌谱:以食品中常见的致病菌和实验室保藏的产乳酸菌素的近源性乳酸菌为指示菌进行抑菌实验,结果如表3所示,该乳酸菌素对单增李斯特,沙门氏菌,金黄色葡萄球菌,大肠埃希氏菌均有一定的抑制作用,对福氏志贺氏菌没有抑制作用,对乳酸菌的产乳酸菌素近源菌株干酪乳杆菌,植物乳杆菌,嗜酸乳杆菌,瑞士乳杆菌和戊糖片球菌没有抑制作用,说明乳酸菌素M44能很好的作为生物防腐剂应用于食品中。
3 结论
从广西巴马长寿村的天然发酵食品米粉样品中筛选出一株具有抑菌活性的乳酸菌菌株M44,通过形态学和16S rDNA序列分析鉴定为植物乳杆菌。乳酸菌M44发酵上清液排除有机酸和过氧化氢酶的影响后,仍具有抑菌活性,用胃蛋白酶、胰蛋白酶处理后,抑菌活性消失,这说明其代谢产物中主要的抑菌活性物质属于蛋白类,且能被胃蛋白酶和胰蛋白酶完全消化,证明其在人体内能被消化吸收。初步确定为乳酸菌素。用盐析法提取发酵上清液中的乳酸菌素,确定硫酸铵最佳沉淀浓度为60%。通过测定乳酸菌素产量与菌株生长关系,乳酸菌素M44的最佳收获期为发酵培养12 h。乳酸菌素M44有较好的热稳定性,经121 ℃处理15 min后仍具有抑菌活性;其在pH2~8范围内具有良好的抑菌效果。该乳酸菌素不仅对单核增生李斯特细菌、金黄色葡萄球菌等革兰氏阳性菌有抑制作用,而且对大肠杆菌、沙门氏菌革兰氏阴性菌也有抑制作用。此乳酸菌素来源于食品,为天然食品防腐剂和动物饲料添加剂提供研究和应用基础。
[1]黄艳娥,刘海波. 食品防腐剂对人体健康的影响及发展趋势 [J]. 化工中间体,2005,07:1-6.
[2]周志江. 生物防腐剂及其在食品防腐中的应用 [J]. 保鲜与加工,2015,01:1-8.
[3]Buckenh Skes H J. Selection criteria for lactic acid bacteria to be used as starter cultures for various food commodities [J]. FEMS Microbiology Reviews,1993,12(1-3):253-271.
[4]El-Ghaish S,Ahmadova A,Hadji-Sfaxi I,et al. Potential use of lactic acid bacteria for reduction of allergenicity and for longer conservation of fermented foods [J]. Trends in Food Science and Technology,2011,22(9):509-516.
[5]Jack R W,Tagg J R. Bacteriocins of gram-positive bacteria [J]. Microbiology and Molecular Biology Reviews,1995,59(2):171-200.
[6]G Lvez A,Abriouel H,L Pez R L,et al. Bacteriocin-based strategies for food biopreservation [J]. International Journal of Food Microbiology,2007,120(1-2):51-70.
[7]刘长建,姜波,崔玉波,等. 生物防腐剂乳酸菌素的研究进展 [J]. 微生物学杂志,2010,03:87-90.
[8]刘慧. 现代食品微生物学实验技术 [M]. 北京:中国轻工业出版社,2011:260-284.
[9]O’shea E F,O’connor P M,Raftis E J,et al. Subspecies diversity in bacteriocin production by intestinal Lactobacillus salivarius strains [J]. Gut microbes,2012,3(5):468-473.
[10]De Kwaadsteniet M,Fraser T,Van Reenen C A,et al. Bacteriocin T8,a Novel Class IIa sec-Dependent Bacteriocin Produced by Enterococcus faecium T8,Isolated from Vaginal Secretions of Children Infected with Human Immunodeficiency Virus [J]. Applied and Environmental Microbiology,2006,72(7):4761-4766.
[11]Nieto-Lozanoa J C,Reguera-Userosa J I,Mar,et al. Effect of a bacteriocin produced by Pediococcus acidilactici against Listeria monocytogenes and Clostridium perfringens on Spanish raw meat [J]. Meat Science,2006,72(1):57-61.
[12]Piddock L J. Techniques used for the determination of antimicrobial resistance and sensitivity in bacteria. Antimicrobial Agents Research Group [J]. Journal of Applied Bacteriology,1990,68(4):307-318.
[13]Tahiri I,Desbiens M,Benech R,et al. Purification,characterization and amino acid sequencing of divergicin M35:a novel class IIa bacteriocin produced by Carnobacterium divergens M35 [J]. International Journal of Food Microbiology,2004,97(2):123-136.
[14]Zhu W M,Liu W,Wu D Q. Isolation and characterization of a new bacteriocin from Lactobacillus gasseri KT7 [J]. Journal of applied microbiology,2000,88(5):877-886.
[15]Cintas L M,Casaus M P,Herranz C,et al. Review:Bacteriocins of Lactic Acid Bacteria [J]. Food Science and Technology International,2001,7(4):281-305.
[16]张红星,刘丽,谢英,等. 风干肠中戊糖片球菌所产细菌素L5-6的理化特性研究 [J]. 中国食品学报,2011,01:75-79.
Identification and antimicrobial characters of a strain producing lactobacillin
ZHANG Jun-chao,XIE Yuan-hong,JIN Jun-hua,DUAN Hui-xia,LIU Hui,ZHANG Hong-xing*
(Beijing Key Laboratory of Agricultural Product Detection and Control of Spoilage Organisms and Pesticide Residue,Beijing Laboratory of Food Quality and Safety,Faculty of Food Science and Engineering,Beijing University of Agriculture,Beijing 102206,China)
The extraction,purification and functional characterization of the bacteriocin produced byLactobacillusplantarumM44 selected from rice noodles products of Guangxi province were studied.It was identified asLactobacillusplantarumvia using microbial morphology identification and 16S rDNA gene sequence homology analysis.The fermentation supernatant of strain M44 have antibacterial activity,and antibacterial substances was identified as protein.The bacteriocin was purified by protein salting-out method and the optimal concentration of 60% ammonium sulfate precipitation was determined.The most appropriate harvest time of the bacteriocin was 12 h by studying production of bacteriocin during the growth of strain M44.The results indicated that the lactobacillin M44 still had antibacterial activity at 121 ℃ for 15 min,and had strong antibacterial activity in the range of pH2.0~8.0,but had no antibacterial activity after pepsin and trypsin treatment,whatever lactobacillin M44 proved its good inhibitory effect on proliferation ofListeriamonocytogenes,Escherichiacoli,Salmonellatyphimurium,andStaphylococcusaureusby the oxford cup method.In this paper a preliminary study on the bacteriocin produced byLactobacillusplantarumM44 had been made to lay the basis for the development of natural biological preservatives.
Lactobacillusplantarum;bacteriocin;extraction and purification;antibacterial characterization
2015-10-14
张君超(1990-),女,硕士研究生,研究方向:农产品加工与贮藏专业,食品安全方向,E-mail:18810833052@163.com。
张红星(1970-),男,博士,教授,研究方向:食品微生物,食品安全检测与控制,E-mail:hxzhang511@163.com。
国家高技术研究发展计划(863计划)项目(SS2012AA101606-5,2012BAD28B02-01);北京市长城学者培养计划(CIT&TCD20140315);2015年北京农学院学位与研究生教育改革与发展项目(2015YJS059)。
TS201.3
A
1002-0306(2016)09-0169-06
10.13386/j.issn1002-0306.2016.09.025
