改良成年小鼠心室肌细胞分离方法
2016-09-11石山慧吕定超翟旭雯李端端周密左琳
石山慧 吕定超 翟旭雯 李端端 周密 左琳
基础研究
改良成年小鼠心室肌细胞分离方法
石山慧 吕定超 翟旭雯 李端端 周密 左琳
目的 改进小鼠成体心肌细胞的分离方法,以提高小鼠心室肌细胞的成活率和收获量。方法
采用心脏在体主动脉插管,行独创的前加压灌流法冲洗心脏后接入改进的langendorff装置,用胶原酶液Ⅱ灌流、消化心脏后,将心脏剪碎并用吸管吹打,经200目滤网过滤后获得单个小鼠心室肌细胞。检测并对比在体和离体主动脉插管获得的心肌细胞的状态:梯度复钙后,在倒置显微镜下观察细胞的形态和杆状心室肌细胞的数目。结果 研究结果显示,改良的主动脉逆行灌流法在缩短手术时间的同时,提高了小鼠心室肌细胞收获量和存活率。本课题组利用医用三通管,独创倒置灌流排气法,可以迅速排空灌流装置中的气体;利用注射器和灌流针结合,独创前加压灌流法,可以快速彻底地冲洗心脏中的血液;并采用实验室常规眼科镊和血管钳巧妙组合成协助装置,可以单人独立完成插管,不需要助手协助,节约人力,节省经费开支。结论成年小鼠心室肌细胞分离方法的改进使整个实验流程简化,缩短了实验时间,操作简便易学;同时该分离方法稳定、可靠、有效,可以为同类型实验提供思路和借鉴。
成年小鼠;心室肌细胞;分离;Langendorff;胶原酶
缺血性心肌病(ischemic cardiomyopathy,ICM)是指由于冠状动脉粥样硬化引起心肌缺血、纤维化,进而产生与原发性扩张型心肌病类似的临床综合征。WTO组织报道:目前ICM已经成为威胁人类健康的头号杀手[1]。ICM发病过程中,大量心室肌细胞缺血坏死是导致心脏结构和功能改变的主要原因。因此,针对如何减少心室肌细胞死亡是缺血性心肌病防治的核心。
在ICM研究中常用到的细胞类型有乳鼠心肌细胞、H9C2等细胞类型,和以上细胞相比,成年鼠心室肌细胞(ventricular cardiomyoctyes,VCMs)在结构和功能上更接近在体的真实状况,因而被广泛用于ICM的病理生理学研究,同时它也是药物干预的良好细胞材料[2-4]。但是,成年小鼠VCMs的分离和培养一直是该领域的技术难点。经典的心肌细胞分离方法是将心脏取出后挂于langendorrf灌流装置上,先用无钙台氏液灌流心脏,然后用胶原酶Ⅱ进一步酶解消化心脏,分离得到VCMs[3,5]。该经典方法多适用于兔子、大鼠和豚鼠等中等大小的物种[6,7],而对于小鼠VCMs的分离,目前主要有以下三个技术难题:小鼠心脏小,手术难度高;手术需助手协助:灌流装置不易排气。
针对以上问题,我们对该经典分离方法进行了改进,对Langendorff灌流装置行倒置灌流排气法,同时采用在体主动脉插管和前加压灌流法对心脏进行冲灌、酶解,急性分离成年小鼠心室肌细胞。方法改进使细胞分离实现了单人操作,同时大大缩短了心脏离体灌流的操作时间,提高了细胞存活率,为小鼠心室肌细胞的分离提供了新的思路和经验。
1 材料与方法
1.1 材料
1.1.1 动物 实验用C57/BL6小鼠,8~10周龄,雌雄均可,购自北京军事医学科学院动物中心。对实验动物的处置遵循山西医科大学动物伦理学的相关标准。
1.1.2 主要试剂 CollagenaseⅡ(Worthington Biochemical Corporation,Lakewood,USA)、Taurine(Sigma,USA)、Albumin Bovine Ⅴ (Roche Molecular Biochemicals,Mannheimm,Germany),laminin (Sigma,USA)。
1.1.3 主要仪器 langendorff灌流装置,酸度计,倒置显微镜,恒温水浴箱,微量蠕动泵。
1.1.4 试剂:pH 7.38。
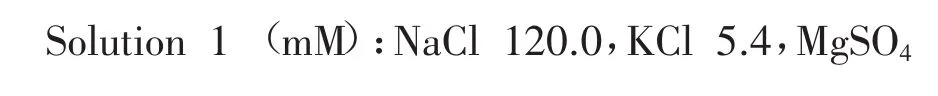

1.2 方法
1.2.1 小鼠的麻醉及心脏暴露 用1.5%戊巴比妥钠0.1 ml/20 g对小鼠进行腹腔麻醉后,仰卧位固定小鼠四肢,碘伏棉球消毒胸腹部皮毛(图1A),打开腹腔,贴近腹后壁寻找腹主动脉(图1B),行腹主动脉放血(图1C)。
用手术剪将剑突处皮毛剪一小口,然后换眼科剪,分别沿着左右肋弓下缘剪至两侧腋后线处,再沿着胸骨柄中间剪皮毛至锁骨下窝,呈倒T字型(图1D),并将皮毛向上掀起充分暴露手术视野。然后换另一套无菌手术器械,用手术剪在剑突上方约0.5 cm处剪胸骨一小切口(图1E),再分别沿着左右肋骨下缘剪至腋后线的位置,沿着胸骨柄中间剪至胸骨窝边缘,将胸壁剪成倒T字型(注:不要划破膈肌暴露腹腔内容物而产生不必要的污染)(图1F),然后沿着胸骨柄中间剪至锁骨下窝,接着分别沿腋后线向上剪至腋窝,将整个胸壁摘下(图1G)暴露胸腔(图1H)。
1.2.2 在体主动脉插管 剪开心包膜,去除覆盖在心脏上方的胸腺(图2A),充分暴露胸腺下方的血管丛。从鼠体右到左依次是上腔静脉、主动脉、肺动脉干(图2B),找到位于中间的颜色鲜红、弹性较大的主动脉,在离心底上方约0.5 cm处插眼科镊的一端于主动脉下方,用于夹持主动脉并协助灌流针插管(图2C)。然后用显微解剖镊穿6号手术线于主动脉弓下方(图2D),用眼科剪在主动脉弓分叉处剪一小切口,大约是主动脉管径的1/3~1/2,切口紧靠主动脉弓距心底约3 mm(图2E),左手持显微解剖镊准确夹持主动脉断端的一侧血管壁(图2F),右手持灌流针管,在心脏舒张期,迅速将灌流针插入主动脉腔内,适当调整位置之后,用眼科镊夹住插管(图2G),同时用血管钳钳住眼科镊的中间位置,防止插管移位,便于单人操作(图2H),然后迅速结扎主动脉,撤去眼科镊(图2I),提起心脏,剪断心脏相连的主动脉及其下方的结缔组织,游离出心脏(图 2J、K、L)。
1.2.3 离体心脏冠状动脉逆行灌流 将装有Solution 1的注射器和连有心脏的灌流针头组合,构成前加压灌流装置,适度按压注射器进行前加压冠脉逆行灌流,会发现心脏迅速充盈并伴有血液流出,心脏颜色由深红色变为粉红色直至呈粉白色(图3A、B、C),灌流流出液颜色逐渐变清直至澄清无肉眼下混浊(图 3D、E),约需要 Solution 1 10 ml,冲洗时间1.0 min(注:勿将空气灌流入心脏产生气体栓塞,图3B)。将Langendorff灌流装置预处理后,采用倒置灌流排气法灌入Solution 2,确保无气泡后调流速约4 ml/min,将连有心脏的灌流针头接入Langendorff灌流装置,用酶解消化液灌流约8 min,至心脏呈微透明状,此时心脏质地软如嘴唇,停止灌流剪下心脏。
将消化好的心室置于5 ml预热的Solution 3中,用显微镊撕成小碎块,用1 ml枪头吹打成细胞悬液,经200目滤网过滤,加25 ml Solution 4吹打成细胞悬浮液,500 r/min,离心1 min,弃上清,再用25 ml Solution 5自然沉淀细胞10 min,弃上清;加适量Solution 5重悬细胞,将细胞滴加于载玻片上,镜下观察细胞形态[8,9]并计数,采用XB-K-25细胞计数板,取左上、右上、左下、右下和中间的中格的细胞,5个格的细胞总数记为N,计算公式:5N×104×5。
1.3 统计学方法 采用SPSS 11.5分析数据。实验数据用±s表示,两组间差异比较采用t检验,两组间率的比较采用χ2检验。P<0.05为差异具有统计学意义。
2 结果
2.1 两种插管法平均插管时间比较 通过比较在体插管法和离体插管法的优劣,我们发现,从平均插管时间来看,在体插管法的平均插管时间明显短于离体插管法[(88.0±10.5)s比(245.0±27.0)s,P<0.01,n=10,见图4]。以上结果提示,改良方法显著缩短插管时间,这一时间的缩短可以明显减轻心肌细胞缺氧损伤,有助于提高其存活率。
2.2 两种插管法的平均细胞收获量比较 我们将两种方法急性分离出来的心室肌细胞悬液,分别滴加在细胞计数板上,测定不同方法的心室肌细胞收获量。结果发现,在体插管法的细胞收获量高于离体插管法[(6.10±0.27)×106比(4.60±0.19)×106,P<0.01,n=6,见图 5]。
2.3 两种插管法分离的心室肌细胞存活率比较 急性分离的小鼠心室肌细胞37℃孵箱贴壁培养24 h后,用PBS洗涤3×5 min后,镜下计数存活细胞数,和前一天种植的细胞数进行比较,计算细胞存活率。每个标本分别观察3个培养皿,每个培养皿中随机观察10个100倍视野下活细胞的数目。活性好的心室肌细胞呈长杆状,条纹清晰;活性差的心室肌细胞会出现自发搏动;死亡的心室肌细胞呈圆团状,絮状皱缩在一起。因此,从细胞形态上可以直接分辨出心室肌细胞的状态,如图6。结果表明,在体插管法的细胞存活率明显高于离体插管法[(58.40±10.92)%比 (38.10±10.74)%,P<0.01,n=10)],说明在体插管法可以保持较高的细胞活性。
3 讨论
快速大量地分离心肌细胞及保持心肌细胞较高的活性是成年小鼠心肌细胞分离技术的两个重点,而易操作性和可行性是实现这两个重要目标的保障。目前该技术主要有以下三个难题:①小鼠的主动脉管径小且易闭合,离体难以寻找和定位,手术操作难度较大。②离体主动脉插管需要助手或者其他装置协助,不能单人独立完成。③Langendorff装置的内管是螺旋管,这一改进增加了液体恒温水浴的接触面积,但该系统不易排气泡,而且先后用无钙台式液和胶原酶Ⅱ灌流心脏时容易出现两种液体的混合,以及灌流系统中极易进入气泡,同时台式液灌流时间不宜控制。针对以上问题,本研究做了如下改进。
第一,本研究用在体主动脉插管法代替了经典的离体主动脉插管法。因小鼠心脏小如黄豆,主动脉直径一般小于1 mm,且离体后会收缩乃至闭合。同时缺血的主动脉和周围静脉脂肪组织的颜色相似,均为白色,难以寻找和定位,离体插管难度大。而在体主动脉充盈程度好,位于三根主血管中间,易寻找和定位,几乎不会发生主动脉定位不准确所导致的插管错误。同时,插管深度也是影响灌流效果的主要因素。插管前首先在主动脉弓处剪一个微小切口,便于无针尖的灌流针插入。在心脏舒张期将灌流针迅速插入主动脉,将灌流针头调整至主动脉和左右冠脉交界处,结扎后完成主动脉插管,手术难度小,易学习,掌握快。本实验团队的同一个实验者同时采用两种方法进行主动脉插管并对比所用时间,在体插管组比离体插管组节约2 min,因为在体插管易定位主动脉位置,所以插管时间大大缩短,心脏离体且未灌流的时间越短,越易保持心脏功能,同时在一定程度上可保持心室肌细胞的活性。在改良的主动脉插管过程中,我们又创新性地将眼科镊和止血钳相结合,不需要支架及助手协助插管[10],巧妙地运用实验室常见的器械实现单人插管,既避免额外购置多余仪器,节减经费开支,又节约了人力。
第二,前加压灌流冲洗心脏中血液具有一定优势。经典分离小鼠心室肌细胞常用的Langendorff灌流系统采用的是恒压灌流,由于高度和管径的限制,这种灌流方法需要大量的灌流液,同时在酶液的回收和循环利用上有一定的浪费。我们在本实验中将该Langendorff灌流系统和微量蠕动泵相连,改为恒流灌流系统。传统的恒压灌流需要先用无钙台约15 ml冲洗心脏中积血约4 min。我们将灌流针和10 ml注射器巧妙结合起来,能在1 min内将心脏中的血液冲洗干净。此前加压冠脉逆行灌流法操作简单,心脏冲洗充分,同时也缩短了心脏离体缺氧的时间。
第三,Langendorff逆行灌流排气法。Langendorff装置通常不易排尽气泡,气泡的残留对于灌流会产生一定的影响。通过方法的改进,我们在灌流管的下端装一个三通管,从这个三通管逆行灌入酶液。该设计能迅速排净灌流管中的气泡。该排气方法简单有效而实用,避免了Langendorff灌流系统排气困难和排气耗时过长对实验产生的影响。
通过在体主动脉插管成功分离心肌细胞后,我们在200倍倒置显微镜下观察了心室肌细胞的形态和数量,发现在体插管法获得的心室肌细胞活性较好,同时细胞收获量也高于传统方法。此外,该手术方法也适用于分离成年小鼠心房肌细胞、窦房结细胞及心脏干细胞,可以为后续的心脏组织细胞的原代培养提供基础技术性支持。经过大量的实验摸索,本课题组得到以下经验:①准确的主动脉插管位置,灌流针管的末端需位于冠状动脉开口处;②将连有心脏的灌流针接入灌流装置时应排尽空气;③开胸之前腹主动脉提前放血,防止插管过程中血液凝固堵塞微小血管,灌流冲洗心脏不充分;④酶解过程中一定控制酶解时间,左右偏离时间尽量不要超过30 s;⑤吹打心肌细胞之前将吸管顶部剪短,用力轻柔或者不用吸管吹打,只需轻轻摇晃盛有心肌组织的EP管,上下颠倒几次即可;⑥实验室温度要在25℃以上,可以避免低温导致的心室肌细胞低活性率。本研究采用详细的图示介绍了在体主动脉分离技术的具体步骤和注意事项,对心肌细胞分离技术的初学者有很大帮助和启迪。

图1 暴露心脏

图2 在体主动脉插管

图3 Lagendorff逆行灌流分离单个心室肌细胞

图4 在体插管法与离体插管法的插管时间对比

图5 在体插管法与离体插管法的细胞收获量对比

图6 心室肌细胞存活率的比较
[1]Lloyd-Jones D,Adams RJ,Brown TM,et al.Heart Disease and Stroke Statistics——2010 Update:A Report From the American Heart Association.Circulation,2010,121:e46-215.
[2]Kruppenbacher JP,May T,Eggers HJ,et al.Cardiomyocytes of adult mice in long-term culture.Naturwissenschaften,1993,80:132-134.
[3]Wolska BM,Solaro RJ.Method for isolation of adult mouse cardiac myocytes for studies of contraction and microfluorimetry.Am J Physiol,1996,271:H1250-1255.
[4]Sambrano GR,Fraser I,Han H,et al.Navigating the signalling network in mouse cardiac myocytes.Nature,2002,420:712-714..
[5]Zhou YY,Wang SQ,Zhu WZ,et al.Culture and adenoviral infection of adult mouse cardiac myocytes:methods for cellular genetic physiology.Am J Physiol Heart Circ Physiol,2000,279:H429-H436.
[6]Mitra R,Morad M.A uniform enzymatic method for dissociation of myocytes from hearts and stomachs of vertebrates.Am J Physiol,1985,249:H1056-1060.
[7]Powell T.The isolation and characterization of calcium-tolerant myocytes.Basic Res Cardiol,1984,80:15-18.
[8]Kabaeva Z,Zhao M,Michele DE.Blebbistatin extends culture life of adult mouse cardiac myocytes and allows efficient and stable transgene expression.Am J Physiol Heart Circ Physiol,2008,294:H1667-1674.
[9]Kohncke C,Lisewski U,Schleubner L,et al.Isolation and Kv channel recordings in murine atrial and ventricular cardiomyocytes.J Vis Exp,2013,12:e50145.
[10]Smith AJ,LewisFC,Aquila I,etal.Isolation and characterization of resident endogenous c-Kit+cardiac stem cells from the adult mouse and rat heart.Nat Protoc,2014,9:1662-1681.
The improvement of adult mouse cardiomyocytes isolation method
SHI Shan-hui,LÜ Ding-chao,ZHAI Xu-wen,et al.Department of Physiology,School of Basic Medical Sciences,Shanxi Medical University,Taiyuan 030001,China
ZUO Lin,E-mail:zuol1505@126.com
Objective The mouse is a better experimental animal suitable for genetic study.In order to increase the harvest and survival rate of adult mouse ventricular cardiomyoctyes AMVCMs,we try to improve the isolation method.Methods In the experiment,we used aortic cannulation in vivo and high-pressure perfusion to flush the heart,then collagenaseⅡ was used to digest the heart by the Langendorff apparatus.Hereafter the fully digestion,the atria of the heart was removed.The remainder of the heart was minced.After repeated pipetting,cell suspension was filtered with 200 μm nylon net,AMVCMs can be collected.The research has compared the amount and quality of AMVCMs between aortic cannulation in vivo and in vitro method after gradient calcium reintroduction.Results The result showed that the improved aortic cannulation method can shorten the operation time and increase the harvest and survival rate of AMVCMs.Our group original create the function of inverted exhaust by using an medical three-way pipe to remove all traces of the bubble in the perfusion apparatus;create pre-perfusion method by combining the syringe and perfusion needle to wash the heart rapidly and thoroughly;combine ophthalmology tweezers and forceps into an equipment to assist to realize cannulation by single person with saving resources and fund.Conclusion The improvements can simplify the whole experimental procedure,shorten the isolation time which is easy to learn.The improved method is stable,reliable and effective which can provide ideas for similar experiments.
Adult mice;Ventricular cardiomyocytes;Isolation;Langendorff;Collagenase
国家自然科学基金青年科学基金项目(项目编号:81200120);山西省留学回国留学人员科研资助项目(项目编号:2014-036)
030001 山西省太原市,山西医科大学基础医学院生理学系
左琳,E-mail:zuol1505@126.com
10.3969/j.issn.1672-5301.2016.08.019
Q95-33;R542.2
A
1672-5301(2016)08-0748-04
2016-02-12)
