新疆红肉苹果杂种一代4个株系类黄酮含量及其合成相关基因表达分析
2016-09-09许海峰姜生辉王意程刘静轩曲常志王得云左卫芳冀晓昊张宗营毛志泉陈学森
许海峰,王 楠,姜生辉,王意程,刘静轩,曲常志,王得云,左卫芳,张 晶,冀晓昊,张宗营,毛志泉,陈学森
(山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东泰安 271018)
新疆红肉苹果杂种一代4个株系类黄酮含量及其合成相关基因表达分析
许海峰,王 楠,姜生辉,王意程,刘静轩,曲常志,王得云,左卫芳,张 晶,冀晓昊,张宗营,毛志泉,陈学森
(山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东泰安 271018)
【目的】研究新疆红肉苹果(Malus sieversii f. neidzwetzkyana(Dieck)Langenf.)与‘富士’(M. domestica cv. Fuji)等苹果品种杂交后代株系间果实类黄酮合成差异的分子机理,为进一步完善功能型苹果育种的理论与技术体系提供科学依据。【方法】以紫红2号及红脆1、2、4号等红肉程度存在明显差异的4个苹果株系发育后期的果实为试材,进行MYB10启动子基因型鉴定,并测定类黄酮组分和含量,分析类黄酮合成相关基因的表达。【结果】红脆1、2、4号MYB10启动子基因型均是R6R1型,而紫红2号启动子类型为R6R6型。红脆1号和紫红2号果实成熟期类黄酮含量分别为3.0 mg·g-1和3.1 mg·g-1;紫红2号花青苷含量(23.9 U·g-1FW)是红脆1号(12.2 U·g-1FW)的2倍,其他类黄酮组分含量(1 635.3 mg·kg-1)仅是红脆1号的69%。紫红2号MYB10和UFGT等转录因子及花青苷合成基因在果实发育后期(花后110—125 d)均具有较高的表达量;红脆4号的MYB10虽然在果实发育后期(花后110—125 d)表达量较高,但bHLH3、TTG1、ANS和UFGT表达量较低。红脆1、2、4号类黄酮组分含量分别为2 355.0、1 247.5和1 337.5 mg·kg-1,差异显著;红脆1号MYB12转录因子及FLS、LAR和ANR等类黄酮生物合成相关结构基因表达量较高,而MYB16和MYB111表达量较低;红脆2、4号MYB12转录因子及FLS、LAR和ANR等类黄酮生物合成相关结构基因表达量较低,而MYB16和MYB111转录因子表达量较高。【结论】MYB10、bHLH3和TTG1等转录因子及ANS和UFGT等花青苷生物合成结构基因在果实发育后期高水平表达,可能是导致紫红2号成熟期果肉花青苷含量高的主要原因,而MYB12、MYB16和MYB111等转录因子及DFR、FLS、LAR和ANR类黄酮生物合成相关结构基因的差异表达,可能是导致红脆1、2、4号等3个株系类黄酮组分及含量差异的主要原因。
新疆红肉苹果;杂交后代;类黄酮;MYB10 ;基因表达分析
0 引言
【研究意义】苹果果实含有较高比例、人体比较容易吸收利用的游离多酚,营养保健价值高,在预防心脑血管疾病、抗肿瘤及抗氧化等方面有较好的作用,世界上许多国家都大力推荐其为主要消费果品[1-2]。中国是世界苹果生产和消费大国,大多为‘富士’,且主要用于鲜食[3]。因此,围绕新疆野苹果及其红肉变型(Malus sieversii f.neidzwetzkyana(Dieck)Langenf.)等苹果资源的科学保护与持续高效利用及栽培苹果品种遗传多样性的拓展,开展功能型苹果育种具有重要意义[4]。【前人研究进展】有关苹果类黄酮及其代谢机理的研究在近几年取得了较大的进展。已报道的苹果果实类黄酮达34种,分属黄烷醇、黄酮醇、二氢查尔酮、花青苷和二氢黄酮醇等5类[5]。有关苹果类黄酮生物合成与调控机理的研究主要集中在花青苷上,目前已克隆、鉴定了CHS、ANS、UFGT等结构基因[6];在苹果转录因子方面,有研究发现 MdMYB1和(MdMYBA)受光照诱导,能够调控果皮花青苷的合成,并从苹果中克隆鉴定了5个MdMYB1等位基因MdMYB1-1—5[7-9];随后,有研究表明MdMYB10转录因子能够调控苹果叶片和果肉的红色发育,并且其调控活性需要转录因子MdbHLH3和MdbHLH33的参与[10-11];AN等[12]研究发现,苹果 MdTTG1仅与bHLH蛋白存在直接相互作用,而无法与 MdMYB1发生互作。TELIAS等[13]研究表明,‘蜜脆’苹果品种着色模式(条红与晕红)的可变性主要是由于MYB10启动子区甲基化的不稳定性;ESPLEY等[14]研究发现,红肉苹果品种‘Red Field’MdMYB10启动子由于6个23 bp重复序列的插入,使得MdMYB10具有自激活特性和组成型表达,枝、叶、花及果实各部分均为红色,并将这种含有6个重复序列的启动子基因型命名为R6;而叶片和果心均为绿(白)色、仅果实外皮层组织为红色的‘Sangrado’和‘jpp35’苹果品种,则由MdMYB10同源基因MdMYB110a和MdMYB110a-jp调控其红色部位花青苷的合成[15-16],上述研究结果表明,不同苹果品种的转录调控机理存在明显差异。【本研究切入点】新疆野苹果及其红肉变型不仅是苹果品质育种的重要基因库,同时也是世界栽培苹果的祖先种[17-18]。但新疆野苹果资源正遭到严重破坏,濒临灭绝[19];为此,笔者课题组在群体遗传结构等相关研究的基础上,于2006年率先构建了新疆红肉苹果与栽培苹果品种的杂种分离群体[20-25]。张芮等[26]研究结果表明,杂种后代绵、脆肉株系果实质地发育受乙烯调控;JI等[27-28]探讨了激素和氮对愈伤组织花青苷生物合成的影响,并对红色和黄色愈伤组织进行了RNA-seq分析,而WANG等[29]则对F1分离群体中的红色和绿色单株各20株进行了RNA-seq分析,筛选到了与类黄酮合成(图 1)相关的差异表达基因,而有关红肉株系间类黄酮差异和果肉着色的分子机理尚有待研究。【拟解决的关键问题】本研究以紫红2号及红脆1、2、4号等红肉程度存在明显差异的4个株系发育后期的果实为试材(图2),进行MYB10启动子类型鉴定,并测定类黄酮和组分含量及相关基因的相对表达量,旨在为进一步完善功能型苹果育种的理论与技术体系提供参考。
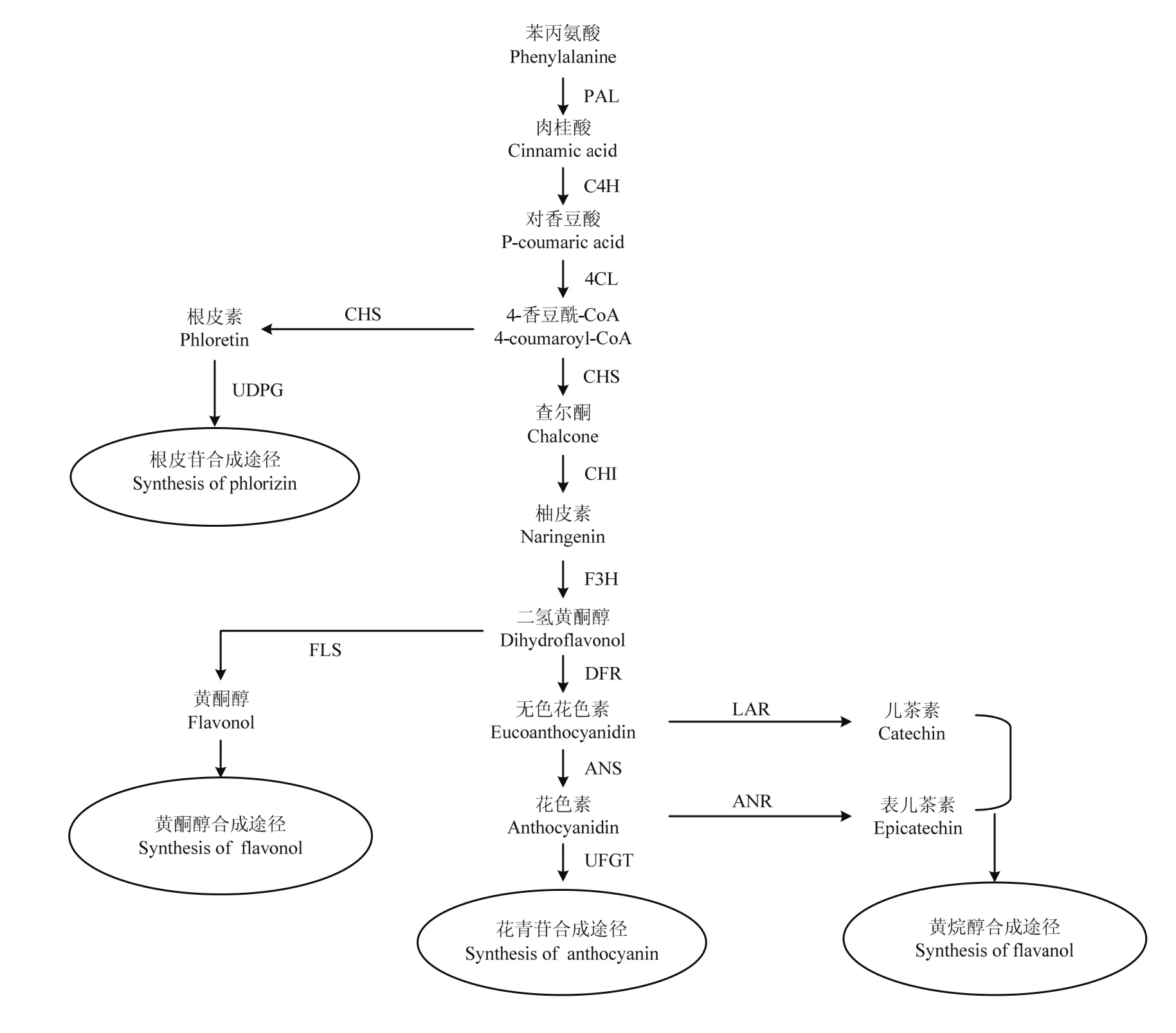
图1 苹果类黄酮代谢途径[30-31]Fig. 1 Metabolic pathway of flavonoid in apple[30-31]

图2 4个苹果株系成熟期截面图Fig. 2 Sectional drawing of 4 apple strains in the mature period
1 材料与方法
试验于 2012—2015年在山东农业大学作物生物学国家重点实验室及泰安市横岭果树育种基地进行。
1.1 植物材料及试剂
1.1.1 植物材料 从新疆红肉苹果(Malus sieversii f. neidzwetzkyana)中的‘塔尔阿尔玛’与‘烟富3号’(M. domestica cv. Fuji)杂种一代选育出紫红2号及红脆1、2、4号等红肉程度存在明显差异的4个株系,以其发育后期(近成熟期)的果实(图 2)为试材,从果实近成熟期到果实完全成熟期,共采3次样,分别为花后110、117和125 d。每次采样均采10个果实,用液氮研磨成粉后,分装成3份作为重复,在-80℃保存备用。
1.1.2 试剂盒及菌株等 DNA提取试剂盒、RNA提
取试剂盒、反转录试剂盒、SYBR染料、phusion高保真DNA扩增酶、琼脂糖凝胶回收试剂盒、零背景快速克隆试剂盒、DH5α感受态细胞均购自天根生化科技北京有限公司,芦丁标准品(rutin;Sigma chemical,St,Louis,USA,≥98%)。
1.2 试验方法
1.2.1 MYB10启动子基因型鉴定及序列分析基因的启动子序列为2 000 bp左右,以NCBI中登录号为 AB557643.1的序列为模板,设计上下游引物分别为F:5′-CAATGTGTTAGGTGTAGCGT-3′,R:5′-CAGAAGCAAACACTGACAAG-3′。以红脆1、2、4号及紫红2号果肉的DNA为模板,phusion高保真酶扩增,琼脂糖凝胶电泳鉴定MYB10启动子类型,胶回收后,按照天根零背景快速克隆试剂盒做连接、转化,摇菌活化涂板,挑取单克隆,菌液PCR鉴定选择6个阳性克隆测序。测序后序列比对采用ClustalX2软件[32],每个克隆间测序结果一致。
1.2.2 花青苷含量的测定 参考冯守千等[33]的方法,取0.5 g克果肉液氮研磨成粉后,用10 mL 1%HCl/甲醇于4℃浸提4 h,12 000 r/min离心10 min,取上清液用分光光度计测定提取液在553 nm和600 nm处吸光值。以每g果肉鲜质量的提取液的吸光度变化值D553-D600=0.01作为1个花青苷单位,以U表示。
1.2.3 类黄酮含量的测定 参考JIA[34]的方法,称取1 g果肉,用液氮研磨成粉后,加入10 mL 65%预冷的乙醇,4℃避光浸提4 h,12 000 r/min离心 20 min,保留上清。吸取0.5 mL上清液于试管中,按顺序分别加入 1 mL NaNO2(5%)、1 mL Al(NO3)3(10%),4 mL NaOH(2 mol·L-1),混匀静置15 min,在510 nm下测定吸光值(以80%乙醇作为空白对照)。以芦丁为标样制作标准曲线,类黄酮含量表示为mg芦丁·g-1FW。重复3次,操作步骤同上。
1.2.4 类黄酮组分的测定 参考陈学森等[4]的方法,去除果皮,称取10 g用液氮研磨成粉的果肉,加入50 mL 0.5%盐酸甲醇溶液,4℃浸提2 h,过滤,滤液4℃暂时避光保存,残渣加入50 mL 0.5%盐酸甲醇溶液,4℃浸提1 h,过滤,合并滤液后37℃旋蒸去除丙酮,残留部分5 000 r/min离心,上清液用甲醇定溶至10 mL。取5 mL定容后的溶液,用购自Waters公司的C18Sep-Pak小柱进行纯化[35]。进样前,所有流动相和样品均过0.22 μm的有机滤膜。
液相色谱条件:色谱仪(WATERS ACQUITY UPLC)采用BEH C18柱(100 mm×2.1 mm)为色谱柱,1.7 μm填料粒径,柱温45℃,进样体积1 μL。流动相:已过滤的乙腈(A),体积分数为0.2%的甲酸溶液(B);梯度:A:0—0.1 min 5%;A:20 min,20%;A:22 min,80%;A:22.1 min,5%;A:25 min,5%,流速为0.3 mL·min-1。350 nm下分析黄酮醇类物质,在280 nm下分析黄烷醇和二氢查尔酮类物质。为确定各类物质在紫外-可见光下的吸收特征,采用WATERS ACQUITY PDA检测器,PAD扫描波长范围200—700 nm。
1.2.5 实时荧光定量PCR 荧光定量PCR仪型号为伯乐 CFX96,荧光定量 PCR 反应体系按 SYBR® Green PCR Master Mix 说明书配制,每个样品设3个重复。反应体系为20 μL:10 μL 2.5×RealMasterMix/ 20×SYBR Solution,1 μL cDNA(50 ng·μL-1),上下游引物各1 μL(5 μmol·L-1),7 μL ddH2O。反应条件如下:①95.0℃预变性30 s;②95.0℃变性5 s;③58℃退火10 s;④72.0℃延伸30 s(②—④共45个循环);⑤65℃孵育20 s;⑥溶解温度从55℃到95℃,每升高0.5℃保持1 s;⑦停止反应。以MdActin为内参,每个基因扩增均有内参同时扩增,默认条件下读取Ct值,采用2-ΔΔCT方法[36]进行数据分析。
1.3 荧光定量引物设计
CHI、F3H、DFR、ANR、UFGT、bHLH3、Actin荧光定量引物参考文献[37],MYB12荧光定量引物参考文献[38],FLS(AF119095)、LAR(AY830131)、ANS(DQ139835)、MYB10(EU518249.2)、TTG1 (GU173814.1)、MYB16(HM122617.1)、MYB111 (HM122615.1)利用Beacon Designer7(http://www.premierbiosoft.com/molecular_beacons/)设计荧光定量引物(表1)。
1.4 数据分析
采用Excel进行数据处理和作图,用DPS 7.05软件(http://www.chinadps.net)进行显著性检验。
2 结果
2.1 4个苹果株系MYB10启动子基因型鉴定
4个苹果株系MYB10启动子基因型鉴定结果见图3、4、5、6。图3(DNA Marker为天根D2000)显示红脆1、2、4号琼脂糖凝胶电泳为两条带,紫红2号为一条带;图4显示红脆1、2、4号和紫红2号在 659—681 bp有一个 23 bp重复序列(GTTAGACTGGTAGCTATTAACAA)[14],紫红2号在520—630 bp比红脆1、2、4号多5个重复序列;图5显示,红脆1、2、4号R6与紫红2号R6基本一致,均含有 6个重复序列。因此,根据 R6型的序列(图6),推测红脆1、2、4号MYB10启动子为R6R1型,而紫红2号MYB10启动子类型为R6R6型。
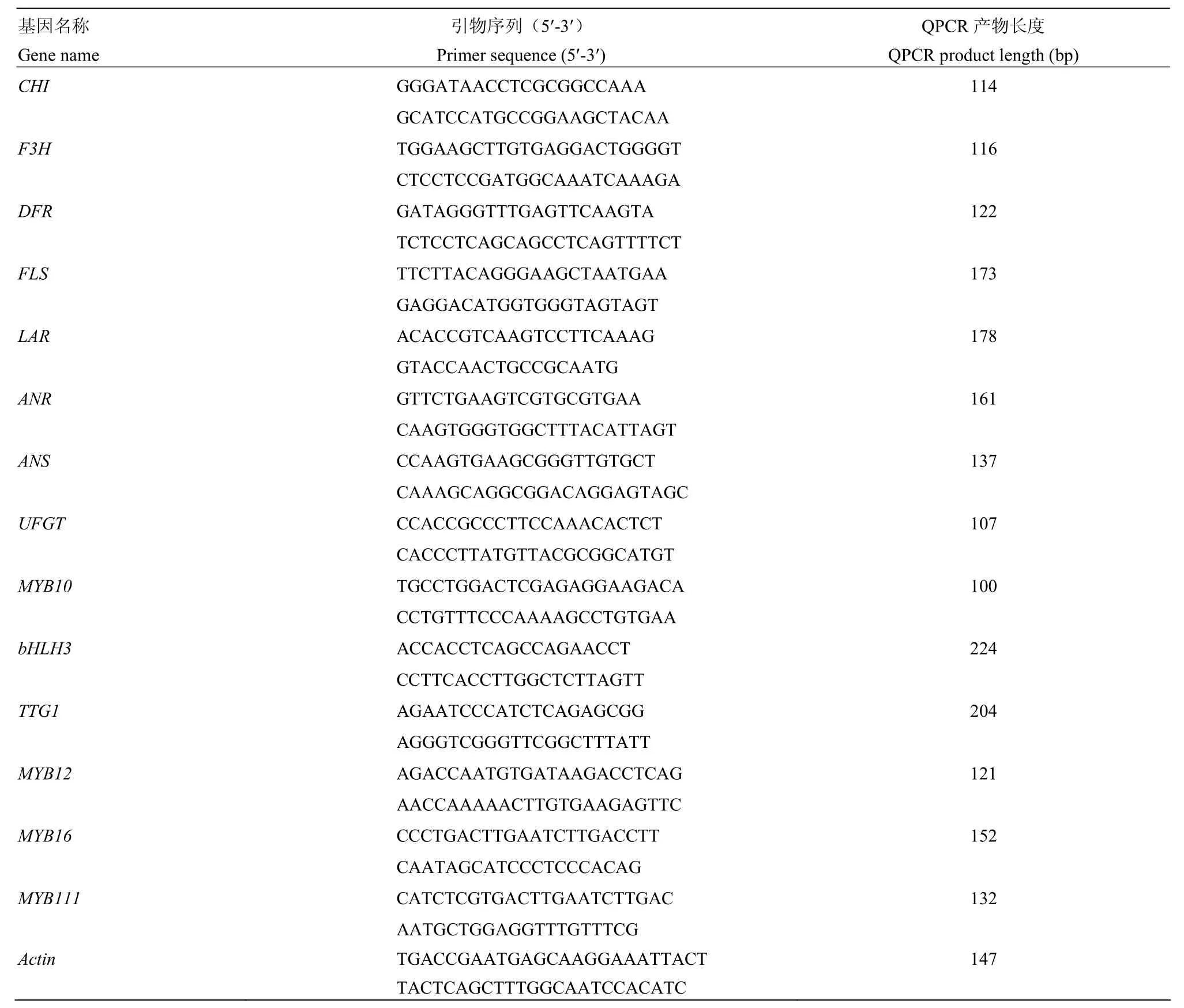
表1 苹果类黄酮生物合成相关基因qPCR扩增引物序列Table 1 Primer sequence for qPCR amplification of flavonoids -biosynthesis genes in apple fruit
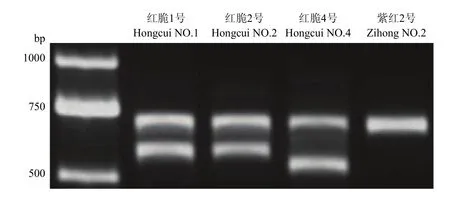
图3 4个苹果株系果实MYB10启动子基因型鉴定Fig. 3 Genotype of MYB10 promoter in 4 apple strains

图4 红脆1、2、4号MYB10启动子R1序列与紫红2号R6序列比对结果Fig. 4 Sequence alignment consequence of MYB10 promoter in R1 of Hongcui NO.1、2、4 and R6 of Zihong NO. 2
2.2 4个苹果株系果实发育后期类黄酮、类黄酮组分及花青苷含量
由图7可以看出,在果实近成熟期(花后110—125 d),红脆1号和紫红2号果实类黄酮含量总体呈上升趋势,其中成熟期(花后125 d),二者果实类黄酮含量分别为(3.0±0.16)mg·g-1和(3.1±0.18)mg·g-1;而红脆2号和红脆4号果实类黄酮含量总体呈下降趋势,其中成熟期(花后125 d),二者果实类黄酮含量分别仅为(2.1±0.05)mg·g-1和(1.9±0.08)mg·g-1,红脆1号和紫红2号与红脆2号和红脆4号差异极显著(P<0.01)。由图8可以看出,4个株系果实发育后期花青苷含量存在极显著差异(P<0.01),在成熟期紫红2号最高(23.9±0.63 U·g-1FW),红脆1号、红脆4号和红脆2号分别为(12.2±0.37)、(7.5±0.43)和(2.2±0.14)U·g-1FW。

图5 红脆1、2、4号MYB10启动子R6序列与紫红2号R6序列比对结果Fig. 5 Sequence alignment consequence of MYB10 promoter in R6 of Hongcui NO.1, 2, 4 and R6 of Zihong NO.2

图6 R6型MYB10启动子6个重复序列[14]Fig. 6 6 repeat sequences of R6 promoter in MYB10[14]
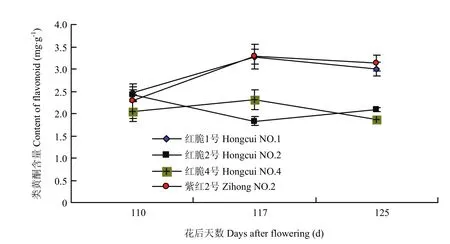
图7 4个苹果株系发育后期类黄酮含量变化Fig. 7 Change of flavonoid contents in 4 apple strains during the latter growth period
4个苹果株系成熟期果实除花青苷之外的其他类黄酮组分及其含量的HPLC检测结果见表2(合计为每个样品每个重复值对应相加后的平均值)。由表2可以看出,4个功能型苹株系成熟期果实类黄酮组分及其含量存在明显差异,其中从红脆1号成熟果实中检测到黄烷醇、二氢查尔酮和黄酮醇等 3类11种组分,总含量高达(2 355.01±15.9)mg·kg-1,而红脆 2号成熟果实中检测到黄烷醇、二氢查尔酮和黄酮醇等3类8种组分,总含量仅为(1 247.4± 12.4)mg·kg-1。
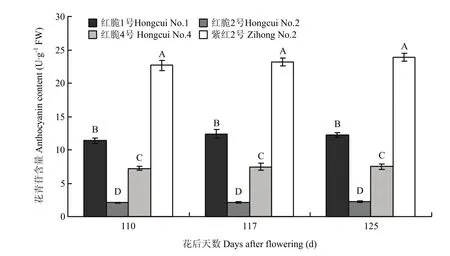
图8 4个苹果株系发育后期花青苷含量变化Fig. 8 Change of anthocyanin contents in 4 apple strains during the latter growth period
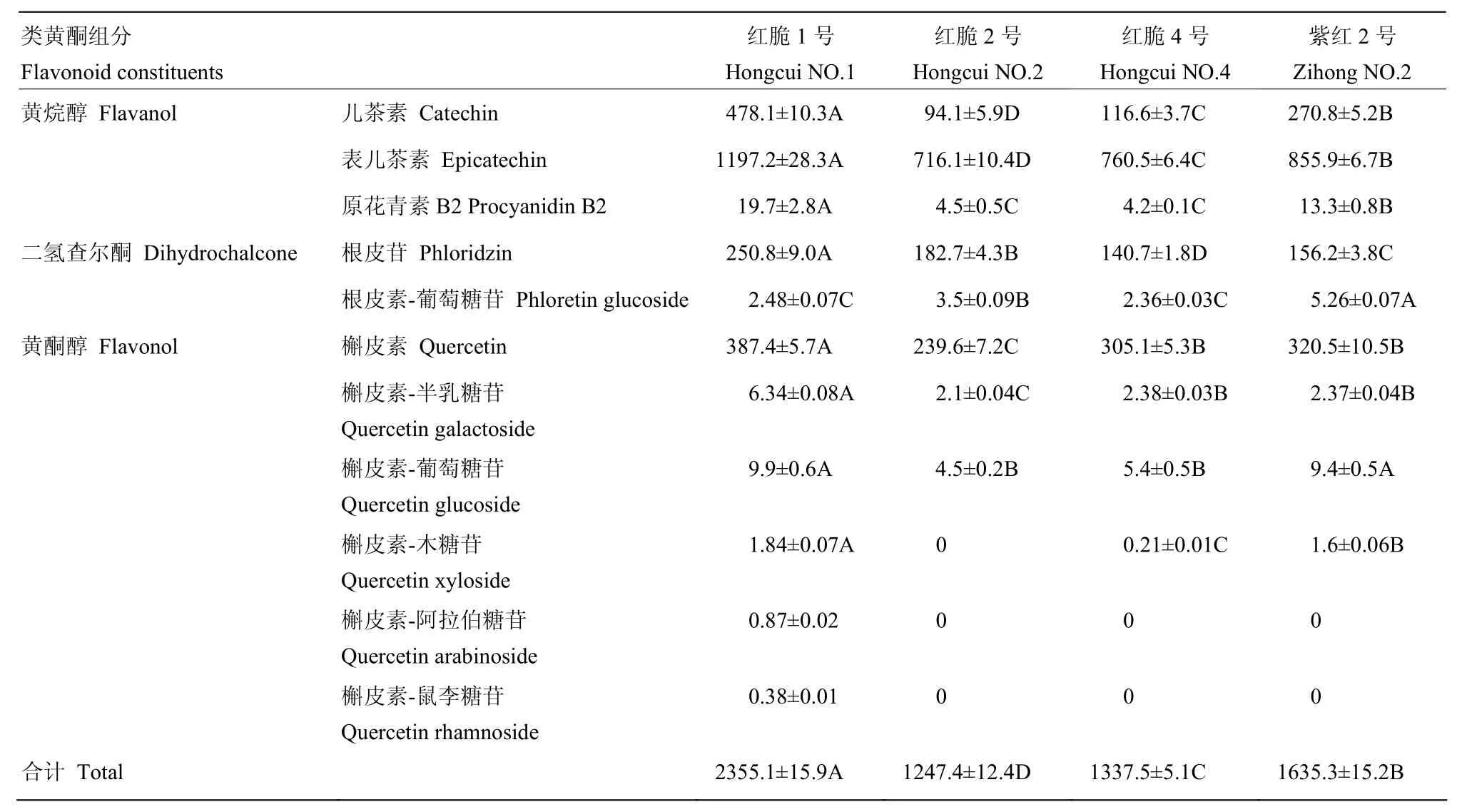
表2 4个苹果株系成熟期果肉类黄酮组分及其含量Table 2 Comparison in composition and content of flavonoid among 4 apple strain’s flesh in the mature period (mg·kg-1)
2.3 4个苹果株系果实发育后期类黄酮生物合成相关结构基因和转录因子的表达分析
由图9、10可以看出,紫红2号MYB10、bHLH3、TTG1等转录因子及花青苷合成相关基因 ANS和UFGT在果实发育后期(花后110—125 d)均具有较高的表达量,而CHI、F3H、DFR、FLS、LAR等6个类黄酮生物合成相关结构基因表达量较低;红脆4号的MYB10虽然在果实发育后期(花后110—125 d)表达量较高,但bHLH3、TTG1、ANS和UFGT均表达量较低;红脆1号MYB12转录因子及FLS、LAR和ANR等类黄酮生物合成相关结构基因表达量较高,而MYB16和MYB111表达量较低;红脆2、4号MYB12转录因子及FLS、LAR和ANR等类黄酮生物合成相关结构基因表达量较低,而 MYB16和MYB111转录因子表达量较高。
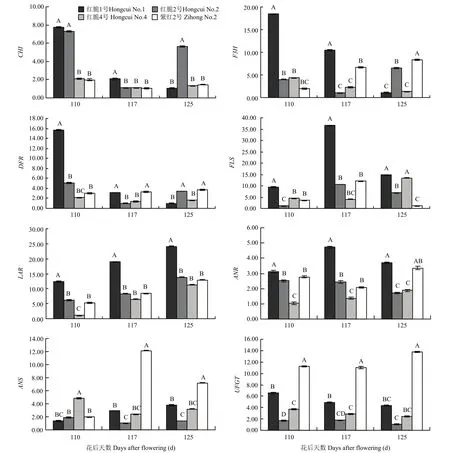
图9 4个苹果株系果实发育后期相关结构基因表达量的变化Fig. 9 Changes of expression of structure-related genes in 4 functional apple strains during the latter period
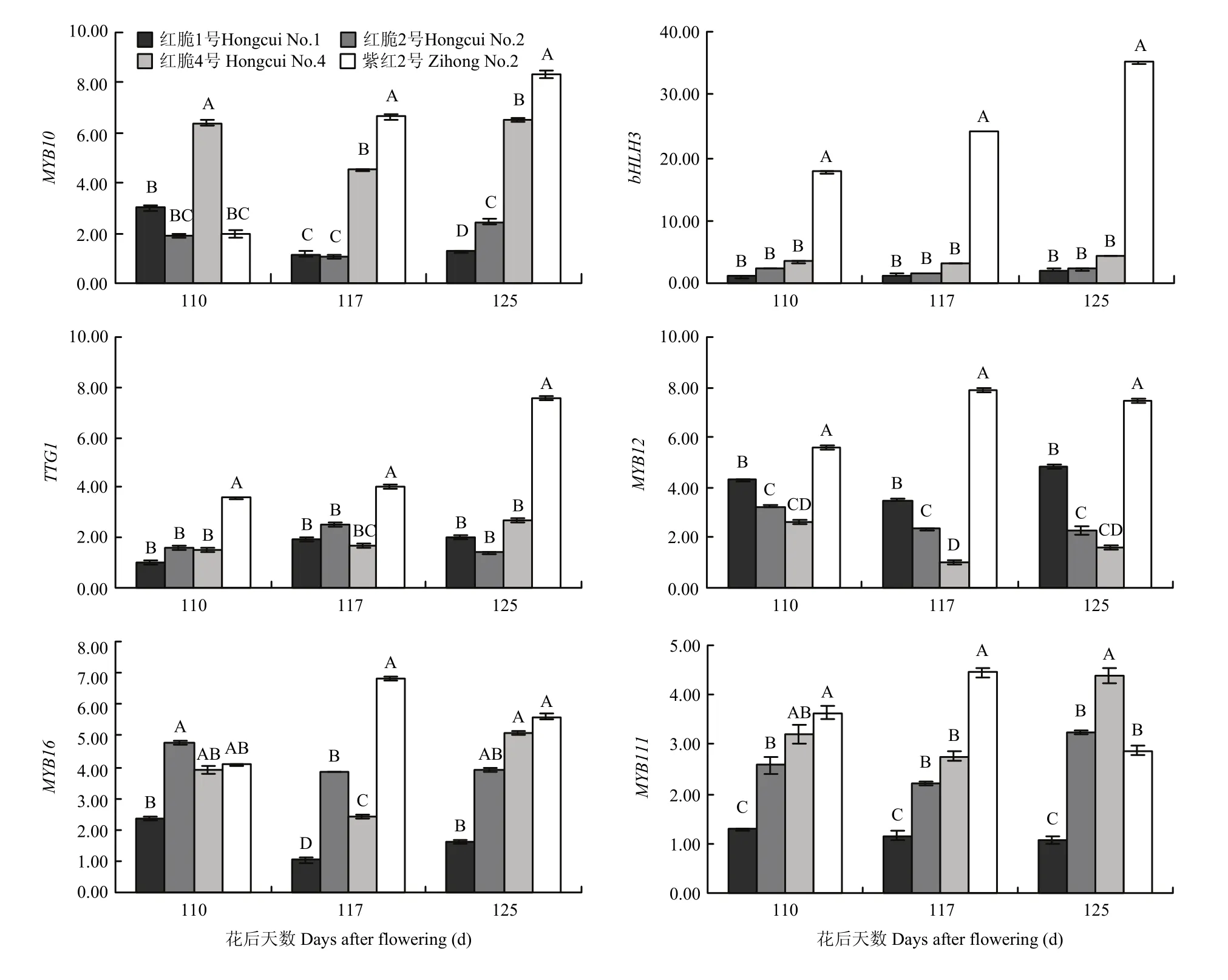
图10 4个苹果株系果实发育后期相关转录因子基因表达量的变化Fig. 10 Changes of expression of transcription factors-related genes in 4 functional apple strains during the latter period
3 讨论
3.1 苹果果实花青苷合成差异及其与相关结构基因和转录因子的关系
花青苷与苹果多种组织器官的呈色有关[39],同时在人类医疗保健方面有重要的营养价值和药理作用[40-41]。花青苷合成是类黄酮合成途径的一个分支,其合成代谢涉及多个结构基因、转录因子以及紫外辐射、干旱、低温、茉莉酸、蔗糖、低氮等环境信号的诱导[42-43]。在苹果花青苷合成途径中,结构基因ANS和UFGT对苹果花青苷的合成具有决定性作用[44-45];在苹果转录因子方面,MdMYB10能够调控果肉的颜色,其调控活性需要转录因子 MdbHLH3 和MdbHLH33的参与,且MdMYB10具有自激活特性[10,14];AN[12]及 BRUEGGEMANN[46]等研究发现,MYB、bHLH和WD40转录因子能够形成MBW复合体促进花青苷的合成,但 MdTTG1仅与 bHLH类(MdbHLH3和MdbHLH33)转录因子相互作用,而无法与 MdMYB1发生互作。上述研究结果表明,MdMYB10(MdMYB1)、bHLH和MdTTG1是苹果花青苷生物合成的主要转录调控因子。
在本研究中,从‘红富士’(R1R1)等苹果品种与新疆红肉苹果(R6R1)杂种一代群体选育的紫红2号,MYB10启动子基因型为R6R6型,在参试的4个株系中红肉程度最大,果肉深红色,成熟期果实花青苷含量(23.9 U·g-1FW)是红脆1号(12.2 U·g-1FW)的2倍,MYB10、bHLH3、TTG1等转录因子及ANS 和UFGT等花青苷合成关键基因在果实发育后期(花后110—125 d)均具有较高的表达量;MYB10启动子类型为R6R1型的红脆4号,虽然在果实发育后期(花后110—125 d)MYB10表达量较高,但bHLH3、TTG1、ANS和UFGT表达量较低。因此,其成熟期果实花青苷含量(7.5 U·g-1FW)仅是紫红2号的31.4%。上述研究结果表明,MdMYB10、bHLH和MdTTG1是紫红2号苹果花青苷生物合成的关键转录调控因子,这与已有的研究结果一致。因此,进一步探讨MdMYB10、bHLH和MdTTG1在调控紫红2号苹果花青苷生物合成进程中的互作关系是今后研究的重要切入点。
STEVEN等[47]对4个资源圃的3 000份红肉苹果种质资源进行了MYB10启动子类型的鉴定和分类,其中包含了栽培种、野生种和杂交种,结果发现,几个R6R1类型的果肉深红,而R6R6类型的果肉却只是轻微粉红,表明 R6位点起作用也要取决于它们的遗传背景,具体有待进一步研究。
3.2 苹果果实类黄酮含量和组分差异及其与相关结构基因和转录因子的关系
已报道的苹果果实类黄酮达34种,分属黄烷醇、黄酮醇、二氢查尔酮、花青苷和二氢黄酮醇等5类[4]。张小燕等[20]研究发现,新疆野苹果多酚物质含量的遗传多样性极为丰富,总酚及主要多酚物质含量显著高于‘红星’苹果品种,表现出明显的高黄酮特性。聂继云等[48]研究发现,冬红果和山荆子等 22种苹果属野生种质资源的果实总黄酮含量均明显高于栽培品种。
除了花青苷之外,有关苹果黄烷醇及黄酮醇生物合成及调控机理的研究报道相对较少。LIN-WANG等[49]将 MdMYB16和 MdMYB111转入过表达 bHLH3+ MdMYB10的烟草叶片中,发现能够抑制DFR启动子的活性,认为MdMYB16和MdMYB111属于苹果类黄酮代谢途径的负调控因子;周兰等[38]在苹果中克隆出与拟南芥 AtMYB12同源的 MdMYB12,其功能与AtMYB12相同,都能够促进黄酮醇的合成,认为MdMYB12是苹果类黄酮代谢途径的正调控因子;AN等[50]发现,苹果MdMYB9和MdMYB11能够促进原花青素的合成;WANG等[29]则对新疆红肉苹果F1分离群体中的红色和绿色单株各 20株进行了RNA-seq分析,筛选到了与类黄酮合成相关的差异表达基因,推测MdMYB12和MdMYB6可能参与了类黄酮代谢途径。
在本研究中,紫红2号和红脆1号果实成熟期类黄酮含量相当,分别为3.0 mg·g-1和3.1 mg·g-1,但紫红2号花青苷含量(23.9 U·g-1FW)是红脆1号(12.2 U·g-1FW)的2倍,黄烷醇和黄酮醇等类黄酮组分含量(1 635.3 mg·kg-1)仅是红脆1号(2 355.0 mg·kg-1)的69%,而紫红2号FLS、LAR及ANR等类黄酮生物合成结构基因的低表达水平可能是其类黄酮组分含量低的主要原因;HAN等[51]研究发现,苹果MdANR在转基因烟草中过表达,导致儿茶素和表儿茶素(黄烷醇)含量增加,而抑制了CHI和DFR的表达及花青苷的合成;因此,紫红2号MYB10、bHLH3、TTG1等转录因子及ANS和UFGT等花青苷合成关键基因在果实发育后期的高水平表达,可能是FLS、LAR及ANR等类黄酮生物合成结构基因表达量低的主要原因,其调控关系有待进一步研究。
红脆1、2、4号的MYB10启动子基因型均为R6R1,类黄酮组分含量分别为 2 355.0 mg·kg-1、1 247.5 mg·kg-1和1 337.5 mg·kg-1,差异显著;红脆1号MYB12、CHI、F3H、DFR、FLS、LAR和ANR等转录因子及类黄酮生物合成相关结构基因表达量较高,而MYB16 和MYB111表达量较低;红脆2、4号MYB12表达量较低,而MYB16和MYB111表达量较高。因此,MYB12、MYB16和MYB111等转录因子及DFR、FLS、LAR和ANR类黄酮生物合成相关结构基因的差异表达,可能是导致MYB10启动子基因型均为R6R1型的红脆1、2、4号等3个株系类黄酮及组分含量差异的主要原因。进一步探讨MYB12、MYB16和MYB111等转录因子在功能型苹果株(品)系类黄酮生物合成中的调控机理,是今后研究的重要切入点之一。
4 结论
红脆1、2、4号的MYB10启动子基因型均为R6R1,而紫红2号MYB10启动子类型为R6R6型。紫红2号和红脆1号果实成熟期类黄酮含量相当,但紫红2号花青苷含量是红脆1号的2倍。MYB10、bHLH3和TTG1等转录因子及ANS和UFGT等花青苷生物合成结构基因在果实发育后期的高水平表达,可能是导致紫红 2号成熟期果肉花青苷含量高的主要原因;而MYB12、MYB16和MYB111等转录因子及DFR、FLS、LAR和 ANR类黄酮生物合成相关结构基因的差异表达,可能是导致MYB10启动子基因型均为R6R1型红脆1、2、4号等3个株系类黄酮及组分含量差异的主要原因。
References
[1] 陈学森, 韩明玉, 苏桂林, 刘凤之, 过国南, 姜远茂, 毛志泉, 彭福田, 束怀瑞. 当今世界苹果产业发展趋势及我国苹果产业优质高效发展意见. 果树学报, 2010, 27(4): 598-604. CHEN X S, HAN M Y, SU G L, LIU F Z, GUO G N, JIANG Y M,MAO Z Q, PENG F T, SHU H R. Discussion on today’s world apple industry trends and the suggestions on sustainable and efficient development of apple industry in China. Journal of Fruit Science,2010, 27(4): 598-604. (in Chinese)
[2] 陈学森, 郭文武, 徐娟, 丛佩华, 王力荣, 刘崇怀, 李秀根, 吴树敬,姚玉新, 陈晓流. 主要果树果实品质遗传改良与提升实践. 中国农业科学, 2015, 48(17): 3524-3540. CHEN X S, GUO W W, XU J, CONG P H, WANG L R, LIU C H, LI X G, WU S J, YAO Y X, CHENX L. Genetic improvement and promotion of fruit quality of main fruit trees. Scientia Agricultura Sinica, 2015, 48(17): 3524-3540. (in Chinese)
[3] VRHOVSEK U, RIGO A, TONON D, MATTIVI F. Quantitation of polyphenols in different apple varieties. Journal of Agricultural and Food Chemistry, 2004, 52(21): 6532-6538.
[4] 陈学森, 张晶, 刘大亮, 冀晓昊, 张宗营, 张芮, 毛志泉, 张艳敏,王立霞, 李敏. 新疆红肉苹果杂种一代的遗传变异及功能型苹果优株评价. 中国农业科学, 2014, 47(11): 2193-2204. CHEN X S, ZHANG J, LIU DA L, JI X H, ZHANG Z Y, ZHANG R,MAO Z Q, ZHANG Y M, WANG L X, LI M. 2014. Genetic variation of F1 population between Malus sieversii f. neidzwetzkyana and apple varieties and evaluation on fruit characters of functional apple excellent strains. Scientia Agricultura Sinica, 2014, 47(11):2193-2204. (in Chinese)
[5] 聂继云, 吕德国, 李静, 刘凤之, 李萍. 苹果果实中类黄酮化合物的研究进展. 园艺学报, 2009, 36(9): 1390-1397. NIE J Y, LÜ D G , LI J, LIU F Z, LI P. Advances in studies on flavonoids in apple fruit. Acta Horticulturae Sinica, 2009, 36(9):1390-1397. (in Chinese)
[6] CHIKAKO H, NOBUHIRO K, MASATO W, SATORU K, SHOZO K, JUNICHI S, ZILIAN Z, TOMOMI T, TAKAYA M. Anthocyanin biosynthetic gene are coordinately expressed during red coloration in apple skin. Plant Physiology and Biochemistry, 2002, 40: 955-962.
[7] TAKOS A M, JAFFÉ F W, JACOB S R, BOGS J, ROBINSON S P,WALKER A R. Light-induced expression of a MYB gene regulates anthocyanin biosynthesis in red apples. Plant Physiology, 2006,142(3): 1216-1232.
[8] BAN Y, HONDA C, HATSUYAMA Y, IGARASHI M, BESSHO H,MORIGUCHI T. Isolation and functional analysis of a MYB transcription factor gene that is a key regulator for the development of red coloration in apple skin. Plant and Cell Physiology, 2007, 48:958-970.
[9] SEKIDO K, YAMADA K, SHIRATAKE K, FUKUI H, MATSUMOTO S. MdMYB alleles responsible for apple skin and flesh color. Current Topics in Plant Biology, 2010, 11: 17-21.
[10] ESPLEY R V, HELLENS R P, PUTTERILL J, STEVENSON D E,KUTTY-AMMA S, ALLAN A C. Red colouration in apple fruit is due to the activity of the MYB transcription factor MdMYB10. The Plant Journal, 2007, 49: 414-427.
[11] XIE X B, LI S, ZHANG R F, ZHAO J, CHEN Y C, ZHAO Q, YAO Y X, YOU C X, ZHANG X S, HAO Y J. The bHLH transcription factor MdbHLH3 promotes anthocyanin accumulation and fruit colouration in response to low temperature in apple. Plant, Cell and Environment, 2012, 35: 1884-1897.
[12] AN X H, TIAN Y, CHEN K Q, WANG X F, HAO Y J. The apple WD40 protein MdTTG1 interacts with bHLH but not MYB proteins to regulate anthocyanin accumulation. Journal of Plant Physiology, 2012,169(7): 710-717.
[13] TELIAS A, LIN-WANG K, STEVENSON D E, COONEY J M,HELLENS R P, ALLAN A C, HOOVER E E, BRADEEN J M. Apple skin patterning is associated with differential expression of MYB10. BMC Plant Biology, 2011, 11: 93.
[14] ESPLEY R V, BRENDOLISE C, CHAGNÉ D, KUTTY-AMMA S,GREEN S, VOLZ R, PUTTERILL J, SCHOUTEN H J, GARDINER S E, HELLENS R P, ALLAN A C. Multiple repeats of a promoter segment causes transcription factor autoregulation in red apples. The Plant Cell, 2009, 21: 168-183.
[15] CHAGNÉ D,LIN-WANG K,ESPLEY R V,VOLZ R K,HOW N M,ROUSE S,BRENDOLISE C,CARLISLE C M,KUMAR S, DE SILVAN,MICHELETTI D, GHIE T, ROWHURST R N, TOREY D,LASCO R, ENS R P, INER S E. An ancient duplication of apple MYB transcription factors is responsible for novel red fruit-flesh phenotypes. Plant Physiology, 2013, 161: 225-239.
[16] UMEMURA H, OTAGAKI S, WADA M, KONDO S,MATSUMOTO S. Expression and functional analysis of a novel MYB gene, MdMYB110a_JP, responsible for red flesh, not skin colorin apple fruit. Planta, 2013, 238: 65-76.
[17] NOCKER S V, BERRY G, NAJDOWSKI J, MICHELUTTI R,LUFFMAN M, FORSLINE P, ALSMAIRAT N, BEAUDRY R,NAIR M G, ORDIDGE M. Genetic diversity of red-fleshed apples (Malus). Euphytica, 2012, 185: 281-293.
[18] CHEN X S, FENG T, ZHANG Y M, HE T M, FENG J R, ZHANG C Y. Genetic diversity of volatile components in Xinjiang wild apple (Malus sieversii). Journal of Genetic and Genomics, 2007, 34(2):171-179.
[19] 冯涛, 张艳敏, 陈学森. 新疆野苹果居群年龄结构及郁闭度研究.果树学报, 2007, 24(5): 571-573. FENG T, ZHANG Y M, CHEN X S. Study on the age structure and density of the wild apple forest of Malus sieversii. Journal of Fruit Science, 2007, 24(5): 571-573. (in Chinese)
[20] 张小燕, 陈学森, 彭勇, 王海波, 石俊, 张红. 新疆野苹果酚类物质组分的遗传多样性. 园艺学报, 2008, 35(9): 1351-1356. ZHANG X Y, CHEN X S, PENG Y, WANG H B, SHI J, ZHANG H. Genetic diversity of phenolic compounds in Malus sieversii. Acta Horticulturae Sinica, 2008, 35(9): 1351-1356. (in Chinese)
[21] 张小燕, 陈学森, 彭勇, 王海波, 石俊, 张红. 新疆野苹果矿质元素与糖酸组分的遗传多样性. 园艺学报, 2008, 35(2): 277-280. ZHANG X Y, CHEN X S, PENG Y, WANG H B, SHI J, ZHANG H. Genetic diversity of mineral elements, sugar and acid components in Malus sieversii (Ldb.) Roem. Acta Horticulturae Sinica, 2008, 35(2):277-280. (in Chinese)
[22] ZHANG C Y, CHEN X S, HE T M, LIU X L, FENG T, YUAN Z H. Genetic structure of Malus sieversii population from Xinjiang, China,revealed by SSR markers. Journal of Genetics and Genomics, 2007,34(10): 947-955.
[23] 张艳敏, 冯涛, 张春雨, 何天明, 张小燕, 吴传金, 刘遵春, 王艳玲,束怀瑞, 陈学森. 新疆野苹果研究进展. 园艺学报, 2009, 36(3):447-452. ZHANG Y M, FENG T, ZHANG C Y, HE T M, ZHANG X Y, WU C J, LIU Z C, WANG Y L, SHU H R, CHEN X S. Advances in research of the Malus sieversii (Lebed.) Roem. Acta Horticulturae Sinica, 2009, 36(3): 447-452. (in Chinese)
[24] 冯涛, 张红, 陈学森, 张艳敏, 何天明, 冯建荣, 许正. 新疆野苹果果实形态与矿质元素含量多样性以及特异性状单株. 植物遗传资源学报, 2006, 7(3): 270-276. FENG T, ZHANG H, CHEN X S, ZHANG Y M, HE T M, FENG J R,XU Z. Genetic diversity of fruit morphological traits and content of mineral element in Malus sieversii (Ldb.) Roem and its elite seedlings. Journal of Plant Genetic Resources, 2006, 7(3): 270-276. (in Chinese)
[25] 王延玲, 张艳敏, 冯守千, 宋杨, 徐玉亭, 张友朋, 陈学森. 新疆红肉苹果果皮果肉呈色差异机理. 中国农业科学, 2012, 45(13):2771-2778. WANG Y L, ZHANG Y M, FENG S Q, SONG Y, XU Y T, ZHANG Y P, CHEN X S. The mechanism of red coloring difference between skin and cortex in Malus sieversii f. neidzwetzkyana (Dieck) Langenf. Scientia Agricultura Sinica, 2012, 45(13): 2771-2778. (in Chinese)
[26] 张芮, 张宗营, 高利平, 冀晓昊, 毛志泉, 许海峰, 王楠, 吴树敬,陈学森. 苹果绵肉与脆肉株系果实质地差异的分子机理. 中国农业科学, 2015, 48(18): 3676-3688. ZHANG R, ZHANG Z Y, GAO L P, JI X H, MAO Z Q, XU H F,WANG N, WU S J, CHEN X S. Study on the molecular mechanism controlling differences in fruit texture formation of apple soft/crisp strains. Scientia Agricultura Sinica, 2015, 48(18): 3676-3688. (in Chinese)
[27] JI X H , WANG Y T , ZHANG R, WU S J , AN M M, LI M,WANG C Z , CHEN X L , ZHANG Y M , CHEN X S. Effect of auxin,cytokinin and nitrogen on anthocyanin biosynthesis in callus cultures of red-fleshed apple (Malus sieversii f. niedzwetzkyana). Plant Cell,Tissue and Organ Culture, 2015, 120: 325-337.
[28] JI X H, ZHANG R, WANG N, YANG L, CHEN X S. Transcriptome profiling reveals auxin suppressed anthocyanin biosynthesis in red-fleshed apple callus (Malus sieversii f. niedzwetzkyana). Cell,Tissue and Organ Culture, 2015, 123: 389-404.
[29] WANG N, ZHENG Y, DUAN N B, ZHANG Z Y, JI X H, JIANG S H, SUN S S, YANG L, BAI Y, FEI Z J, CHEN X S.Comparative transcriptomes analysis of red and white-fleshed apples in an F1 populationof Malus sieversii f. niedzwetzkyana crossed with M. domestica ‘Fuji’. PLoS One, DOI:10.1371/journal.pone.0133468, July 24, 2015.
[30] CHRISTIAN G, HEIDI H, JASMIN K, SILVIJA M, KARL S. Biosynthesis of phloridzin in apple (Malus domestica Borkh). Plant Science, 2009, 6: 223-231.
[31] IRIS S, HENRYK F, LI H H, HEIDRUN H, DIETER T, IONELA R,HANKE M V, KARL S, THILO C F. Shift in polyphenol profile and sublethal phenotype caused by silencing of anthocyanidin synthase in apple (Malus sp). Planta, 2009, 229: 681-692.
[32] LARKIN M A, BLACKSHIELDS G, BROWN N P, CHENNA R,MCGETTIGAN P A, MCWILLIAM H, VALENTIN F, WALLACE I M, WILM A, LOPEZ R, THOMPSON J D, GIBSON T J, HIGGINS D G. Clustal W and Clustal X version 2.0. Bioinformatics, 2007, 23:2947-2948.
[33] 冯守千, 陈学森, 张春雨, 刘晓静, 刘遵春, 王海波, 王延玲, 周朝华. 砂梨品种‘满天红’及其芽变品系‘奥冠’花青苷合成与相关酶活性研究. 中国农业科学, 2008, 41(10): 3184-3190. FENG S Q, CHEN X S, ZHANG C Y, LIU X J, LIU Z C, WANG H B,WANG Y L, ZHOU Z H. A Study of the relationship between anthocyanin biosynthesis and related enzymes activity in Pyrus pyrifolia ‘Mantianhong’ and its bud sports ‘Aoguan’. Scientia Agricultura Sinica, 2008, 41(10): 3184-3190. (in Chinese)
[34] JIA Z S, TANG M C, WU J M. The determination of flavonoid contents in mulberry and their scavenging effects on superoxideradicals. Food Chemistry, 1999, 64(4): 555-559.
[35] LONGO L, SCARDINO A, VASAPOLLO G. Identification and quantification of anthocyanin in the berries of Pistacia lentiscus L. Phillyrea latifolia L. and Rubia peregrina L. Innovative Food Science &Emerging Technologies, 2007, 8: 360-364.
[36] KENNETH J L, THOMAS D S. Analysis of relative gene expression data using real-time quantitative PCR and the 2-CT△△method. Methods, 2001, 25: 402-408.
[37] XU Y T, FENG S Q, JIAO Q Q, LIU C C, ZHANG W W, CHEN W Y, CHEN X S. Comparison of MdMYB1 sequences and expression of anthocyanin biosynthetic and regulatory genes between Malus domestica Borkh. cultivar ‘Ralls’ and its blushed sport. Euphytica,2012, 185: 157-170.
[38] 周兰. 苹果果实发育中类黄酮含量变化及相关基因的研究[D]. 北京: 中国农业科学院, 2013. ZHOU L. Study on the concentration changes and related genes of flavonoids in apple [D]. Beijing: Chinese Academy of Agricultural Sciences, 2013. (in Chinese)
[39] KOES R, VERWEIJ W, QUATTROCCHIO F. Flavonoids: A colorful model for the regulation and evolution of biochemical pathways. Trends in Plant Science, 2005, 10(5): 236-242.
[40] PETRONI K, TONELLI C. Recent advances on the regulation of anthocyanin synthesis in reproductive organs. Plant Science, 2011,181(3): 219-229.
[41] 刘晓芬, 李方, 殷学仁, 徐昌杰, 陈昆松. 花青苷生物合成转录调控研究进展. 园艺学报, 2013, 40(11): 2295-2306. LIU X F, LI F, YIN X R, XU C J, CHEN K S. Recent advances in the transcriptional regulation of anthocyanin biodynthesis. Acta Horticulturae Sinica, 2013, 40(11): 2295-2306. (in Chinese)
[42] JAAKOLA L. New insights into the regulation of anthocyanin biosynthesis in fruits. Trends in Plant Science, 2013,18(9): 477-483.
[43] PATRA B, SCHLUTTENHOFER C, WU Y, PATTANAIK S, YUAN L. Transcriptional regulation of secondary metabolite biosynthesis in plants. Biochimicaet Biophysica Acta-Gene Regulatory Mechanisms,2013, 1829(11): 1236-1247.
[44] KIM S Y, LEE J R, KIM S R. Characterization of an apple anthocyanidin synthase gene in transgenic tobacco plants. Journal of Plant Biology, 2006, 49(4): 326-330.
[45] KONDO S, HIRAOKA K, KOBAYASHI S, HONDA C, TERAHARA N. Changes in the expression of anthocyanin biosynthetic genes during apple development. Journal of the American Society for Horticultural Science, 2002, 127: 971-976.
[46] BRUEGGEMANN J, WEISSHAAR B, SAGASSER M. A WD40-repeat gene from Malus×domestica is a functional homologue of Arabidopsis thaliana TRANSPARENT TESTA GLABRA1. Plant Cell Reports, 2010, 29(3): 285-294.
[47] StevenV N, Garrett B, James N, Roberto M, Margie L, Philip F,Nihad A, Randy B, Nair M G, Matthew O. Genetic diversity of red-fleshed apples (Malus). Euphytica, 2012, 185: 281-293
[48] 聂继云, 吕德国, 李静, 刘凤之, 李海飞, 王昆. 22种苹果种质资源果实类黄酮分析. 中国农业科学, 2010, 43(21): 4455-4462. NIE J Y, LÜ D G, LI J, LIU F Z, LI H F, WANG K. A preliminary study on the flavonoids in fruits of 22 apple germplasm resources. Scientia Agricultura Sinica, 2010, 43(21): 4455-4462. (in Chinese)
[49] LIN-WANG K, MICHELETTI D, PALMER J, VOLZ R, LOZANO L,ESPLEY R V, HELLENS R P, CHAGNÈ D, ROWAN D D,TROGGIO M, IGLESIA I, ALLEN A C. High temperature reduces apple fruit colour via modulation of the anthocyanin regulatory complex. Plant, Cell and Environment, 2011, 34: 1176-1190.
[50] AN X H, TIAN Y, CHEN K Q, LIU X J, LIU D D, XIE X B, CHENG C G, CONG P H, HAO Y J. MdMYB9 and MdMYB11 are involved in the regulation of the JA-induced biosynthesis of anthocyanin and proanthocyanidin in apples. Plant Cell Physiology, 2015, 56(4):650-662.
[51] HAN Y P, VIMOLMANGKANG S, SORIA-GUERRA R E,KORBAN S S. Introduction of apple ANR genes into tobacco inhibits expression of both CHI and DFR genes in flowers, leading to loss of anthocyanin. Journal of Experimental Botany, 2012, 63(7): 2437-2447.
(责任编辑 赵伶俐)
Content and Analysis of Biosynthesis-Related Genes of Flavonoid Among Four Strains of Malus sieversii f. neidzwetzkyana F1Population
XU Hai-feng, WANG Nan, JIANG Sheng-hui, WANG Yi-cheng, LIU Jing-xuan, QU Chang-zhi, WANG De-yun,ZUO Wei-fang, ZHANG Jing, JI Xiao-hao, ZHANG Zong-ying, MAO Zhi-quan, CHEN Xue-sen
(College of Horticultural Science and Engineering, Shandong Agricultural University/State Key Laboratory of Crop Biology,Tai’an 271018, Shandong)
【Objective】In order to develop the theory and breeding technology of functional apple, the molecular mechanism of the differences of flavonoid biosynthesis in several cross progenies of Malus sieversii f.neidzwetzkyana and M. domestica cv. Fuji was studied. 【Method】 Four apple stains (Zihong NO.2, Hongcui NO.1, Hongcui NO.2 and Hongcui NO.4) with significantdifference in red-flesh degree during the latter growth period were used as materials. The type of MYB10 promoter was identified,and the components and contents of flavonoids and the relative expressions of related genes were determined.【Result】The type of MYB10 promoter in Hongcui NO.1, Hongcui NO.2, and Hongcui NO.4 was R6R1, and that of Zihong NO.2 was R6R6. The contents of flavonoids in the mature period between Hongcui NO.1 (3.0 mg.g-1)and Zihong NO.2 (3.1 mg·g-1) were equivalent, while the anthocyanin content in Zihong NO.2 (23.9 U·g-1FW) was twice as that in Hongcui NO.1 (12.2 U·g-1FW), and other contents of flavonoid of anthocyanin in Zihong NO.2 (1 635.3 mg·kg-1) was only 69% of that in Hongcui NO.1 (2 355.0 mg·kg-1). The transcription factors and anthocyanin biosynthesis genes such as MYB10 and UFGT in Zihong NO.2 had higher expression during the latter growth period (110-125 d). The expression of MYB10 in Hongcui NO.4 during the latter growth period (110-125 d) was higher,but the expression of bHLH3, TTG1, ANS and UFGT were lower. The contents of flavonoid components among Hongcui NO.1 (2 355.0 mg·kg-1), Hongcui NO.2 (1 247.5 mg·kg-1) and Hongcui NO.4 (1 337.5 mg·kg-1) indicated significant differences. In Hongcui NO.1, the MYB12, FLS, LAR and ANR showed higher expression, while the expression of MYB16 and MYB111 were lower. The MYB12, FLS, LAR and ANR in Hongcui NO.2 and Hongcui NO.4 showed lower expression, while the expression of MYB16 and MYB111 were higher.【Conclusion】The transcription factors, such as MYB10, BHLH3, TTG1, and the structure genes which were associated with anthocyanin biosynthesis including ANS, UFGT were obviously up-regulated during the latter growth period, and it might be the main reason that caused high anthocyanin content in Zihong NO.2 flesh in the mature period. Meanwhile, the transcription factors, for example, MYB12, MYB16, MYB111, and the structure genes that relative to flavonoid biosynthesis such as DFR, FLS, LAR, ANR had different expressions, and it might be the main reason that led to the difference in the components and contents of flavonoid among the 3 strains of Hongcui NO.1, Hongcui NO.2 and Hongcui NO.4.
M.sieversii f. neidzwetzkyana; cross progeny; flavonoid; MYB10; gene expression analysis
2016-01-31;接受日期:2016-04-15
国家自然科学基金(31572091)、国家公益性行业(农业)科研专项(201303093)、山东省水果创新团队项目(SDAIT-03-022-01)
联系方式:许海峰,E-mail:997524744@qq.com。通信作者陈学森,E-mail:chenxs@sdau.edu.cn
