两种组织透明技术在免疫荧光染色观察脊髓3D结构中的应用①
2016-09-09段红梅尚俊奎李千千杨飞祥杨朝阳李晓光
段红梅,尚俊奎,郝 鹏,李千千,杨飞祥,杨朝阳,,李晓光,
两种组织透明技术在免疫荧光染色观察脊髓3D结构中的应用①
段红梅1,尚俊奎2,郝鹏2,李千千1,杨飞祥2,杨朝阳1,2,李晓光1,2
目的观察CUBIC和iDISCO两种透明技术在脊髓免疫荧光染色中的效果。方法应用两种组织透明技术处理1 mm厚脊髓冠状切片,然后行神经丝(NF)蛋白免疫荧光染色,激光共聚焦扫描显微镜观察染色效果。结果与CUBIC透明相比,iDISCO透明技术所需时间短,透明度高(F=6.64,P<0.01),免疫荧光染色深(F=5117.55,P<0.01)。结论应用iDISCO透明方法和免疫荧光染色相结合的方法可以完整观察脊髓轴突,更加简单快速,染色效果更好。
脊髓;透明;轴突再生;CUBIC;iDISCO;大鼠
[本文著录格式]段红梅,尚俊奎,郝鹏,等.两种组织透明技术在免疫荧光染色观察脊髓3D结构中的应用[J].中国康复理论与实践,2016,22(4):417-421.
CITED AS:Duan HM,Shang JK,Hao P,et al.Application of two kinds of tissue clearing method in observing 3D imaging of spinal cord with immunofluorescent staining[J].Zhongguo Kangfu Lilun Yu Shijian,2016,22(4):417-421.
传统上对成年大鼠脊髓组织的形态研究,多采用组织切片后化学染色或免疫组织化学染色的方法进行观察。组织切片限制了对整段脊髓中细胞分布和纤维联系的完整观察。例如,在脊髓轴突再生的研究中,损伤的轴突因为在组织切片制作过程中其连续性可能被破坏,导致在一个切片中仅能观察到部分再生的轴突,不能很精准地对轴突再生的完整效果进行综合评价[1]。另外,组织切片对再生轴突的走向和投射部位也不能详细观察。因此,理想的状态应该是对整段脊髓进行染色观察。
免疫荧光染色利用抗原与抗体相结合的原理可以对组织内的目标蛋白进行可视化观察。正常脊髓组织由灰质和白质组成,白质主要包含由神经元轴突聚集而成的上下传导束,这些轴突纤维大部分由髓鞘包裹,脂质含量丰富。故对整段脊髓染色时,抗体渗透能力有限。并且整段脊髓较厚,光学成像过程中,光在通过不同结构层时因神经细胞和纤维束的折射率不同而出现散射,从而失去其激发和发射效率,导致获得的图像分辨率低、成像深度浅等问题[2-3]。
1 材料和方法
1.1实验动物
成年雌性Wistar大鼠20只,体质量180~200 g,SPF级,首都医科大学实验动物部提供。
1.2取材
大鼠称重,6%水合氯醛0.6 ml/100 g腹腔注射麻醉,4%多聚甲醛经心脏灌流固定,取出胸段脊髓,4%多聚甲醛4℃固定过夜。
1.3切片
应用振动切片机,选取T8脊髓节段行1 mm冠状切片。
1.4染色及透明处理
1.4.1主要仪器、试剂及配制
CUBIC-1(试剂1):25%尿素(SIGMA公司)+25%四乙二胺(SIGMA公司)+15%Triton X-100+35%蒸馏水。CUBIC-2(试剂2):50%蔗糖+25%尿素+10%三乙醇胺(SIGMA公司)+0.1%Triton X-100+15%蒸馏水。四氢呋喃、二氯甲烷和苄醚:SIGMA公司。小鼠抗大鼠神经丝(neurofilament,NF)单克隆抗体:中杉金桥;Alexa-Fluor594标记山羊抗小鼠荧光二抗:INVITROGEN公司。激光共聚焦扫描显微镜:LEICA。
1.4.2 CUBIC染色及透明方法
PBS洗30 min,共3次,20%蔗糖脱水,4℃至沉底;CUBIC-1中浸泡至透明(2 d);PBS洗30 min,共3次,常温;20%蔗糖脱水,4℃至沉底,OCT包埋,-80℃过夜;OCT解冻,PBS洗30 min,共3次;PBST(0.3%Triton,1×PBS)+10%山羊血清封闭,37℃过夜;NF一抗(1∶40)+PBST+3%山羊血清,37℃孵育3 d;PBS洗30 min,共3次,洗过夜;二抗(1∶200)+PBST+3%山羊血清,37℃孵育2 d;PBS洗30 min,共3次,洗1 d;20%蔗糖脱水,4℃至沉底;CUBIC-2中浸泡至透明。
1.4.3 iDISCO染色及透明方法
PBS洗30 min,共3次;室温下20%、40%、60%、80%、100%甲醇/PBS溶液脱水,各30 min;100%甲醇1 h,共3次,4℃;5%H2O2/甲醇4℃12 h;80%甲醇/PBS 30 min室温;80%、60%、40%、20%、0%甲醇/PBST各30 min室温;PBST洗1 h,2次,室温;PBST+10%DMSO+10%山羊血清封闭,37℃过夜;NF一抗+PTwH(0.2%Tween-20,1×PBS(含10 μg/ml肝素钠))+3%山羊血清,37℃过60 h;PTwH洗10 min、15 min、30 min、1 h,洗过夜;二抗+PT-wH+3%山羊血清,37℃过48 h;PTwH洗10 min、15 min、30 min、1 h,洗1 d;50%、70%、80%四氢呋喃/H2O,各30 min,100%四氢呋喃30 min,共3次,二氯甲烷至沉底,约10 min,苄醚至透明10 min,储存在苄醚中。
激光共聚焦扫描显微镜观察染色效果。
1.5评价
对两种方法的实验所需时间、脊髓表面积变化、透明效果以及免疫荧光染色的深度进行比较。
应用传统的数码相机(关闭相机的自动白平衡功能)对透明前和透明后的冠状脊髓切片进行照相。应用Image-Pro Plus 6.0图像分析软件,计算透明前后脊髓切片的累积光密度值(IOD),并画出透明前后脊髓的轮廓,然后计算其表面积(μm2)。

1.6统计学分析
应用SPSS 17.0软件进行统计学分析。所有计量资料均采用(x¯±s)表示。组间比较采用单因素方差分析,独立样本t检验。显著性水平α=0.05。
2 结果
2.1实验所需时间、脊髓表面积变化和透明效果
CUBIC方法需要1 mm厚脊髓组织在试剂1中处理2 d,试剂2中处理1 d,整个透明过程为5 d,持续时间较长。iDISCO方法仅需要1 mm厚脊髓组织在四氢呋喃、二氯甲烷和苄醚中处理3~4 h即能完成透明过程,持续时间短。见图1。
与透明前相比,CUBIC处理后的脊髓表面积增大约49.4%,iDISCO透明后脊髓表面积减少42.6%。
两种方法对脊髓组织的透明效果显示,CUBIC的透明效果未达肉眼透明,组织透明度为50%;iDISCO透明后脊髓能达到肉眼透明的效果,透明度达99.2%,两种方法间存在显著性差异(F=6.64,P<0.01)。见图2。
2.2免疫荧光染色深度
常规免疫荧光染色,即未经透明处理的脊髓,只有表层可见NF阳性纤维,染色深度仅为30 μm(图3A)。CUBIC处理后染色深度有所增加,为60 μm(图3B)。iDISCO方法处理后染色深度进一步加深,脊髓深部也可见NF阳性信号,染色深度达150 μm,是常规染色的5倍,并且该方法的非特异性染色较弱(图3C)。两种方法染色深度有非常显著性差异(F= 5117.55,P<0.01)。
2.3提高染色效果
虽然iDISCO方法的染色效果更佳,但也存在一定的不足之处,如对组织深部的轴突不能很好染色,从而造成两端的轴突能够标记,但组织深部NF染色为阴性,导致轴突标记的不连续性(图4A),限制了对轴突的完整追踪观察。进一步改善染色条件,在一抗孵育的第2天追加1/2初始量的抗体,染色深度增加,但脊髓深部的神经纤维染色不均匀且不连续(图4B),继续增加抗体孵育时间,同时再次追加抗体,至第3天达到神经纤维完整、连续的显示(图4C),有利于轴突染色的三维重建。
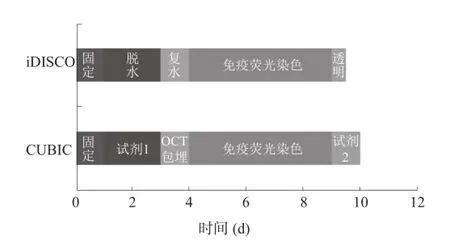
图1 两种方法染色和透明的具体流程

图2 两种透明方法的比较

图3 三种条件下NF免疫荧光染色的深度

图4 iDISCO下追加抗体后NF免疫荧光染色深度
3 讨论
3.1透明效果
利用一定的方法使组织达到肉眼透明后,才能够对完整组织进行3D观察。两种透明方法均能够一定程度改善脊髓的透明效果。CUBIC透明的方法应用尿素等无毒的水溶性溶剂,需要脊髓组织在两种溶剂中处理一定时间即可校正脊髓组织的折射率,提高透明度[13]。CUBIC的操作方法虽然简单,但持续时间较长,而iDISCO透明方法在几个小时内就能使脊髓组织达到肉眼透明效果,透明时间短,但需要特殊的有机溶剂,这些有机溶剂多是有毒的,需要特殊的防护[14]。因此,两种透明方法虽然都能改善脊髓组织的透明度,但各有优缺点,可以根据自身的需要选择相应的透明方法。
3.2染色深度
NF是细胞骨架蛋白,主要表达于神经元的胞体和轴突,脊髓损伤后,轴突纤维断裂,目前治疗脊髓损伤的一个有效方法即促进长轴突的再生。本研究观察两种透明方法对脊髓NF免疫荧光染色的效果。应用免疫荧光染色方法进行完整组织观察时,提高抗体的染色深度是对组织进行完整观察的关键。抗体因其渗透动力学的原因,有时不能达到组织内部,从而仅能获得浅表的组织染色,特别是组织中富含的蛋白染色,这样不利于对深部组织进行观察。iDISCO的方法中,Renier等提到此种方法在免疫荧光化学染色观察中的优势。应用梯度甲醇对标本进行处理,有利于抗体的渗透,缩短抗体孵育时间,增加染色深度;同时,甲醇可能会对某些抗原表位有影响,不利于抗原与抗体的结合。因此,Renier等建议首先应用组织切片进行甲醇处理,了解甲醇是否影响抗原抗体的结合。另外,iDISCO的方法中,Renier等应用过氧化氢来减少组织的自发荧光,应用甘氨酸和肝素减轻背景着色[14]。CUBIC方法中,免疫荧光化学染色中,抗体也能够渗透相当的深度,但不如iDISCO染色深度深。
3.3改善染色条件可以提高染色效果
研究报道,在iDISCO方法中,假设组织内富含某种蛋白或者目标蛋白分布比较分散,如脊髓中的NF和胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP),其抗体会在组织表面凝结成块,不利于抗体渗透,难以对深部的组织进行染色观察。可以通过增加抗体孵育时间或者增加抗体浓度来提高染色效果[14]。我们发现,通过上述两种方法能改善染色效果,但染色效果不能得到明显改善。通过反复补充抗体的方法,能明显提高染色效果。如NF染色中,在染色的第2天、第3天,在抗体孵育液中再次加入1/2第1天量的抗体,提高NF的染色效果。
有研究也指出,组织内也富含细胞外基质,细胞外基质也一定程度阻止抗体的渗透[16],两种透明方法都不能去除细胞外基质,从而也一定程度上影响了抗体的渗透。因此,有必要进一步改善染色的条件,进一步提高染色的深度和染色的效果。
[1]Steward O,Zheng B,Tessier-Lavigne M.False resurrections:distinguishing regenerated from spared axons in the injured central nervous system[J].J Comp Neurol,2003,459(1):1-8.
[2]Erturk A,Becker K,Jahrling N,et al.Three-dimensional imaging of solvent-cleared organs using 3DISCO[J].Nat Protoc,2012,7(11):1983-1995.
[3]Erturk A,Mauch CP,Hellal F,et al.Three-dimensional imaging of the unsectioned adult spinal cord to assess axon regeneration and glial responses after injury[J].Nat Med,2012,18(1):166-171.
[4]Genina EA,Bashkatov AN,Tuchin VV.Tissue optical immersion clearing[J].Expert Rev Med Devices,2010,7(6):825-842.
[5]Kim SY,Chung K,Deisseroth K.Light microscopy mapping of connections in the intact brain[J].Trends Cogn Sci,2013,17(12):596-599.
[6]Treweek JB,Chan KY,Flytzanis NC,et al.Whole-body tissue stabilization and selective extractions via tissue-hydrogel hybrids for high-resolution intact circuit mapping and phenotyping[J].Nat Protoc,2015,10(11):1860-1896.
[7]Peters AJ,Chen SX,Komiyama T.Emergence of reproducible spatiotemporal activity during motor learning[J].Nature,2014,510(7504):263-267.
[8]Hama H,Kurokawa H,Kawano H,et al.Scale:a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain[J].Nat Neurosci,2011,14(11):1481-1488.
[9]Erturk A,Lafkas D,Chalouni C.Imaging cleared intact biological systems at a cellular level by 3DISCO[J].J Vis Exp,2014(89):e51382.
[10]Kuwajima T,Sitko AA,Bhansali P,et al.ClearT:a detergentand solvent-free clearing method for neuronal and non-neuronal tissue[J].Development,2013,140(6):1364-1368.
[11]Ke MT,Fujimoto S,Imai T.SeeDB:a simple and morphology-preserving optical clearing agent for neuronal circuit reconstruction[J].Nat Neurosci,2013,16(8):1154-1161.
[12]Tomer R,Ye L,Hsueh B,et al.Advanced CLARITY for rapid and high-resolution imaging of intact tissues[J].Nat Protoc,2014,9(7):1682-1697.
[13]Susaki EA,Tainaka K,Perrin D,et al.Whole-brain imaging with single-cell resolution using chemical cocktails and computational analysis[J].Cell,2014,157(3):726-739.
[14]Renier N,Wu Z,Simon DJ,et al.iDISCO:a simple,rapid method to immunolabel large tissue samples for volume imaging[J].Cell,2014,159(4):896-910.
[15]Lu P,Wooruff G,Wang Y,et al.Long-distance axonal growth from human induced pluripotent stem cells after spinal cord injury[J].Neuron,2014,83(4):789-796.
[16]Lee E,Choi J,Jo Y,et al.ACT-PRESTO:Rapid and consistent tissue clearing and labeling method for 3-dimensional(3D)imaging[J].Sci Rep,2016,6:18631.
Application of Two Kinds of Tissue Clearing Method in Observing 3D Imaging of Spinal Cord with Immunofluorescent Staining
DUAN Hong-mei1,SHANG Jun-kui2,HAO Peng2,LI Qian-qian1,YANG Fei-xiang2,YANG Zhao-yang1,2,LI Xiao-guang1,2
1.Department of Biomedical Engineering,School of Biological Science and Medical Engineering,Beihang University,Beijing 100191,China;2.Department of Neurobiology,Capital Medical University,Beijing 100069,China
Correspondence to LI Xiao-guang.E-mail:lxgchina@sina.com
Objective To compare the application of CUBIC and iDISCO clearing methods in observing 3D imaging of spinal cord with immunofluorescent staining.Methods 1 mm thick spinal cord coronal sections were processed with CUBIC and iDISCO,respectively.The neurofilament(NF)protein was detected by immunofluorescent staining and then was observed by a laser confocal microscope.Results Compared with CUBIC,iDISCO had the advantages of shorter time,higher transparency(F=6.64,P<0.01),and deeper penetration(F= 5117.55,P<0.01).Conclusion Immunofluorescent staining combined with iDISCO could completely observe the spinal axons with shorter time and better stain effect.
spinal cord;transparency;axon regeneration;CUBIC;iDISCO;rats
10.3969/j.issn.1006-9771.2016.04.010
R651.2
A
1006-9771(2016)04-0417-05
1.国家“863”计划项目(No.2012AA020506);2.国家自然科学基金面上项目(No.31271037);3.国家自然科学基金国际合作与交流项目(No.31320103903);4.“十二五”国家科技支撑计划项目(No.2012BAI17B04);5.高等学校全国优秀博士学位论文作者专项资金资助项目(No.201356);6.国家国际科技合作专项项目(No.2014DFA30640);7.国家自然科学基金委员会资助项目(No.31130022)。
1.北京航空航天大学生物与医学工程学院,北京市100191;2.首都医科大学神经生物学系,北京市100069。作者简介:段红梅(1983-),女,河南驻马店市人,博士研究生,主要研究方向:生物材料在细胞诱导及脊髓损伤修复过程中的作用。通讯作者:李晓光(1959-),男,吉林长春市人,博士,教授,主要研究方向:应用组织工程学的方法修复神经系统损伤的研究。E-mail:lxgchina@sina.com。
有学者在一个世纪前首先发明了组织透明技术,该技术利用一定的方法可以使组织透明化,从而使完整组织的折射率一致,从而达到肉眼透明的效果。透明后的组织由于不同结构层的光折射率一致,光不会再出现散射,实现了对组织内部结构的成像,有利于对组织进行三维成像观察[4-7]。中枢神经系统因为结构的复杂性,使得组织透明技术对中枢神经系统发育、损伤修复和可塑性等的研究变得更加重要。最近出现的几种组织透明技术,如ScaleA2[8]、3DISCO[2,9]、ClearT2[10]、SeeDB[11]和CLARITY[12]等都存在一定程度的缺陷。ScaleA2整个透明时间需要数月,ClearT2需要特殊的采集图像条件,而CLARITY需要特殊的仪器和装置。CUBIC[13]和iDISCO[14]两种透明方法相对简单,持续时间短,不需要特殊的装置。所以本实验选取并比较这两种透明技术在应用免疫荧光染色观察完整脊髓中的效果,以期为进一步研究脊髓损伤修复过程中轴突再生的完整观察提供理论基础和实验依据。
(2016-03-15
2016-04-13)
