黑果枸杞的组织培养和快速繁殖
2016-09-07李宜珅石建业
杨 宁,李宜珅,陈 霞,石建业
(1.西北师范大学生命科学学院,甘肃兰州 730070;2.定西市农业科学研究院,甘肃定西 743000)
黑果枸杞的组织培养和快速繁殖
杨宁1,李宜珅1,陈霞1,石建业2
(1.西北师范大学生命科学学院,甘肃兰州730070;2.定西市农业科学研究院,甘肃定西743000)
本研究以黑果枸杞(Lycium ruthenicum)为对象,对其愈伤组织诱导、不定芽分化、诱导生根的培养条件进行筛选,并探究了黑果枸杞实验室试管苗的大田移栽.结果表明,诱导愈伤组织最适培养基为:MS+0.5 mg·L-16-BA+0.1 mg·L-12,4-D+10 g·L-1蔗糖,出愈率达88%,愈伤组织生长状态良好;不定芽分化增殖的最适培养基为:MS+0.2 mg·L-16-BA+10 g·L-1蔗糖,不定芽增殖倍数达5.05倍;诱导生根最适培养基为:MS+0.1 mg·L-1IBA+5 g·L-1蔗糖,生根率为95%.逐级炼苗后的试管苗大田移栽成活率达90%.
黑果枸杞;愈伤组织;诱导;分化;再生植株
黑果枸杞(Lycium ruthenicum Murr)为茄科枸杞属多年生小灌木,分布于我国陕西北部黄土高原、甘肃、青海、内蒙古、新疆和西藏等地区,中亚、高加索和欧洲等地区均有分布[1].叶肉质、无柄簇生于短枝上.浆果球形,成熟后紫黑色,有甜味,种子褐色肾形,是一种重要的中药材[2],其含油量为5.54%,含有三种脂肪酸,主要以不饱和脂肪酸为主,其中亚油酸含量最高,达71.48%,并富含有17种氨基酸[3].黑果枸杞能益精明目、滋补肝肾,适用于头晕目眩、腰膝酸软、两眼昏花等症状.现代科学研究不仅证实了上述说法,并且认为黑果枸杞可以兴奋大脑神经,降低胆固醇,增强免疫功能,防治癌症,抗衰老和美容,对人体健康非常有益.黑果枸杞提取物可促进细胞免疫功能、增强淋巴细胞的增殖能力、促进肿瘤坏死因子的生成,对白细胞介素Ⅱ有双向调解作用[4].黑果枸杞多糖、黄酮和多酚具有抗氧化活性、对线粒体有保护作用[5].其果实中含有丰富的紫红色素,是珍稀的天然花色苷类色素资源.黑果枸杞是迄今为止发现的原花青素含量最高的天然野生植物,远超蓝莓等植物,而原花青素是最有效的天然水溶性自由基清除剂,其功效是VE的50倍、Vc的20倍[6-7].
黑果枸杞在盐渍化和次生盐渍化土壤上大量分布,常构成盐爪爪(Kalidium foliatum)-黑果枸杞盐生植物群落[8].野生黑果枸杞适应性很强,能忍耐38.5 ℃高温,且在-25.6 ℃下无冻害[9];为较耐旱树种,土壤水合补偿点为3.81%[10];是一种典型的储盐植物,也是荒漠化地区特别是盐碱化土地恢复植被的备选植物之一[11].
黑果枸杞常规繁殖方法为播种育苗再到扦插育苗,过程繁琐,繁殖速度较慢,而且在雨季容易发生黑果病,影响植株生长,甚至导致其退化[12],因此难以适应市场商品化生产的需求.植物组织培养起源于20世纪初,为植物学的发展起到了十分重要的作用[13].采用植物组织离体培养与快速繁殖方法对黑果枸杞进行研究,建立较为系统的无性快速繁殖体系,以满足中药现代化产业对种苗的大量需求,有望改变传统的生态破坏型育苗模式,保障黑果枸杞苗的品质,但目前有关黑果枸杞组织培养的报道较少,局限于比较简单的培养条件探索,缺乏适用于大规模田间生产的试验依据.本研究以黑果枸杞种子为材料,以Murashige and Skoog(MS)培养基为基本培养基,用组织培养技术培育黑果枸杞试管苗,以无菌苗外植体诱导愈伤组织,在分化培养基上培养不定芽,筛选其最适不定芽增殖培养基,诱导生根并移栽,为黑果枸杞试管苗工厂化生产、幼苗的培育、抗盐碱化机制研究和育种研究奠定基础.
1 材料与方法
1.1实验材料
在甘肃省民勤县黑果枸杞集中生长的地段,选择生长健壮的黑果枸杞植株20株,采集发育正常、无病虫害、果实饱满的黑果枸杞果实若干,阴干后用无菌水浸泡,去除果皮以及种子外附着的紫黑色素,自然风干后得到黑果枸杞种子,备用.
1.2方法
1.2.1种子萌发挑选大小与饱满度一致的种子200颗,低温春化24 h,在70%的乙醇中浸泡30 s,1.5%次氯酸钠溶液中浸泡3 min,用无菌水冲洗三次,灭菌滤纸沾干后置于1/2 MS+5 g·L-1蔗糖琼脂培养基上萌发,温度25 ℃,光周期14 h/10 h(昼/夜),光照强度3 klx,统计萌发率.
1.2.2愈伤组织诱导种子萌发后,将植株转移至含MS+10 g·L-1蔗糖琼脂培养基的100 mL锥形瓶中,待第一对真叶长至2~3 cm时,将其剪切成1 cm长的小段,分别转接至含不同浓度的6-苄氨基腺嘌呤(6-BA)与(2,4-dichlorophenoxy)acetic acid(2,4-D)的MS蔗糖(10 g·L-1)琼脂脱分化培养基中,诱导愈伤组织,温度25 ℃,光周期14 h/10 h(昼/夜),光照强度3 klx,统计出愈率.
1.2.3不定芽的分化在最优脱分化培养基上培养10~15 d,叶片脱分化成为愈伤组织.将长势优良的愈伤组织转入含不同浓度6-BA的MS蔗糖琼脂培养基中,温度25 ℃,光周期14 h/10 h(昼/夜),光照强度3 klx,培养35~45 d,愈伤组织逐渐分化为丛生不定芽.将不定芽切成约0.5 cm的单茎芽,继续在不定芽增殖培养基上增殖生长,统计芽增殖倍数.1.2.4植株的诱导生根将长势良好的不定芽剪切成1.5~2 cm,转移至含不同浓度吲哚丁酸(IBA)的MS蔗糖琼脂生根培养基中培养,温度25 ℃,光周期14 h/10 h(昼/夜),光照强度2 klx,诱导芽生根.培养约15~25 d,不定芽长高,开始生长出明显根系,统计生根率.培养约35 d左右,根长约5~6 cm时将植株转移至外界土壤环境中生长.
1.2.5植株的移栽将根系生长旺盛的黑果枸杞植株移至日光下炼苗2 d后打开锥形瓶封口膜,继续日光下炼苗2 d.之后将试管苗取出,洗净根系上的琼脂培养基,移栽至腐殖土、沙土(2∶1)的混合土壤中,初期保持湿度90%以上,逐渐降低湿度与室内湿度持平,在实验室沙床中培养一个月后移栽至大田中,统计成活率.
1.2.6指标分析[14]
种子萌发率=发芽种子数/接种种子的总数×100%;
芽的增殖倍数=芽的增殖总数/接种单茎芽的总数;
出愈率=产生的愈伤组织数/接种外植体总数×100%;
生根率=生长出根系的植株数/移栽的不定芽数×100%;
移栽成活率=移栽成活植株数/移栽总植株数×100%.
每组实验均设置3次独立重复实验.
2 结果与分析
2.1黑果枸杞种子的萌发
黑果枸杞种子经消毒栽入培养基后,约15~20 d种子萌发,生长出第一对真叶.本实验中选取200枚种子分别栽入10个培养基中,计算发芽率.在使用1/2MS+5 g·L-1蔗糖琼脂培养基中,种子萌发187枚,萌发率达93.5%(图1:A).

图1 黑果枸杞组织培养
A.黑果枸杞种子萌发;B.黑果枸杞愈伤组织的诱导;C.黑果枸杞不定芽分化;D.黑果枸杞不定芽增殖;E.黑果枸杞大田移栽Ⅰ;F.黑果枸杞大田移栽Ⅱ;G.黑果枸杞幼苗越冬前;H.黑果枸杞幼苗越冬后
A.Seed germination;B.Callus induction;C.Redifferentiation of adventitious buds;D.Adventitious buds proliferation;E.Field transplantingⅠ;F.Field transplanting Ⅱ;G.Before overwintering;H.After overwintering
2.2黑果枸杞愈伤组织的诱导
将黑果枸杞叶片剪短移栽至愈伤诱导培养基中,约10 d后叶片变黄,逐渐脱分化形成愈伤组织.实验结果表明,不同激素浓度配比的培养基对黑果枸杞愈伤组织的诱导率有一定程度的影响.由表1可知,当培养基中不存在激素时,出愈率很低;6-BA和2,4-D两种激素适当浓度共同作用可以提高愈伤组织诱导率;而当6-BA和2,4-D浓度高时,愈伤组织受到明显的抑制,未见明显生长变化,且浓度较高的2,4-D会使愈伤组织出现褐化的现象.本研究中以培养基MS+0.1 mg·L-12.4-D+0.5 mg·L-16-BA诱导的愈伤组织出愈率高达88%,愈伤组织生长较好(图1:B).
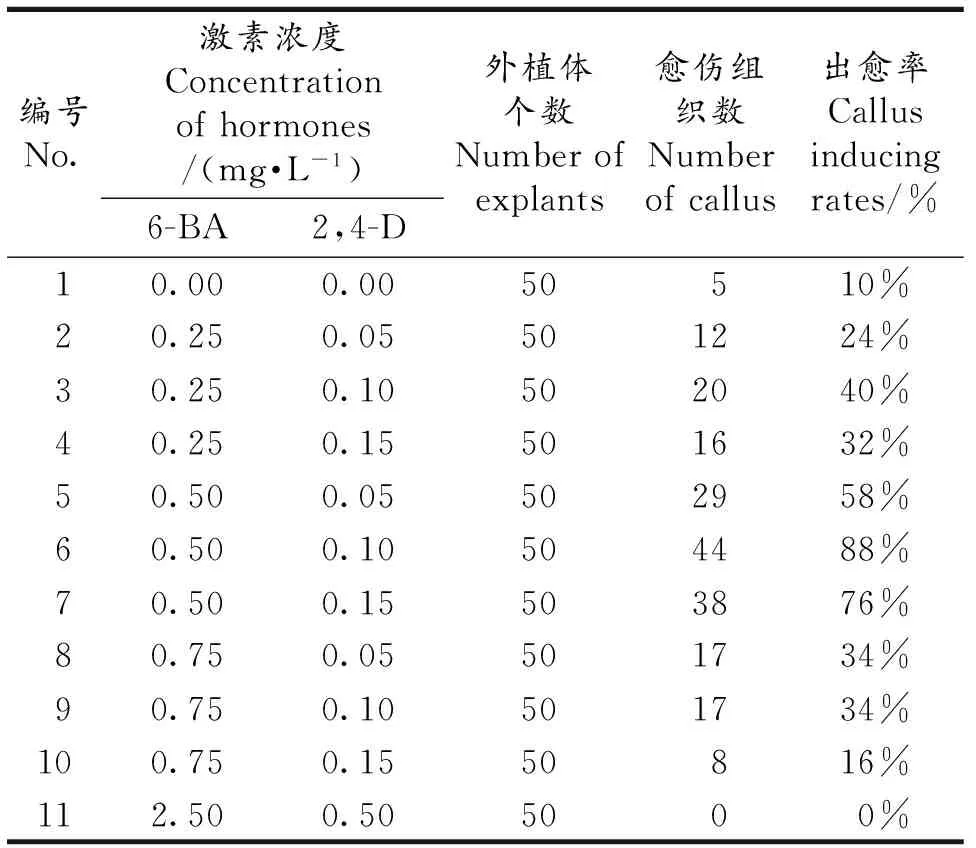
表1 不同激素与浓度对黑果枸杞愈伤组织诱导的影响
2.3黑果枸杞不定芽的诱导与增殖
将生长状态良好的愈伤组织转接至不定芽分化诱导培养基中,愈伤组织逐渐重新分化成不定芽.将长势良好的不定芽植株切成单茎芽继续培养.由表2可知,不同浓度的6-BA对不定芽分化有明显的影响.当6-BA浓度为0.2(mg·L-1)时,黑果枸杞不定芽的增殖状态最好,分化较好的不定芽继续生长成丛生芽,在芽基部形成愈伤组织,愈伤组织继续在此增殖培养基中培养,不断增殖并长出不定芽.将丛生芽切开接入增殖培养基中,已抽出的真叶会再分化出不定芽.增殖获得大量的不定芽可以进一步进行规模化组织培养和工厂化育苗.而高浓度的6-BA会抑制不定芽的生长,甚至导致植物体死亡(图1:C,D).
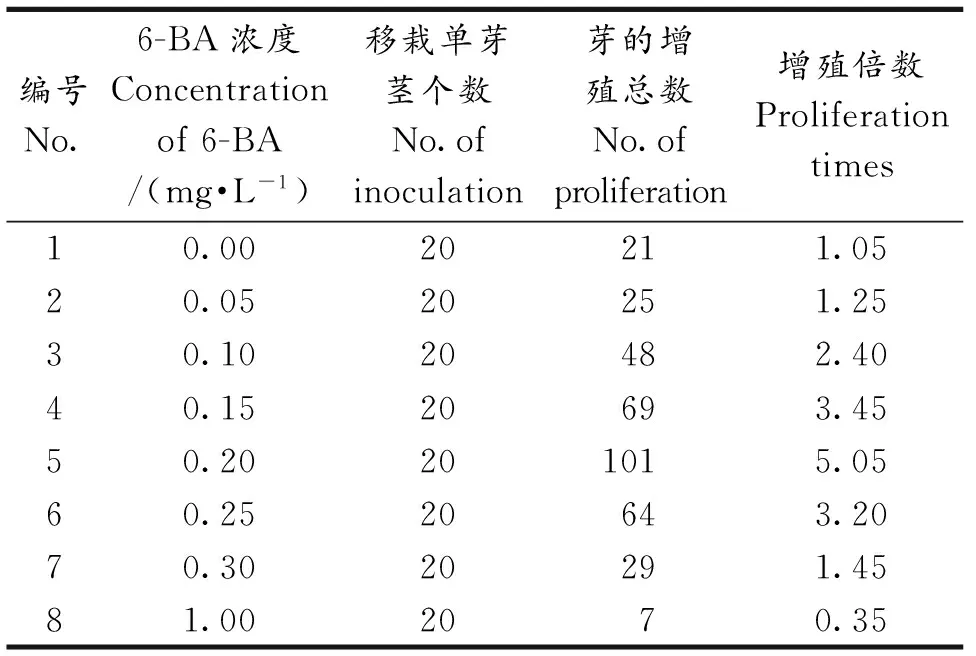
表2 不同浓度6-BA对黑果枸杞不定芽增殖的影响
2.4黑果枸杞植株生根的诱导
本实验中采用IBA作为植物生根的诱导激素,将生长健壮的不定芽移栽至诱导生根培养基中,不定芽植株开始长高,从植株底部生出具有明显根毛的根,每个植株生出约4~6个.由表3可知,较低浓度IBA对植株有一定的诱导作用.当IBA浓度达到0.2 mg·L-1时,生根率达到95%;而高浓度IBA对植株的生根有明显抑制作用.
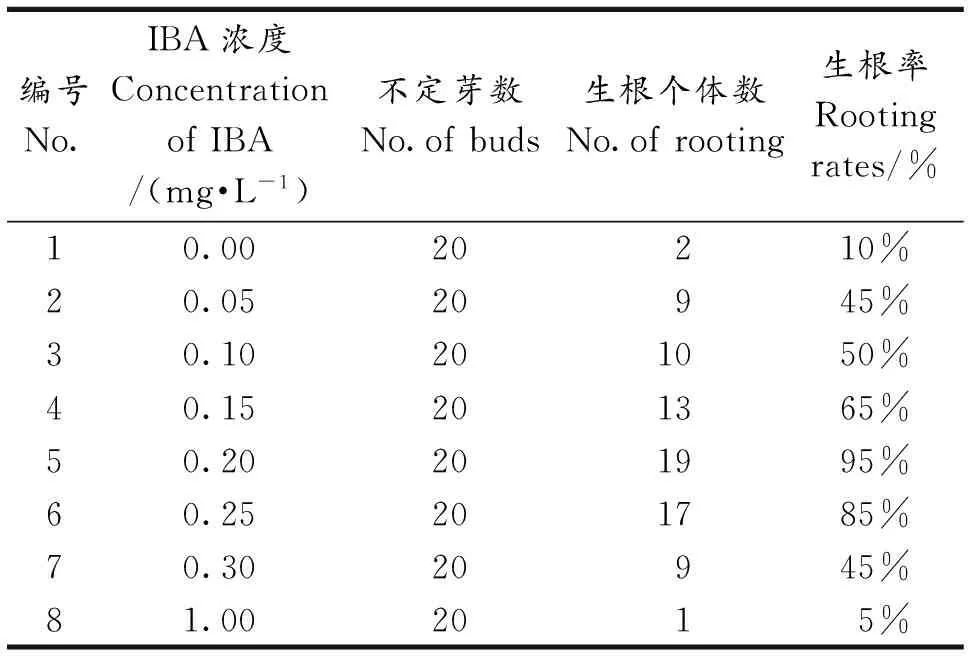
表3 不同浓度IBA对黑果枸杞不定芽生根的影响
2.5黑果枸杞的移栽
选取生长良好的具根试管苗,逐步炼苗移栽至实验室沙床,试管苗移栽成活率达95%,之后转移幼苗栽入田间沙质土,成活率达90%,后期田间大规模移栽时,成活率达98%(图1:E,F).
3 讨论
黑果枸杞是藏药中的一味常见药材,名曰“旁玛”,而维吾尔族医生常用黑果枸杞的果实及根皮治疗牙龈出血、结石等疾病,食药兼得[15].坊间用作滋补强壮、明目及降压[16].因具有出色的耐旱耐盐耐碱能力,已被用于改善荒漠化,在甘肃沙漠地区广泛种植.黑果枸杞果实中含有大量对人体有益的物质,尤其是原花青素含量巨大,可以作为今后研究原花青素的提取来源.果实中所含色素无毒性,着色能力强,可以替代人工色素.因此,黑果枸杞有巨大的生态价值、经济价值与医药价值.但是,由于黑果枸杞成果时间长,主要来源于野生,产量低、采摘不易,导致黑果枸杞成品价格偏高、工业应用量小、无后续的生产研发,使得这一十分宝贵的自然资源未能完全开发与利用[17].
在组织培养中,植物激素是影响组培快繁的重要因素,激素的成份、配比和浓度会对试验结果产生很大的影响,各因素之间最适宜搭配效果是组织培养研究者所关注的问题[18].本实验结果表明,筛选获得黑果枸杞愈伤组织最适诱导培养基为MS+0.5 mg·L-16-BA+0.1 mg·L-12,4-D+10 g·L-1蔗糖琼脂培养基,在该配比与浓度下诱导出的愈伤组织饱满,生长状态良好.将长势良好的黑果枸杞愈伤组织转移至不定芽分化培养基,在MS+0.2 mg·L-16-BA+10 g·L-1蔗糖琼脂培养基上,不定芽分化速度快,长势良好,有利于扩大培养.黑果枸杞最适宜的生根培养基为MS+0.1 mg·L-1IBA+5 g·L-1蔗糖琼脂培养基,在生根培养基中将蔗糖减半可以使植株适应外源能量供给减少的条件,从而促进试管苗在培养后期利用光能合成其生长所需物质,为植株移栽做准备.由于黑果枸杞植株在生根过程中迅速拔高,致使在移栽中茎过于细弱而折断,实际操作中建议沙床搭建起固定移栽苗作用的小支架.移栽至大田中的黑果枸杞植株生长状态良好,并在大棚中可顺利越冬.本实验研究了黑果枸杞在实验室条件下的组织培养和快速繁育,在短时间内能得到大量黑果枸杞试管苗移栽植株、从实验室走向大棚的过程,为广泛栽培与后期育种等工作的开展提供了实验依据.
[1]匡可任,路安民.中国植物志[M].北京:科学出版社,1978:10.
[2]青海木本植物志编委会.青海木本植物志[M].青海:青海人民出版社,1987:570.
[3]陈红军,侯旭杰,自红进.黑果枸杞中的几种营养成分的分析[J].中国野生植物资源,2002.21(2):55.
[4]陈海魁,蒲凌奎,曹君迈,等.黑果枸杞的研究现状及其开发利用[J].黑龙江农业科学,2008(5):155.
[5]夏娜,赵丽凤.黑果枸杞功能性成分抗氧化活性及对线粒体的保护作用研究[J].食品工业科技,2014,35(22):162.
[6]李进,瞿伟箐.大孔树脂吸附分离黑果枸杞色素的研究[J].食品科学,2005,26(6):47.
[7]蔺定运,甘青梅,李炜,等.黑果枸杞色素初步研究[J].中国食品添加剂,1995(2):5.
[8]常兆丰,安富博.生态观测研究方法[M].兰州:甘肃科学技术出版社,2009.
[9]李世忠.永靖县黑果枸杞育苗技术[J].林业实用技术,2011(7):48.
[10]耿生莲.不同土壤水分下黑果枸杞生理特点分析[J].西北林学院学报,2012,27(1):6.
[11]章英才,张晋宁.两种盐浓度环境中的黑果枸杞叶的形态结构特征研究[J].宁夏大学学报(自然科学版),2004,25(4):365.
[12]郝玉兰,石元宁.青藏高原黑枸杞栽培技术[J].现代农业科技,2012(9):138.
[13]HABERLANDT G.Experiments on the culture of isolated plant cells[J].Plant Cell and Tissue Cultures,1902,2:68.
[14]杨宁,陈锡莲,丁芳霞,等.扁桃砧木Nemaguard的微繁研究[J].西北师范大学学报(自然科学版),2013,49(3):76.
[15]刘勇民.维吾尔药志[M].新疆:新疆科技卫生出版社,1999.
[16]甘青梅,骆桂法,李普衍,等.藏药黑果枸杞开发利用的研究[J].青海科技,1997(1):17.
[17]林丽,张裴斯,晋玲,等.黑果枸杞的研究进展[J].中国药房,2013(47):4493.
[18]郭军战,周玮,张杨,等.枸杞组织培养再生体系优[J].西北林学院学报,2010,25(5):73.
(责任编辑俞诗源)
Tissue culture and rapid propagation of Lycium ruthenicum Murr
YANG Ning1,LI Yi-shen1,CHEN Xia1,SHI Jian-ye2
(1.College of Life Science,Northwest Normal University,Lanzhou 730070,Gansu,China;2.Dingxi Institute of Agricultural Sciences,Dingxi 743000,Gansu,China)
Tissue culture of Lycium ruthenicum is studied to select the best culture condition including callus inducing,redifferentiation of adventitious buds,rooting.And then,the field transplanting of Lycium ruthenicum tube seedlings preliminary explored.The result shows that the best medium of callus inducing is MS supplemented with 0.5 mg·L-16-BA, 0.1 mg·L-12,4-D and 10 g·L-1sucrose,the callus inducing rates is 88%.The best medium of differentiation of adventitious buds is MS supplemented with 0.2 mg·L-16-BA and 10 g·L-1sucrose,the proliferation times can be 5.05.The best medium of rooting is MS supplemented with 0.1 mg·L-1IBA and 5 g·L-1sucrose,the rooting rates is 95%.The survive rate of field transplanting is 90%.
Lycium ruthenicum;callus;inducing;redifferentiation;regeneration plant
10.16783/j.cnki.nwnuz.2016.02.017
2015-09-26;修改稿收到日期:2015-11-16
国家自然科学基金资助项目(31160087,31360061)
杨宁(1973—),女,山东青州人,教授,博士.主要研究方向为植物分子细胞生物学.
E-mail:xbsd-yn@163.com
Q 945.51
A
1001-988Ⅹ(2016)02-0084-05
