甘肃陇西黄芪根腐病病原菌的分离与鉴定
2016-09-07牛世全韩彩虹阎薇如达文燕
牛世全,耿 晖,韩彩虹,阎薇如,达文燕
(西北师范大学生命科学学院,甘肃兰州 730070)
甘肃陇西黄芪根腐病病原菌的分离与鉴定
牛世全,耿晖,韩彩虹,阎薇如,达文燕
(西北师范大学生命科学学院,甘肃兰州730070)
黄芪根腐病是严重影响黄芪产量的病害之一,为确定其致病的主要致病菌,本实验对采自甘肃陇西的黄芪根腐病病株以组织分离、离体根部接种、盆栽实验法进行病原菌的分离和致病性测定.结果获得了5株黄芪根腐病致病菌,并通过培养特征、显微形态及rDNA ITS序列分析综合鉴定,确定菌株G2、G3、G4为茄腐镰刀菌(Fusarium solani),G5、 G6为尖孢镰刀菌(Fusarium xoysporum).
黄芪;根腐病;致病菌;分离;ITS序列分析;鉴定
黄芪(Astragalus membranaceus)属豆科(Leguminosae sp)黄芪属(Astragalus),为多年生草本植物,被列为国家三级保护植物.由于其具有补气固表、利水消肿、托疮生肌等多种功效,作为传统的药用植物被大量使用.陇西是全国黄芪主产地之一,近年来黄芪栽培作为该县的重要产业得到迅速发展,而随着栽培面积不断扩大、轮作周期频繁缩短、连作面积连续增加,黄芪的病害问题逐渐凸显,严重制约着黄芪产业的持续性发展.其中黄芪根腐病尤为突出,该病发病的主要特点是根茎部产生大的褐色纵向或龟裂纹,地上部分长势衰弱,植株瘦小,严重时整株叶片枯黄、脱落.目前对于黄芪根腐病的研究已有一些进展,张艳芳[1]通过对黄芪病株的病根解剖观察,发现真菌通过侵染黄芪根部来汲取细胞中营养物质的同时产生抑制根部细胞正常生长的代谢产物,使得大量细胞解体死亡,最终导致植株死亡;陈玉萍[2]研究了黄芪感染根腐病时植物抗逆生理生化指标的变化,发现黄芪植株可以通过提高抗氧化能力来抵抗病害胁迫带来的伤害,但其防御系统的能力有限;罗光宏等[3]从河西走廊绿洲灌区的黄芪病根中分离并鉴定的尖孢镰刀菌(Fusarium xoysporum)与茄腐镰刀菌(Fusarium solani)为黄芪根腐病的主要致病菌;陈垣等[4]利用离体根部接种法回接鉴定的黄芪根腐病的致病菌为尖孢镰刀菌(Fusarium xoysporum)、茄腐镰刀菌(Fusarium solani)、立枯丝核菌(Rhizoctonia solani).本研究结合离体根部法与盆栽实验法对甘肃陇西栽培的黄芪根腐病致病性进行测定,并在经典形态学方法鉴定的基础上,结合分子技术对黄芪根腐病病原菌种类及其分类学地位进一步确认,以期为黄芪根腐病的防治提供依据.
1 材料与方法
1.1供试材料
2013年9—10月采集甘肃陇西黄芪栽培地典型染病黄芪病株.
1.2实验方法
1.2.1病原菌分离与纯化采用常规组织分离法[5]取病株根部病斑进行病原菌分离.取病株根部病健交界处4~5 mm组织,用70%乙醇消毒5 s,用0.1%HgCl2浸泡30 s,无菌水冲洗3次后,接种于PDA培养基上,27 ℃条件下培养,待菌丝长成熟后再进行单孢纯化培养,将纯化好的菌种置于4 ℃冰箱中保存.1.2.2致病性测定根据病原菌分离及初步的鉴定结果,选取代表性菌株进行回接致病性测定.采用离体根部接种法[5],将供试菌株制成4 mm的菌饼接种于刺伤的健康根段,菌丝面贴于刺伤根部,每株分离菌株做四次重复实验.置于27 ℃培养箱培养7 d后观察染病情况,将发病部位重新分离培养,观察分离到的菌种与初接菌种是否为同株,重新分离比率大于50%认为属于致病菌.采用盆栽实验二次鉴定,筛选当年采集的饱满的黄芪种子在30~40 ℃温水中浸泡过夜后,用3%的NaClO消毒30 min,蒸馏水冲洗后均匀撒入高温消毒灭菌后的土壤中[6],每盆5~8颗种子,于27 ~30 ℃温室中培养,待植株长到发有两轮或三轮真叶时将供试菌株用无菌水配成孢子悬浮液(约106个·mL-1),取约10 mL接种到健康植株根围,避光放置1 d后正常光照,以无菌水为对照,处理后持续观察植株发病情况,20 d后扣盆记录病情.
1.2.3病原菌的形态鉴定将经回接实验致病性测定的菌种接种在PDA培养基上,在27 ℃培养箱中培养7 d后,观察菌落特征.待产孢后,在显微镜下观察分生孢子形态特征,并参照相关资料[7-9],进行分类学鉴定.
1.2.4病原菌的基因序列分析鉴定分离得到的菌种在PDA培养基上经活化培养后取新鲜菌丝,加入石英砂充分研磨成粉末,用CTAB法提取DNA,用DNA纯化回收试剂盒(离心柱型TIANGEN)切胶回收纯化,用通用引物ITS1(5′-TCC GTAGGT GAACCT GCG G-3′)和ITS4(5′-TCC TCC GCT TAT TGA TAT GC-3′)对rDNA-ITS区段进行PCR扩增.PCR反应体系25 μL,premix EX Taq聚合酶12.5 μL,前后引物各1 μL,ddH2O 8.5 μL.PCR扩增的反应参数:94 ℃预变性5 min,94 ℃变性45 s,58 ℃退火45 s,72 ℃延伸1 min,共30个循环,最后72 ℃总延伸5 min,PCR扩增得到的产物送华大基因公司测序,测序结果提交GenBank数据库,用BLAST程序与已知序列进行比对分析,利用MEGA 5.0软件Neighbor-Joining方法进行聚类,选择1 000个重复做Bootstrap值分析,构建系统发育树.
2 结果与分析
2.1症状特征
根腐病主要危害黄芪的茎基与根部,植株染病后表现为叶片变黄萎蔫,茎基与主根上有红褐色干腐的纵裂或龟裂状条纹,侧根较少且多染病.病情严重时叶片大部分枯萎并脱落,同时主根上出现黑色的凹陷状病斑,且病株容易从土中拔出.
2.2病原菌的分离和致病性
通过常规分离法得到15株真菌,依据柯赫氏法则将培养物接种于刺伤的健康根段,观察病斑产生情况.通过统计,根部产病斑组织经重新分离得到原始接入的病株,且分离概率大于50%认为属于致病菌的菌种共5株.其中G2,G5重新分离得到概率为100%(图1).通过盆栽实验,将二次分离鉴定的致病菌株接种于栽培有健康黄芪植株的土壤中,观察植株长势,20 d后扣盆得到根部致病情况与离体根部接种法结果一致.染病菌株较正常菌株主根短,须根少伴有褐色网状病斑,叶片有萎蔫现象,其中G5菌株的致病性最高(图2).
2.3病原菌的鉴定
结合致病性测定结果,通过菌株显微形态特征鉴定出菌株G2,G3,G4为茄腐镰刀菌(Fusarium solani),G5, G6为尖孢镰刀菌(Fusarium xoysporum).茄腐镰刀菌的病原菌菌落白色、絮状、较稀疏,菌背白色或蓝绿色,菌丝无色、有隔,小型分生孢子呈椭圆状或短杆状、产孢结构单瓶梗状,大型分生孢子镰刀状、两端稍钝.尖孢镰刀菌的病原菌菌落白色、隆起、绒状、较厚,菌背白色或红褐色,菌丝无色、有隔,小型分生孢子椭圆状、少有梭状、产孢结构单瓶梗状,大型分生孢子镰刀状、两端较尖、多有隔.

图1 重新分离得到菌株G2(A)、G5(B)与对照组的根部接种结果
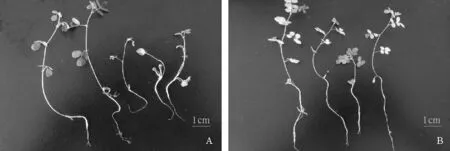
图2 菌株G5实验组A与对照组B盆栽实验结果

图3 基于rDNA ITS基因序列构建的病原菌株的系统发育树
通过ITS序列分析,经PCR扩增和正向测序得到镰刀菌菌株的序列长度分别为G2 541 bp,G3 521 bp,G4 524 bp,G5 500 bp,G6 538 bp.将这5株菌的序列通过BLAST与GenBank数据库中序列进行核酸序列一致性比对,选取一致性大于99%的菌株建立系统发育树,其中菌株G5与分离自加拿大番茄植株的病原菌尖孢镰刀菌(Fusarium oxysporum)(KF494069)具有100%相似性,菌株G4与分离自波兰马铃薯植株的病原菌茄腐镰刀菌(Fusarium solani)(KP264655)具有99%的相似性.结合显微形态、培养特征和rDNA ITS基因序列系统发育分析结果,鉴定菌株G5,G6为尖孢镰刀菌,菌株G2,G3,G4为茄腐镰刀菌,并获得登录号(KR997532-KR99753)(图3).
3 讨论
镰刀菌属(Fusarium)是半知菌类瘤座孢目最大的属,包含许多危害经济植物的种,其中尖孢镰刀菌和腐皮镰刀菌可引致多种栽培作物的枯萎病和苗木立枯病[10].黄仲生等[11]经分离鉴定的尖孢镰刀菌会致黄瓜枯萎病;李金花等[12]明确茄腐镰刀菌属于甘肃马铃薯干腐病的优势病原菌种;向征等[13]从新疆南疆枣树苗根茎部分离的尖孢镰刀菌、茄腐镰刀菌会致枣树根腐病.目前对黄芪根腐病致病菌的研究显示,根腐病的主要致病菌为尖孢镰刀菌与茄腐镰刀菌[3,4],与本研究结果一致.
植物病原菌的致病性测定方法依据病害类型的不同而不同,而植物根腐病致病菌的测定多采用盆栽实验法[14-15].近些年也出现一些更为简便的验证方法,如陈垣等[4]通过离体根部接种法取健康植株的根段对分离获得的病原菌进行测定;向征等[13]利用纸钵菌土法将材料在营养钵上培养后用孢子液侵染并对病原菌进行测定;本实验结合离体根部接种法与盆栽实验法对所分离到的菌株二次鉴定,以重新分离概率大于50%作为判定致病菌的依据,最终得到5株黄芪根腐病的致病菌株.
原有的对黄芪根腐病致病菌的鉴定主要依据经典分类学鉴定方法,由于镰刀菌是真菌中最难鉴定的属之一,其分类系统较多且不统一[16],通过经典分类学方法鉴定有一定的难度和不确定性,而分子生物学方法却能弥补传统方法分类依据中的不足,其中序列rDNA-ITS具有高度的保守性,成为鉴定真菌非常好的辅助手段[14].
本研究将分子手段与传统鉴定方法相结合对分离于黄芪病株的致病菌进行鉴定,结果表明通过致病性测定得到的5株病原真菌均属于镰刀菌属,结合产孢结构与孢子形态等特征综合分析,最终确定菌株G2,G3,G4为茄腐镰刀菌(Fusarium solani),G5,G6为尖孢镰刀菌(Fusarium oxysporum),结合文献[3,4,17],认为茄腐镰刀菌与尖孢镰刀菌是黄芪根腐病的主要致病菌株.目前针对黄芪根腐病病害已开展了一些生物防治方面的工作,通过利用有机肥料、植物提取液、生防真菌等手段针对主要致病菌菌丝进行生长抑制,从而达到控制病情的效果.本实验后期研究已筛选获得了对分离到的致病菌具有生防能力的放线菌.由于真菌病害所引起的农作物减产一直都是影响农业发展的主要问题[18],故该研究结果为后续黄芪根腐病的防治工作提供了一定的理论支撑.
[1]张艳芳.黄芪根腐病病根的形态及解剖学研究[D].兰州:西北师范大学,2013.
[2]陈玉萍.黄芪根腐病病原菌的致病性及其对植物抗逆生理生化指标的影响[D].兰州:西北师范大学,2013.
[3]罗光宏,陈叶,王振,等.黄芪根腐病发生危害与防治[J].植物保护,2005,31(4):74.
[4]陈垣,朱蕾,郭凤霞,等.甘肃渭源蒙古黄芪根腐病病原菌的分离与鉴定[J].植物病理学报,2011,41(4):428.
[5]方中达.植病研究方法[M].北京:中国农业出版社,1998:46.
[6]陈健.黄芪根腐病病原菌的鉴定及其抑菌活性物质筛选[D].兰州:西北师范大学,2011.
[7]王拱辰,郑重,叶琪明,等.常见镰刀菌鉴定指南[M].北京:中国农业出版社,1996:1.
[8]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:609.
[9]BOOTH C.Fusarium.Laboratory Guide to the identification of the Major Species[J].Transaction of the British Mycological Society,1977,69(3):521.
[10]邢来君,李明春.普通真菌学[M].北京:高等教育出版社,1999:426.
[11]黄仲生,黄习军,杨玉茄,等.京郊黄瓜枯萎病病原菌鉴定初报[J].植物病理学报,1984,14(4):249.
[12]李金花,王蒂,柴兆祥,等.甘肃省马铃薯镰刀菌干腐病优势病原的分离鉴定[J].植物病理学报,2011,41(5):456.
[13]向征,钟聪慧,胡军,等.新疆南疆枣树根腐病病原的分离与鉴定[J].植物病理学报,2015,45(1):80.
[14]谢慧婷,谭海文,唐小丽,等.迷迭香根腐病病原菌的鉴定[J].植物病理学报,2013,43(2):211.
[15]杨成德,王振,代万安,等.西藏设施茄子镰孢根腐病病原菌的分离及鉴定[J].植物保护,2015,41(3):123.
[16]张素轩.镰刀菌属分类进展[J].真菌学报,1991,10(2):85.
[17]赵庆芳,周紫娟,王树红,等.7种植物对黄芪根腐病病原菌的抑制作用研究[J].西北师范大学学报(自然科学版),2009,45(5):92.
[18]令利军,雷蕾,冯蕾,等.独角莲内生细菌TG116的分离鉴定及抑菌特性研究[J].西北师范大学学报(自然科学版),2014,50(5):91.
(责任编辑俞诗源)
Isolation and identification of pathogens causing Astragalus membranaceus root rot in Gansu Longxi
NIU Shi-quan,GENG Hui,HAN Cai-hong,YAN Wei-ru,DA Wen-yan
(College of Life Science,Northwest Normal University,Lanzhou 730070,Gansu,China)
Root rot is one of an Astragalus membranaceus disease seriously affecting Astragalus membranaceus production.The main pathogen are Fusarium solani and Fusarium oxysporum.In this study,the root of Astragalus membranaceus obtained from Gansu Longxi are isolated with pathogens,and then tested its pathogenicity through tissue isolation,root inoculation,pot experiment.Finally,obtained 5 strains of Astragalus membranaceus root rot pathogens,stain G2,G3 and G4 are identified to Fusarium solani,strain G5 and G6 are identified to Fusarium oxysporum by culture characteristics,microscopic morphology and rDNA ITS sequences analysis.
Astragalus membranaceus;root rot;pathogen;isolation;ITS sequences analysis;identification
10.16783/j.cnki.nwnuz.2016.02.015
2015-11-24;修改稿收到日期:2015-12-21
国家自然科学基金资助项目(31260134)
牛世全(1963—),男,甘肃陇西人,教授.主要研究方向为极端环境微生物资源与生态.
E-mail:sqniu@nwnu.edu.cn
S435.672
A
1001-988Ⅹ(2016)02-0075-04
