桑椹提取物与叶黄素联合干预对视网膜光损伤小鼠抗氧化能力的影响
2016-09-07陈春艳钱彩虹
陈春艳,钱彩虹
(湖北生物科技职业学院,武汉 430070)
桑椹提取物与叶黄素联合干预对视网膜光损伤小鼠抗氧化能力的影响
陈春艳,钱彩虹
(湖北生物科技职业学院,武汉430070)
目的:评价桑椹提取物和叶黄素联合干预对光损伤视网膜的抗氧化能力。方法:75只小鼠分为正常对照组、模型对照组和低、中、高剂量给药组,采用自制光照箱进行造模,检测视网膜组织的超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、总抗氧化能力(T-AOC)活力以及丙二醛(MDA)含量。结果:光照导致小鼠视网膜组织中SOD、GSH-Px、CAT和T-AOC活力显著下降,MDA含量显著增加,摄入低、中、高剂量受试物后,与模型对照组相比,SOD活力分别增加24.0%、50.4%和77.3%、GSH-Px活力分别增加13.9%、38.0%和56.5%、CAT活力分别增加26%、69.1%和93.5%、T-AOC活力分别增加15.4%、38.5%和46.2%、MDA含量分别降低20.0%、35.6%和47.2%,其中中、高剂量组具有显著性差异(P<0.05)。结论:桑椹提取物和叶黄素联合干预对视网膜光损伤小鼠具有抗氧化作用。
桑椹提取物;叶黄素;视网膜光损伤;抗氧化能力
视网膜容易受到强光的影响而造成视觉功能障碍、光诱导视网膜损伤等,从而造成细胞一系列损伤、凋亡、生物膜溶解和细胞坏死,导致感光细胞的凋亡和视网膜变性[1]。环境和人造光源都是视网膜损伤的潜在威胁[2,3],因此研究筛选具有保护视网膜光损伤的活性成分具有非常重要的意义。氧化损伤是光导致视网膜损伤的机制之一,感光细胞外节盘膜中含有高水平的长链多不饱和脂肪酸,其对感光细胞具有保护作用,但易于氧化,慢性持续的光损伤会使眼内自由基的浓度增加,产生单线态氧、过氧化氢及羟基自由基等一系列自由基,作用于长链多不饱和脂肪酸产生脂质过氧化产物,破坏细胞膜的完整性、流动性,严重影响细胞功能[4-7]。桑椹是桑科桑属植物成熟果穗的统称,我国桑椹资源非常丰富,除青藏高原外,全国各地均有栽培。桑椹提取物中富含黄酮、糖类及生物碱等多种生物活性成分,其中桑椹多糖提取物具有显著的清除自由基作用[8,9];叶黄素可与细胞膜上的脂类结合,有效地抑制脂类的氧化反应,减轻氧化产物对视网膜的毒害[10,11]。叶黄素与桑椹提取物联合干预对视网膜光损伤的保护作用还未见报道。本文以视网膜光损伤小鼠模型为研究对象,研究桑椹提取物和叶黄素联合干预对氧化损伤的保护作用,为具有缓解视疲劳功能食品的研发提供科学依据。
1 材料与方法
1.1材料与试剂
复方托吡卡胺滴眼液,沈阳兴齐眼药股份有限公司;氯霉素滴眼液,沈阳神龙药业有限公司;SOD、MDA、CAT、GSH-PX和T-AOC检测试剂盒,南京建成公司;BCA蛋白浓度测定试剂盒,碧云天公司;桑椹,市售;5%叶黄素,DSM公司。
1.2仪器与设备
SpectraMaxM2e酶标仪,美国Molecular公司;TES-1332A照度计,泰仕电子工业股份有限公司;DY89-Ⅱ型电动玻璃均浆机,宁波新芝生物科技有限公司;白色荧光灯(85W),中山市重诚照明电器有限公司。
1.3实验动物
健康成年昆明小鼠75只,购于湖北省疾病预防控制中心,雌雄不限,体重约25~32g,经前节及眼底检查无眼部疾病。动物房内通风良好,自然昼夜光线照明。小鼠适应性喂养3d后开始实验。
1.4实验方法
1.4.1动物分组和造模给药75只小鼠分为正常对照组、光损伤模型对照组和低、中、高剂量给药组,每组5只,除正常对照组外,均进行光照处理。采用自制光损伤箱造模,箱的体积为1m3,箱内6个面均装有36W的冷光源荧光灯共20个,箱顶装有排风扇,光照箱四周及底部设有密集的通风小孔,用数字式光照度计检测箱内的光照度为16 000~18 000lx。动物分组光照,每组5只。光照前先暗适应12h,于光照前30min,用复方托吡卡胺眼药水对所有的动物进行双眼散瞳,然后光照12h,再进行暗适应,连续3个循环,总光照时间为36h。在光照全过程中箱内温度保持在28~32℃。光照前给药2W、光照后给药1W。低、中、高给药剂量按照成人每日每kg体重摄入量(成人桑椹和叶黄素每天推荐在摄入量分别为3g、10mg)的5、10、20倍给药,即小鼠桑椹给药剂量分别为0.25、0.5、1g/kg;叶黄素给药剂量分别为0.88、1.767、3.534mg/kg,桑椹10倍水95℃温度下提取2次,每次40min,合并浓缩至合适浓度获得桑椹多取物,加叶黄素微囊粉制成混悬液灌胃,低、中、高给药组小鼠灌胃量分别为0.1、0.2、0.4mL/20g。
1.4.2视网膜组织中SOD、MDA、CAT、GSH-PX和T-AOC检测各组小鼠取眼球,在冰盘上小心将眼球沿角巩膜缘剪开,去除眼前节、晶体及玻璃体,剥除视网膜组织,用滤纸吸掉表面多余液体,置于EP管中,保存于-80℃超低温冰箱中,待检测生化指标(SOD、MDA、CAT、GSH-PX和T-AOC)使用。制备视网膜组织匀浆时,取出保存在-80℃液氮冰箱中的视网膜组织标本,分析天平准确称量待测标本的重量,按重量体积比1∶9 加冰生理盐水,在冰水浴下用研磨棒将EP管中视网膜组织研磨成组织匀浆。4℃、2 500r/min低温高速离心机离心15min,取上清液备用。BCA蛋白浓度、SOD、MDA、CAT、GSH-PX和T-AOC根据试剂盒说明检测。
1.5统计方法
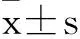
2 结果与分析
2.1桑椹提取物和叶黄素联合干预对视网膜组织中MDA含量的影响
视网膜在过量光照环境中视网膜发生脂质过氧化,会产生大量包括MDA的活性醛类物质,这些脂质过氧化产物能够影响DNA功能,影响DNA的合成、裂解及转录,可损伤生物膜结构,使视网膜的脂类受到不可逆损伤[12,13]。图1表明,光照能导致小鼠视网膜组织中MDA含量显著增加,而摄入低、中、高受试物后,与模型组相比,MDA含量分别下降20.0%、35.6%和47.2%,其中,中、高剂量组具有显著性差异(P<0.05)。

图1 受试物对光损伤小鼠视网膜组织MDA含量的影响注:#表示与正常组相比具有显著性差异(P<0.05);*表示与模型组相比具有显著性差异(P<0.05),下同
2.2桑椹提取物和叶黄素联合干预对视网膜组织中SOD活力的影响
外源性SOD作为一种抗氧化酶对视网膜的保护作用在以往大量实验中已得到证实[14]。图2结果表明,光照导致小鼠视网膜组织中SOD活力显著下降(P<0.05),光照射后视网膜组织中SOD活力降低而MDA含量升高,小鼠视网膜组织产生了自由基代谢紊乱现象[13],而摄入低、中、高剂量受试物小鼠,与模型对照组相比,SOD活力分别增加24.0%、50.4%和77.3%,其中,中、高剂量组具有显著性差异(P<0.05)。

图2 受试物对光损伤小鼠视网膜组织SOD活力的影响
2.3桑椹提取物和叶黄素联合干预对视网膜组织中CAT的影响
CAT也是体内重要的抗氧化酶系之一,SOD或者CAT活力下降,氧自由基可损伤关键性亚细胞结构[15]。图3结果表明,光损伤小鼠模型视网膜组织中CAT活力与正常组对比下降57%(P<0.05);摄入低、中、高剂量受试物后,与模型对照组相比CAT活力分别增加26%、69.1%和93.5%,其中中、高剂量受试物有显著性差异(P<0.05)。

图3 受试物对光损伤小鼠视网膜组织CAT活力的影响
2.4桑椹提取物和叶黄素联合干预对视网膜组织中GSH-Px的影响
抗氧化物酶活力的高低间接反映了机体清除氧自由基的能力[16]。图4结果表明,光损伤模型小鼠视网膜组织中GSH-Px活力显著下降(P<0.05),低、中、高剂量模型小鼠中GSH-Px活力与模型对照组比较,分别增加13.9%、38.0%和56.5%,具有剂量效应关系,其中,中、高剂量受试物有显著性差异(P<0.05)。

图4 受试物对光损伤小鼠视网膜组织GSH-Px活力的影响
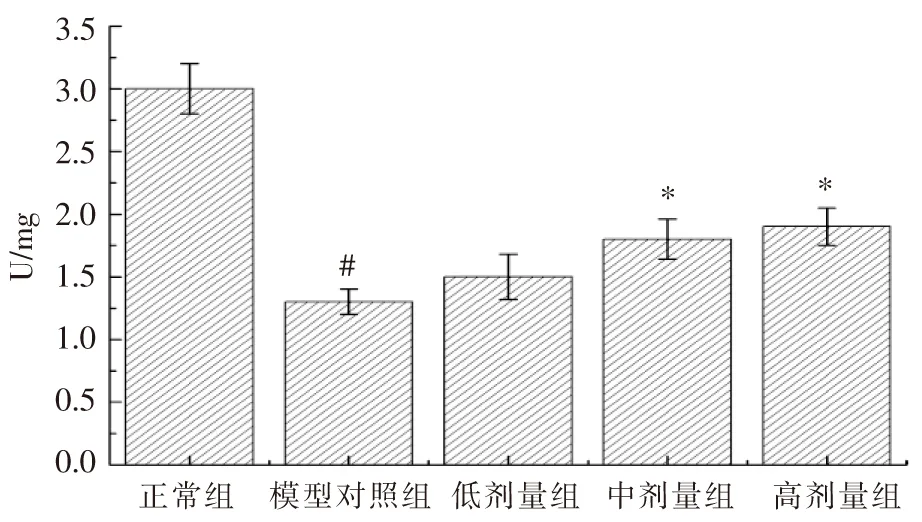
图5 受试物对光损伤小鼠视网膜组织T-AOC活力的影响
2.5桑椹提取物和叶黄素联合干预对视网膜组织中T-AOC的影响
在机体防御体系中,T-AOC能全面地反映动物机体的抗氧化状态,其作用是维持内环境活性氧的动态平衡,清除过高的活性氧,使机体处于氧化还原相对稳定的状态[17]。图5结果表明,光照损伤小鼠模型视网膜组织中T-AOC活力与正常对照组相比显著下降(P<0.05),低、中、高剂量模型小鼠中GSH-Px活力与模型对照组比较,分别增加15.4%、38.5%和46.2%,具有剂量效应关系,其中,中、高剂量受试物有显著性差异(P<0.05)。
3 结论
本文研究结果表明,强烈的光照射可导致小鼠视网膜抗氧化能力显著下降,表现在视网膜组织抗氧化酶系活性降低、产生过量的丙二醛脂质过氧化产物,进而影响视网膜功能。采用不同剂量的桑椹提取物和叶黄素对光损伤小鼠模型联合干预后,视网膜组织中SOD、GSH-Px和CAT等3个抗氧化体系保护酶活性显著增加,从而显著阻止了脂质过氧化产物的生产,MDA含量显著下降,最终表现为能代表机体总体抗氧化状态的T-AOC活性显著增强,以上作用具有剂量效应关系,因此桑椹提取物和叶黄素联合干预能有效抑制光损伤导致小鼠视网膜组织氧化应激过程。以上结果为缓解视疲劳保健食品研发提供了一定的科学依据。◇
[1]郭星,梅妍.视网膜光化学损伤机制的研究进展[J].四川解剖学杂志,2012,20(4):61-64.
[2]MainsterMA,etal.Potentialretinalhazards:instrumentandenvironmentlightsourse[J].Ophthalmology,1983,90:927-932.
[3]CruickshanksKJ,etal.Sunlightandagerelatedmaculardegeneration[J].ArchOphthalmol,1993,111:514-518.
[4]刘爱琴,等.视网膜光化学损伤机制及其防治的研究进展[J].中国中医眼科杂志,2003,13(4):229-233.
[5]BindewaldA,etal.Classificationofabnormalfundusauto-fluorescencepatternsinthejunctionalzoneofgeographicatrophyinpatientswithagerelatedmaculardegeneration[J].BrJOphthalmol,2005,89:874-878.
[6]ChenE.Inhibitionofcytochromeoxidaseandblue-lightdamageinratretina[J].GraefesArchClinExpOphthalmol,1993,231(7):416.
[7]尤新.叶黄素和叶黄素酶的护眼功能[J].中国食物与营养,2015,21(7):79-80.
[8]李颖,李庆典.桑椹多糖抗氧化作用的研究[J].中国酿造,2010,217(4):59-61.
[9]王锐,何嵋,袁晓春,等.桑椹多糖体外清除自由基活性研究[J].安徽农业科学,2012,40(2):775-776,779.
[10]马乐,林晓明.叶黄素对视网膜光损伤的保护作用与机制[J].中国慢性病预防与控制,2007,15(4):405-407.
[11]KrinskyNI,etal.Carotenoidactionsandtheirrelationtohealthanddisease[J].MolAspectsMed,2005,26:459-516.
[12]VoulgaridouGP,etal.DNAdamageinducedbyendogenousaldehydes:currentstateofknowledge[J].MutatRes,2011,711(1-2):13-27.
[13]方圆,等.α-倒捻子素对小鼠视网膜光损伤的保护作用[J].国际眼科杂志,2015,15(7):1143-1147.
[14]张文华,等.小鼠视网膜紫外线光损伤中MDA与SOD的作用[J].国际眼科杂志,2010,10(8):1490-1492.
[15]季宇彬,杨书良,谷春山.羊栖菜多糖对L615小鼠LPO含量及GR、GSH-Px、CAT和SOD活性的影响[J].中国海洋药物,1994,50(2):20-23.
[16]SilvestraF,etal.DifferentialproteexpressionprofilesinanteriorgillsofEriocheirsinensisduringaccmationtocadmium[J].AquatToxicol,2006,79:46-58.
[17]李焰,等.银杏叶复方对实验性脾虚证模型小鼠消化酶活性和抗氧化性能的影响[J].中国畜牧杂志,2010,46(21):52-55.
(责任编辑李婷婷)
Effects of Fructus mori Extracts and Lutein on Antioxidant Capability in Mice After Retinal Light Exposure
CHEN Chun-yan,QIAN Cai-hong
(Hubei Vocational College of Bio-technology,Wuhan 430070,China)

Fructus moriextracts;lutein;retinallightdamage;antioxidantcapability
FoodandNutritioninChina
陈春艳(1980—),女,硕士,讲师,研究方向:天然产物化学。
