地塞米松对抗大鼠急性肺损伤的作用及其机制
2016-09-06符榕
符榕
(天津儿童医院,天津300000)
·基础研究·
地塞米松对抗大鼠急性肺损伤的作用及其机制
符榕
(天津儿童医院,天津300000)
目的观察地塞米松(Dex)对脂多糖(LPS)、抗盐酸(HCl)、LPS+HCl所致大鼠急性肺损伤的作用,并探讨其机制。方法将64只雄性SD大鼠随机分为NS组、LPS组、HCl组、LPS+HCl组、NS+Dex组、LPS+Dex组、HCl+Dex组、LPS+HCl+Dex组,每组8只。NS组大鼠尾静脉注射生理盐水0.6 mL。LPS组尾静脉注射LPS 8 mg/kg。HCl组气管内缓慢滴注 pH为1.8的盐酸2 mL/kg。LPS+HCl组先尾静脉注射LPS 4 mg/kg,4 h后气管内缓慢滴注pH为1.8的盐酸0.5 mL/kg。NS+Dex组、LPS+Dex组、HCl+Dex组、LPS+HCl+Dex组先分别按照NS组、LPS组、HCl组、LPS+HCl组方法给药,然后腹腔注射Dex 2 mg/kg。4 h后处死大鼠。取血采用ELISA法检测血清TNF-α、IL-4。取支气管肺泡灌洗液(BALF)离心,计数细胞沉淀中白细胞总数,取上清液用考马斯亮兰法检测蛋白总量,用ELISA法检测TNF-α、IL-4水平。取肺组织行病理学观察,并计算肺湿/干重比(W/D),用RT-PCR检测肺组织中性粒细胞弹性蛋白酶(NE)mRNA。结果与NS组相比,LPS组、HCl组、LPS+HCl组大鼠肺组织病理改变较重,肺W/D、BALF中白细胞总数及总蛋白含量升高,血清和BALF中TNF-α、IL-4升高,肺组织NE mRNA表达升高(P均<0.05)。上述指标LPS+Dex组低于LPS组,LPS+HCl+Dex组低于LPS+HCl组(P均<0.05),HCl+Dex组和HCl组差异无统计学意义。结论Dex可对抗LPS、HCl、LPS+HCl所致大鼠急性肺损伤,其机制与降低NE有关。与LPS、LPS+HCl所致急性肺损伤相比,Dex对HCl所致大鼠急性肺损伤干预效果较差。
糖皮质激素;地塞米松;急性肺损伤;细胞因子;中性粒细胞弹性蛋白酶;盐酸;脂多糖
急性肺损伤可进行性加重发展为成人呼吸窘迫综合征(ARDS),危及患者生命,病死率高。其特征性表现是肺微血管通透性增加,弥漫性肺泡浸润,肺水肿以及严重低氧血症[1,2]。中性粒细胞弹性蛋白酶(NE)对急慢性炎性疾病的组织和器官损伤有重要作用,已成为许多炎性疾病的治疗靶点。NE由活化的中性粒细胞分泌,在急性肺损伤的病理生理过程中发挥重要,肺组织NE表达与患者预后存在一定相关性[3]。糖皮质激素对不同诱因急性肺损伤的疗效差异很大,机制尚未阐明。2015年1~3月,我们分别用脂多糖(LPS)、盐酸(HCl)和LPS+HCl建立大鼠急性肺损伤模型,并用地塞米松(Dex)处理,观察Dex对不同原因导致的大鼠急性肺损伤的对抗作用,并探讨其机制。
1 材料与方法
1.1材料健康雄性SD大鼠64只,体质量250~300 g,购自河北医科大学动物中心。大肠杆菌LPS购自Sigma公司,地塞米松磷酸钠注射液购自石家庄制药厂,考马斯亮蓝蛋白测定试剂盒购自南京建成生物公司,TNF-α、IL-4 ELISA检测试剂盒购自上海森雄科技实业有限公司(进口分装),RT-PCR试剂盒购自Promega公司。β-actin引物序列上游5′-AGCCATGTACGTAGCCATCC-3′,下游5′-ACCCTCATAGATGGGCACAG-3′,扩增片段长度115 bp;NE 引物序列上游5′-TCTCCACCGACCATCCAAC-3′,下游5′-GTCATGTCAGCAGCCCACTG-3′,扩增片段长度185 bp。
1.2动物分组及处理将64只雄性SD大鼠随机分为NS组、LPS组、HCl组、LPS+HCl组、NS+Dex组、LPS+Dex组、HCl+Dex组、LPS+HCl+Dex组,每组8只。正常对照组大鼠尾静脉注射生理盐水0.6 mL。LPS组尾静脉注射LPS 8 mg/kg。HCl组气管内缓慢滴注 pH为1.8的盐酸2 mL/kg。LPS+HCl组先尾静脉注射LPS 4 mg/kg,4 h后气管内缓慢滴注pH为1.8的盐酸0.5 mL/kg。NS+Dex组、LPS+Dex组、HCl+Dex组、LPS+HCl+Dex组先分别按照NS组、LPS组、HCl组、LPS+HCl组方法给药,然后腹腔注射Dex 2 mg/kg。4 h后处死大鼠。
1.3观测指标及方法
1.3.1肺组织形态学变化用4%甲醛固定右肺下叶24 h,行HE染色,普通光镜下观察肺组织病理改变。
1.3.2支气管肺泡灌洗液(BALF)中白细胞计数及蛋白总量测定钳夹左肺肺门,行气管插管,用4 ℃无菌生理盐水3 mL行左肺灌洗,反复3次,回收后用两层纱布过滤BALF,1 200 r/min、4 ℃离心10 min。取上清液用考马斯亮兰法检测蛋白总量。蛋白含量(g/L)=[(测定管吸光度-空白管吸光度)/(标准管吸光度-空白管吸光度)]×标准管浓度(g/L)。取细胞沉淀用血细胞计数板在光学显微镜下计数白细胞总数。
1.3.3肺组织湿/干比(W/D)测定先称量切下的右肺后叶和副叶湿重,然后将其置于烤箱80 ℃烘烤48 h,取出称量干重,计算W/D。
1.3.4血清、BALF中TNF-α、IL-4水平检测心脏穿刺取液,3 000 r/min、4 ℃下离心10 min,吸取上清,用ELISA法检测TNF-α、IL-4水平,操作按试剂盒说明书进行。同法检测BALF上清液中TNF-α、IL-4水平。
1.3.5肺组织NE mRNA检测取右肺前叶肺组织100 mg,TRIzol试剂抽提组织总RNA,取2 g总RNA,采用RT-PCR试剂盒合成cDNA,PCR 扩增反应条件为: 94 ℃预变性2 min,其后94 ℃变性1 min,56 ℃退火1 min,72 ℃延伸2 min,共25个循环,最后72 ℃延伸5 min。在2%琼脂糖凝胶中电泳,采用凝胶成像分析系统获取图像,测定电泳带吸光度值,以β-actin作为内参照,计算NE mRNA相对表达量。
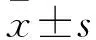
2 结果
2.1各组肺组织形态学比较肉眼观NS组肺组织呈粉红色,无水肿、渗液、淤点淤斑。LPS组肺组织为暗红色,存在典型的出血及水肿。HCl组肺组织体积增大,出血和水肿也很明显,切面呈红色实变,有粉红色泡沫样液体流出。LPS+HCl组肺组织出血水肿更为明显,部分肺组织实变。NS+Dex组、LPS+Dex组、HCl+Dex组、LPS+HCl+Dex组病理改变与NS组、LPS组、HCl组、LPS+HCl组相比均有不同程度的减轻。光镜下观察NS组肺泡结构清晰,具有正常的肺泡隔。LPS组、HCl组和LPS+HCl组均有不同程度的肺组织破坏、毛细血管扩张、充血、肺泡隔增厚、大规模白细胞浸润、肺泡和间质水肿和出血、局灶性肺不张等。LPS组主要表现肺泡隔增厚和白细胞浸润;HCl组主要是气管上皮细胞脱落和肺泡水肿渗出;LPS+HCl组介于两组之间。NS+Dex组、LPS+Dex组、LPS+HCl+Dex组病理改变与NS组、LPS组、LPS+HCl组相比均有不同程度的减轻,HCl+Dex组和HCl组差异不明显。
2.2各组肺组织W/D比较各组肺组织W/D见表1。由表1可见,与NS组比较,LPS组、HCl组、LPS+HCl组肺组织W/D均升高(P均<0.05)。NS+Dex组肺组织W/D低于NS组,LPS+Dex组肺组织W/D低于LPS组,LPS+HCl+Dex组肺组织W/D低于LPS+HCl组(P均<0.05),HCl+Dex组和HCl组肺组织W/D差异无统计学意义。
2.3各组BALF中白细胞总数、总蛋白含量比较各组BALF中白细胞总数、总蛋白含量见表1。由表1可见,与NS组比较,LPS组、HCl组、LPS+HCl组BALF中白细胞总数和总蛋白含量明显升高(P均<0.05),且HCl组和LPS+HCl组均高于LPS组(P均<0.05)。上述指标NS+Dex组低于NS组,LPS+Dex组低于LPS组,LPS+HCl+Dex组低于LPS+HCl组(P均<0.05),HCl+Dex组和HCl组差异无统计学意义。NS+Dex组、LPS+Dex组、LPS+HCl+Dex组、HCl+Dex组上述指标与NS组、LPS组、HCl组、LPS+HCl组相比均明显降低(P均<0.05)。

表1 各组肺组织W/D和BALF中白细胞总数、总蛋白含量比较±s)
注:与NS组比较,*P<0.01;与NS+Dex组比较,△P<0.05;与LPS 组比较,▲P<0.05;与HCl组比较,▼P<0.05;与LPS+HCl组比较,#P<0.05;与LPS+Dex组比较,※P<0.05。
2.4各组血清和BALF中TNF-α、IL-4比较各组血清和BALF中TNF-α、IL-4见表2。由表2可见,与NS组比较,LPS组、HCl组、LPS+HCl组血清和BALF中TNF-α、IL-4升高(P均<0.05);上述指标NS+Dex组低于NS组,LPS+Dex组低于LPS组,LPS+HCl+Dex组低于LPS+HCl组(P均<0.05),HCl+Dex组和HCl组差异无统计学意义。
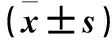
表2 各组血清和BALF中TNF-α、IL-4比较
注:与NS组比较,*P<0.01;与LPS组比较,▲P<0.05;与LPS+HCl组比较,#P<0.05;与NS+Dex组比较,△P<0.05;与HCl+Dex组比较,■P<0.05。
2.5各组肺组织NE mRNA比较各组肺组织NE mRNA见表3。与NS组比较,LPS组、HCl组、LPS+HCl组肺组织NE mRNA表达均升高(P均<0.05);NS+Dex组肺组织NE mRNA低于NS组,LPS+Dex组肺组织NE mRNA低于LPS组,LPS+HCl+Dex组肺组织NE mRNA低于LPS+HCl组(P均<0.05),HCl+Dex组和HCl组肺组织NE mRNA差异无统计学意义。
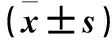
表3 各组肺组织NE mRNA比较
注:与NS组比较,*P<0.01;与NS+Dex组比较,△P<0.05;与LPS组比较,▲P<0.01;与LPS+HCl组比较,#P<0.05。
3 讨论
急性肺损伤是临床常见危重症,也是多脏器功能障碍(MODS)或全身炎症反应综合征(SIRS)时最先出现的组织损伤。内毒素、失血性休克、缺氧、外伤、烧伤、缺血再灌注及机械通气等因素均可造成肺损伤,还可以放大肺损伤中的炎症反应过程,引起严重的肺功能障碍,因此急性肺损伤发病率和病死率较高[4]。肺是SIRS的主要靶器官,失控的炎症反应是急性肺损伤的本质,其特征表现为活化的中性粒细胞的大量浸润、毛细血管的通透性增加、弥漫性肺泡损伤、高水平活性氧和蛋白酶释放,从而导致肺泡内水肿、纤维蛋白沉积、透明膜形成和Ⅰ型肺泡上皮细胞的破坏。临床表现上为顽固低氧血症,PaO2/FiO2下降,胸片示双侧肺浸润,肺顺应性下降[5]。临床上,直接和间接的肺损伤均可导致ARDS,肺内直接原因包括胃内容物吸入、肺炎,肺外间接原因包括败血症、失血性休克、严重创伤、输血或胰腺炎[6]。研究表明,脓毒症是急性肺损伤发展的最高危因素,胃内容物误吸仅次于脓毒血症[7]。人类急性肺损伤的发生和发展是非常复杂的,很少由单一因素引起。相比LPS或者HCl一次打击模型,LPS+HCl二次打击模型更能准确地代表患者常见的病理状态。本研究建立了LPS尾静脉注射和HCl气管滴入的一次打击模型以及LPS+HCl二次打击模型,来模拟脓毒症和(或)误吸导致的急性肺损伤甚至ARDS,探讨细胞因子及NE在不同诱因急性肺损伤患者肺组织和血液中的表达及激素干预效果。
肺组织病理学检查所见、肺组织W/D和BALF中总蛋白含量是反映肺损伤程度的经典指标。本研究LPS、HCl、LPS+HCl组光镜下可见到相似的病理改变,如肺组织破坏。LPS组有大量炎细胞浸润,间质水肿、毛细血管淤血更明显,肺泡隔增厚。HCl组以肺泡腔内改变为主,多见气管上皮脱落,肺泡腔大量水肿液渗出,可合并肺泡出血导致肺实变。而LPS+HCl组纤维蛋白渗出、炎细胞浸润均可多见,但上皮脱落轻于HCl组。LPS、HCl、LPS+HCl组肺W/D和BALF中总蛋白含量均高于NS组,表明HCl吸入直接引起的上皮和内皮细胞损伤较严重,肺泡微血管通透性进一步增加,富含蛋白质的水肿液大量渗出,导致明显的肺水肿。近年来研究表明,中性粒细胞是急性肺损伤炎症反应中重要的效应细胞。中性粒细胞激活和招募在急性肺损伤的发生进展中起着重要作用[8]。中性粒细胞是数量最多的人免疫细胞,在天然免疫防御中起重要作用,形成抵御微生物入侵的第一线。中性粒细胞被迅速激活,黏附到血管壁或者聚集到靶器官加重微循环障碍(通常肺是第一个目标),可导致和加重急性肺损伤,是急性炎症反应的主要环节。活化的中性粒细胞可释放多种细胞毒性物质,包括活性氧和蛋白酶,参与炎症反应的调节[9,10]。抑制和消除局部的中性粒细胞可能会减弱急性肺损伤。本研究结果显示,LPS、HCl、LPS+HCl组BALF中白细胞总数明显高于对照组。
炎症介质、细胞因子介导的全身炎症级联反应是导致急性肺损伤的重要机制[11~13]。促炎因子水平可以反映急性肺损伤或ARDS的严重程度。TNF-α是最重要的致炎细胞因子, 也是多种细胞因子的启动因子。肺局部炎症可激活炎性细胞,活化或启动促炎细胞因子(如 IL-1β、IL-8)。TNF-α反过来可直接损伤肺血管内皮细胞,增加内皮细胞的通透性,造成肺水肿,同时能刺激中性粒细胞释放炎性介质,引起炎症级联反应,加重肺损伤[14,15]。本研究结果显示,LPS、HCl、LPS+HCl组血清和BALF中TNF-α均较NS组升高。 IL-4是新发现的抗炎因子,可抑制TNF-α的生成,在炎症反应中主要起抗感染和免疫抑制作用[16]。促炎因子和抑炎因子失衡是急性肺损伤发生发展的重要原因。在急性肺损伤中炎性因子和抑炎因子含量均增加,但抑炎因子含量相对较低,且时间滞后[17]。
NE是储存于中性粒细胞胞质中的丝氨酸蛋白酶,属于糜蛋白酶家族,位于体液性介质网络的下游,它结合活性氧以帮助吞噬溶酶体降解吞噬的微生物,消化和降解细胞外基质组分及上皮连接结构,不仅可引起直接组织损伤,同时也放大炎性反应,刺激中性粒细胞趋化因子的合成和释放,有助于中性粒细胞趋化、迁移。被招募激活的中性粒细胞脱颗粒,释放出更多的蛋白酶,触发瀑布样级联反应,引起持续的炎症反应[18,19]。这种促炎反应并不局限于肺,也可延伸进入体循环,导致SIRS和MODS。NE是监测急性肺损伤或ARDS进展的指标,可用来判断急性肺损伤患者的预后。抑制NE可改善急性肺损伤患者的结局,防治急性肺损伤后肺纤维化。NE抑制剂已被推荐用于急性肺损伤的治疗[20,21]。研究表明,NE抑制剂具有治疗纤维增生阶段急性肺损伤或ARDS的能力[22]。本研究发现,LPS、HCl、LPS+HCl组肺组织NE mRNA与NS组相比升高。与以往研究结果符合[23,24]。
Dex是一种常用糖皮质激素,能稳定细胞膜,抑制促炎细胞因子的释放,有镇静、止痛和抗交感神经作用[25,26]。由于其较强的抗炎效应,Dex在急性肺损伤或ARDS中已经得到广泛的应用,但在临床应用中,Dex的适应证、剂量和疗程仍有很大争议。本研究结果显示,Dex可以对抗LPS和LPS+HCl所致的肺损伤,但对HCl所致肺损伤效果较差,说明Dex对不同原因导致的急性肺损伤的治疗作用存在差异,这可能受疾病种类、肺内外部炎症反应、肺损伤发病机制等因素影响。笔者推测其机制可能与Dex抑制TNF-α等促炎细胞因子的表达和释放、抑制中性粒细胞脱颗粒、改善急性肺损伤时的Th1/Th2细胞比例有关[ 27~29]。另外Dex可以抑制急性肺损伤时肺组织NE的释放,从而改善局部蛋白酶-抗蛋白酶的失衡,对抗急性肺损伤。
[1] 赵存华.胸外伤并发急性呼吸窘迫综合征的诊治分析[J].中国煤炭工业医学杂志, 2012, 15(9):1380-1381.
[2] Herridge MS. Recovery and long-term outcome in acute respiratory distress syndrome[J]. Crit Care Clin, 2011,27(3):685-704.
[3] Miura M, Sugiura T, Aimi Y, et al. Effects of ulinastatin on PMNL and vascular endothelial injury in patients undergoing open heart surgery with CPB[J]. Masui, 1998,47(1):29-35.
[4] Rubenfeld GD, Herridge MS. Epidemiology and outcomes of acute lung injury[J]. Chest, 2007,131(2):554-562.
[5] Esper AM, Martin GS. Evolution of treatments for patients with acute lung injury[J]. Expert Opin Investig Drugs, 2005,14(5):633-645.
[6] Reiss LK, Uhlig U, Uhlig S. Models and mechanisms of acute lung injury caused by direct insults[J]. Eur J Cell Biol, 2012,91(6-7):590-601.
[7] Fowler AA, Hamman RF, Good JT, et al.Adult respiratory distress syndrome: risk with common predispositions[J]. Ann Intern Med, 2003,98(5 Pt 1):593-597.
[8] Zhou X, Dai Q, Huang X. Neutrophils in acute lung injury[J]. Front Biosci (Landmark Ed), 2012,17(2):2278-2283.
[9] He ZG, Huang J, Zhou SG, et al.Peripheral leukocytapheresis attenuates acute lung injury induced by lipopolysaccharide in vivo[J].Mediators Inflamm, 2012,2012:694635.
[10] Luna-Gomes T, Filardy AA, Rocha DB, et al.Neutrophils increase or reduce parasite burden in trypanosoma cruzi-Infected macrophages, depending on host strain: role of neutrophil elastase[J]. PLoS One, 2014, 9(3):90582.
[11] Yang R, Yang L, Shen X, et al. Suppression of NF-κB pathway by crocetin contributes to attenuation of lipopolysaccharide-induced acute lung injury in mice[J]. Eur J Pharmacol, 2012,674(2-3):391-396.
[12] Kaido T, Uemoto S. Effects of neutrophil elastase inhibitor onprogressionof acute lung injury after liver transplantation[J]. Transplantation, 2010,90(3):335-337.
[13] Chi XJ, Cai J, Luo CF, et al. Relationship between the expression of Toll-like receptor 2 and 4 in mononuclear cells and postoperative acute lung injury in orthotopic liver transplantation[J]. Chin Med J, 2009,122(8):895-899.
[14] Kruger P, Saffarzadeh M, Weber ANR, et al. Neutrophils:between host defence,immune modulation, and tissue injury[J]. PLoS Pathog, 2015,11(3):1004651.
[15] 徐伟松,范辉,刘玉峰,等.血必净对急性胰腺炎大鼠血清中TNF-α、IL-1β和IL-6浓度的影响[J]. 世界华人消化杂志,2012,20(29):2777-2781.
[16] Macedo FY, Mouro LT, Freitas HC, et al.Interleukin-4 modulates the inflammatory response in ifosfamide-induced hemorrhagic cystitis[J]. Inflammation, 2012,35(1):297-307.
[17] 戴甜,曹书华.细胞因子在急性肺损伤/急性呼吸窘迫综合征中的作用[J]. 医学综述,2008,14(6):900-902.
[18] Griffin KL, Fischer BM, Kummarapurugu AB, et al. 2-O, 3-O-desulfated heparin inhibits neutrophil elastase-induced HMGB-1 secretion and airway inflammation[J]. Am J Respir Cell Mol Biol,2014,50(4):684-689.
[19] Tsai YF,Yu HP,Chang WY, et al. Sirtinol inhibits neutrophil elastase activity and attenuates lipopolysaccharide-mediated acute lung injury in mice[J]. Sci Rep,2015,5(4): 8347.
[20] Eaton S, Martin G. Clinical developments for treating ARDS[J].Expert Opin Investig Drugs, 2002,11(1):37-48.
[21] Wang ZQ, Chen LQ, Yuan Y, et al. Effects of neutrophil elastase inhibitor in patients undergoing esophagectomy: A systematic review and meta-analysis[J]. World J Gastroenterol, 2015,21(12): 3720-3730.
[22] Fujino N, Kubo H, Suzuki T, et al. Administration of a specific inhibitor of neutrophil elastase attenuates pulmonary fibrosis after acute lung injury in mice[J]. Exp Lung Res, 2012,38(1):28-36.
[23] Kawabata K, Hagio T, Matsumoto S, et al.Delayed neutrophil elastase inhibition prevents subsequent progression of acute lung injury induced by endotoxin inhalation in hamsters[J]. Am J Respir Crit Care Med, 2000,161(6):2013-2018.
[24] Tomashefski JF Jr.Pulmonary pathology of acute respiratory distress syndrome[J]. Clin Chest Med, 2000,21(3):435-466.
[25] Gotoh M, Okubo K, Okuda M, et al. Clinical pharmacology study of the corticosteroid nasal spray dexamethasone cipecilate (NS-126): examination of the durability of efficacy in the nasal induction test[J]. Expert Opin Investig Drugs, 2010,19(12):1475-1486.
[26] Kumar S, Allen DA, Kieswich JE, et al. Dexamethasone ameliorates renal ischemia-reperfusion injury[J]. J Am Soc Nephrol, 2009,20(11):2412-2425.
[27] Tak PP, Firestein GS. NF-kappaB: a key role in inflammatory diseases[J]. J Clin Invest, 2001,107(1):7-11.
[28] 冯英凯,徐剑铖,杨庆华,等.地塞米松对内毒素肺损伤大鼠Th1/Th 2 细胞偏移的影响[J] . 现代免疫学,2004,24(2):146-149.
[29] 叶正龙,徐巧莲,邱海波,等.地塞米松对大鼠急性肺损伤中性粒细胞凋亡的影响[J].江苏医药,2007,33(2):168-170.
10.3969/j.issn.1002-266X.2016.26.009
R563.8
A
1002-266X(2016)26-0031-05
2016-03-12)
