鼻咽癌组织FHIT、WWOX基因表达变化及其原因探讨
2016-09-06黄春妮莫武宁黄健李屏刘磊杨峥
黄春妮,莫武宁,黄健,李屏,刘磊,杨峥
(1广西医科大学第一附属医院,南宁530021;2广西中医药大学第一附属医院)
鼻咽癌组织FHIT、WWOX基因表达变化及其原因探讨
黄春妮1,莫武宁1,黄健1,李屏2,刘磊1,杨峥1
(1广西医科大学第一附属医院,南宁530021;2广西中医药大学第一附属医院)
目的观察鼻咽癌组织中脆性组氨酸三联体(FHIT)基因和WW结构域氧化还原酶(WWOX)基因表达变化,并探讨其原因。方法 选择89例鼻咽癌患者为观察组,取其手术切除的鼻咽癌组织标本和血液标本;61例慢性鼻黏膜炎患者为对照组,留取其鼻咽部黏膜组织标本以及血液标本。采用RT-PCR法检测观察组鼻咽癌组织和对照组鼻咽部黏膜组织FHIT mRNA、WWOX mRNA及启动子甲基化情况。用MSP法检测两组患者血液中FHIT 、WWOX 基因杂合性缺失情况。结果 观察组FHIT、WWOX mRNA相对表达量低于对照组(P均<0.05)。观察组临床分期Ⅲ~Ⅳ期者FHIT、WWOX mRNA相对表达量低于Ⅰ~Ⅱ期者(P均<0.05)。观察组鼻咽癌患者临床分期与FHIT、WWOX mRNA相对表达量呈负相关(r分别为-0. 731、-0. 816,P均<0.05)。观察组FHIT、WWOX基因启动子甲基化程度分别为0.46±0.34、0.37±0.28,高于对照组的0.15±0.17、0.11±0.09,P均<0.05。Spearman相关分析显示观察组FHIT、WWOX mRNA与该基因启动子甲基化程度呈负相关(r分别为-0.689、-0.594,P均<0.05)。观察组39例(43.8%)存在至少1个FHIT基因位点杂合性缺失,42例(47.2%)存在至少1个WWOX基因位点杂合性缺失,明显高于对照组的3例(4.9%)和2例( 3.3%),P均<0.05。观察组FHIT、WWOX mRNA与该基因基因杂合性缺失存在负相关(r分别为-0. 239、-0. 364,P均<0.05)。结论 鼻咽癌的发生、发展与FHIT、WWOX基因的表达下调有关,而引起鼻咽癌组织FHIT、WWOX表达下调的原因可能是该基因启动子甲基化和杂合性缺失,其中基因启动子甲基化可能是导致其表达下调的主要原因。
鼻咽癌;脆性组氨酸三联体基因;WW结构域氧化还原酶基因;启动子甲基化
Expression changes of FHIT and WWOX gene in nasopharyngeal carcinoma and the mechanism
鼻咽癌是一种上皮源性的恶性肿瘤,由于发生部位隐匿,大部分患者确诊时已处于中晚期,错过了最佳治疗时间。流行病学表明,鼻咽癌是多种遗传学及表观遗传学改变积累的结果,涉及多种癌基因的激活或抑癌基因的失活。脆性组氨酸三联体(FHIT)基因和基因和WW结构域氧化还原酶(WWOX)基因是近年来发现的抑癌基因。研究证实,FHIT和WWOX表达的下调或者缺失与上皮恶性肿瘤有着密切的关系,如乳腺癌、宫颈癌、肺癌、卵巢癌、胃癌[1~4]等,但有关鼻咽癌组织中FHIT和WWOX基因表达变化及其启动子区甲基化情况的研究并不多。2015年2~11月,我们检测并比较了89例鼻咽癌患者肿瘤组织和61例慢性鼻黏膜炎患者鼻黏膜组织FHIT和WWOX基因表达情况及启动子甲基化程度。现报告如下。
1 资料与方法
1.1临床资料选择89例鼻咽癌患者为观察组,其中男47例、女42例,年龄22~72岁,中位年龄47岁。均根据2008版美国肿瘤联合会(AJCC)和国际抗癌联盟(UICC)的鼻咽癌诊断标准确诊,临床分期Ⅰ期8例、Ⅱ期23例、Ⅲ期33例、Ⅳ期25例。均为初诊,入院前未行治疗,且未合并其他肿瘤。入院后行手术治疗,留取鼻咽癌组织标本和血液进行实验。另选61例慢性鼻黏膜炎患者为对照组,其中男33例、女28例,年龄21~64岁,中位年龄35岁。取其鼻咽部黏膜组织标本和血液进行实验。两组年龄、性别差异无统计学意义。两组患者均来自广西地区,且遗传学上无相互关联。均签署知情同意书。本研究已得到本校伦理委员会批准。
1.2FHIT、WWOX mRNA检测方法采用RT-PCR法检测观察组鼻咽癌组织和对照组鼻咽部黏膜组织FHIT mRNA、WWOX mRNA。严格按照说明书操作。根据 GenBank提供的FTIH基因和WWOX基因启动子序列,用Primer 5.0 软件设计引物。FHIT基因上游引物5′-CAACATCTCATCAAGCCCTCT-3′,下游引物5′-TCCACCACTGTCCCGACT-3′,扩增片段长度191 bp;WWOX基因上游引物5′-GAGTTCCTGAGCGAGTGGAC-3′,下游引物5′-CCCCAGGAATTCCCTGCTT-3′,扩增片段长度1 490 bp;β-actin上游引物5′-AACAAGATGAGATTGGCA-3′,下游引物5′-AGTGGGGTGGCTTTTAGGAT-3′,扩增片段长度251 bp。PCR反应体系:2×Super Real Pre Mix Plus 10 μL,上、下游引物各0.6 μL, cDNA 2.0 μL,50×ROX Reference Dye 2.0 μL,DdH2O 4.8 μL。FTIH PCR过程:95 ℃预变性10 min,95 ℃ 15 s、60 ℃ 20 s、72 ℃ 15 s为1个循环,共进行45 个循环,72 ℃延伸10 min。WWOX PCR过程:95 ℃预变性5 min,95 ℃ 5 s、57 ℃ 30 s、72 ℃ 60 s为1个循环,共进行35个循环, 72 ℃延伸10 min。采用2-ΔΔCt法计算FHIT mRNA、WWOX mRNA相对表达量。
1.3FHIT、WWOX基因启动子区甲基化检测方法按照DNA提取试剂盒说明书操作提取观察组鼻咽癌组织和对照组鼻咽部黏膜组织DNA。 按照DNA 修饰试剂盒说明书操作行DNA甲基化修饰,修饰后的 DNA 用乙醇沉淀回收并重悬于去离子水中。用Primer 5.0 软件设计甲基化引物。FHIT基因甲基化引物(M引物)引物A:5′-TTTTCGTTTTTGTTTTTAGATMGC-3′;引物B:5′-AAAAATATACCCACTAAATAACCGC-3′。FHIT非甲基化引物(U引物)引物A: 5′-TGGTTTTTGTTTTTGTTTTTAGATAAGT-3′;引物B:5′-AAAATATACCCACTAAATAACCACC-3′。WWOX甲基化引物(M引物)引物A:5′-AGGATTGGTTAGAATAACGC-3′;引物B:5′-AAAATACCTAAAAAATCGCG-3′。WWOX非甲基化引物(U引物)引物A:5′-TGTAGGATTGGTTAGAATAATGT-3′;引物B′:5′-AAAAATACCTAAAAAATCACACT-3′。PCR 反应体系:2×Super Real Pre Mix Plus 10 μL,上下游引物各0.6 μL,亚硫酸氢盐处理后的 DNA 模板 2 μL,50 ×ROX Reference Dye μL,补水至20 μL。FTIH PCR过程:95 ℃预变性10 min,95 ℃ 15 s、60 ℃ 20 s、72 ℃ 15 s为1个循环,共进行40个循环,72 ℃延伸5 min。WWOX PCR过程:95 ℃预变性5 min,95 ℃ 45 s、48 ℃ 45 s、72 ℃ 45 s为1个循环,共进行35个循环,72℃延伸5 min。目标基因启动子甲基化程度=目的基因M引物的2-CT值/ (目的基因U引物的2-CT值+目的基因M引物的2-CT值)。
1.4基因杂合性缺失检测方法根据文献[5,6]选取位于WWOX基因内显子8内的D16S504、16S3096、D16S3029位点和位于FHIT基因内显子5 的D3S1300位点、内显子8的D3S1234位点。按DNA提取试剂盒说明书操作提取两组受检者血液标本DNA。并用MSP法扩增两组DNA标本上述位点的基因序列。引物序列FHIT基因D3S1300位点上游引物5′-ACAAAGGAACGTCATGTGGTAGG-3′,下游引物5′-GCTGTTTATTCTTCGTGGAATGCC-3′;D16S504位点上游引物5′-CCTGTGAGACAAAG-CAAGAC-3′,下游引物5′-GACATTAGGCACAGGGC-TAA-3′;WWOX基因D16S3029位点上游引物5′-ATAGAGTTGGGCTGCATAGA-3′,下游引物5′-CTTTCCTGAAATTGGAAGTGA-3′;D16S3096位点上游引物5′-GATCTGGCTTACGATGATTTCTAAC-3′,下游引物5′-CCGTGATGATGTCTGCAAC-3′;D16S504位点上游引物5′-AGCTTGTTCAGGGAAACC-3′,下游引物5′-CAGGGATGTAGGACGTAGG-3′。PCR反应体系:2×Taq PGR Master Mix 12.0 μL、上、下游引物各0.8 μL、DNA 2.0 μL和DdH2O 9.4 μL。FHIT基因PCR反应条件:95 ℃预变性5 min,95 ℃ 20 s、58 ℃ 20 s、72 ℃ 20 s为1个循环,共进行35个循环,72 ℃延伸5 min。WWOX基因PCR反应条件:95 ℃预变性5 min,95 ℃ 45 s、55 ℃~58 ℃ 45 s、72 ℃ 45 s为1个循环,共进行35个循环,72 ℃延伸5 min。取PCR扩增产物5 μL,加入5 μL的变性载样缓冲液后95 ℃变性 10 min,迅速上样于 8%聚丙烯酰胺凝胶,电泳(电压8 V/cm,电泳2~3 h)和银染。以正常外周血DNA为对照。若某一条等位基因条带消失或相对密度减少50%以上则记录为杂合性缺失[7]。

2 结果
2.1两组FHIT、WWOX mRNA相对表达量比较见表1。观察组FHIT、WWOX mRNA相对表达量低于对照组(P均<0.05)。观察组临床分期Ⅲ~Ⅳ期者FHIT、WWOX mRNA相对表达量低于Ⅰ~Ⅱ期者(P均<0.05)。观察组鼻咽癌患者临床分期与FHIT、WWOX mRNA相对表达量呈负相关(r分别为-0.731、-0.816,P均<0.05)。

表1 两组FHIT、WWOX mRNA比较
注:与对照组相比,*P<0.05;与临床分期Ⅰ~Ⅱ期者相比,#P<0.05。
2.2两组FHIT、WWOX基因启动子甲基化程度比较观察组FHIT、WWOX基因启动子甲基化程度分别为0.46±0.34、0.37±0.28,高于对照组的0.15±0.17、0.11±0.09,P均<0.05。
2.3观察组FHIT、WWOX mRNA与启动子甲基化程度的相关性Spearman相关分析显示,观察组FHIT、WWOX mRNA与其启动子甲基化程度呈负相关(r分别为-0. 689、-0. 594,P均<0.05)。
2.4两组FHIT、WWOX基因杂合性缺失情况比较见表2。观察组39例(43.8%)存在至少1个FHIT基因位点杂合性缺失,42例(47.2%)存在至少1个WWOX基因位点杂合性缺失,明显高于对照组的3例(4.9%)和2例(3.3%),P均<0.05。
2.5观察组FHIT、WWOX mRNA与基因杂合性缺失的相关性Spearman相关分析显示,观察组FHIT、WWOX mRNA与该基因基因杂合性缺失存在负相关(r分别为-0. 239、-0. 364,P均<0.05)。
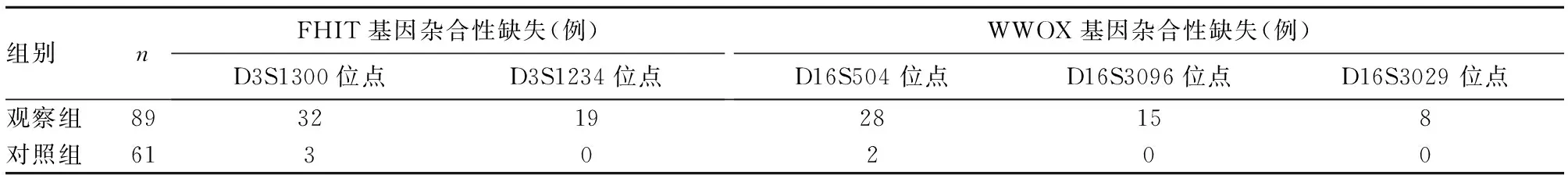
表2 两组FHIT、WWOX基因杂合性缺失情况比较
3 讨论
鼻咽癌是一种在我国南方地区常见的上皮源性恶性肿瘤。由于鼻咽部淋巴循环丰富,鼻咽癌早期发生淋巴结转移率高。同时由于发生部位隐匿,大部分鼻咽癌患者确诊时已为Ⅲ、Ⅳ期,5年生存率很低。地域性和家族性是鼻咽癌的两大特征。遗传因素在鼻咽癌的发生、发展中占主导作用。抑癌基因WWOX所处染色体区域极易发生断裂或丢失,导致位于附近区域的基因失活导致癌症[8]。FHIT基因也是位于染色体脆性位点FRA3B的抑癌基因。目前许多研究[1~4]发现,在上皮源性肿瘤中FHIT和WWOX基因的是重要的抑癌基因,它们的下调或者缺失与多种恶性肿瘤的发生发展密切相关。
本研究结果显示,鼻咽癌组织FHIT、WWOX mRNA降低, 与罗海清等[9~11]报道基本一致。本研究还发现,FHIT、WWOX mRNA和鼻咽癌临床分期有关,晚期鼻咽癌组织中的FHIT、WWOX mRNA表达明显低于早期鼻咽癌,提示FHIT、WWOX mRNA的下调甚至缺失可能参与调控鼻咽癌的发生、发展。这与在宫颈癌和乳腺癌中研究结果相一致[12,13]。
本研究结果显示鼻咽癌组织FHIT、WWOX基因启动子区甲基化程度高于慢性鼻黏膜炎患者。这与Yan等[14]研究结果一致。进一步研究发现鼻咽癌组织FHIT、WWOX mRNA与基因启动子甲基化程度呈负相关,说明启动子高度甲基化是导致这两个基因 mRNA低表达的重要因素。
染色体脆性位点的等位基因杂合性缺失在肿瘤中是高概率事件,其存在区域是基因组的不稳定区域,在外界压力下易发生断裂、缺失和重排,诱发肿瘤。因此,染色体脆性位点的等位基因杂合性缺失与抑癌基因的失活有着重要的联系。本研究结果显示观察组39例(43.8%)鼻咽癌患者存在至少1个FHIT基因位点杂合性缺失,D3S1300位点杂合性缺失检出率最高,为36.0%,稍低于邓燕飞等[15]的报道;42例(47.2%)存在至少1个WWOX基因位点杂合性缺失,其中D16S504位点杂合性缺失检出率最高。可见在鼻咽癌组织中FHIT、WWOX基因杂合性缺失比较常见。我们将上述两个基因 mRNA表达水平与其杂合性缺失情况进行了相关性分析,发现基因mRNA表达水平与基因杂合性缺失呈负相关,但相关关系并不密切。说明杂合性缺失也是造成FHIT和WWOX基因mRNA表达下调的原因,但是相关性不明显。
综上所述,鼻咽癌的发生、发展与FHIT、WWOX基因的表达下调有关,而引起鼻咽癌组织FHIT、WWOX表达下调的原因可能是基因启动子甲基化和杂合性缺失,其中基因启动子甲基化可能是导致其表达下调的主要原因。
[1] Wang HL, Zhou PY, Liu P, et al. Abnormal FHIT protein expression may be correlated with poor prognosis in gastric cancer:a meta-analysis[J].Tumor Biol, 2014,35(7):6815-6821.
[2] Jecong YJ, Jeong HY, Lee SM, et al. Promoter methylation status of the FHIT gene and Fhit expression ::association with HER2/neustatus in breast cancer patients[J]. Oncol Rep,2013,30 ( 5 ):2270 -2278.
[3] Du CX, Li SQ, Wang AH, et al. Significance of combined detection of p53 and FHIT in cervical carcinoma diagnosis [J].Eur J Gynaecol Oncol,2014,5 (3):298-300.
[4] Gthlin-Eremo A, Wegman P. WWOX expression may prediet benefit from adjuvant tamoxifen in randomized breast cancer patients[J].Oncol Rep,2013,29 (4):1467-1474.
[5] Aqeilan RI, Kuroki T, Pekarsky Y, et al. Loss of WWOX expression in gastric carcinoma[J]. Clin Cancer Res, 2004,10(9):3053-3058.
[6] Zucchini C, Concu M, Martini F, et al. FHIT oncosuppressor gene expression profile in human anal cancers[J]. Int J Biol Markers, 2007,22(1):39 - 42.
[7] Kaghad M, Bonnet H, Yang A, et al. Monoallelically expressed gene related to p53 at 1p36, a region frequently deleted in neuroblastoma and other human cancers[J]. Cell, 1997,90(4):809-819.
[8] Bednarek AK, Laflin KJ, Daniel RL, et al. WWOX, a novel WW domain-containing protein mapping to human chromosome 16q23.3-24.1, a region frequently affected in breast cancer[J]. Cancer Res, 2000,60(8):2140-2145.
[9] 罗海清,黄静,杨东红,等.FHIT基因和蛋白在鼻咽癌组织及正常鼻咽组织中的表达及[J].海南医学,2014,25(24): 3640-3642.
[10] Yendamuri S, Kuroki T, Trapasso F, et al. WW domain containing oxidoreductase gene expression is altered in non-small cell lung cancer[J]. Cancer Res, 2003,63(4):878-881.
[11] Park SW, Ludes MJ, Zimonjic DB, et al. Frequent downregulation and loss of WWOX gene expression in human hepatocellular carcinoma[J]. Br J Cancer, 2004,91(4):753-759.
[12] Jcong YJ, Jcong S, Lee SM, et al. Promoter methylation status of the FHIT gene and Fhit expression :association with HER2/neu status in breast cancer patients[J]. Oncol Rep, 2013, 30(5):2270-2278.
[13] Du CX, Li SQ, Wang AH, et al. Significance of combined detection of p 53 and FHIT in cervical carcinoma diagnosis[J].Eur J Gynaecol Oncol, 2014,35(3):298-300.
[14] Yan J, Zhang M, Zhang J, et al. Helicobacter pylori infection promotes methylation of WWOX gene in human gastric cancer[J].Biochem Biophys Res Commun, 2011,408 (1):99-102.
[15] 邓燕飞,田芳,杨新明,等.鼻咽癌染色体3p14的精细等位基因缺失研究[J].中华耳鼻咽喉科杂志,2000,25(5):70-72.
HUANGChunni1,MOWuning,HUANGJian,LIPing,LIULei,YANGZheng
(1TheFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China)
Objective To observe the expression changes of FHIT gene and WWOX gene in nasopharyngeal carcinoma and to explore the mechanism. MethodsWe chose 89 patients with nasopharyngeal carcinoma as the experimental group, and took their surgical removal of the nasopharyngeal carcinoma tissue specimens and blood specimens; and 61 patients with chronic nasal mucosal inflammation as the control group, and took their nasopharyngeal mucosa tissue specimens and blood specimens. RT-PCR was used to detect the expression of FHIT mRNA, WWOX mRNA and promoter methylation in nasopharyngeal carcinoma tissue specimens of the experimental group and nasopharyngeal mucosa tissue specimens of the control group. MSP was used to detect loss of heterozygosity (LOH) of FHIT and WWOX genes from blood specimens in the two groups. ResultsThe relative expression of FHIT mRNA and WWOX mRNA in the experimental group was significantly lower than that in the control group (allP<0.05). The relative expression of FHIT mRNA and WWOX mRNA in clinical stage Ⅲ~Ⅳ was significantly lower than that in clinical stage Ⅰ-Ⅱ of the experimental group (allP<0.05). In the experimental group, clinical stage was negatively correlated with the relative expression of FHIT and WWOX mRNA (r=-0. 731,-0. 816, allP<0.05). FHIT and WWOX gene promoter methylation degree in the experimental group were 0.46±0.34 and 0.37±0.28, higher than 0.15±0.17 and 0.11±0.09 in the control group (allP<0.05). Spearman correlation analysis showed that the FHIT and WWOX mRNA was negatively correlated with the degree of the gene promoter methylation in the experimental group (r=-0. 689, -0.594, allP<0.05). In the experimental group, 39 cases (43.8%) had at least 1 LOH in the FHIT gene and 42 cases (47.2%) had at least 1 LOH in the WWOX gene, which significantly higher than 3 cases (4.9%) and 2 cases (3.3%) of the control group (allP<0.05). The FHIT and WWOX mRNA was negatively correlated with gene LOH in the experimental group (r=-0.239, -0.364, allP<0.05). ConclusionThe down-regulation expression of FHIT gene and WWOX gene is related to the occurrence and development of nasopharyngeal carcinoma. Gene promoter methylation and LOH may be the causes of the down-regulation expression in the carcinoma tissues, and gene promoter methylation may be the main reason.
nasopharyngeal carcinoma; FHIT gene; WWOX gene; promoter methylation
广西壮族自治区卫生厅科研基金资助项目(Z2013024)。
黄春妮(1980-),女,硕士研究生,主管技师,主要研究方向为临床检验及肿瘤相关诊断。E-mail: 25883175@qq.com
简介:杨峥(1985-),男,硕士研究生,主管技师,主要研究方向为肿瘤相关诊断。E-mail: jackyyoung@foxmail.com
10.3969/j.issn.1002-266X.2016.26.006
R739.63
A
1002-266X(2016)26-0020-04
2016-03-17)
