人SNCG基因shRNA慢病毒载体质粒的构建及鉴定
2016-09-06李文怡范余娟徐红范江涛孙丹
李文怡,范余娟,徐红,范江涛,孙丹
(广西医科大学第一附属医院,南宁530022)
人SNCG基因shRNA慢病毒载体质粒的构建及鉴定
李文怡,范余娟,徐红,范江涛,孙丹
(广西医科大学第一附属医院,南宁530022)
目的构建人SNCG基因短发夹干扰RNA(shRNA)慢病毒载体质粒,并观察用其转染后人子宫内膜癌HEC-1-A和Ishikawa细胞SNCG mRNA和蛋白的表达变化。方法设计3种SNCG基因特异性shRNA序列SNCG-KD1、SNCG-KD2、SNCG-KD3 ,用脂质体Lipofectamine 2000在293T细胞构建成慢病毒载体质粒。用SNCG-KD1、SNCG-KD2、SNCG-KD3慢病毒载体质粒转染人子宫内膜癌HEC-1-A和Ishikawa细胞,用实时荧光定量PCR法检测SNCG mRNA,用Western blot法检测SNCG蛋白。结果利用Age Ⅰ和EcoR Ⅰ双酶切连接转化后的3组阳性转化子,1%琼脂糖凝胶电泳,特异条带与预计结果相符。Chromas Lite比对分析基因测序结果,鉴定结果与GenBank数据库一致,表明合成的3对SNCG shRNA序列SNCG-KD1、SNCG-KD2、SNCG-KD3插入正确。HEC-1-A和Ishikawa细胞转染SNCG-KD1、SNCG-KD2、SNCG-KD3慢病毒载体质粒后SNCG mRNA和蛋白的表达均显著降低(P均<0.05)。结论 成功构建了3种SNCG shRNA慢病毒载体质粒,用其转染HEC-1-A和Ishikawa细胞后可有效沉默SNCG基因表达。
SNCG基因;短发夹干扰RNA;慢病毒载体质粒;子宫内膜癌;基因沉默
synuclein-γ(SNCG)基因又称为乳腺癌特异性基因-1,是一种致癌基因,它与synuclein家族中的synuclein-α和synuclein-β在基因序列上有较高的同源性[1]。短发夹干扰RNA(shRNA)以慢病毒作为载体转染入宿主细胞后可以整合到宿主DNA 上发挥稳定持久的干扰效果[2]。SNCG与乳腺癌、结直肠癌、卵巢癌、前列腺癌、膀胱癌的关系已被广泛研究[3~7],但有关SNCG基因与子宫内膜癌的研究却较少。本课题组前期实验发现,SNCG基因表达与子宫内膜癌发生、发展及侵袭、转移和预后有关[8,9]。2015年3~10月,我们构建了人SNCG基因shRNA 慢病毒载体质粒,并用其转染人子宫内膜癌HEC-1-A和Ishikawa细胞,观察转染后上述两种细胞SNCG mRNA和蛋白表达变化。现报告如下。
1 材料与方法
1.1主要材料和试剂 293T 细胞株和人子宫内膜癌Ishikawa、HEC-1-A细胞株由中国科学院细胞研究所提供。慢病毒载体系统(GV112载体、pHelper1.0、pHelper2.0 质粒)购自上海吉凯基因化学技术有限公司。限制性内切酶、T4DNA 连接酶购自NEB公司。Lipofectamine 2000、TRIzol购自Invitrogen 公司。质粒抽提试剂盒、凝胶回收试剂盒购自QIAGEN公司。荧光定量PCR 试剂盒购自TaKaRa公司。兔抗鼠Cx43 抗体和嘌呤霉素溶剂均购自Sigma 公司。
1.2方法
1.2.1SNCG shRNA慢病毒载体质粒的构建和序列鉴定根据GenBank数据库中人SNCG基因的核苷酸序列(NM_003087), 应用Invitrogen 公司的在线RNAi设计服务软件BLOCK-iT RNAi Designer,设计SNCG基因的3对shRNA干扰靶序列。使用BLAST将其与相应的人基因组数据库进行比对,排除与其他编码序列同源的序列,最终确定3条干扰靶序列shRNA分别为5′-CCAAGGAGAATGTTGTACA-3′、5′-AAGGAGAATGTTGTACAGA-3′、5′-AGACCAAGGAGAATGTTGT-3′。将3对寡核苷酸火形成双链,用AgeⅠ与EcoRⅠ双酶切后用T4DNA连接酶连接GV112载体。将3组连接产物转化DH5α化学感受态细胞,次日随机挑选阳性单克隆菌落,使用GV112 通用引物行PCR 鉴定阳性转化子,行基因测序,序列无误后分别命名为SNCG-KD1、SNCG-KD2、SNCG-KD3。取对数生长期的293T细胞,以含10%血清的培养基调整细胞密度至5×106/15 mL,接种于直径10 cm细胞培养皿,37 ℃、5%CO2培养箱内培养,待细胞密度达70%~80%时用脂质体Lipofectamine 2000进行GV112、pHelper 1.0、pHelper 2.0载体质粒共转染SNCG-KD1、SNCG-KD2、SNCG-KD3。48 h后收集上清液,浓缩纯化,得到SNCG-KD1、SNCG-KD2、SNCG-KD3慢病毒载体质粒原液,于-80 ℃保存。
1.2.2人子宫内膜癌细胞的转染Ishikawa、HEC-1-A细胞分别传代,按2×105/孔接种于6孔板中,培养 2 d。每种细胞设SNCG-KD1、SNCG-KD2、SNCG-KD3组和对照组,分别用SNCG-KD1、SNCG-KD2、SNCG-KD3慢病毒载体质粒原液和慢病毒空载体质粒原液孵育24 h,转染增强剂为5 μL/mL ploybrene,更换含有10%胎牛血清的DMEM培养基继续培养72 h,再用含2 μg/mL嘌呤霉素新鲜培养基培养24 h。24 h后收集细胞。对照组用慢病毒空载体质粒原液转染。
1.2.3SNCG mRNA表达检测采用实时荧光定量RT-PCR法。收集各组细胞,按TRIzol说明书提取总RNA,逆转录试剂盒合成cDNA进行RT-PCR分析。引物内参基因GAPDH上游引物5′-TGACTTCAACAGCGACACCCA-3′,下游引物5′-CACCCTGTTGCTGTAGCCAAA-3′;目的基因SNCG上游引物5′-CAAGAAGGGCTTCTCCATCG-3′,下游引物5′-GGTCACGCTCTGTACAACAT-3′。RT-PCR反应体系包括2 μL cDNA、2 μL SYBR Green Supermix 混合染料、0.5 μL浓度为10 μmol/L的PCR上游引物、0.5 μL浓度 10 μmol/L的 PCR下游引物和14 μL去离子水。荧光PCR仪反应条件为95 ℃变性5 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,重复40~50个循环;60~95 ℃绘制溶解曲线。用2-ΔΔCt法计算各组SNCG mRNA表达量。SNCG-KD1、SNCG-KD2、SNCG-KD3组SNCG mRNA表达敲减率=1-SNCG-KD1、SNCG-KD2、SNCG-KD3组SNCGmRNA表达量/对照组SNCG mRNA表达量×100%。
1.2.4SNCG蛋白表达检测采用Western blot 法。收集各组细胞并提取总蛋白,行SDS-PAGE电泳,将蛋白电转移至PVDF膜,5% 脱脂奶粉TBST 溶液封闭1 h,兔抗鼠Cx43 单克隆抗体4 ℃孵育过夜,洗膜,鼠抗兔IgG 二抗孵育1 h,按ECL试剂盒显色,暗室内行胶片曝光显影。使用Gel Proanalyzer 5.0 分析软件测算各组SNCG 蛋白条带灰度与GAPDH条带灰度的比值,作为各组SNCG蛋白表达量。各组SNCG蛋白表达敲减率计算方法同1.2.3。

2 结果
2.1SNCG基因shRNA慢病毒载体质粒鉴定利用Age Ⅰ和EcoR Ⅰ双酶切连接转化后的3组阳性转化子,1%琼脂糖凝胶电泳,特异条带与预计结果相符。Chromas Lite(版本2.01)比对分析基因测序结果,鉴定结果与GenBank数据库比对一致,表明合成的3对SNCG shRNA序列SNCG-KD1、SNCG-KD2、SNCG-KD3插入正确。
2.2转染后各组SNCG mRNA 及蛋白表达比较SNCG-KD1、SNCG-KD2、SNCG-KD3组Ishikawa、HEC-1-A细胞SNCG mRNA 及蛋白表达量见表1。SNCG-KD1、SNCG-KD2、SNCG-KD3组Ishikawa、HEC-1-A细胞SNCG mRNA 及蛋白表达量均低于对照组,P均<0.05。SNCG-KD1、SNCG-KD2、SNCG-KD3组HEC-1-A细胞SNCG mRNA敲减率均达到90%以上,其中SNCG-KD1组最高,为98.60%;SNCG蛋白敲减率均达80%以上,其中SNCG-KD3组最高,为97.90%。SNCG-KD1、SNCG-KD2、SNCG-KD3组Ishikawa细胞SNCG mRNA敲减率均达到85%以上,其中SNCG-KD1组最高,为95.30%;SNCG蛋白敲减率均达75%以上,其中SNCG-KD1组最高,为79.30%。
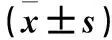
表1 各组SNCG mRNA 及蛋白表达量比较
注:与对照组比较,*P<0.05。
3 讨论
子宫内膜癌是女性生殖道三大恶性肿瘤之一,发病率仅次于宫颈癌,占女性生殖系统恶性肿瘤发病率的20%~30%。近年来,子宫内膜癌在我国的患病率明显上升且趋于年轻化, 成为严重威胁我国女性健康的生殖道恶性肿瘤。75% 的患者临床发现时为早期(Ⅰ~Ⅱ期),与其他部位女性恶性生殖道肿瘤相比预后较好。但对于晚期或复发病例,治疗效果并不令人十分满意,且缺乏有效的治疗方法供选择。
近年来许多研究证实,SNCG基因的过表达能够增加多种肿瘤细胞的侵袭转移能力及增加肿瘤细胞对某些化疗药的耐药性,并与其临床预后有关[10]。我们前期研究发现,与正常子宫内膜组织相比,子宫内膜癌组织中SNCG阳性表达率明显增高,且随着临床分期、淋巴结转移及癌组织肌层浸润深度的增加而增高,SNCG阳性表达组总体生存率显著低于阴性表达组[8,9]。Gupta等[11]发现SNCG基因可以抑制BubR1基因功能,使得细胞基因表达异常,导致肿瘤并促使其恶化。Lu等[12]证实乳腺癌细胞SNCG 内含子中有两个AP1 结合位点,推测SNCG 可通过AP-1 途径促进细胞癌变。近来研究发现,转录因子Sp1 在肿瘤组织中的异常表达和活化,可通过促进肿瘤生长因子和血管生成因子的基因转录,参与调控肿瘤的增殖、血管生成和转移[13]。在SNCG 基因的启动子上游存在富含GC 序列(-202~-173)的区域,转录因子Sp1 可以与该区域特异结合[14]。Jiang等[15]发现,SNCG 起着类似热休克蛋白的分子伴侣功能,SNCG 与热休克蛋白70 结合后再与雌激素受体结合,使雌激素受体与雌激素的亲和力大大提高,进而参与子宫内膜癌的发生发展过程。但是,其具体的作用机制目前还不十分明确。因此, 进一步研究SNCG基因功能及其在子宫内膜癌细胞中的作用, 将有助于探讨SNCG影响子宫内膜癌发生发展的机制。
随着分子生物学的发展, 应用基因转染技术研究SNCG对子宫内膜癌细胞恶性生物学行为的影响成为可能。用于目的基因转染的病毒载体主要包括腺病毒、腺相关病毒、逆转录病毒和慢病毒载体[16]。慢病毒载体质粒是逆转录病毒的一个亚型,应用较多的来源于HIV-1的病毒载体,载体容量大,有着广泛的宿主范围,且可感染分裂期和非分裂期细胞,能在机体内持续、稳定表达。由于本课题组后续相关研究涉及动物实验,对病毒感染效率要求高,因此采用干扰SNCG表达的shRNA 慢病毒载体质粒来转染人子宫内膜癌HEC-1-A、Ishikawa细胞,以构建稳定干扰SNCG表达的人子宫内膜癌HEC-1-A、Ishikawa细胞,从而进一步研究SNCG与人子宫内膜癌细胞生物学特性(如生长增殖、裸鼠成瘤、侵袭、迁移等)的相关性,进一步明确SNCG与人子宫内膜癌的关系。
本实验在筛选出针对SNCG的有效序列后,构建了干扰SNCG的慢病毒载体质粒,经酶切鉴定及DNA 测序,证实成功构建了靶向干扰SNCG 的慢病毒载体质粒。将其成功转染至人子宫内膜癌细胞HEC-1-A、Ishikawa,应用实时荧光定量PCR和Western blot法检测发现,构建的3个慢病毒质粒都不同程度抑制SNCG mRNA和蛋白的表达且效果显著。本研究成功构建了SNCG特异性RNA干扰慢病毒载体质粒,为进一步研究沉默SNCG后对人子宫内膜癌恶性进展机制的影响以及子宫内膜癌基因治疗的研究,提供了稳定、高效,可靠的技术平台。
[1] Ji H, Liu Y, Jia T,et al. Identification of a breast cancer-specific gene,BCSG1,by direct diferential cDNA sequencing[J].Cancer Res, 1997,57(4):759.
[2] Schaniel C, Lee DF, Lemischka IR. Exploration of self-renewaland pluripotency in ES cells using RNAi[J]. Methods Enzymol, 2010,477:351-365.
[3] Gu YM, Tan JX, Lu XW, et al. BCSG1 methylation status andBCSG1 expression in breast tissues derived from Chinese womenwith breast cancer[J]. Oncology, 2008,74(1-2):61-68.
[4] Ye Q, Wang TF, Peng YF, et al. Expression of alpha-,beta- andgamma-synuclein in colorectal cancer,and potential clinicalsignificance in progression of the disease[J]. Oncol Rep, 2010,23(2):429-436.
[5] Bruening W, Giasson BI, Klein-Szanto AJ, et al. Synucleins areexpressed in the majority of breast and ovarian carcinomas and inpreneoplastic lesions of the ovary[J]. Cancer, 2000,88(9):2154-2163.
[6] Sankpal UT, Goodison S, Abdelrahim M, et al. Targeting Sp1transcription factors in prostate cancer therapy[J]. Med Chem, 2011,7(5):518-525.
[7] Iwaki H , Kageyama S, Isono T, et al. Diagnostic potential in bladdercancer of a panel of tumor markers (calreticulin, gamma-synuclein ,and catechol-o-methyltransferase)identified by proteomic analysis[J]. Cancer Sci, 2004,95(12):955-961.
[8] Zou J, Fan YJ, Meng YQ, et al. An Exploratory analysis of g-synuclein expression in endometrioid endometrial cancer[J]. BMJ Open, 2012,2012(2):000611.
[9] 邹靖,范余娟,徐红.γ-Synuclei在子宫内膜癌中的表达及其与预后的关系[J].广西医学,2012,34(2):163-165.
[10] Liu H, Liu W, Wu Y, et al. Loss of epigenetic control ofsynuclein-gamma gene as a molecular indicator of metastasis in awide range of human cancers[J]. Cancer Res, 2005,65(17):7635-7643.
[11] Gupta A, Inaba S, Wong OK, et al. Breast cancer-specific gene 1interacts with the mitotic checkpoint kinase BubR1 [J]. Oncogene, 2003,22(48):7593-7599.
[12] Lu A, Zhang F, Gupta A, et al. Blockade of AP1 transactivationabrogates the abnormal expression of breast cancer-specific gene 1 inbreast cancer cells[J]. J Biol Chem, 2002,277(35):31364-31372.
[13] Knappskog S, Lonning PE. Effects of the MDM2 promoter SNP285and SNP309 on Sp1 transcription factor binding and cancer risk [J]. Transcription, 2011,2(5):207-210.
[14] Lu A, Li Q, Liu J.Regulatory mechanisms for abnormal expression ofthe human breast cancer specific gene 1 in breast cancer cells[J]. SciChina C Life Sci, 2006,49(4):403-408.
[15] Jiang Y, Liu YE, Goldberg ID, et al. Gamma synuclein,a novelheat-shock protein-associated chaperone, stimulates ligand-dependentestrogen receptor alpha signaling and mammary tumorigenesis[J]. Cancer Res, 2004, 64(13): 4539-4546.
[16] Pang MS, Chen X, Lu B, et al. Lentiviral vector mediated doxycycline inducible iASPP gene targeted RNA interference in hepato cellularcarcinoma[J]. Chin J Cancer, 2010,29(9):796-801.
Construction and identification of shRNA lentivirus vector plasmid of human SNCG gene
LIWenyi,FANWenjuan,XUHong,FANJiangtao,SUNDan
(TheFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530022,China)
ObjectiveTo construct short hairpin RNA (shRNA) lentiviral vector plasmid of human SNCG gene and to detect the changes of SNCG mRNA and protein expression in human endometrial carcinoma cells HEC-1-A and Ishikawa after transfection. MethodsThree SNCG gene specific shRNA sequences were designed, which were SNCG-KD1, SNCG-KD2 and SNCG-KD3, respectively. Using Lipofectamine 2000 to construct a lentiviral vector plasmid in 293T cells. Human endometrial carcinoma HEC-1-A and Ishikawa cells were transfected with SNCG-KD1, SNCG-KD2 and SNCG-KD3 lentiviral vector plasmids. Using real-time PCR to detect the expression of SNCG mRNA, and Western blotting to detect SNCG protein expression.ResultsAge I and EcoR I were used to connect the three groups of positive transformation. The specific bands were in agreement with the predicted results by 1% agarose gel electrophoresis. The results of the analysis and identification of Lite Chromas (VERSION 2.01) gene sequencing were in agreement with GeneBank database alignment, which showed that the synthesis of three pairs of shRNA Oligo DNA SNCG sequences SNCG-KD1, SNCG-KD2 and SNCG-KD3 inserted correctly. After the three lentiviral vectors were transfected into HEC-1-A and Ishikawa cells, the expression of SNCG mRNA and protein in HEC-1-A and Ishikawa cells was significantly decreased (P<0.05).ConclusionThree shRNA SNCG lentiviral vector plasmids are successfully constructed and transfected into HEC-1-A and Ishikawa cells, which may effectively knock down the SNCG gene and inhibit the expression of SNCG mRNA and protein in HEC-1-A and Ishikawa cells.
SNCG gene; short hairpin RNA; lentivirus vector plasmid; endometrial carcinoma; gene silencing
国家自然科学基金资助项目(81460396)。
李文怡( 1990-),女,在读硕士,主要研究方向为普通妇科及妇科肿瘤。E-mail: Yvonneliwy@163.com
简介:范余娟(1965-),女,医学博士,教授,主要研究方向为普通妇科及妇科肿瘤。E-mail: yjfan530@163.com
10.3969/j.issn.1002-266X.2016.26.004
R737.33;Q782
A
1002-266X(2016)26-0013-04
2016-05-12)
