利用鸡蛋壳资源制备乳酸钙的工艺研究
2016-09-05蒙君荣
蒙君荣
(百色学院化学与环境工程学院,广西 百色 533000)
利用鸡蛋壳资源制备乳酸钙的工艺研究
蒙君荣
(百色学院化学与环境工程学院,广西 百色 533000)
该实验研究了利用废弃鸡蛋壳作为原料发生中和反应制备乳酸钙的生产工艺。采用控制变量法,探讨了温度、时间、乳酸用量、加水量对反应体系生成乳酸钙的产率及乳酸钙含量的影响。实验结果表明:鸡蛋壳在恒温950℃下灰化125min,称取鸡蛋壳灰分2g加入20mL蒸馏水以及6mL质量分数为85%的乳酸发生中和反应,获得最佳工艺条件。产品中乳酸钙产率为69.8%,乳酸钙含量为86.4%。
鸡蛋壳;乳酸;乳酸钙;产率
鸡蛋中含有极其丰富的维生素、矿物质和蛋白质等高营养物质,它们对人体机制来说都非常重要,是不可缺少的物质[1-3]。进入21世纪后,我国的食品加工行业的迅速崛起,鸡蛋被加工成各种美食,数以万计的鸡蛋被消耗的同时,也留下了数不胜数的鸡蛋壳。据不完全统计,我国每年扔掉的鸡蛋壳多达400万吨[4]。鸡蛋壳中钙资源非常丰富,人们大量丢弃的鸡蛋壳不仅浪费了这种天然钙源,还会给环境带来极大的污染。乳酸钙作为钙源,相对其他钙源来说,有很多优点。如极易溶于水、无异味、不刺激肠胃、容易被人体吸收、没有副作用,可以长期食用,因此广泛应用在人们生活中,有着广大市场份额[5-7]。乳酸钙除了应用于食品领域,还被广泛应用于医学、农业等领域[8-11]。利用鸡蛋壳制备乳酸钙,不仅开发了家禽行业的深加工行业链,提供了就业岗位,创造了社会财富,还解决了废弃鸡蛋壳所带来的环境污染问题,使鸡蛋壳这种天然钙资源"变废为宝",跳出了环境单纯靠治理的观念,开辟一条环境综合治理,充分利用资源的创新道路。为开发鸡蛋壳资源提供一种有效的、合理的方法,从而进一步提高我国鸡蛋壳的回收利用率,对我国走可持续发展道路具有重要意义。
1 材料与方法
1.1 仪器与试剂
BSA224S型电子天平(赛多利斯科学仪器(北京)有限公司);DHG-9030型电热恒温鼓风干燥箱(上海贺德实验设备有限公司);HH-S2型数显恒温水浴锅(金坛市医疗仪器厂); TM-0617型陶瓷纤维马弗炉(北京盈安美诚科学仪器有限公司);SHB-B95型循环水式多用真空泵(郑州长城科工贸有限公司)。
乳酸(AR);无水乙醇(AR);氢氧化钠(AR);钙羧酸指示剂(AR);乙二胺四乙酸二钠(AR)。
1.2 原材料
鸡蛋壳(学校食堂收集)。
1.3 实验设计
1.3.1 实验基本原理
鸡蛋壳经预处理除杂后,干燥碾碎成粉末,放入马弗炉中在950℃下灰化125min得到高成分CaO的鸡蛋壳灰分,将鸡蛋壳灰分加水制成Ca(OH)2,然后边搅拌边加入乳酸,充分中和反应后,经抽滤、结晶、抽滤、洗涤、干燥得到乳酸钙粉末(Ca[CH3CH(OH)COO]2)。主要反应式为:
CaCO3→CaO+CO2
CaO+H2O→Ca(OH)2
Ca(OH)2+2CH3CH(OH)COOH→Ca[CH3CH(OH)COO]2+2H2O
1.3.2 实验工艺流程
鸡蛋壳→水洗→除杂→壳膜分离→恒温干燥→高温灰化→制成氢氧化钙→加入乳酸中和→抽滤→静止结晶→抽滤→恒温干燥→乳酸钙产品
1.3.3 鸡蛋壳预处理
用自来水清洗一下收集来的鸡蛋壳,除去粘附在鸡蛋壳表面的污垢及鸡蛋壳里面残留的蛋清等杂质,再用自来水浸泡鸡蛋壳一段时间,剥掉鸡蛋壳膜,得到干净的鸡蛋壳,晾干后用电热恒温鼓风干燥箱干燥,最后用碾钵碾碎得到干燥的鸡蛋壳粉末装瓶备用。
1.3.4 鸡蛋壳灰化温度的选择
用电子天平称取5组2 g的鸡蛋壳粉末,放入陶瓷纤维马弗炉中分别在650,750,850,950,1050℃恒温灰化125 min,然后加入2.5mol/L的HCl溶液20 mL,观察反应现象,对比产生的气泡数量多少,确定分解情况是否完全,得出最佳灰化温度。
1.3.5 鸡蛋壳灰化时间的选择
用电子天平称取5组2g的鸡蛋壳粉,放入陶瓷纤维马弗炉中,在温度为950℃下分别灰化85,95 ,105,115,125 min然后加入20mL2.5mol/L的盐酸,观察反应现象,对比产生的气泡数量多少,确定分解状况是否完全,得出最佳灰化时间。
1.3.6 乳酸用量的选择
准备5只编有1、2、3、4、5编号的100 mL烧杯,用电子天平各称取2g鸡蛋壳灰分。加入20 mL蒸馏水,不断搅拌,使其充分反应得到Ca(OH)2,再分别对应加入4 ,5 ,6 ,7 ,8mL质量分数为85%的乳酸发生中和反应,并不断搅拌,充分反应后,自然冷却静止一段时间,完全析出乳酸钙晶体后用抽滤机抽滤,再恒温80℃恒温干燥300min,得到乳酸钙粉末。用电子天平称出乳酸钙产品的质量,并测出产品中乳酸钙的含量,通过实验结果对比,得出乳酸的最适用量。
1.3.7 水用量的选择
准备5只编有1、2、3、4、5编号的100mL烧杯,用电子天平各称取2g鸡蛋壳灰分,分别对应加入12 ,16 ,20 ,24 ,28 mL的水。并不断搅拌使其充分反应得到Ca(OH)2,再边搅拌边加入6mL乳酸,待充分反应后,自然冷却静止一段时间,完全析出乳酸钙晶体后用抽滤机抽滤,得到的固体再转移到恒温干燥箱中,恒温80℃干燥300min,最终得到乳酸钙粉末。用电子天平称出乳酸钙质量,并测出产品中乳酸钙的含量,通过实验结果对比,得出加水的最适用量。
1.3.8 反应温度的选择
准备5只编有1、2、3、4、5编号的100mL烧杯,用电子天平各称取2g鸡蛋壳灰分,分别加入20mL水制成Ca(OH)2,然后分别在30,45,60,75,90℃的恒温条件下边搅拌边加入6mL质量分数为85%的乳酸,充分反应后自然冷却,待完全析出乳酸钙后抽滤,再恒温80℃干燥300min,得到乳酸钙产品。用电子天平称出其质量,并测出产品中乳酸钙含量。通过实验结果对比,得出乳酸中和反应的最适温度。
1.3.9 结晶时间的选择
准备5只编有1、2、3、4、5编号的100mL烧杯,用电子天平各称取2g鸡蛋壳灰分,分别加入20mL水制成Ca(OH)2,在恒温75℃条件下,边搅拌边加入6mL质量分数为85%的乳酸。充分反应后,趁热抽滤,除去未反应的Ca(OH)2和其他杂质。将滤液放置室温下自然冷却,时间分别为15 ,30 ,45 ,60 ,75 min。然后抽滤,在恒温80℃条件下干燥300min,得到乳酸钙产品。用电子天平称出产品质量,并测出产品中乳酸钙含量,通过实验结果对比,得出最佳的结晶时间。
1.3.10 干燥时间的选择
用电子天平称取2g鸡蛋壳灰分,加入20mL水制成Ca(OH)2,在恒温75℃下缓慢加入6mL质量分数为85%的乳酸。充分中和反应后,趁热用抽滤机抽滤,除掉未反应的杂质。滤液置于室温中,自然冷却结晶60min后再抽滤。由于乳酸溶于乙醇,而乳酸钙不溶于乙醇,因此用无水乙醇洗涤多次后得到纯度极高的乳酸钙产品。乳酸钙水合物在120℃下干燥会失水变成无水乳酸钙。因此,把洗涤后高纯度的乳酸钙水合物产品在120℃下分别干燥100 ,150,200,250 ,300 min,得到乳酸钙粉末。用电子天平称出各干燥时间段的产品质量,通过实验结果对比,确定最适干燥时间。
1.3.11 平行实验
准备5只编有1、2、3、4、5编号的100mL烧杯,各称取2g鸡蛋壳灰分,分别加入20mL水,在恒温75℃下边搅拌边加入6mL质量分数为85%的乳酸,充分反应后趁热抽滤除去杂质,将滤液置于室温下自然冷却结晶60min,再用抽滤机抽滤,并用无水乙醇洗涤多次乳酸钙产品,然后在120℃下恒温干燥250min,得到白色乳酸钙粉末。
1.3.12 乳酸钙鉴别方法
用电子天平称0.5g产品,加入10mL蒸馏水溶解,滴加硫酸使其显酸性。加入适量高锰酸钾溶液,加热有乙醛气味产生。重新用电子天平称取0.5g实验产品,慢慢滴加草酸铵溶液,即有白色沉淀产生。分离白色沉淀,加入乙酸,白色沉淀不溶解;再加入盐酸,白色沉淀完全溶解[12]。
1.3.13 乳酸钙含量的测定方法
用电子天平称取产品样品0.3g,精确到0.002g,先加入0.5mol/L的EDTA二钠溶液25mL溶解,再加入10%的NaOH溶液5mL和0.1g钙红混合指示剂,然后继续用0.5mol/L的EDTA二钠滴定至蓝色即为终点[13]。
乳酸钙含量(%)=V×C×0.218×100/m
式中:V——EDTA二钠溶液的用量;C——EDTA溶液的摩尔浓度;m——样品的质量。
2 结果与分析
2.1 鸡蛋壳灰化温度的影响
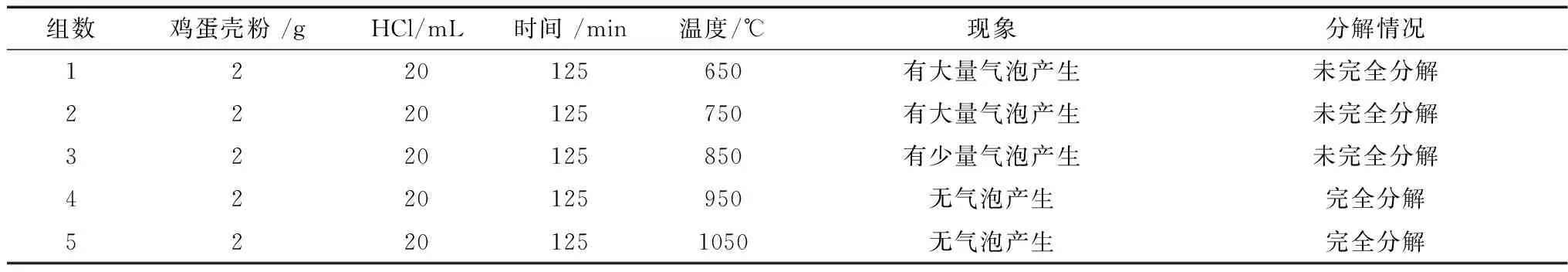
表1 不同温度对鸡蛋壳灰化生成CaO的影响
由表1可以看出,随着反应温度的升高,产生的气泡不断减少,但温度达到950℃时,已没有气泡产生。这说明随着反应温度的不断升高,鸡蛋壳中的CaCO3不断减少,分解成CaO,到950℃时,已完全分解成CaO,温度继续升高对CaCO3分解作用已无影响,却消耗电量,浪费资源。因此,在灰化125min条件下灰化温度为950℃,灰化效果达到最好。
2.2 鸡蛋壳灰化时间的影响
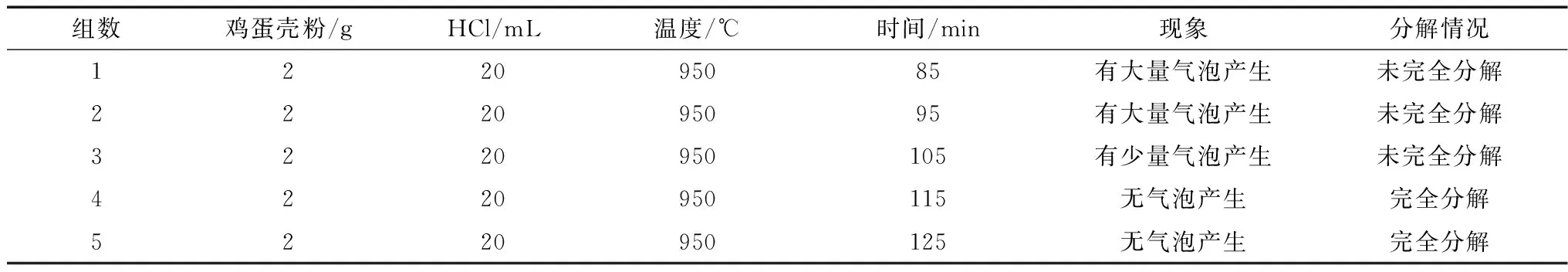
表2 不同灰化时间对鸡蛋壳灰化生成CaO的影响
由表2可以看出,随着灰化时间逐渐增加,反应产生的气泡不断减少,当灰化时间达到115min时,已没有气泡产生了。这说明随着灰化时间的延长,鸡蛋壳中的CaCO3不断分解成CaO,当灰化时间到115min时,CaCO3已完全分解。灰化时间的增加对灰化效果已无影响,只会消耗电量,浪费资源,更浪费金钱。因此,在950℃灰化条件下,选择灰化115min为宜。
2.3 乳酸用量的影响
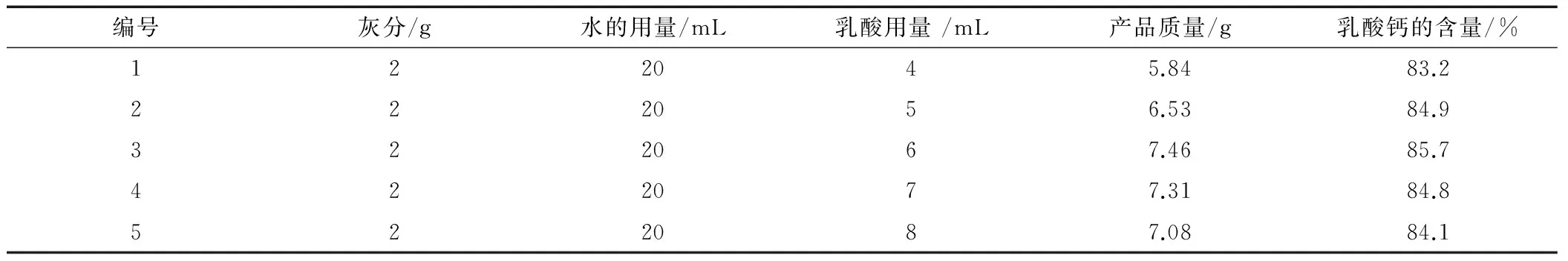
表3 乳酸的不同用量对反应体系生成乳酸钙的影响
由表3可以看出,在其他条件不变情况下,乳酸用量从4mL升到6mL时,产品质量和乳酸钙含量都在不断增加,当乳酸用量为6mL时,达到最大值,分别为7.46g和85.7%。随着乳酸用量的不断增多,产品的质量和乳酸钙的含量都在不断减低。因此,2g鸡蛋壳灰分对应最适合乳酸用量为6mL质量分数85%的乳酸。
2.4 加水量的影响
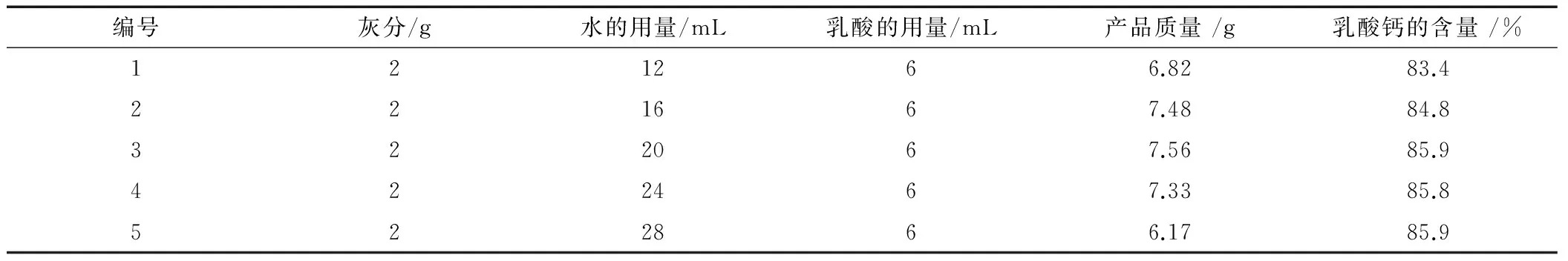
表4 加水量的不同对反应体系生成乳酸钙的影响
由表4可以看出,在其他条件不变的情况下,水的用量从12mL增加到20mL时,产品的质量和乳酸钙的含量都在增加,当水的用量增加到20mL时,产品的质量和乳酸的含量都达到最大值,分别为7.56g和85.9%。水的用量继续增加时,产品的质量反而减低,这极可能是有部分乳酸钙溶于水中,跟随母液一起在抽滤时流失掉,没能转化成固体,降低乳酸钙的产率。因此,2g鸡蛋壳灰分的最佳用水量为20mL合适。
2.5 反应温度的影响
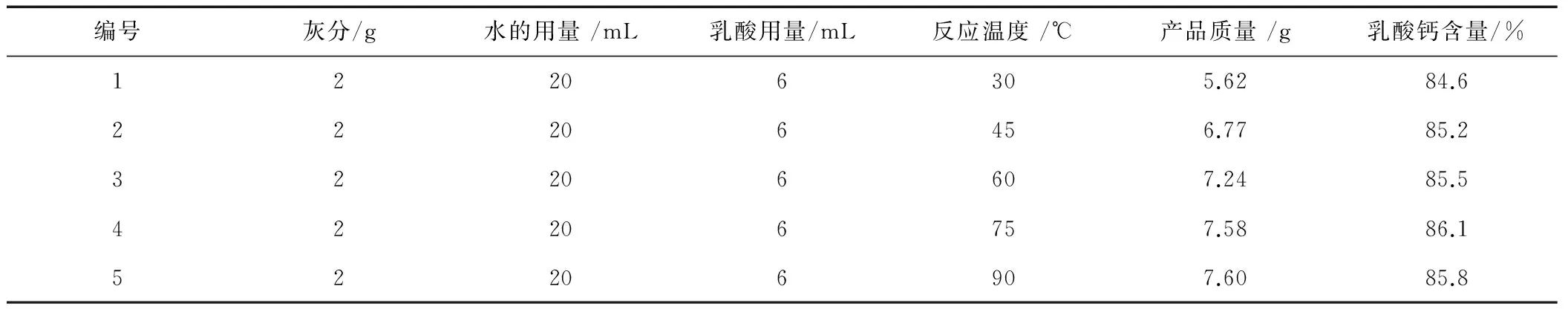
表5 不同反应温度对体系生成乳酸钙的影响
由表5可以看出,在其他条件不变情况下,反应温度的不断升高,产品的质量也在不断增多,乳酸钙的含量也在提高。然而当反应温度达到75℃时,乳酸钙含量达到最大值为86.1%,温度的继续升高对产品质量影响不大,反而使乳酸钙含量降低。因此,考虑综合因素,乳酸的最佳中和反应温度为75℃。
2.6 结晶时间的影响
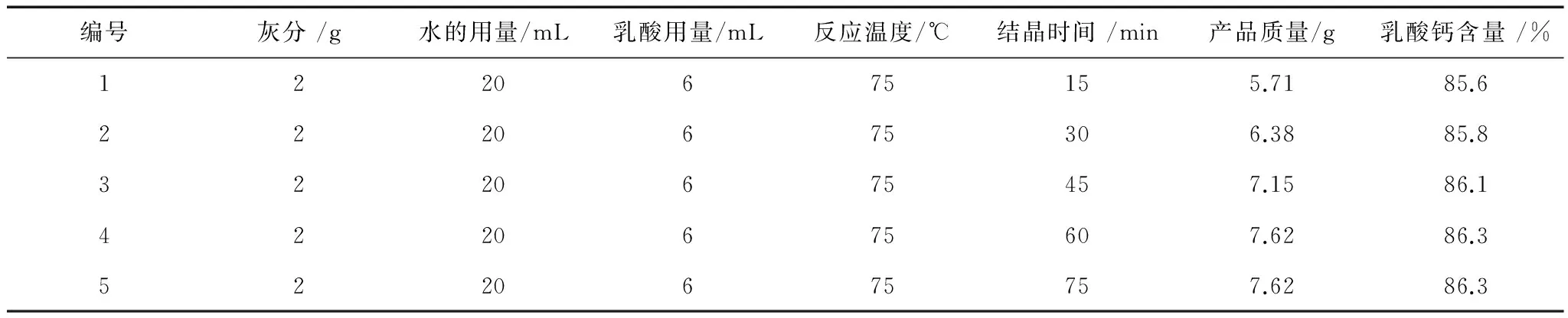
表6 结晶时间的不同对反应体系生成乳酸钙的影响
由表6可以看出,在其他条件不变的情况下,随着结晶时间的延长,产品的质量和乳酸钙含量都在增加。当结晶时间达到60min时,产品质量和乳酸钙含量均达到最大值,分别为7.62g和86.3%。结晶时间的继续增加对产品质量和乳酸钙含量已经没有影响了。因此,为了节约时间,缩短生产周期,2g鸡蛋壳灰分中和反应后的结晶时间为60min合适。
2.7 干燥时间的影响
从表7可以看出,干燥时间的不断延长,产品质量也不断减少,说明产品中水含量也跟着不断地减少。当干燥时间达到250min后,产品质量几乎不再减少,说明产品中水的含量极低,很难再蒸发掉了。继续干燥对减少产品中的含水量几乎影响不大,却大量浪费电量。因此,考虑众多因素,乳酸钙产品的干燥时间应为250min合适。
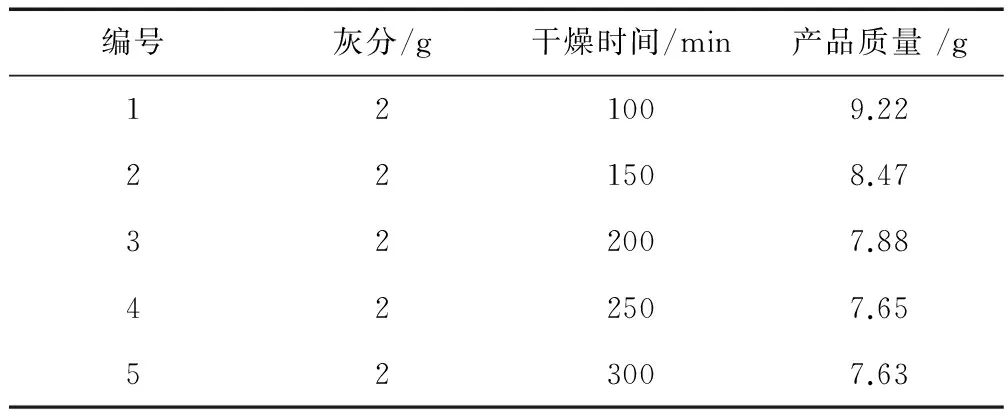
表7 干燥时间的不同对产品中水的含量的影响
2.8 重复性实验
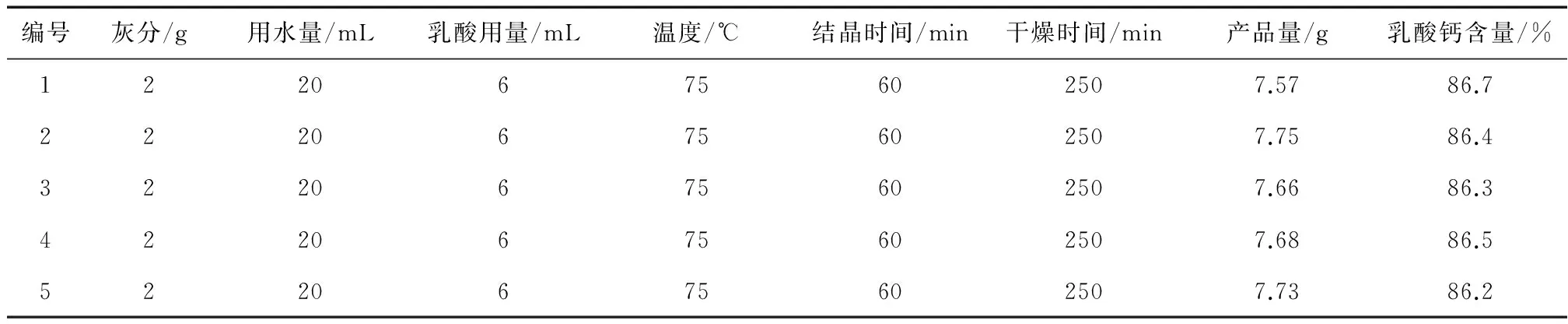
表8 重复性实验
从表8可以得出,2g鸡蛋壳灰分与乳酸中和反应生成的产品平均质量为7.68g。而2g鸡蛋壳灰分按93%CaO来计算则理论值为10.23g,因此,乳酸钙的产率为75.1%,乳酸钙含量为86.4%。
3 结论
影响乳酸钙制备工艺的因素众多,通过对鸡蛋壳灰分、用水量、乳酸用量、反应温度、结晶时间、干燥时间的考察,对乳酸钙的生产工艺条件进行优化,为实际乳酸钙的生产应用提供一定的参考依据。
[1] 唐 琦.常吃鸡蛋好处多[J].初中生,2009(7):64.
[2] 赵 磊.鲜鸡蛋致病微生物检测与控制技术研究[D]. 乌鲁木齐:新疆农业大学,2010.
[3] 李春光.鸡蛋功效[J].农产品市场周刊,2011(15):26-27.
[4] 徐有均.鸡蛋的营养价值[J].畜牧与饲料科学,2012(9):116-117.
[5] 李惠明.吃鸡蛋的学问[J].家庭医学(新健康),2007(11):44-45.
[6] 梦 娜.鸡蛋的营养价值新说[J].河北农机,2007(6):28.
[7] 郑学斌.浅析鸡蛋的营养价值及食用误区[J].湖北畜牧兽医,2008(6):13-14.
[8] 杨 理,闫清华,马孝琴,等.鸡蛋壳再资源化的开发及应用前景[J].农产品加工(学刊),2009(10):136-138.
[9] 胡 茂,苟兴能.鸡蛋壳的性状[J].绵阳经济技术高等专科学校学报,2002(4):10-14.
[10] 司伟达,王旭清,韩兆鹏,等.鸡蛋壳资源的再开发及研究进展[J].农产品加工,2014(1):36-37.
[11] 洪坤.鸡蛋壳制备高水溶性果汁钙的研究[J].粮油食品科技,2008(2):53-54.
[12] 盛淑玲,姜罡丞,高丽.鸡蛋壳制备丙酮酸钙[J].许昌学院学报,2004(2):109-112
[13] 黄奕颖.钙强化营养荞麦蛋糕的工艺研究[D]. 呼和浩特市:内蒙古农业大学,2013.
(本文文献格式:蒙君荣.利用鸡蛋壳资源制备乳酸钙的工艺研究[J].山东化工,2016,45(24):15-18.)
The Technology Research for Preparating Calcium Lactate by Using Egg Shell Resource
Meng Junrong
(College of Chemistry&Environmental Engineering,Baise University, Baise 533000,China)
This experiment to study the preparation of calcium lactate using egg shell resource by neutralization reaction process. Using the control variable method, This paper discusses the temperature, time, dosage of lactic acid and water content on the yield of the reaction system to generate calcium lactate and calcium lactate. Experimental results show that the egg shells under the temperature 950 ℃ ashing 125 min, weighing egg shell ash content of 2g 20 mL distilled water and 6 ml of the mass fraction of 85% lactic acid neutralization reaction occurs, get the best process conditions. Products of calcium lactate production rate was 69.8%, calcium lactate content is 86.4%.
egg shell; lactic acid; calcium lactate; yield
2016-11-10
蒙君荣(1989—),女,广西南宁人,教师,硕士研究生,研究方向:化学工艺。
O627
A
1008-021X(2016)24-0015-04
