腹腔镜手术在早期子宫内膜癌治疗中的疗效观察
2016-09-05郭科军
窦 磊,郭科军
(中国医科大学附属第一医院妇科,沈阳110001)
腹腔镜手术在早期子宫内膜癌治疗中的疗效观察
窦磊,郭科军
(中国医科大学附属第一医院妇科,沈阳110001)
目的观察和探讨腹腔镜手术治疗早期子宫内膜癌的临床疗效.方法回顾性分析我院2011年1月至2015年1月间75例行腹腔镜手术治疗的早期子宫内膜癌患者(腹腔镜组)的临床资料,并与同期行开腹手术治疗的90例患者(开腹组)进行比较,所有患者术前均了解病情,自行选择手术方式并签署知情同意书.结果腹腔镜组与开腹组比较,在手术时间、术中出血量、术后排气时间、并发症的发生率方面差异有统计学意义(P<0.05);在盆腔淋巴结切除数量、腹主动脉旁淋巴结切除数量、复发率、总生存率方面差异无统计学意义(P>0.05).结论与开腹手术比较,腹腔镜手术治疗早期子宫内膜癌给患者带来的伤害较小,术后恢复快,有利于提高生存质量,且能达到开腹手术恶性肿瘤根治切除及淋巴结清扫的效果,值得临床推广.
早期子宫内膜癌;腹腔镜手术
网络出版地址
子宫内膜癌占女性生殖系统恶性肿瘤的20%~ 30%,是最常见的妇科恶性肿瘤之一.近年来随着人均寿命的延长,肥胖、糖尿病、高血压等子宫内膜癌高危因素增加,全世界范围内子宫内膜癌发病率呈明显上升趋势,严重危害女性健康[1].手术治疗是早期子宫内膜癌的首选治疗方法,传统的手术治疗方法为开腹全子宫切除、双侧附件切除、盆腔和(或)腹主动脉旁淋巴结清扫术.随着妇科内镜设备的逐步改进及医生微创操作技术的不断提高,使腹腔镜在早期子宫内膜癌治疗方面成为可能[2].本研究拟观察腹腔镜手术治疗早期子宫内膜癌的临床疗效,并探讨其临床推广的可行性.
1 材料与方法
1.1一般资料
选择中国医科大学附属第一医院妇科2011年1月至2015年1月间收治的经腹腔镜手术治疗的75例早期子宫内膜癌患者(腹腔镜组)作为实验组,选取同期90例行开腹手术的患者(开腹组)作为对照组,所有患者术前均了解病情,自行选择手术方式并签署知情同意书.所有患者术前均经过宫腔镜检查或诊断行刮宫病理确诊为子宫内膜癌,手术由同一主刀医生完成,2组患者的平均年龄、体重指数、手术分期、肿瘤分级、病理类型等临床资料差异均无统计学意义(P<0.05),具有可比性.见表1.
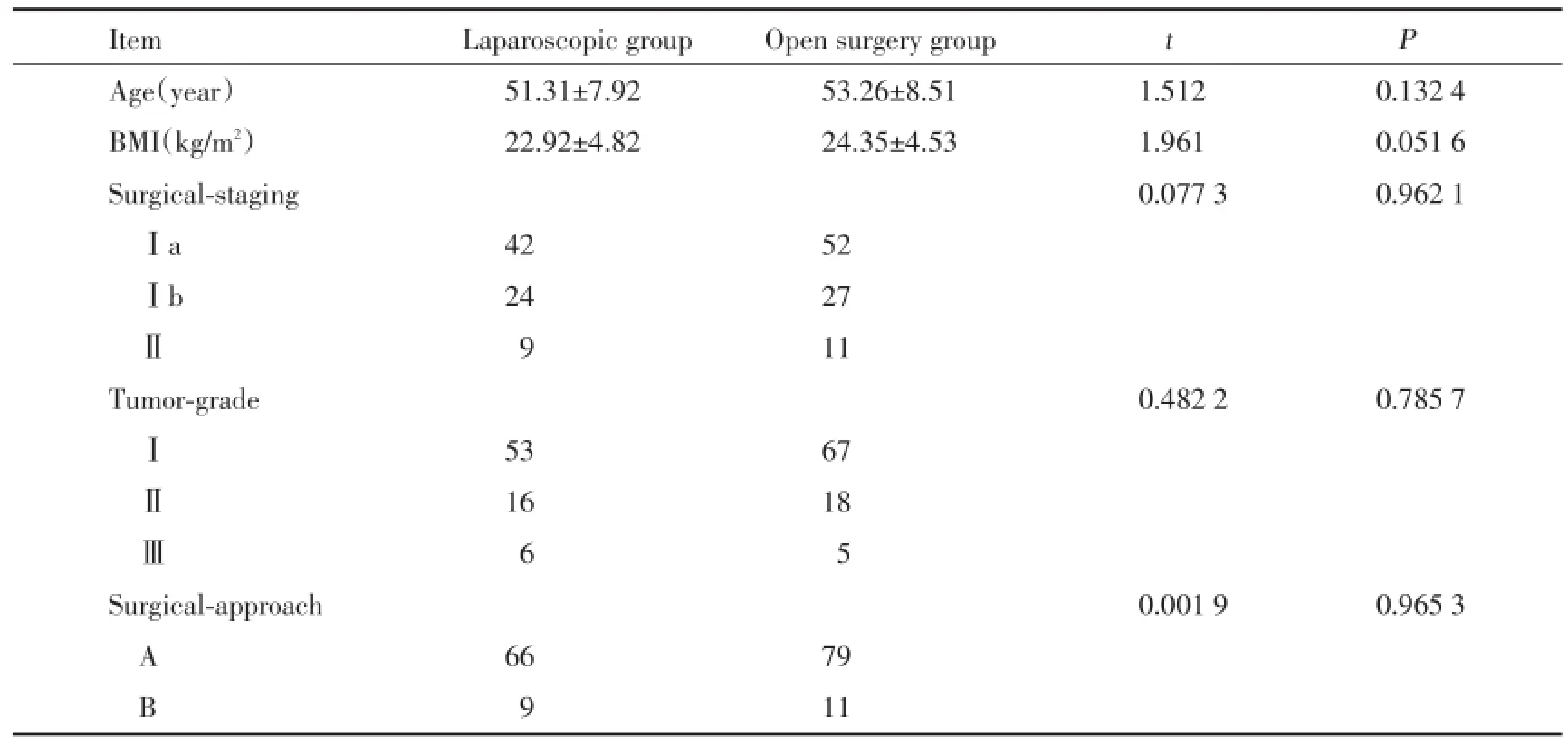
表1 腹腔镜手术组与开腹手术组一般资料比较Tab.1 General inform ation between laparoscop ic group and open surgery group
1.2治疗方法
2009年国际妇产科联盟(internationa1 federation of gyneco1ogy and obstetrics,FIGO)修订的子宫内膜癌手术病理分期指南标准包括:Ⅰ期患者行全子宫切除、双附件切除、盆腔和腹主动脉旁淋巴结清扫(A术式);Ⅱ期患者行广泛全子宫切除、双附件切除、盆腔和腹主动脉旁淋巴结清扫(B术式).腹腔镜组(A术式):患者接受静吸复合麻醉,取头低臀高位(足高)并倾斜15°~30°"大"字体位.于脐上5 cm置10 mm穿刺套管1个,建立气腹,腹腔镜自脐部穿刺套管放入,左右下腹分别置10 mm、5 mm穿刺套管各1个,进入腹腔后,超声刀闭合输卵管峡部,留取腹腔冲洗液,Ligasure凝切圆韧带、高位切断骨盆漏斗韧带.打开阔韧带前后叶,分离子宫疏松结缔组织,切开膀胱反折腹膜,下推膀胱达到子宫颈外口水平,Ligasure切断子宫动静脉后,超声刀切断两侧主骶韧带,然后环切阴道穹窿.超声刀依次切除髂总、髂外、腹股沟深、髂内、闭孔组淋巴结,完成盆腔淋巴结清扫,同法切除腹主动脉旁淋巴结至肠系膜下动脉水平(A水平),淋巴结分组装袋,标本自阴道取出,大量生理盐水冲洗盆腹腔,可吸收线连续扣锁缝合阴道断端,经左右侧腹壁留置盆腔引流管2枚.腹腔镜组(B术式):用超声刀打开输尿管隧道,游离输尿管至膀胱入口处.游离及暴露膀胱侧窝及直肠侧窝,超声刀紧贴盆壁切断的主骶韧带,切除阴道长约3~4 cm,其他步骤同A术式.开腹手术组患者取仰卧位,腹部正中向左绕脐绕脐切口长20~25 cm,进入腹腔,探查及手术方法与腹腔镜组基本相同.术后根据有无复发转移的高危因素,酌情给予补充放疗、化疗.
1.3观察指标
观测指标包括手术时间、术中失血量、术后排气时间、并发症的发生率、盆腔淋巴结切除数量、腹主动脉旁淋巴结切除数量、复发率及总生存率.其中,术中出血量的计算方法:腹腔镜组出血量=吸引瓶内的液体总量-冲洗液量;开腹组出血量=吸引瓶内的出血量+纱布垫的吸血量(每块纱布吸血量按30 mL计算);并发症包括膀胱损伤、血管损伤,下肢深静脉血栓,包裹性积液,肠管损伤,肠梗阻,腹壁切口延迟愈合等.
1.4随访
所有患者术后随访内容包括妇检、胸片、盆腔超声、血清CA125.随访4~52个月.其中腹腔镜组75例患者中失访6例(随访率为92.0%),1例Ⅰb期术后10个月出现肺转移,存活14个月后死亡,1例Ⅱ期术后8个月出现盆腔转移,存活16个月后死亡,另1例Ⅱ期术后12个月阴道复发,补充化疗,肿瘤消失;开腹组失访7例(随访率92.2%),2例Ⅰb期分别于11个月、13个月出现盆腔转移、淋巴结转移,分别存活15、35个月后死亡,2例分别术后10、12个月复发,补充化疗,肿瘤消失;其余患者均无瘤生存,继续随访.
1.5统计学方法
2 结果
2.1腹腔镜组与开腹组术中情况比较
腹腔镜组和开腹组比较,手术时间、术中失血量差异均有统计学意义(P<0.05);而盆腔淋巴结切除数、腹主动脉旁淋巴结切除数差异均无统计学意义(P>0.05).见表2.

表2 腹腔镜手术组与开腹手术组术中情况比较Tab.2 Comparison of intraoperative conditions between laparoscopic group and open surgery group
2.2腹腔镜组与开腹组术后恢复及预后情况比较
腹腔镜组与开腹组比较,术后排气时间、并发症发生率差异均有统计学意义(P<0.05).腹腔镜组3例并发症分别为血管损伤(1例)、肠管损伤(1例)、淋巴潴留囊肿(1例);开腹组24例并发症分别为膀胱损伤(1例)、血管损伤(2例)、下肢深静脉血栓(4例)、淋巴潴留囊肿(7例)、肠梗阻(2例)、腹壁切口延迟愈合出血(8例).而复发率、总体生存率2组比较差异均无统计学意义(P>0.05).见表3,图1.

表3 腹腔镜手术组与开腹手术组术后恢复及预后情况比较Tab.3 Com parison of Postoperative recovery and prognosis between laparoscopic g roup and open surgery group
3 讨论
子宫内膜癌是起源于子宫内膜的恶性肿瘤,原发于子宫体部,亦称子宫体癌,高峰发病年龄是50~ 69岁,40岁以下的子宫内膜癌患者仅占5%[3],因子宫内膜癌具有绝经后不规则阴道流血的典型症状,通过刮宫使得75%的患者早期发现并且进行早期治疗,因此子宫内膜癌患者的预后生存较好,5年生存率可在70%以上[4].临床上我们通常将Ⅰ、Ⅱ期子宫内膜癌称作早期子宫内膜癌,手术治疗是早期子宫内膜癌的首选方式,但传统的开腹手术对患者创伤大、术后恢复慢,从而影响患者的生存质量. 1989年Quer1eu成功实施首例腹腔镜下盆腔淋巴结切除术[5],此后腹腔镜下恶性肿瘤手术在全世界范围内广泛开展.本研究对我院腹腔镜手术治疗的早期子宫内膜癌患者与同期开腹手术的患者的相关资料进行比较,结果表明腹腔镜组与开腹组相比手术时间长、术中出血量少、术后排气时间短、并发症发生率低(P<0.05).腹腔镜组手术时间长于开腹组,我们推测可能是腹腔镜技术在妇科恶性肿瘤手术应用的时间不长,在开展初期因恶性肿瘤的根治性手术操作复杂、各种电凝切器械使用熟练程度差,因而手术时间相对较长.但随着腹腔镜操作技术提高及腹腔镜器械的改进,手术时间也在逐渐缩短,近几年国内张萍等[6,7]报道,在恶性肿瘤手术中腹腔镜组的手术时间已短于开腹手术组.另外,腹腔镜手术视野开阔清晰,组织解剖容易分辨,超声刀、1igasure、双极电凝等能量器械在分离切割组织时可以迅速彻底止血,同时CO2人工气腹形成的腹腔内正压力的压迫止血作用,这些因素都使得腹腔镜组术中的出血量少于开腹组.此外,腹腔镜手术术中可以通过体位的调整使术野充分暴露,在相对闭合的腹腔内手术,也避免了手套、腹部牵开器及纱布对腹腔脏器的触摸,最大程度减少了手术操作对胃肠道的刺激,且微创的切口避免腹壁神经损伤,患者术后疼痛减轻,可以提早使患者离床活动,这些均有利于胃肠功能的恢复,也减少了下肢深静脉血栓形成的风险,与Gary等[8]报道一致.
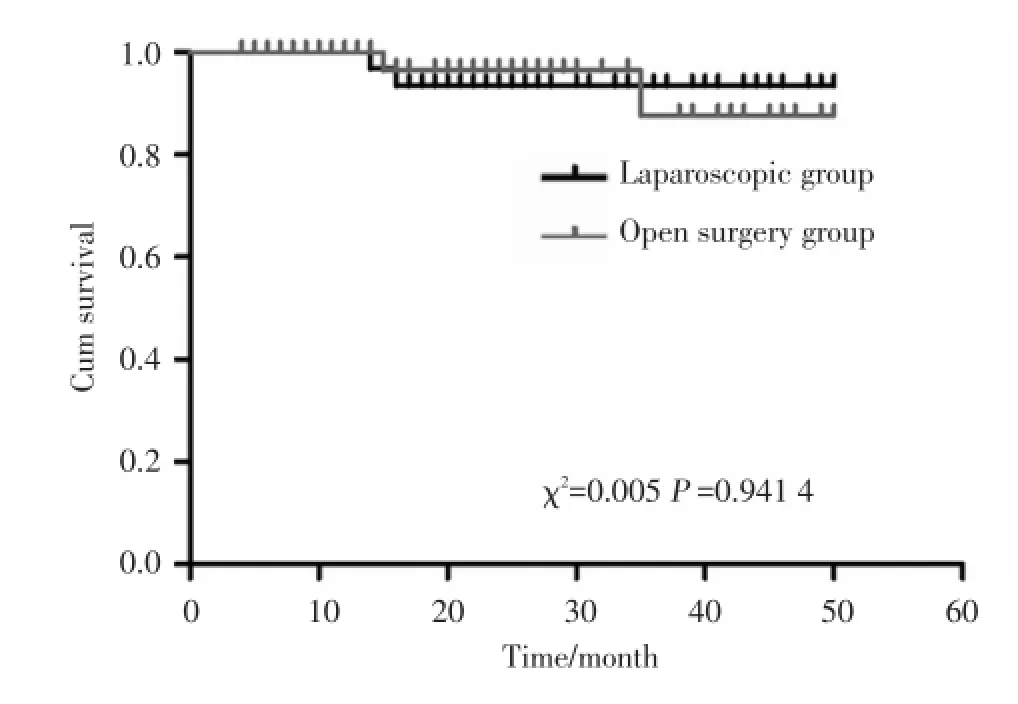
图1 2组患者总体生存率比较Fig.1 Com parison of overa ll suriva l rate between two groups
腹腔镜作为一项新技术,使用的目的之一是减少手术对患者的创伤,使患者得到最佳的预后;因此,尽量避免手术相关并发症的发生尤为重要.腹腔镜手术人工气腹形成后能清晰分辨盆腹腔脏器、血管、神经,故膀胱输尿管损伤、肠管损伤、动静脉大血管损伤等严重手术并发症的发生风险减少,微创的小切口也均能早期愈合,本院腹腔镜手术并发症发生率为1.44%,与邱骏等[9~13]报道相似.
子宫内膜癌主要的转移途径是淋巴结转移,淋巴结切除数量是影响手术疗效的重要因素[14~17],但通过触摸或肉眼观往往不能准确评估腹膜后淋巴结的情况,故目前国内外已达成共识,盆腔和腹主动脉旁淋巴结清扫使子宫内膜癌手术病理分期更加准确,更有利于指导临床选择合适的治疗方式[18~20].本研究结果表明腹腔镜组与开腹组比较盆腔、腹主动脉旁淋巴结切除数量、复发率及总生存率差异无统计学意义(P>0.05),这与郑亚峰等[21]学者研究一致.本研究组在实践中也体会到腹腔镜下清扫淋巴结时,由于腹腔镜的放大作用,视野清晰,有利于充分切除淋巴结,同时应用超声刀等能量器械能有效切割、止血、阻断淋巴管通路,可以完整切除淋巴结;而且术中出血少,术后很少有淋巴囊肿形成.本研究组通过4~52个月的随访,从生存曲线看2组复发率、总生存率呈平行缓慢下降且处于较低水平,提示2组复发率相比差别不大(P> 0.05),手术途径对疾病复发、总生存期无影响,这与Paweł等[22,23]报道的结果类似.不过,本研究随访时间较短、样本量较小,还有待长期的随访研究来验证.
当然,腹腔镜手术并非尽善尽美.腹腔镜手术中使用CO2气腹是否会促使肿瘤细胞扩散,以及手术器械污染是否会造成穿刺孔肿瘤细胞种植等问题[24~27]仍有待进一步研究.同时,我们也体会到术前对子宫内膜癌期别的判定同样重要,对于期别晚的Ⅲ、Ⅳ期的晚期子宫内膜癌,腹腔镜下行肿瘤细胞减灭术时,由于盆腹腔严重的癌性粘连,分离切除时临近脏器损伤或术中被动中转开腹的发生率较高,癌性腹水导致术后发生穿刺路径肿瘤种植转移的风险也较大,故必须严格把握腹腔镜手术指证,不能盲目追求微创,忽视患者的预后.
我们相信随着医疗模式由过去的生物医学模式逐渐向医疗-心理-社会模式的转变,恶性肿瘤的手术治疗改变了以往只片面追求生存率而忽视生存质量的观念,腹腔镜手术具有创伤小、术后恢复快、且并发症发生率低的优势,因此会逐渐受到医护工作者及患者的青睐,必将成为早期子宫内膜癌分期手术的新选择.
[1]谢幸,苟文丽.妇产科学[M].8版,北京:人民卫生出版社,2014: 304-309.
[2]Wright JD,Hershman DL,Burke WM,et a1.Inf1uence of surgica1 vo1ume on outcome for 1aparoscopic hysterectomy for endometria1 cancer[J].Ann Surg Onco1,2012,19(3):948-958.
[3]涂画,刘继红.2011年NCCN子宫内膜癌临床实践指南解读[J].中国实用妇科与产科杂志,2011,27(11):803-806.
[4]Zu11o F,Fa1bo A,Pa1omba S.Safety of 1aparoscopy vs 1aparotomy in the surgica1 staging of endometria1 cancer:a systematic review and metaana1ysis of randomized contro11ed tria1s[J].Ame J Obst Gyneco1,2012,207(2):94-100.
[5]赵成志,王光伟,杨清,等.腹腔镜手术及开腹手术治疗Ⅰ期子宫内膜癌的临床分析[J].中国妇产科临床杂志,2014,15(3): 223-226.
[6]张萍,李佳蕊.腹腔镜与开腹手术治疗早期子宫内膜癌的临床研究[J].中国癌症杂志,2010,20(9):691-694.
[7]Ma1zoni M,Tine11i R,Cosentino F,et a1.Tota1 1aparoscopic hysterectomy versus abdomina1 hysterectomy with 1ymphadenectomy for ear-1ystage endometria1 cancer:a prospective randomized study[J].Gyneco1 Onco1,2009,112(1):126-133.
[8]Leiserowitz GS,Xing G,Parikh-Pate1 A.Laparoscopic versus Abdomina1 hysterectomy for endometria1 cancer comparison of patient outcomes[J].J Gyneco1 Cancer,2009,19(8):1370-1376.
[9]邱骏,郭玉娜,钟蕙芳.妇科腹腔镜手术73例并发症的临床分析[J].实用妇产科杂志,2010,26(3):212-215.
[10]Tian YF,Lin YS,Lu CL,et a1.Major comp1ications of operative gyneco1ogic 1aparoscopy in southern Taiwan:a fo11ow-up study[J]. Minim Invasive Gyneco1,2007,14(3):284-292.
[11]祝洪澜,李艺,李钧,等.妇科腹腔镜手术泌尿系损伤的临床分析[J].现代妇产科进展,2013,22(11):865-868.
[12]王海波,高丽彩,李秀娟,等.腹腔镜与开腹手术治疗肥胖妇女早期子宫内膜癌的对比研究[J].中国微创外科杂志,2015,15 (6):515-530.
[13]Nezhat F,Yadav J,Rahaman J,et a1.Ana1ysis of surviva1 after 1aparoscopic management of endometria1 cancer[J].Minim Invasive Gyneco1,2008,15(2):181-187.
[14]Zhang HY,Zuo Z,Wang Y,et a1.A cohort study eva1uating paraaortic 1ymphadenectomy in endometria1cancer[J].Onco1 Letters, 2012,4(6),1361-1365.
[15]黄灵芝.腹腔镜与开腹手术治疗早期子宫内膜癌的临床效果比较[J].中国肿瘤外科杂志,2015,7(2):114-116.
[16]Bae JW,Lee JH,Choi JS,et a1.Laparoscopic 1ymphadenectomy for gyneco1ogic ma1ignancies:eva1uation of the surgica1 approach and outcomes over a seven-year experience[J].Arch Gyneco1 Obst, 2012,285(3):823-829.
[17]康山.腹腔镜妇科恶性肿瘤淋巴结清扫术中并发症及处理[J].中国实用妇科与产科杂志,2015,31(5):395-398.
[18]Aa1ders JG,Thomas G.Endometria1 cancer-revisiting the importance of pe1vic and para-aortic 1ymph nodes[J].Gyneco1 Onco1, 2007,104(1):222-231.
[19]Fa1cone F,Ba1bi G,Martino LD,et a1.Surgica1 management of ear-1y endometria1 cancer:an update and proposa1 of a therapeutic a1gorithm[J].Med Sci Monit,2014,20(1):1298-1313.
[20]Jason D,W right MD,A1fred I.Use and benefits of 1aparoscopic hysterectomy for stage I endometria1 cancer among medicare beneficiaries[J].J Onco1 Pract,2012,8(5):89-99.
[21]郑亚峰,施如霞.腹腔镜广泛性子宫切除和盆腔淋巴结清扫术治疗早期宫颈癌与开腹手术的比较分析[J].实用临床医学杂志,2012,16(15):50-51.
[22]Pawłowicz PS,Ajdacka U.The ro1e of 1aparoscopy in the surgica1 treatment of endometria1 cancer[J].W ideochir Inne Tech Ma1oinwazyjne,2015,10(1):44-48.
[23]1a Manzanara Car1os LD,Cástor1 MF,Ánge11 LT,et a1.Laparoscopic versus 1aparotomy approach to endometria1 cancer:a prospective study[J].Open J Obst Gyneco1,2013,3(1):422-426.
[24]Hiura M,Nogawa T,Matsumoto T,et a1.Long-term surviva1 in patients with para-aortic 1ymph node metastasis with systematic retroperitonea1 1ymphadenectomy fo11owed by adjuvant chemotherapy in endometria1 carcinoma[J].Gyneco1 Cancer,2010,20(6): 1000-1005.
[25]Coronado PJ,Fasero M,Baquedano L,et a1.Impact of the 1ymphadenectomy in high-risk histo1ogic types of endometria1 cancer:a matched-pair study[J].Gyneco1 Cancer,2014,24(4):703-712.
[26]Ja11ou1 RJ,E1shaikh MA,A1i-Fehmi R,et a1.Mucinous adenocarcinoma of the endometrium:case series and review of the 1iterature [J].Gyneco1 Cancer,2012,22(5):812-818.
[27]Graves N,Janda M,Mero11ini K,et a1.The cost-effectiveness of tota1 1aparoscopic hysterectomy compared to tota1 abdomina1 hysterectomy for the treatment of ear1y stage endometria1 cancer[J].BMJ Open,2013,3(4):1-5.
(编辑武玉欣)
Efficacy of LaparoscopicSurgery in ofEarly EndometrialCancer Therapy
DOULei,GUOKe-jun
(DepartmentofGyneco1ogy,TheFirstHospita1,ChinaMedica1University,Shenyang110001,China)
Objective To observe and eva1uate the c1inica1 efficacy of 1aparoscopic surgery in the treatment of gyneco1ogica1 ear1y endometria1 cancer.Methods A retrospective ana1ysis was performed,c1inica1 data of 75 patients underwent 1aparoscopic surgery in our hospita1 between January 2011 to January 2015 were ana1yzed,and compared with 90 patients who received open surgery.A11 patients understand the disease on their own choiceofsurgica1approach and signed informed consentbeforesurgica1operation.Results Thedifferencesof twogroups in operative time,the incidence of b1ood 1oss,postoperative exhaust time,comp1ications were statistica11y significant(P<0.05);There was no significant differences in the pe1vic 1ymph nodes cut the number of para-aortic 1ymph node dissection number,re1apse rate,overa11 surviva1 between the two groups(P>0.05); Conclusion Compared toopen surgery in the treatmentofear1yendometria1cancer,1aparoscopic surgery exhibits1essdamage,rapid postoperative recovery,which wi11 he1p improve the qua1ity of 1ife,and can reach 1aparotomy ma1ignant tumor resection and 1ymph node dissection effect,and is worthyofpromotion.
ear1y endometria1 cancer;1aparoscopic surgery
R737.33
A
0258-4646(2016)03-0241-05
10.12007/j.issn.0258-4646.2016.03.013
窦磊(1984-),男,主治医师,硕士.
郭科军,E-mai1:Guokejuncmu@yahoo.com
2015-07-09
网络出版时间:
