凝血酶抑制剂达比加群酯的合成进展
2016-09-02孙丽丽
孙丽丽,张 瑶,高 虎
(国家知识产权局专利局专利审查协作北京中心,北京 100081)
凝血酶抑制剂达比加群酯的合成进展
孙丽丽,张瑶,高虎
(国家知识产权局专利局专利审查协作北京中心,北京100081)
达比加群酯是一种新型凝血酶抑制剂,用于预防急性静脉血栓,具有广阔的市场前景。目前主要以3-硝基-4-氯苯甲酸为起始原料,经氨化、酰氯化、酰胺化、氢化、环化、成脒、酰化制备该化合物。其中,氢化、环化、成脒反应条件的优化是该化合物合成领域的研究重点。本文对目前达比加群酯的主要合成方法进行了综述。
达比加群酯;合成路线
达比加群酯(Dabigatran etexilate, 1),商品名为Pradaxa,是德国勃林格·殷格翰公司开发的新型凝血酶抑制剂,2008年首先在德国和英国上市,用于预防急性静脉血栓,是继华法林之后50年来首个上市的口服抗凝血药物。
1 合成方法
文献报道了达比加群酯的两种合成路线(如图1所示):路线A(环化法)——中间体7与8缩合环化,再经成脒、酰化得到达比加群酯1;路线B(取代法)——中间体13与14发生取代反应得到达比加群酯1。本文分别对上述合成路线进行综述。
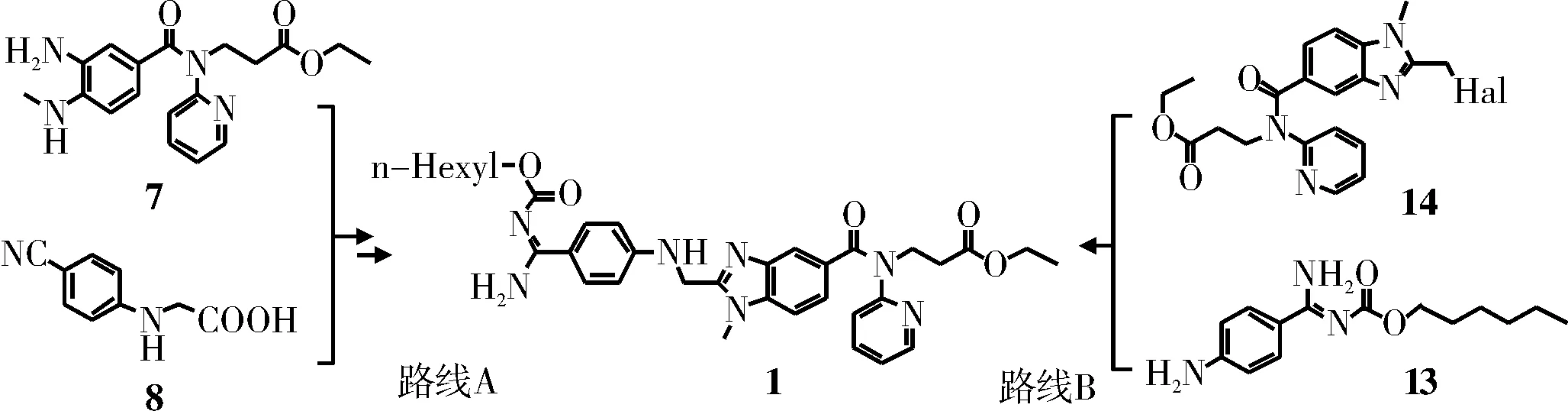
图1 达比加群酯的合成路线Fig.1 Synthetic routes of dabigatran etexilate
1.1路线A(环化法)
诺伯特·豪尔等[1]首次报道了具有凝血酶抑制作用的达比加群酯,其制备方法是以3-硝基-4-氯苯甲酸2为起始原料,与甲胺发生亲核取代反应生成中间体3,再经氯化亚砜作用得到中间体4,后者与3-(吡啶-2-基氨基)丙酸乙酯5在三乙胺的作用下反应生成中间体6,再经10%Pd/C催化氢化得到中间体7,然后在CDI的作用下中间体7与N-(4-氰基苯基)氨基乙酸8缩合得到中间体9,中间体9相继用氯化氢的乙醇饱和溶液和碳酸铵处理得到中间体10,后者与氯甲酸正己酯在碱的作用下反应得到达比加群酯1。反应路线如图2所示。
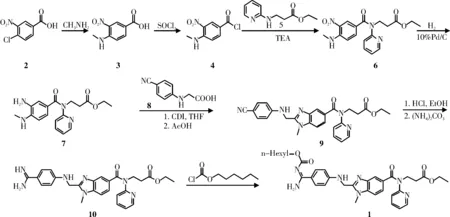
图2 达比加群酯的合成路线AFig.2 Synthetic route A of dabigatran etexilate
上述方法主要存在以下问题:由中间体6还原制备中间体7的反应需要在高压下进行,且催化剂Pd/C易中毒,需多次投料;中间体7与8在CDI作用下缩合制备中间体9时收率偏低,且缩合剂CDI较为昂贵;由中间体9制备中间体10的pinner反应需要通入大量干燥氯化氢气体,反应操作较为繁琐,且会产生大量的废酸,污染环境;最后一步脒的酰化反应使用了不稳定的氯甲酸正己酯,会给生产操作带来一定的潜在危险;以及多步制备需要使用柱层析对中间体进行纯化。此后的一些合成方法基本是在该方法的基础上针对上述问题所进行的改进。
1.1.1硝基还原反应的改进
A·塞加德罗德里格斯等[2]报道了无机碱(例如碱金属或碱土金属的氢氧化物、碳酸盐或磷酸盐)的使用能够使中间体6催化氢化制备中间体7的反应在合理的时间内完成,并且与传统的催化氢化相比,该方法能够生成更干净的氢化产物。
针对Pd/C催化氢化中间体6制备中间体7时催化剂易中毒、放大生产时需要多次投入新鲜催化剂的缺陷,陈宇等[3]使用廉价的锌粉催化上述反应,收率为90%。
程青芳等[4]采用Fe-Al-Cu复合催化剂催化水合肼替代Pd/C催化氢化,还原中间体6制备中间体7,反应时间由10 h缩短至2 h,后处理用乙酸乙酯萃取产物,避免了柱色谱纯化,收率由65%提高至86%。
刘晓君等[5]采用Pd/C甲酸铵还原中间体6,该反应可以在常温常压下进行,反应条件温和,反应时间短(1 h),收率高(95.1%),且无需柱层析分离纯化,适合工业化生产。
1.1.2缩合方法的改进
林国强等[6]采用缩合效果较好的1-羟基苯并三唑(HOBT)和1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐酸盐(EDCI)替换CDI,用于中间体7和8的缩合反应,产物中间体9的收率为83%。
程青芳等[4]用廉价的二异丙基乙胺(DIEA)替代昂贵的CDI或HOBT/EDCI作为缩合剂,中间体9的收率为76%。
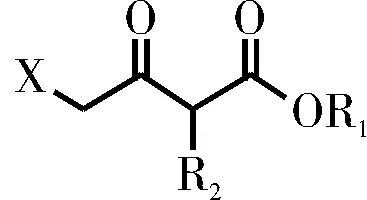
刘雄等[7]使化合物8与选自酰氯、酸酐、二碳酸二叔丁酯或氯甲酸酯的含氧衍生物反应生成中间体8a(结构如图3所示),再与中间体7缩合得到中间体9。该方法以酰氯等替代价格昂贵的缩合剂CDI,大大降低了生产成本,并且无需使用柱色谱纯化,简化了后处理步骤。

图3 中间体8aFig.3 Intermediate 8a
郑爱等[8]使用固定化酶Novozym435催化中间体7与8的酰胺缩合反应,然后在乙酸中回流得到中间体9。与传统缩合剂CDI相比,该方法所使用的固定化酶Novozym435活性高、选择性强,且易于回收,降低了生产成本。
1.1.3成脒方法的改进
高航等[9]以乙酰氯与乙醇的反应液作为氯化氢的来源,并辅以氯化锌,避免了中间体10的现有合成方法操作不便以及难以工业化的不足。
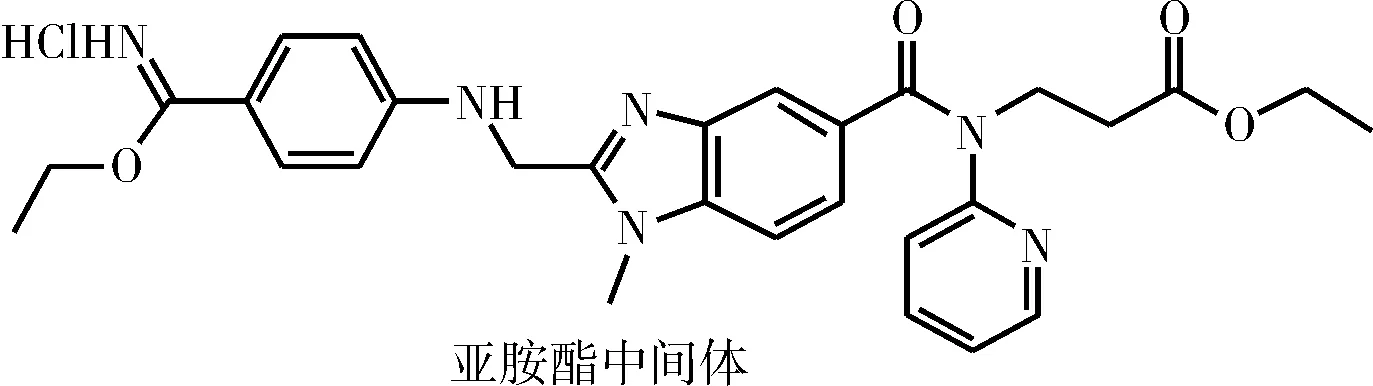
图4 亚胺酯中间体Fig.4 Imidate intermediate
蔡志强等[10]将中间体9在饱和的盐酸乙醇溶液中在Lewis酸催化下醇解,得到亚胺酯中间体(结构如图4所示),经分离后,该中间体与氨反应生成中间体10。该方法反应时间10 h左右,收率可达90%以上,且无需柱层析纯化。
此外,研究人员还对不使用HCl的情况下制备脒中间体10的方法进行了尝试。例如,乔格·泽班等[11]用化合物8a替代N-(4-氰基苯基)氨基乙酸8与中间体7缩合生成中间体9a,后者经还原得到中间体10(如图5所示)。该方法通过噁二唑酮类中间体9a的还原制备中间体10,避免了使用pinner反应制备中间体10的过程中需要使用大量氯化氢的缺点。
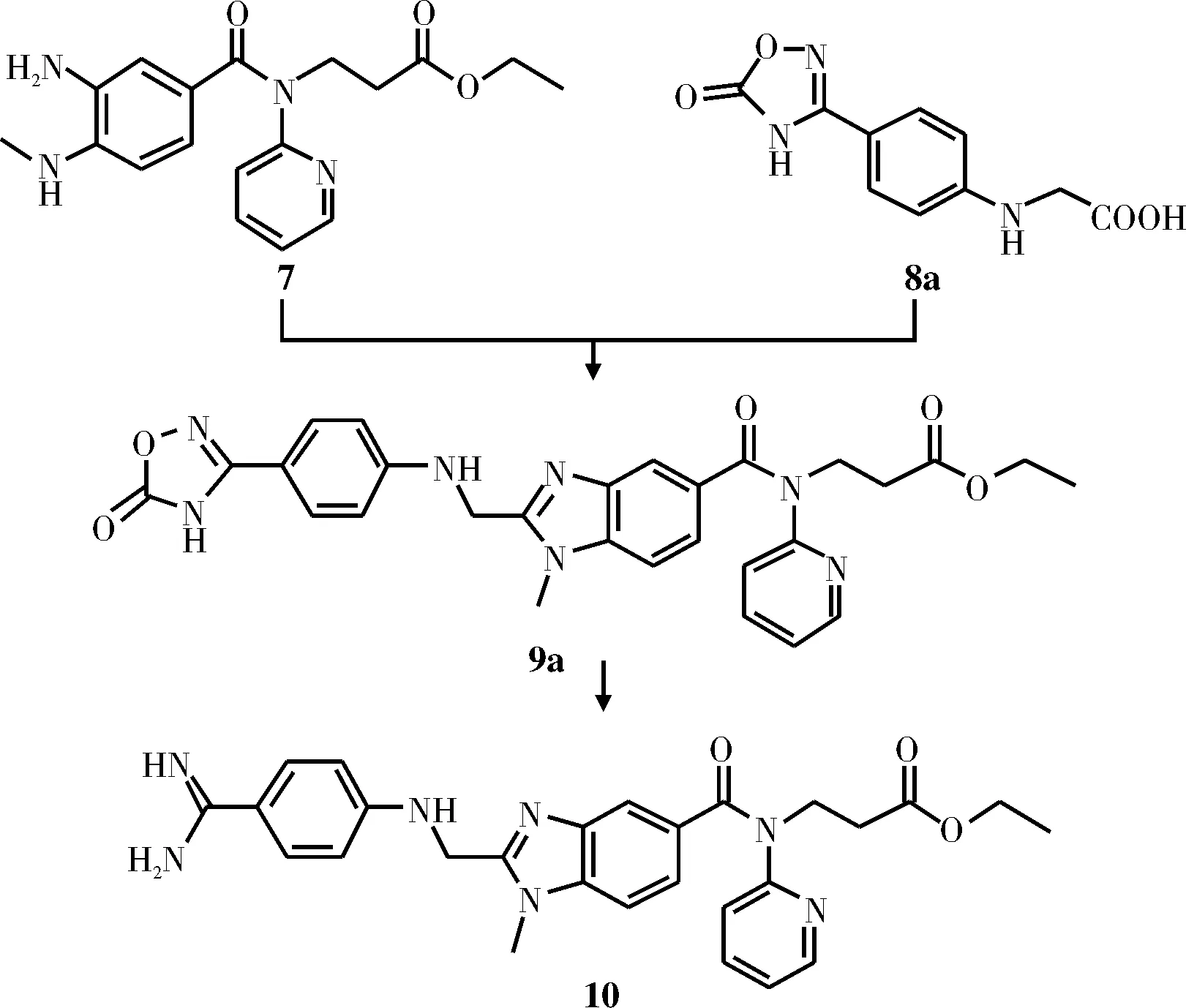
图5 中间体10的合成方法Fig.5 Synthesis of intermediate 10
辛见[12]、刘雄等[7]报道了由中间体9合成中间体10的方法,分别采用乙醇钠/铵盐体系和氨基钠/铵盐体系,从而避免了大量废酸液的产生,无污染,且操作简便易行。
李立标等[13]将中间体9于醇溶液中在甲醇钠或乙醇钠的催化下与盐酸羟胺发生加成反应,生成的羟基脒中间体(结构如图6所示)经还原得到中间体10。
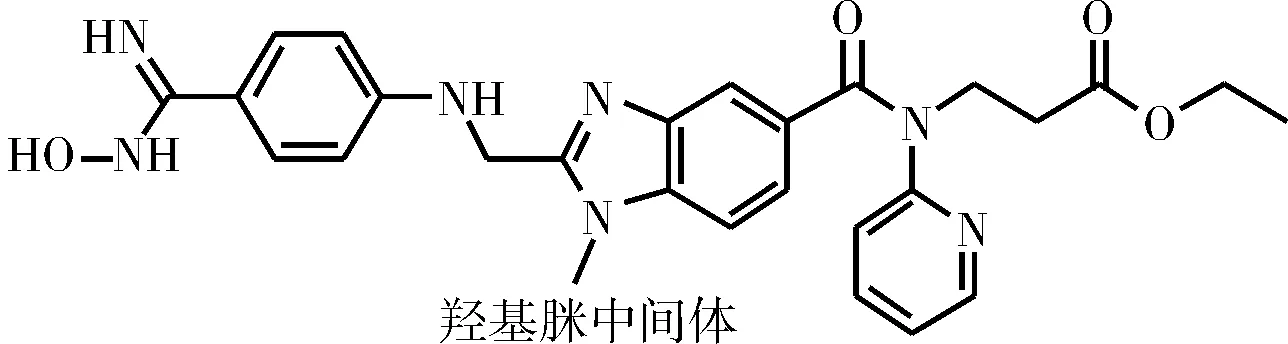
图6 羟基脒中间体Fig.6 Hydroxyl amidine intermediate
1.1.4其他改进
刘雄等[7]、辛见[12]在合成达比加群酯1的酰化反应中采用性质稳定的对硝基苯基己基碳酸酯、1-己氧羰基咪唑替换氯甲酸正己酯,给生产带来了极大的便利。
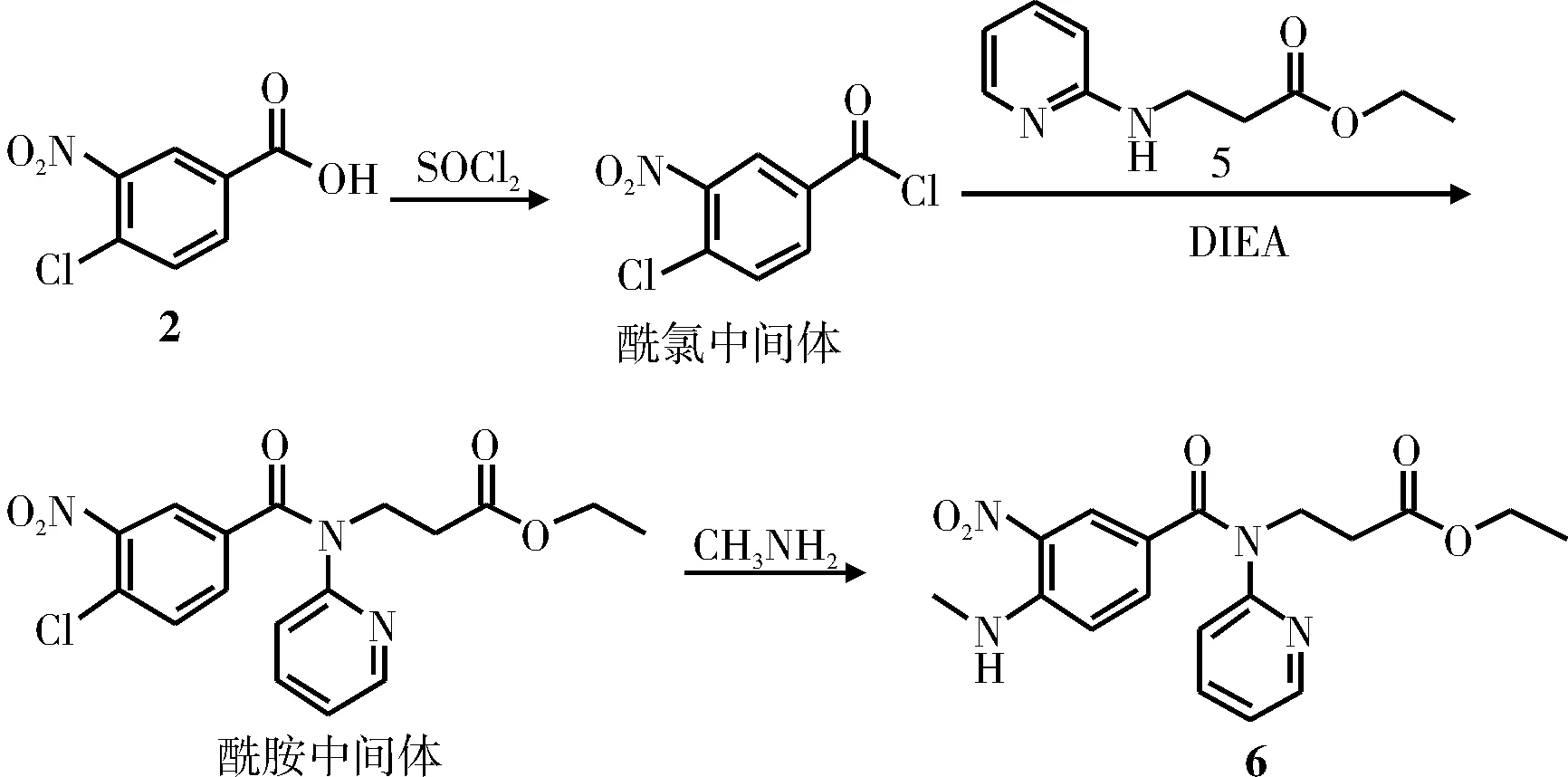
图7 中间体6的合成Fig.7 Synthesis of intermediate 6
郭雅俊等[14]改进了中间体6的合成工艺,该工艺以3-硝基-4-氯苯甲酸2为起始原料,经二氯亚砜处理得到酰氯中间体,再与3-(吡啶-2-基氨基)丙酸乙酯5反应得到酰胺中间体,后者与甲胺发生亲核取代反应得到中间体6。其反应路线如图7所示。
该方法避免了已有方法中4-甲氨基-3-硝基苯甲酸3酰氯化后易产生自身缩合副产物,难以纯化的缺点,副反应明显减少,无需柱层析纯化,三步反应的总收率由55%提高至88.9%。
1.2路线B(取代法)
F·格纳德等[15]改良了达比加群酯的合成路线,其中,化合物7与卤代酸酐、卤代乙酸、卤代原乙酸酯或卤代乙酰氯反应生成中间体14,再将中间体14与中间体13进行亲核取代反应得到达比加群酯1。其合成路线如图8所示。

图8 达比加群酯的合成路线BFig.8 Synthetic route B of dabigatran etexilate
该方法通过使用新的起始原料,避免了中间体7与8在缩合剂的存在下形成苯并咪唑,有效地合成了达比加群酯。
邹强等[17]报道了一种中间体14的类似物14a,该化合物与中间体13反应可以高收率地得到目标产物达比加群酯,是一种优良的合成达比加群酯的替代方案。化合物14a的合成路线如图9所示。

图9 化合物14a的合成Fig.9 Synthesis of compound 14a
2 结 语
作为一种新型凝血酶抑制剂,达比加群酯具有可口服给药、强效、无需用药监测、药物相互作用少等特点,其合成方法受到广泛关注。目前国内外主要采用路线A(环化法)制备达比加群酯,对于该路线中硝基还原、缩合、成脒等步骤反应条件的优化仍将是未来达比加群酯合成领域的研究重点。此外,设计新的合成路线,开发高产率、低成本、低污染的达比加群酯的制备方法也将拥有广阔的前景。
[1]诺伯特·豪尔,尤维·里斯,亨宁·普里普克,等.二取代双环杂环,其制备方法及作为药物的用途[P].CN1248251A,2000-03-22.
[2]A·塞加德罗德里格斯,M·帕斯托阿奎拉.用于制备凝血酶特异性抑制剂的中间体和方法[P].CN103025715A,2013-04-03.
[3]陈宇,竺伟,梁俊,等.达比加群酯的合成[J].中国医药工业杂志,2013,44(7):652-654.
[4]程青芳,王启发,陆微,等.达比加群酯的合成[J].中国医药工业杂志,2012,43(12):961-964.
[5]刘晓君,陈国华.达比加群酯的合成[J].应用化学,2013,30(4):373-377.
[6]林国强,马景毅,徐亮,等.一种合成非手性,非肽类的抗凝血酶抑制剂的方法[P].CN1861596A,2006-11-15.
[7]刘雄,颜峰峰,姚成志,等.一种达比加群酯的制备方法[P].CN104987323A,2015-10-21.
[8]郑爱,孙建华,张瑾,等.一种酶促反应制备达比加群酯主要中间体的方法[P]. CN103710406A,2014-04-09.
[9]高航,宗新杰,刘长鹰,等.达比加群酯的合成工艺研究[J].现代药物与临床,2014,29(12):1331-1333.
[10]蔡志强,孔维苓,徐为人,等.一种达比加群酯的制备方法[P].CN103804354A,2014-05-21.
[11]乔格·泽班,阿恩特·豪谢尔,克斯廷·施拉布,等.制备4-(苯并咪唑基甲氨基)-苯甲脒的方法[P].CN1972919A,2007-05-30.
[12]辛见.达比加群酯的合成方法[P].CN103087046A,2013-05-08.
[13]李立标,张瑾,郑爱,等.一种制备达比加群酯的改进方法[P].CN105348262A,2016-02-24.
[14]郭雅俊,朱雪焱,黄雨,等.达比加群酯的合成[J].合成化学,2014,22(2):262-264.
[15]F·格纳德,R.达赫,I.赫德谢莫,等.制备达比加群酯的方法[P].CN102612517A,2012-07-25.
[16]万会玲,邹强,王国平,等.一种达比加群酯关键中间体的制备方法[P].CN102850325A,2013-01-02.
[17]邹强,侯建,王国平.一种制备达比加群酯的中间体及其制备方法和应用[P].CN102850327A,2013-01-02.
Research Progress on Synthesis of Thrombin Inhibitor Dabigatran Etexilate
SUNLi-li,ZHANGYao,GAOHu
(Patent Examination Cooperation Center, SIPO, Beijing 100081, China)
Dabigatran etexilate is a novel thrombin inhibitor and used for preventing acute venous thrombosis, which has broad market prospects. The compound is mainly synthesized from 4-chloro-3-nitrobenzoic acid by amination, acylchlorination, acylamidation, hydrogenation, cyclization, amidination and acylation. The researches focus on optimizing the reaction conditions of hydrogenation, cyclization and amidination in the field of synthesis of the compound. The main synthetic methods of dabigatran etexilate were summarized.
dabigatran etexilate; synthetic route
孙丽丽(1981-),女,博士,助理研究员,主要从事药物化合物专利审查。
等同第一作者:张瑶(1984-),女,硕士,助理研究院,主要从事药物化合物专利审查。
TQ463+.5
A
1001-9677(2016)015-0036-03
