一种高效的苯胺及其苯环衍生物的单溴代方法*
2016-09-01任志斌陈锦春
任志斌,陈锦春
(烟台大学化学化工学院,山东 烟台 264005)
一种高效的苯胺及其苯环衍生物的单溴代方法*
任志斌,陈锦春
(烟台大学化学化工学院,山东烟台264005)
以丙酸、甲基叔丁基醚和三乙胺的缓冲体系为溶剂,在低温条件下用溴素直接对苯胺及其苯环衍生物进行溴代,高产率得到单溴代产物,产物结构均由1H NMR确认无误。与文献报道方法相比较,该方法减少了副反应的发生,同时回收一半量的溴原子,避免了对环境的污染,也避免了浪费。该溴代方法简单、高效、经济、环保而且不用金属催化剂,易实现规模化生产。
苯胺;单溴代反应;溴素
芳基溴化物可以通过交叉偶联反应如:Stille、Suzuki、Heck或Sonogashira等用于碳碳键的形成[1]。所以该类化合物是许多有机金属试剂、精细化学品[2]、治疗药物、农药和生物活性分子合成的重要中间体[3]。
在芳香化合物的卤代反应中,溴的反应活性高于碘,因此很难控制只生成一溴代的产物[4]。直接用溴素对芳香化合物进行溴代的方法会使一半的溴转化为有毒、有腐蚀性的溴化氢。这不仅浪费了溴原子而且会对环境造成污染[5]。目前已经发展了许多溴代试剂来替代溴素用于芳香化合物和芳杂环化合物的溴代反应。例如:NBS-Al2O3、NBS-NH4OAc、NBS-Pd(OAc)2、NBS-DMF(or THF)、NBS-PTSA、NBSac-Amberlyst-15等[6]。虽然这些方法大部分都有比较好的产率,但是高成本和有机废物的产生限制了这些试剂在工业中的应用范围。此外,氧化溴化法如:KBr-NaBO3-4H2O,HBr-H2O2、HBr-O2-NaNO2,KBr-H2O2、NH4Br-H2O2[7]、LiBr-O2-Cu(OAc)2[8]等,解决了传统溴化方法带来的溴原子利用率低和环保问题。但是这些方法也存在一种或几种缺点。而不用溴化氢的方法也需要用到多聚物或者钨、铜、银等金属催化剂[9],成本较高,极大地限制了其工业应用范围。
由于苯胺及其苯环衍生物易发生氧化反应加之氨基的强活化作用,以上反应条件大部分不适于苯胺及其衍生物的单溴代物的制备。
本研究论文介绍了一种苯胺及其苯环衍生物的单溴代方法:以甲基叔丁基醚、丙酸和三乙胺的缓冲体系为溶剂,溴素做溴化试剂,低温进行反应。反应结束后抽滤得到固体三乙胺的氢溴酸盐,回收一半的溴原子。在减少溴原子的浪费同时避免了对环境的污染。该方法的主要产物是单溴代产物,二溴代和三溴代副产物之和低于6%,使得产物的纯化相对简单。反应式如下:

1 实 验
1.1试剂与仪器
苯胺,溴素,甲基叔丁基醚,丙酸和碳酸氢钠等试剂,均为分析纯,天津博迪化工股份有限公司。
85-1 磁力搅拌器,上海司乐;DF-101S 集热式恒温加热搅拌器,郑州长盛;ARX-400 型核磁共振仪,德国Bruker 公司。
1.2实验操作
取溴素(50.9 g 318 mmol 1.05 eq)加入1 L的圆底烧瓶中,用甲基叔丁基醚(200 mL)和丙酸(200 mL)的混合溶液稀释备用。
在装有磁力搅拌的2 L圆底烧瓶中加入苯胺(28.2 g 302.8 mmol 1 eq)、甲基叔丁基醚(520 mL)和丙酸(520 mL),搅拌溶解,氮气保护降温至-15 ℃,加入三乙胺(183.9 g 1.816 mol 6 eq)。将溴素的稀释溶液用恒压滴液漏斗缓慢的滴加至反应体系中,滴加时间维持1 h。溴素滴加完后在-15 ℃下继续反应0.5 h,TLC检测反应结束。减压抽滤得到三乙胺氢溴酸盐。减压蒸除滤液的溶剂,加入1 L二氯甲烷,用氨水调pH=10。水洗两次,饱和食盐水洗,无水硫酸钠干燥,减压浓缩至80 mL,滴加石油醚200 mL重结晶,过滤,真空干燥得到产品,产率79%。1H NMR (CDCl3, 400 MHz): δ 3.55 (br, 2H), 6.62 (d, 2H,J=8.0 Hz), 7.24 (d, 2H,J=8.0Hz)。
2 结果与讨论
2.1反应温度对苯胺二溴代产物和单溴代产物比例的影响
优化实验证明:温度对苯胺及其衍生物溴代反应产物的比例影响很大。反应温度影响反应速率,温度越高反应速率越快,二溴代产物所占比例越大;反应温度越低,反应速率越慢,二溴代产物所占比例越小。
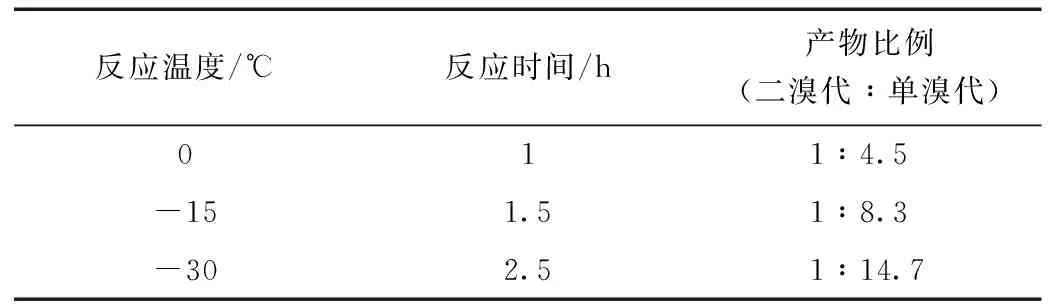
表1 反应温度对苯胺二溴代产物和单溴代产物比例的影响
2.2反应体系酸度对苯胺多溴代产物和单溴代产物比例、产率的影响
我们对于苯胺及其衍生物的溴代反应采用丙酸和三乙胺的缓冲体系。反应体系的酸碱度会影响苯胺及衍生物的反应活性,对反应多溴代产物与单溴代产物的比例有很大的影响。反应体系的酸性越强底物的反应活性越高,产物中多溴代产物所占比例越大,反之,反应体系酸性越弱,则反应产物中多溴代产物所占比例越小。

表2 反应体系酸度对苯胺多溴代产物和单溴代产物比例、转化率的影响
2.3该反应体系对不同的苯胺衍生物溴代结果
(1)4-取代的苯胺衍生物反应只有邻位溴代产物,且产率较高,这应该是因为-NH2是强邻对位定位基,而对位已经有取代基了。该方法产率比一般溴代方法高8%~20%。具体产物和产率结果如下:
底物:4-氯苯胺 产物:2-溴-4-氯苯胺(89.2%)
4-氟苯胺2-溴-4-氟苯胺(80.5%)
4-甲基苯胺2-溴-4-甲基苯胺(82.9%)
4-甲氧基苯胺2-溴-4-甲氧基苯胺(87.4%)
4-甲酸乙酯苯胺2-溴-4-甲酸乙酯苯胺(85.6%)
(2)3-取代的苯胺衍生物由于-NH2是强邻对位定位基,而其中一个邻位的位阻较大,所以产物主要为邻位溴代产物和对位溴代产物。该方法的产率比文献报道的产率高10%~20%,且提高了邻位溴代产物的产率。具体产物和产率结果如下:
底物:3-溴苯胺;产物:2,5-二溴苯胺(47.4%),3,4-二溴苯胺(49.4%);3-甲氧基苯胺;2-溴-5-甲氧基苯胺(41.0%);3-甲氧基-4-溴苯胺(52.2%)。
(3)3,4-取代的苯胺衍生物有2-、5-、6-、三个位点可以溴代,由于-NH2是强邻对位定位基,反应主要生成两个邻位的溴代产物,产率与文献报道的产率接近。
底物:3,4-二甲基苯胺;
产物:2-溴-4,5-二甲基苯胺(19.3%),2-溴-3,4-二甲基苯胺(48.6%);
底物:3-氯-4-甲基苯胺;
产物:2-溴-5-氯-4-甲基苯胺(41.9%),2-溴-3-氯-4-甲基苯胺(53.8%)。
苯胺衍生物的溴代反应产物的结构均由1H NMR确认无误。部分1H NMR谱图数据如下:
2-溴-4-氯苯胺:1H NMR (CDCl3, 400 MHz): δ 4.01 (br, 2H), 6.69 (d, 1H,J=8.0 Hz), 7.08 (d, 1H,J=8.0 Hz), 7.41 (s, 1H)。
2-溴-4-甲基苯胺:1H NMR (CDCl3, 400 MHz): δ 2.24 (s, 3H), 3.89 (br, 2H), 6.69 (d, 1H,J=8.0 Hz), 6.93 (d, 1H,J=8.0 Hz), 7.25 (s, 1H)。
2,5-二溴苯胺:1H NMR (CDCl3, 400 MHz): δ 3.71 (br, 2H), 6.48 (d, 1H,J=8.0 Hz), 6.96 (s, 1H), 7.32 (d, 1H,J=8.0 Hz)。
2-溴-3-甲氧基苯胺:1H NMR (CDCl3, 400 MHz): δ 3.84 (br, 5H), 6.19 (d, 1H,J=8.0 Hz), 6.26 (s, 1H), 7.25 (d, 1H,J=8.0 Hz)。
2-溴-3,4-二甲基苯胺:1H NMR (CDCl3, 400 MHz): δ 2.25 (s, 3H), 2.36 (s, 3H), 3.70 (br, 2H), 6.59 (d, 1H,J=8.0 Hz), 6.91 (d, 1H,J=8.0 Hz)。
2-溴-4,5-二甲基苯胺:1H NMR (CDCl3, 400 MHz): δ 2.15 (s, 6H), 3.70 (br, 2H), 6.60 (s, 1H), 7.18 (s, 1H)。
2-溴-5-氯-4-甲基苯胺:1H NMR (CDCl3, 400 MHz): δ 2.23 (s, 3H), 3.97 (br, 2H) 6.77 (s, 1H), 7.25 (s, 1H)。
2-溴-3-氯-4-甲基苯胺:1H NMR (CDCl3, 400 MHz): δ 2.32 (s, 3H), 3.97 (br, 2H) 6.60 (d, 1H,J=8.0 Hz), 6.96 (d, 1H,J=8.0 Hz)。
3 结 论
本文结合工业化生产的实际,对苯胺及其苯环衍生物的溴代反应条件进行了改进。用价格低廉的溴素进行溴代反应,后处理过程中回收一半的溴原子,节约了原料,降低了生产成本,同时又有利于环境保护。通过对反应体系、温度和时间的优化,在不用催化剂的条件下提高了单溴代产物的产率,有利于溴代苯胺及其衍生物的规模化生产。
[1]D’Aleo DN, Allard SR, Foglia CC, et al. Green halogenation of aromatic heterocycles using ammonium halide and hydrogen peroxide in acetic acid solvent[J]. Canadian Journal of Chemistry,2013,91(8):679-683.
[2]Alinezhad H, Tavakkoli SM, Salehian F. Efficient, Rapid, and Regioselective Bromination of Phenols and Anilines withN-Bromosaccharin Using Tungstophosphoric Acid as a Heterogeneous Recyclable Catalyst[J]. Synthetic Communications, 2010,40(21):3226-3232.
[3]Boruah JJ, Das SP, Borah R, et al. Polymer-anchored peroxo compounds of molybdenum and tungsten as efficient and versatile catalysts for mild oxidative bromination[J]. Polyhedron, 2013,52:246-254.
[4]Park MY, Yang SG, Jadhav V, et al. Practical and regioselective brominations of aromatic compounds using tetrabutylammonium peroxydisulfate[J]. Tetrahedron Letters, 2004,45(25):4887-4890.
[5]Islam SM, Roy AS, Mondal P, et al. Selective oxidation of sulfides and oxidative bromination of organic substrates catalyzed by polymer anchored Cu(II) complex[J]. Tetrahedron Letters, 2012,53(2):127-131.
[6]R B, H A, S A, et al. REGIOSELECTIVE AND HIGH-YIELDING BROMINATION OF PHENOLS AND ANILINS USING N-BROMOSACCHARIN AND AMBERLYST-15[J]. J Chil Chem Soc, 2011,56(4):863-865.
[7]Krishna Mohan KVV, Narender N, Srinivasu P, et al. Novel Bromination Method for Anilines and Anisoles Using NH4Br/H2O2in CH3COOH[J]. Synthetic Communications, 2004,34(12):2143-2152.
[8]Menini L, da Cruz Santos JC, Gusevskaya EV. Copper-Catalyzed Oxybromination and Oxychlorination of Primary Aromatic Amines Using LiBr or LiCl and Molecular Oxygen[J]. Advanced Synthesis & Catalysis, 2008,350(13):2052-2058.
[9]Zhang R, Huang L, Zhang Y, et al. Silver Catalyzed Bromination of Aromatics with N-bromosuccinimide[J]. Catalysis Letters, 2012,142(3):378-383.
An Efficient Method for Mono Bromination of Aniline and Its Benzene Derivatives*
RENZhi-bin,CHENJin-chun
(School of Chemistry and Chemical Engineering,Yantai University,Shandong Yantai 264005,China)
Direct bromination of aniline and its benzene derivatives had been achieved by the reaction with molecular bromine under low temperature, using propionic acid, methyl tert-butyl ether and triethylamine as buffer solvent. The monobromo compounds were obtained in good yield. Structure of the products was characterized by1H NMR. Compared with reported methods,this method suppressed side reactions,and one-half of the bromine atoms were recycled, avoiding the waste of bromine atoms and the harm to the environment. It’s a simple, efficient, environmentally safe, and economical method for the mono bromination of anilines without metal catalysts, makes it easy to realize large-scale production.
anilines; mono bromination; molecular bromine
烟台大学博士科研启动基金项目(HY07B30)。
任志斌(1988-) ,男,烟台大学在读硕士生,师从陈锦春副教授,从事天然产物合成及其应用研究。
TQ246.3
A
1001-9677(2016)010-0079-03
