鲍鱼壳中活性物质的相互作用指纹图谱初步研究
2016-08-29朱苑露王旭莹刘承君谭成玉
张 红,朱苑露,王旭莹,刘承君,段 蓿,谭成玉,孔 亮,李 伟
(大连海洋大学,辽宁大连 116023)
试验研究
鲍鱼壳中活性物质的相互作用指纹图谱初步研究
张红,朱苑露,王旭莹,刘承君,段蓿,谭成玉,*孔亮,*李伟
(大连海洋大学,辽宁大连116023)
将色谱方法与光谱技术充分结合,用于对海洋药物鲍鱼壳的分析。利用傅里叶红外变换初步分析鲍鱼壳成分,进一步利用化学法——苯酚-硫酸法测定糖含量。采用氨基柱和糖分析柱分析了鲍鱼壳粗提取物,分别得到14种组分和37种组分。通过微超滤-HPLC相互作用指纹谱,筛选出其中至少有5种成分与DNA和7种成分与HSA有相互作用的活性成分。
天然药物;微超滤-HPLC;相互作用指纹图谱;鲍鱼壳
0 引言
鲍鱼壳是一种来自海洋的常用传统中药,又名石决明,经过洗净、烘干、敲碎、研磨后可入药,具有清热平肝、滋阴壮阳的作用。另外,对目障、翳痛、青光眼、夜盲等症都能起到良好的治疗作用。研究表明,其中CaCO3含量占90%以上,其他成分包括蛋白质、微量元素和多糖类成分等[1-3]。海洋多糖类作为天然高分子化合物同蛋白质、核酸一样,是维持机体正常运转的重要组成部分,同时具有特殊的药理活性[4-7]。
包括海洋药物在内的天然药物均具有成分复杂、组分物化性质差异大、干扰成分多等特点,而高效液相色谱具有高效、快速、适应面广的优点,这种分析手段克服了天然药物成分多样复杂、分析难度大的问题,在天然药物活性成分的筛选分析和品质控制等方面得到了迅速的发展。作为高效分离工具,色谱及其联用技术已经广泛应用于复杂样品的分析中[8-9]。然而,常规的液相色谱虽有着卓越的分离能力,但不能提供药物与生物分子相互作用的生物活性信息。生物指纹图谱基于药物与生物分子识别原理,将药物与生物大分子的相互作用和色谱分析相结合,通过比较药物与生物大分子作用前后色谱图的变化,即可鉴别出具有生物活性的物质,而这些物质很有可能是潜在的药物先导化合物[10-11]。
本文以鲍鱼壳为分析对象,利用了微超滤-HPLC筛选和分析其中的糖类活性成分,在色谱分析之前,将药物提取物与生物大分子(人血清白蛋白、ct-DNA) 混合,使二者充分进行相互作用,通过比较样品与靶点作用前后色谱图的变化,获得具有相互作用信息的生物指纹图谱。
1 试验部分
1.1材料和仪器
1.1.1试剂与材料
鲍鱼壳,大连獐子岛渔业集团产品;乙腈(色谱纯)、100%乙醇(分析纯),山东禹王实业有限公司产品;苯酚(分析纯),天津科密欧化学试剂开发中心产品[80%苯酚(80 g苯酚中加入20 g水,使之溶解)],[5%苯酚(临用前以80%苯酚配制,每次测定均需现配)];葡萄糖(分析纯),天津市大茂化学试剂厂产品;其余试剂均为分析纯;试验用水,均为经Milli-Q水处理系统(Millipore,USA)纯化的超纯水。
小牛胸腺DNA(ct-DNA)购于Sigma(St.Louis,USA),经氯仿/异戊醇抽提并除去蛋白后,溶于PBES(6 mmol/L Na2HPO4,2 mmol/L NaH2PO4,1 mmol/L EDTA,185 mM NaCl,pH值为7.0)缓冲液中,每次使用前新鲜配制;人血清白蛋白HSA购于Sigma(St.Louis,USA),准确称量0.019 9 g HSA(分子量为66 478 Da),将其溶于1 mL pH值7.4的磷酸盐缓冲溶液中,得到的HSA浓度为0.3 mmol/L,每次使用时新鲜配制;超滤管(截流分子量10 kDa,Millipore,USA)。
1.1.2仪器设备
(1)液相色谱系统1是由2台LC-10ATvp型泵(Shimadzu,Japan),7725i型进样阀带有20 μL或10 μL的定量环,Waters 996型二极管阵列检测器(Waters,USA),Millennium32型色谱工作站(Waters,USA) 组成。色谱柱(分析型,250 mm×4.6 mm I.D.),填充5 μm Hypersil-NH2的色谱填料,大连依利特分析仪器有限公司产品。
(2)液相色谱系统2是由Waters 1525型二元梯度泵(Waters,USA),Waters2707型自动进样器(Waters,USA),Waters 2998型二极管矩阵检测器(Waters,USA),Waters 2414型示差检测器(Waters,USA),Breeze 2型色谱工作站(Waters,USA) 组成。色谱柱(分析型,300 mm×7.8 mm I.D.),填充9 μm聚苯乙烯二乙烯苯树脂的色谱填料(BIORAD,USA)。
(3)MALDI-TOF检测都在在线正离子模式下进行。延迟时间90 ns,萃取电压20 kV。以DHB(10 mg/mL,含10 mmol/L NaCl的50%ACN-H2O)溶液作为分析多糖的基质。点靶体积是0.5 μL,室温下挥发至干。
(4) FT-IR系统(Spectrum GX,Perkin Elmer,USA),DTGS检测器(England)。
(5)紫外分光光度计(OPTIZN2120 UV,MECASYS,Korea)。
(6)离心机(Beckman,AllegraTM64R Centrifuge,USA)。
1.2试验条件与方法
1.2.1色谱条件
(1) 色谱柱1为250 mm×4.6 mm I.D.,填充5 μm Hypersil-NH2的色谱填料;流动相为梯度洗脱0~30 min、80%~40%乙腈/水(V/V),30~60 min、40%~20%乙腈/水(V/V);流速为1.0 mL/min;柱温为室温;检测器为二极管阵列检测器。
(2) 色谱柱2为300 mm×7.8 mm I.D.,填充9 μm聚苯乙烯二乙烯苯树脂的色谱填料;流动相为等梯度洗脱的0.01 mol/L H2SO4;流速为0.6 mL/min;柱温为35℃;检测器为示差检测器。
1.2.2鲍鱼壳中糖类提取物溶液的制备
(1)粗提取物的制备。鲍鱼壳经清洗晾干、粉碎过筛后,以水为溶剂进行索氏提取6 h,提取液经0.45 μm微孔滤膜过滤,经减压浓缩,冷冻干燥至粉末状,于-20℃条件下贮藏,作为粗提取物备用。
(2)初级分离物的制备。上述滤液经大孔树脂吸附后,依次用100%水、20%乙醇/水、40%乙醇/水、60%乙醇/水(V/V)洗脱,得到4个分级组分,旋转冷冻浓缩至粉末状,于-20℃条件下贮藏,作为初级分离物备用。
准确称取10 mg上述粉末,加入0.5 mL水,充分溶解后,在离心力为18 000×g下离心10 min,取上清液进样分析,进样体积为20 μL。
1.2.3红外光谱分析
参照文献[12-13]进行。取严格脱水的供试品微量,采用KBr研磨压片后,在4 000~400 cm-1红外波数范围内进行扫描。
1.2.4提取物中总糖含量的测定
苯酚-硫酸法是利用多糖在硫酸的作用下先水解成单糖,并迅速脱水生成糖醛衍生物,然后与苯酚生成橙黄色化合物,再以比色法测定。
(1) 工作曲线的绘制。准确称取标准葡萄糖20 mg于500 mL容量瓶中,加水至刻度,分别吸取0.4,0.6,0.8,1.0,1.2,1.4,1.6,1.8 mL,各以蒸馏水补至2.0 mL,然后加入5%苯酚1.0 mL及浓硫酸5.0 mL,摇匀冷却,室温放置20 min后于490 nm处测定吸光度。以2.0 mL水按同样显色操作为空白,平行3组,横坐标为多糖含量、纵坐标为吸光度,制作工作曲线。
(2)供试品中总糖含量的测定。精确称取所有供试品10 mg,加入1.0 mL水,充分溶解后,在离心力为18 000×g下离心10 min,取上清液进行测定。方法同上。
1.2.5药物与DNA结合率的测定
移取鲍鱼壳粗提物溶液60 μL,加入300 μL PBES缓冲溶液配制成与DNA作用之前的样品溶液。同时,取同上述相同体积的鲍鱼壳粗提物溶液,加入300 μL溶解有DNA的PBES缓冲溶液,将混合物置于37℃的恒温水浴锅中温浴10 min,温浴后将其移至超滤管中,然后置于离心机中,在离心力为5 000×g下离心10 min。取离心后超滤液连续进样3次,测定其中生物碱类化合物的色谱峰面积,并计算RSD。药物与DNA结合率计算式如下:
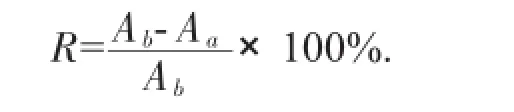
式中:Aa——药物与DNA结合的混合溶液中游离药物的峰面积;
Ab——混合物与DNA反应之前的峰面积。
1.2.6药物与HSA结合率的测定
方法同上,将上述DNA溶液替换为HSA溶液。
2 结果与讨论
2.1傅里叶变换红外光谱仪对供试品的成分分析
在本文中,利用傅里叶变换红外光谱仪对从鲍鱼壳中提取的糖类成分结构初步进行了分析。
鲍鱼壳提取物的红外光谱图比较见图1,鲍鱼壳粗提物的红外光谱见图2。
由图1可知,这5个提取物在关键区域都有出峰,且极为相似,可以鉴定这5个供试品中都含有相同类的物质。
由图1和图2红外光谱显示,鲍鱼壳提取物经红外光谱分析在3 500~3 200,3 000~2 800,1 400~1 200,1 200~1 000 cm-1处均有多糖特征吸收峰。3 423.7 cm-1处有宽展圆滑的强吸收峰为O-H键的伸缩振动,表明多糖存在分子内和分子间的氢键;2 935.5 cm-1处的吸收峰是C-H(CH,CH2和CH3)伸缩振动引起的,这个吸收峰常常被O-H伸缩振动引起的宽峰所掩盖;1 440.5 cm-1处的吸收峰属C-H的弯曲振动;1 603.2 cm-1处为C=0键的伸缩振动吸收峰;1 200~1 000 cm-1的吸收峰为吡喃环结构C-O的吸收蜂;880.8 cm-1吸收峰表明多糖分析结构中存在β2糖苷键结构。
通过红外光谱的结构鉴定,可以看出试验中提取的鲍鱼壳粗提物和经层析分离的4种组分均为多糖类化合物。
2.2苯酚-硫酸法测定提取物中总糖含量
为进一步明确上述多糖类提取物中的总糖含量,采用苯酚-硫酸法测定提取物中糖含量。
(1) 工作曲线的绘制。按照1.2.4(1) 所示方法,于490 nm处测定不同质量浓度葡萄糖的吸光度值,以吸光度对多糖微克数进行线性回归,获得葡萄糖的工作曲线方程。
葡萄糖的工作曲线见表1。

表1 葡萄糖的工作曲线
(2)提取物中总糖含量的测定。按照1.2.4(2)所示方法,对鲍鱼壳的粗提取物和初级分离物进行了总糖含量的测定。
供试品中总糖含量考察(n=3)见表2。

图1 鲍鱼壳提取物的红外光谱图比较

图2 鲍鱼壳粗提物的红外光谱
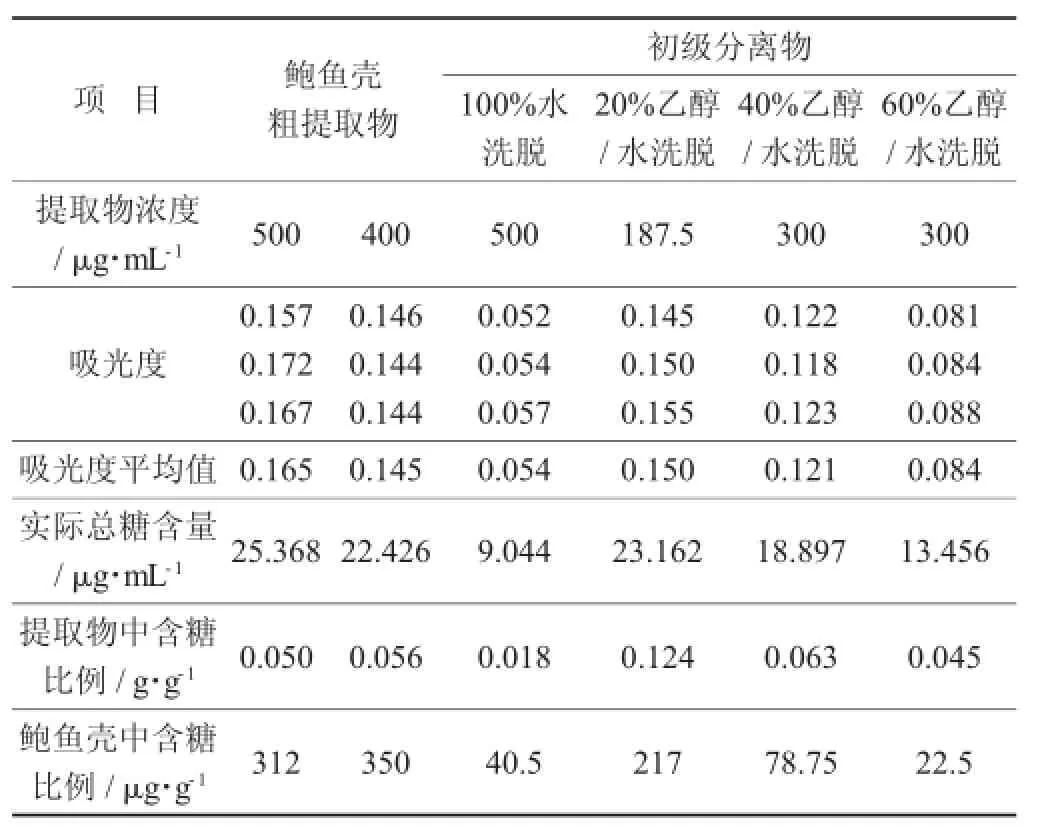
表2 供试品中总糖含量考察(n=3)
由表2可知,在20%乙醇/水洗脱的分离物中含糖量较多。
2.3色谱条件的考察
色谱柱为250 mm×4.6 mm I.D.,填充5 μm Hypersil-NH2的色谱填料,在确定乙腈/水(V/V)为流动相的基础上,考察了不同的梯度洗脱条件,梯度条件如下:
梯度洗脱条件1:0~60 min,80%~20%乙腈/水(V/V);
梯度洗脱条件2:0~30 min,80%~40%乙腈/水(V/V);30~60 min,40%~20%乙腈/水(V/V);
梯度洗脱条件3:0~60 min,80%~40%乙腈/水(V/V);
梯度洗脱条件4:0~60 min,60%乙腈/水(V/V);
梯度洗脱条件5:0~30 min,70%~30%乙腈/水(V/V);30~60 min,30%~20%乙腈/水(V/V);
梯度洗脱条件6:0~20 min,80%~70%乙腈/水(V/V);20~40 min,70%~50%乙腈/水(V/V);40~60 min,50%~20%乙腈/水(V/V)。
6种洗脱条件下鲍鱼壳提取物的分离色谱见图3。

图3 6种洗脱条件下鲍鱼壳提取物的分离色谱
由图3可知,通过色谱分析,在6种梯度洗脱条件下获得的馏分中均含有较多的组分,其中梯度洗脱条件2下分离的色谱峰更多,同时分析时间适中,比较适合用于指纹谱分析,因此选择梯度洗脱条件2作为接下来色谱分析中的色谱条件。
2.4鲍鱼壳中粗提取物、初级分离物中活性成分的分析
由于鲍鱼壳粗提取物中的组分主要是糖类化合物,因此除了采用氨基柱以外,还采用糖分析柱对提取的组分进行分离分析,作为对氨基柱分析的补充。同时,糖类化合物在紫外可见光下检测灵敏度较低,因此试验采用2种检测器对提取物进行检测。使用的检测器分别是示差折光检测器和二极管阵列检测器,其中示差折光检测器用于糖分析柱分离,二极管阵列检测器用于氨基柱分离。在试验中,采用2种模式分别对粗提取物、初级分离物的溶液进行色谱分析。
鲍鱼壳粗提取物和分离组分的色谱图比较见图4。
由图4可知,提取物中成分种类多,色谱峰分布较为均匀,满足随后的指纹谱分析要求。
由图4(a)可知,在此色谱条件下,从图中可以看到粗提取物中至少有14种成分得到较好的分离,进一步说明供试品中含有糖类物质等极性组分。
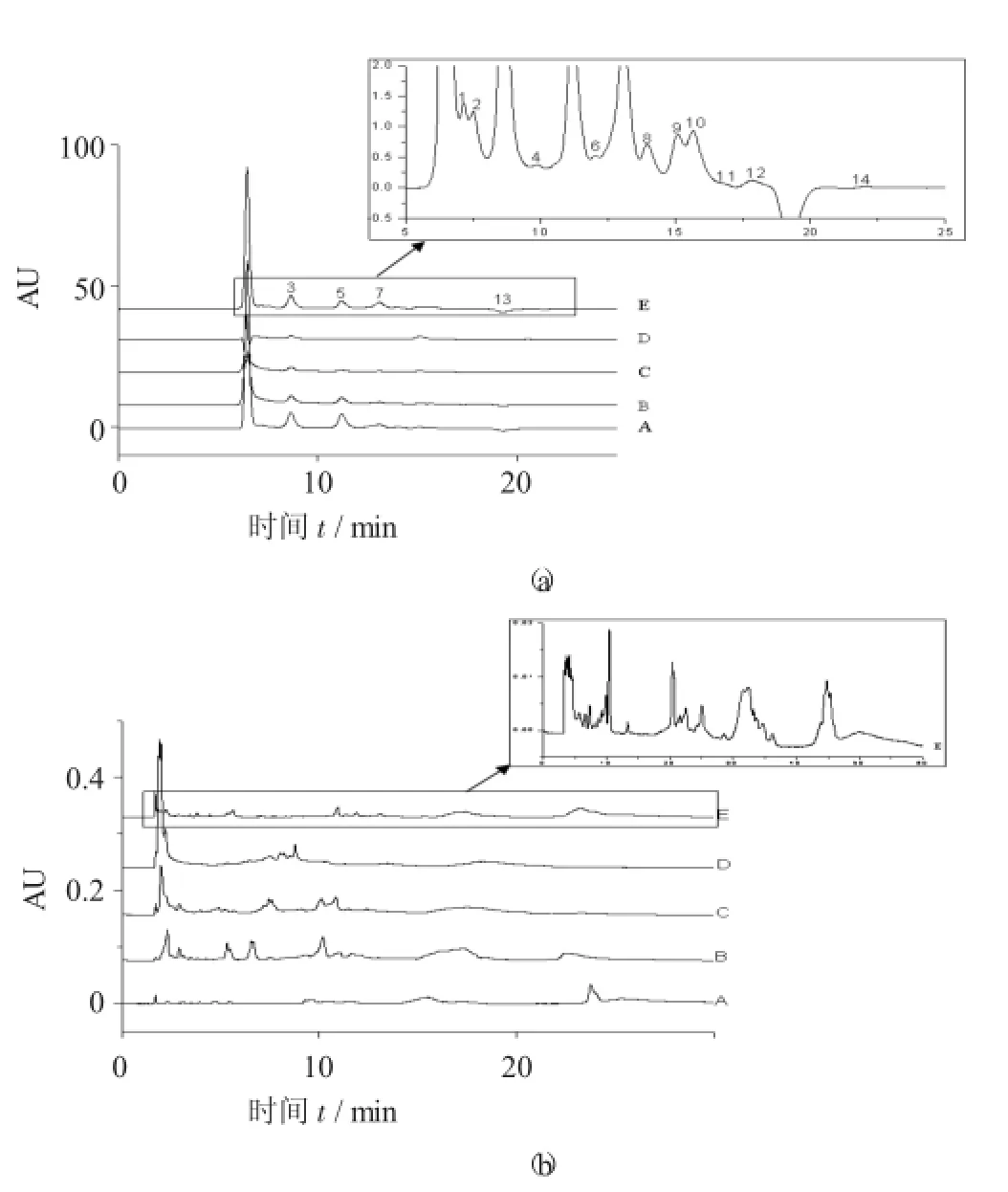
图4 鲍鱼壳粗提取物和分离组分的色谱图比较
由图4(b)可知,在粗提取物的分离谱图中至少检测到37种成分,较为复杂,由于氨基柱对极性化合物的选择性不强,因此其中分离出的组分可能含有非糖类的极性化合物。上述的分离谱图,可以作为相互作用指纹图谱的依据。
2.5微超滤-高效液相色谱法用于鲍鱼壳提取物相互作用指纹图谱分析
由于采用氨基柱分离鲍鱼壳粗提取物时,分离的色谱峰数量较多,有利于在相互作用指纹图谱分析中获得更多的信息,因此按照1.2.5、1.2.6所述方法,在一定色谱条件下(见1.2.1),采用离心微超滤-氨基高效液相色谱柱对提取物与生物大分子之间的相互作用进行表征,分别测定了鲍鱼壳中活性成分与小牛胸腺DNA和人血清白蛋白HSA的结合率。
鲍鱼壳粗提取物与DNA相互作用前后图谱比较见图5。
由图5中鲍鱼壳粗提取物与ct-DNA作用前后的谱图比较可以看到,在5~37 min范围内有至少5个组分的色谱峰面积有明显变化。
鲍鱼壳粗提取物与ct-DNA结合率的测定结果(n=3)见表3。
由表3可知,提取物中有5种组分与ct-DNA发生了不同程度的相互作用,这5种组分的分离谱图如图5所示。峰1~峰5的结合率分别为19.13%,7.44%,2.79%,45.71%,16.74%,其中峰4的结合率最高。
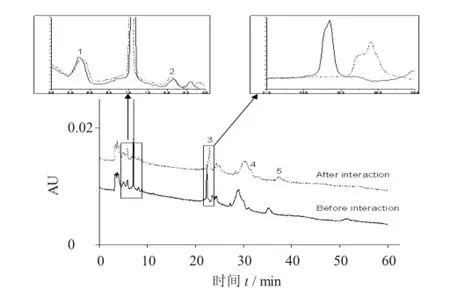
图5 鲍鱼壳粗提取物与D N A相互作用前后图谱比较

表3 鲍鱼壳粗提取物与ct-D N A结合率的测定结果(n=3)
人血清白蛋白(HSA)作为血浆中的主要蛋白质,起到营养与运输的作用,在药物相互作用研究中常用作药物作用的靶蛋白。在本试验中,采用同样方式对鲍鱼壳粗提物组分与HSA之间相互作用进行了初步分析。
鲍鱼壳粗提取物与HSA相互作用前后图谱比较见图6。
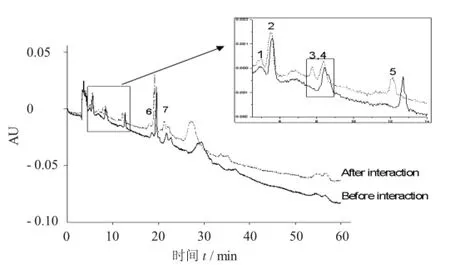
图6 鲍鱼壳粗提取物与H SA相互作用前后图谱比较
由图6可知,鲍鱼壳粗提取物与HSA作用前后的谱图比较可以看出5~15 min,18~23 min内有至少7种组分的色谱峰峰面积明显减小,其他色谱峰未见有显著的变化,说明鲍鱼壳中某些成分与HSA之间具有一定相互作用。其中,峰3,4在与HSA作用后明显得到完全分离,有可能是其中某个组分化学性质不稳定而引起的变化。
鲍鱼壳粗提取物与HSA结合率的测定结果(n=3)见表4。
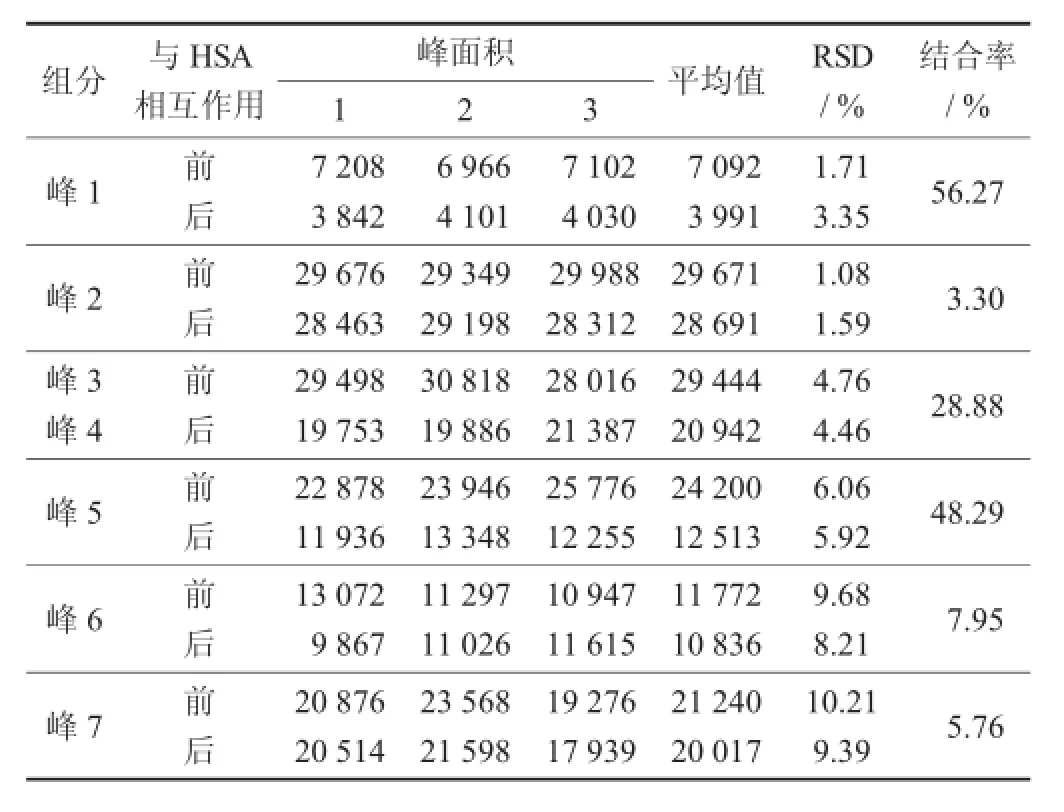
表4 鲍鱼壳粗提取物与H SA结合率的测定结果(n=3)
由表4可知,鲍鱼壳粗提取物与HSA结合的7种组分结合率分别为56.27%,3.30%,28.88%,48.29%,7.75%,5.76%。由于HSA往往与酸性物质发生相互作用,因此这些数据表明粗提取物中存在与HSA结合的酸性物质。
3 结论
本文将微超滤-色谱方法用于海洋药物中活性成分与生物大分子相互作用研究。首先,利用红外光谱初步确定了鲍鱼壳中含有多糖类化合物,并采用苯酚-硫酸法测定了总糖含量,以HPLC进一步确定了其中至少含有14种多糖类物质。其次,通过HPLC考察了不同洗脱条件对鲍鱼壳在氨基柱上的分离情况,确定0~30 min,80%~40%乙腈/水(V/V);30~60 min,40%~20%乙腈/水(V/V) 为最佳洗脱条件,并与糖分析柱的分离情况进行了比较;在最佳洗脱条件下,也检测到了至少37种组分,并在其中发现了至少有5种成分与DNA有相互作用,至少有7种成分与HSA有相互作用,为海洋药物中活性成分药理活性分析与筛选提供了依据。
[1]梁红宝,郭葳,董声雄,等.鲍鱼壳水溶性基质抗氧化活性研究 [J].食品科学,2010,31(9):113-116.
[2]吴德康,吴启南,叶冠,等.石决明成分与结构的分析研究 [J].中草药,2000,31(12):887-888.
[3]王志力,陈善飞,方哲翔,等.鲍鱼壳蛋白组分研究进展 [J].现代生物医学进展,2010(24):4 778-4 781.
[4]Kaithwas G,Singh P,Bhatia D.Anticancer and cancer preventive properties of marine polysaccharides:some results and prospects[J].Drug Chem.Toxicol.,2014,37(2):135-143.
[5]Kokoulin M S,Kalinovsky A I,Komandrova N A,et al. The structure of the O-specific polysaccharide from marine bacterium Litorimonas taeanensis G5(T)containing 2-acetamido-4-(3S,5S)-3,5-dihydroxyhexanamido-2,4-dideoxy-D-quinovose and 2-acetamido-2,6-dideoxy-L-xylo-hexos-4-ulose[J].Carbohyd.Res.,2013(10):105-111.
[6]Kim M,Yim J H,Kim S Y,et al.In vitro inhibition of influenza a virus infection by marine microalga-derived sulfated polysaccharide p-KG03[J].Antivir.Res.,2012,93(2):253-259.
[7]Yokose T,Nishikawa T,Yamamoto Y,et al.Growthpromoting effect of alginate oligosaccharides on a unicellular marine microalga,nannochloropsis oculata[J].Biosci. Biotech.Bioch.,2009,73(2):450-453.
[8]Sun L,Wei H,Zhang F,et al.Qualitative analysis and quality control of Traditional Chinese Medicine preparation Tanreqing injection by LC-TOF/MS and HPLC-DADELSD[J].Anal.Methods,2013(5):6 431-6 440.
[9]Wu H W,Gao J,Li S J,et al.Study on blood amino acid metabonomics of cerebral ischemia treated by huangqi injection based on HPLC-MS/MS[J].Chinese J.Anal. Chem.,2013,41(3):344-348.
[10]Yu F J,Kong L,Zou H F,et al.Progress on the screening and analysis of bioactive compounds in traditional Chinese medicines by biological fingerprinting analysis[J]. Comb.Chem.High T.Scr.,2010(10):855-868.
[11]吴曦,罗碧容,袁文杰,等.代谢指纹谱用于丹参活性成分的分析与筛选 [J].世界科学技术—中医药现代化,2011,13(1):170-179.
[12]梁中焕,郭志欣,张丽萍.白术水溶性多糖的结构特征 [J].分子科学学报,2007,23(3):185-188.
[13]孙元琳,顾小红,汤坚,等.当归水溶性多糖的分离、纯化及结构初步分析 [J].食品与生物技术学报,2006,25(1):1-4.◇
A Preliminary Study on the Biological Fingerprinting Chromatograms for Evaluation of the Interactions of Active Components in the Shell of Ablone
ZHANG Hong,ZHU Yuanlu,WANG Xuying,LIU Chengjun,DUAN Xu,TAN Chengyu,*KONG Liang,*LI Wei
(Dalian Ocean University,Dalian,Liaoning 116023,China)
In this thesis,the methods of chromatography and spectroscopy are used to analyze components from the shell of abalone.The polysaccharide components are preliminary analyzed by FTIR,and the total sugar concentration is determined by phenol-sulfuric acid method.There are more than 14 polysaccharide components and 37 compositions from the crude extract of shell of abalone are separated by HPLC.The interaction fingerprint of CUF-HPLC indicated that five components and seven components showed the binding activities to DNA and HSA,respectively.
natural medicines;micro ultrafiltration HPLC;inteaction fingerprint;the shell of ablone.
R284.1
A
10.16693/j.cnki.1671-9646(X).2016.07.001
1671-9646(2016)07a-0001-05
2016-05-20
海洋局公益性行业科研专项(201005024-3,201205022-7)。
张红(1990— ),女,硕士,研究方向为分析化学。
孔亮(1970— ),男,博士,教授,研究方向为分析化学。李伟(1964— ),男,博士,教授,研究方向为生物化学。
