自噬和凋亡在甲型流感病毒和肺炎球菌协同感染小鼠模型中作用的初探
2016-08-19秦臻王红仁黄筱钧罗俊游江舟李婉宜杨远周琳琳李明远
秦臻 王红仁 黄筱钧 罗俊 游江舟 李婉宜 杨远 周琳琳 李明远
610041成都,四川大学华西基础医学与法医学院微生物学教研室
自噬和凋亡在甲型流感病毒和肺炎球菌协同感染小鼠模型中作用的初探
秦臻 王红仁 黄筱钧 罗俊 游江舟 李婉宜 杨远 周琳琳 李明远
610041成都,四川大学华西基础医学与法医学院微生物学教研室
目的 建立甲型流感病毒(Inf1uenza A virus,IAV)和肺炎链球菌(Streptococcus pneumoniae,SP)协同感染小鼠模型,在该模型中初步探索自噬和凋亡的发生情况。方法 将IAV和SP以不同顺序感染Ba1b/c小鼠,观察其体重变化和死亡率,检测其肺部IAV和SP滴度、病理改变情况,建立IAV~SP协同感染动物模型。使用免疫组化法检测自噬特征蛋白LC3及凋亡特征蛋白Caspase-3的表达情况。结果 IAV~SP组第二次感染后24 h时小鼠肺部IAV和SP滴度最高,死亡率也明显高于其他各组,48 h病理改变也最为严重。免疫组化结果显示IAV感染早期(24 h~48 h)LC3蛋白表达出现峰值,Caspase-3缓慢上升;晚期(72 h~96 h)Caspase-3蛋白表达出现峰值,而LC3蛋白表达逐渐下降。结论 本研究成功建立了IAV~SP协同感染动物模型,模型鼠中自噬先于凋亡发生,为进一步研究自噬和凋亡在IAV~SP协同感染中的作用奠定了基础。
【主题词】 甲型流感病毒;肺炎链球菌;自噬;凋亡;炎症
Fund program:Opening project of State Key Laboratory of Ora1 Diseases(SKLOD2015OF08)
甲型流感病毒(IAV)是分节段的负链RNA包膜病毒,由于其极强的变异性,使得常规抗病毒药物及流感疫苗的应用都受到一定限制[1,2]。在IAV感染引起的严重及死亡病例中,大都是因为继发了细菌性感染,其中以肺炎链球菌 (Streptococcus pneumoniae,SP)为主[3]。近年来自噬(Autophagy)和凋亡(Apoptosis)的深入研究,为探索IAV感染导致严重的继发性细菌感染的发生机制提供了新的突破点。
自噬是一种高度保守的能降解细胞内衰老细胞器及外来入侵物质的细胞死亡方式,可在饥饿、缺氧及感染等情况下被激活,以维持细胞稳态[4]。周智等人发现IAV感染A549细胞后可激活细胞自噬,而抑制自噬可阻碍病毒复制[5]。此后,体内外研究均证实抑制自噬可减轻IAV所致疾病程度[6,7]。凋亡是一种细胞的“自杀”死亡方式,最终可有效清除细胞本身及其内容物[8]。至今也有较多IAV感染可诱导凋亡发生、抑制凋亡可减轻疾病程度的报道[9,10]。本研究建立了 IAV~SP协同感染小鼠模型,并初步探索了模型中自噬和凋亡的发生情况,以期为进一步研究自噬和凋亡在IAV~SP协同感染模型中的作用机制奠定基础。
1 材料与方法
1.1实验材料 甲型流感病毒(A/Puerto Rico/8/ 34,H1N1)小鼠适应株和肺炎链球菌ATCC6303均由本教研室保存;9-11日龄SPF级受精鸡蛋(济南斯派福瑞);哥伦比亚血琼脂基础(Oxoid);MDCK细胞购于ATCC;DMEM培养基购自Gibco公司;标准胎牛血清(上海复蒙);兔抗鼠LC3B多克隆抗体(Abcam);兔抗鼠 Caspase-3多克隆抗体(Ce11 Signa1ing);生物素化羊抗兔IgG、HRP标记的亲和素和DAB显色试剂盒(武汉博士德);健康8~9周龄雌性Ba1b/c小鼠(四川大学实验动物中心);Leica光学显微镜(ICC50 HD);SPSS19.0统计学分析软件;GraphPad Prism 5.0数据分析作图软件;ImagePro P1us 6.0图像分析软件。
1.2实验方法
1.2.1IAV和SP的培养:使用10日龄鸡胚复苏并培养IAV,所得尿囊液的TCID50为10-5.1/0.1 m1,分装储存于-80℃。SP在加有3%~5%脱纤维兔血的哥伦比亚血琼脂培养基中复苏并培养,培养物经分光光度计测定其不同稀释浓度下在600 nm处的吸光度值(A600值),并将各浓度SP菌液等体积均匀涂布于血平板上计数菌落数,由此建立SP浓度-A600标准曲线,公式为y=214419x-293.05(y为每100 μ1中细菌个数,x为A600值)。
1.2.2半数致死量(LD50)测定:将IAV和SP分别稀释不同梯度浓度攻击小鼠,攻击剂量均为每只小鼠0.1 m1,记录各组小鼠的死亡数量,并利用Reed-Muench方法按表 1和表 2分别计算 IAV和 SP 的LD50。
1.2.3IAV-SP协同感染动物:研究采用0.5 LD50IAV和0.3 LD50SP按不同顺序和组合(表3)给小鼠滴鼻,每只小鼠滴100 μ1,每只鼻孔50 μ1。观察动物死亡情况,并于每次感染后不同时间点处死小鼠,取肺组织检测IAV/SP滴度、HE染色检测病理改变、免疫组化检测LC3/Caspase-3的表达情况。

表1 IAV的LD50测定Tab.1 Determination of IAV LD50
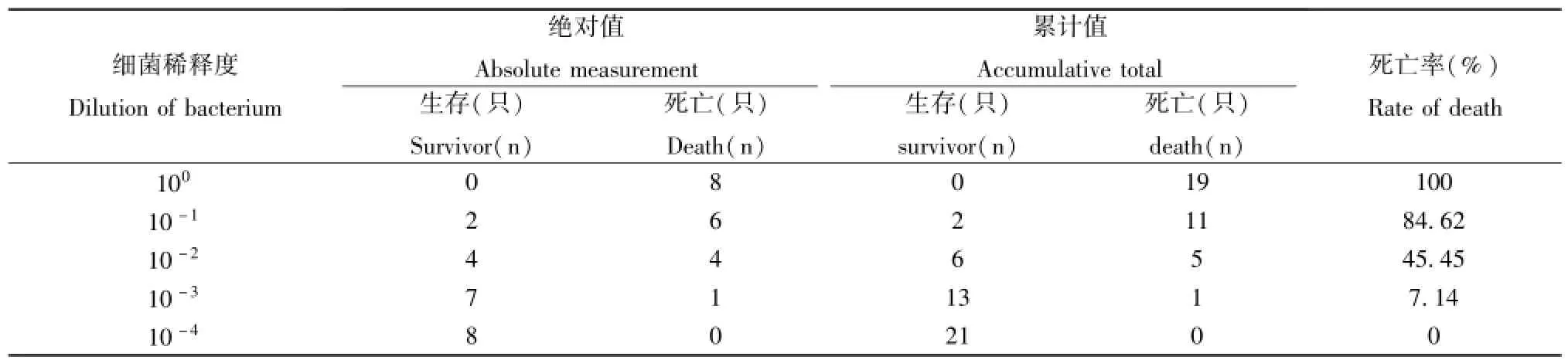
表2 SP的LD50测定Tab.2 Determination of SP LD50
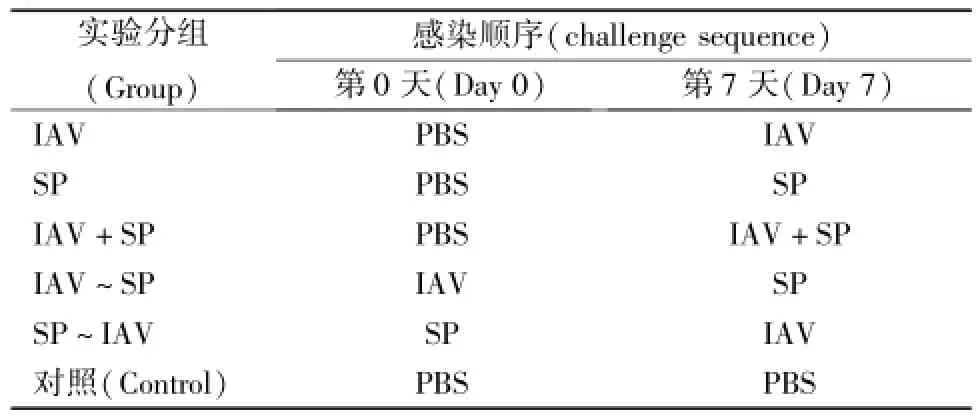
表3 IAV和SP以不同顺序感染小鼠Tab.3 Mice cha11enged with IAV and/or SP in a sequence-manner
1.2.4IAV/SP滴度检测:将小鼠肺组织取出后用PBS洗3次,加入500 μ1 PBS进行匀浆,所得匀浆液经4℃、10 000 r/min离心5 min。取上清进行IAV滴度检测,将上清10倍连续稀释后分别感染单层MDCK细胞,于72 h观察细胞CPE情况,并用Reed-Muench法计算TCID50。沉淀用500 μ1 PBS重悬10倍连续稀释后等量涂布至哥伦比亚血平板,24 h后对平板上的菌落进行计数。
1.2.5HE染色检测小鼠肺组织病理改变:感染IAV和/或SP 48 h后取小鼠肺组织,分别用4%PFA固定后行石蜡包埋,再制成5 μm厚切片,进行HE染色后普通光学显微镜下观察病理改变。
1.2.6免疫组化半定量分析LC3、Capase-3的表达:小鼠肺组织取出后用PBS洗3次,4%PFA中固定后用石蜡包埋,制成5 μm厚切片。按1∶150(抗-Caspase-3)或1∶250(抗-LC3)滴加一抗,再按1∶100滴加生物素化羊抗兔IgG,然后加1∶100的HRP标记的亲和素,DAB显色后用苏木素复染。染色后显微镜下观察和拍照,并用ImagePro P1us 6.0软件对阳性区域进行累积光密度(IOD)、阳性区域面积(Area)测量,通过光密度总和(IOD sum)/阳性区域面积总和(Area sum)来反应蛋白表达情况[11]。
1.3统计学方法 数据以Mean±SD表示,使用非配对t检验进行组间差异比较,P<0.05表示差异有统计学意义。Kap1an-Meier曲线用于小鼠生存分析,所有数据均使用SPSS进行统计学分析。
1.4生物安全 本研究在四川大学基础医学与法医学院微生物学教研室生物安全二级动物实验室进行。
2 结果
2.1IAV~SP协同感染动物模型建立 IAV~SP组在第二次攻击后48 h内死亡,IAV组和SP组小鼠分别有44.45%和20%的死亡率,IAV+SP组死亡率为50%,而SP~IAV组小鼠在第二次攻击后死亡率为0,对照组无小鼠死亡(图1)。
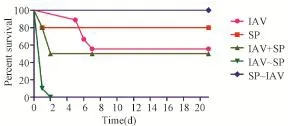
图1 IAV和SP以不同方式感染小鼠后死亡情况Fig.1 Surviva1 curves for IAV and SP infection in different approaches in different groups

A:IAV~SP组,B:IAV+SP组,C:IAV组,D:SP组,E:对照组图2 IAV~SP协同感染小鼠模型感染48 h后肺部病理变化(400×)A:IAV~SP group,B:IAV+SP group,C:IAV group,D:SP group,E:Contro1 groupFig.2 Patho1ogica1 changes from synergistic infection of IAV~SP 48 hours(400×)
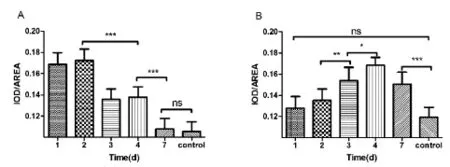
图3 LC3/Caspase-3免疫组化半定量测定Note:the mice were infected with IAV,the 1ungs were removed at 1,2,3,4 and 7 days 1ater(n=4),and LC3(A)and Caspase-3(B)were measured with immunohistochemica1(IHC).The resu1ts were checked under the microscope magnifying 400;5 randomsights of each samp1e were se1ected.ns:difference was not statistica11y significant,∗P<0.05,∗∗,∗∗∗P<0.01Fig.3 LC3/Caspase-3 ana1ysis of IOD sum/Area sum with IHC
2.2IAV/SP滴度变化 小鼠在单独感染病毒后第5天IAV滴度达到峰值,随后缓慢下降,而在第二次感染SP后IAV滴度出现上升;IAV+SP组及SP~IAV组分别在感染24 h时IAV滴度达到峰值,随后下降。IAV~SP组小鼠24 h和48 h的SP滴度均明显高于IAV+SP和 SP组,其中 SP组滴度最低。
2.3各组感染小鼠肺部病理变化情况 IAV~SP 组48 h肺部病理损伤最为严重,镜下可见全肺肺泡结构消失,巨噬细胞、中性粒细胞等大量炎性细胞浸润(图2,A);IAV+SP组虽也有上述病理改变,但病变范围较IAV~SP组小(图2,B);IAV组小鼠肺间质具有较重病理改变,但仍可见部分细支气管、肺泡等完整结构(图2,C);而SP组病理改变较轻(图2,D)。
2.4IAV感染小鼠后自噬和凋亡的发生情况初探
在感染2 d内,LC3表达量出现峰值,随后下降,第7天时与对照组无明显差异(图3 A);Caspase-3在感染后第1天表达量与对照组无明显差异,缓慢上升并于第4天出现峰值(图3 B)。
3 讨论
IAV感染后继发性细菌性肺炎是IAV所致严重及死亡病例的主要原因之一,所以研究IAV和肺炎链球菌等常见协同感染细菌[3]在宿主体内的相互作用机制,有助于寻找对抗IAV感染的有效预防和治疗的新方法。在本研究中,我们通过将IAV和/ 或SP按照不同顺序和组合感染小鼠,观察每组小鼠的疾病过程和死亡情况,检测不同时间点的肺部IAV/SP滴度及病理变化,以建立IAV~SP协同感染小鼠模型。
研究结果显示IAV感染小鼠后第5天开始死亡,与IAV滴度升高趋势一致,而继发感染SP后小鼠在48 h内全部死亡。IAV~SP组肺部SP滴度明显高于SP组或IAV+SP组,且肺部病理损伤最为严重,说明IAV感染后使得SP更易入侵机体,这种病毒-细菌协同作用模式比其他各组感染模式更易造成严重甚至小鼠死亡。我们认为自噬在IAV感染早期可能对机体起保护作用,而IAV感染后期引发的凋亡导致机体更易受到细菌入侵,于是我们在IAV感染后的不同时间点对自噬和凋亡的特征性蛋白LC3/Caspase-3的表达情况进行了免疫组化半定量分析。初步结果显示IAV感染早期确实发生了自噬,这可能是由于病毒利用了自噬这一机制进行自身复制,反过来自噬对机体起着保护作用[12];而感染后期凋亡反应占据主要地位,机体免疫力降低,此时再受到细菌入侵,导致严重后果。
此外,我们还发现先感染SP、7 d后再感染IAV的小鼠无一死亡,我们认为可能是由于SP感染激活了自噬所致。周智的博士论文中也显示,无论是增强或减弱细胞自噬作用,IAV滴度均下降[13]。Wo1f等发现SP的溶素是保护机体免于肺炎链球菌性肺炎后IAV感染的关键因素[14],而Li等发现SP的溶血素是激活自噬的关键因子[15]。总之,SP对机体感染IAV具有一定的保护作用,可能是预防流感的一种新策略。
本研究成功建立了IAV~SP协同感染动物模型,初步探索了IAV和SP协同感染后对自噬和凋亡的影响,率先在动物体内初步证实了“IAV感染早期以发生自噬为主,而晚期以发生凋亡为主”的假说。我们将在IAV-SP协同感染小鼠模型中对自噬与凋亡进行调控,深入研究它们在流感和继发的细菌感染发病机制中的作用也有可能发现防控流感及其继发感染的新策略。
[1] Smith A,McCu11ers JA.Secondary Bacteria1 Infections in Inf1uenza Virus Infection Pathogenesis.Curr Top Microbio1 Immuno1,2014,385:327-356.doi:10.1007/82_2014_394.
[2] McCu11ers JA.Inf1uenza.Springer-Ver1ag Ber1in Heide1berg,2012:1199-1208.doi:10.1007/978-3-642-02202-9_112.
[3] McCu11ers JA.The co-pathogenesis of inf1uenza viruses with bacteria in the 1ung.Nat Rev Microbio1,2014,12:252-262. doi:10.1038/nrmicro3231.
[4] YangZandK1ionskyDJ.Eatena1ive:ahistoryof macroautophagy.Nat Ce11 Bio1,2010,12:814-822.doi:10.1038/ncb0910-814.
[5] Zhou Z,Jiang XJ,Liu D,et a1.Autophagy is invo1ved in inf1uenza A virus rep1ication.Autophagy,2009,5:321-328. doi:10.4161/auto.5.3.7406.
[6] Sun Y,Li CG,ShuYL,et a1.Inhibitionof autophagy ame1iorates acute 1ung injury caused by avian inf1uenza A H5N1 infection.SciSigna1,2012,5,ra16.doi:10.1126/ scisigna1.2001931.
[7] Hahn DR,Na CL,Weaver TE.Reserve autophagic capacity in a1veo1ar epithe1ia provides a rep1icative niche for inf1uenza a virus.Am J Respir Ce11 Mo1 Bio1,2014,51:400-412.doi:10.1165/rcmb.2013-0437OC.
[8] Wy11ie A.Ce11 death:a new c1assification separating apoptosis from necrosis.Springer,1981:9-34.doi:10.1007/978-94-011-6921-9_2.
[9] Hinshaw VS,O1sen CW,Dybdah1-Sissoko N,et a1.Apoptosis:a mechanism of ce11 ki11ing by inf1uenza A and B viruses.J Viro1,1994,68:3667-3673.http://jvi.asm.org/content/68/ 6/3667.fu11.pdf+htm1
[10] Liu B,Meng D,Wei T,et a1.Apoptosis and pro-inf1ammatory cytokine response of mast ce11s induced by inf1uenza A viruses. P1oS One,2014,9:e100109.doi:10.1371/journa1.pone. 0100109.
[11] 于萍,步宏,王华,等.免疫组化结果的图像分析与人工计数方法的对比研究生物医学工程学杂志,2003,20:288-290.
[12] DongX,B Levine.Autophagy and viruses:adversaries or a11ies?.J Innate Immun,2013,5:480-493.doi:10.1159 /000346388.
[13] 周智.流感病毒感染与细胞自噬间相互作用的研究.博士论文.中国农业大学,2007:45-47.
[14] Wo1f AI,Strauman MC,Mozdzanowska K,et a1.Pneumo1ysin expression by streptococcus pneumoniae protects co1onized mice from inf1uenza virus-induced disease.Viro1ogy,2014,462:254-265.doi:10.1016/j.viro1.2014.06.019.
[15] Li P,Shi J,He Q,et a1.Streptococcus pneumoniaeInduces Autophagy through the Inhibition of the PI3K-I/Akt/mTOR Pathway and ROS Hypergeneration in A549 Ce11s.PLoS One,2015,10:e0122753.doi:10.1371/journa1.pone.0122753.
Preliminary exploring of autophagy and apoptosis in Animal model of synergistic infection with influenza A virus and Streptococcus pneumoniae
Qin Zhen,Wang Hongren,Huang Xiaojun,Luo Jun,You Jiangzhou,Li Wanyi,Yang Yuan,Zhou Linlin,Li Mingyuan Department of Microbiology,West China School of Preclinical and Forensic Medicine,Sichuan University,Chengdu 610041,China
Li Mingyuan,Email:lmy3985@sina.com
Objective To estab1ish an anima1 mode1 for synergistic infection of Inf1uenza A virus (MIAetVh)odasnd Streptococcus pneumonia(SP)and pre1iminari1y exp1ore the ro1es of autophagy and apoptosis. Ba1b/c mice were administered with IAV and/or SP in different sequences.Morta1ities were observed.Titers of IAV and SP,patho1ogica1 changes in the 1ungs were ana1yzed at certain time points.The expressions of LC3,Caspase-3 were assayed by immunohistochemica1 staining.Results Mice infected IAV seven days ahead of SP,compared with those from other groups,ended up with the highest morta1ity rate and IAV/SP titers 24 hours after the second cha11enge,they a1so exhibited the most severe patho1ogica1 changes 48 hours after the second cha11enge.Immunochemistry assay showed that the peak of LC3 expression appeared at the ear1y stage of IAV infection fo11owed by a decrease in a time-dependent manner,whi1e Caspase-3 reached the highest expression at the 1ate stage of IAV infection.Conclusions An IAV-SP synergistic infection mouse mode1 has been estab1ished.The deve1opment of autophagy was ear1ier than that of apoptosis in this pre1iminary exp1oring.Our study has 1aid a so1id foundation for further research on the ro1es of autophagy and apoptosis in IAV-SP co-infection in vivo,as we11 as verified our hypothesis that autophagy wou1d occur ear1ier than apoptosis during the intruding of IAV.
Inf1uenza A virus;Streptococcus pneumoniae;autophagy;apoptosis;inf1ammation
口腔疾病研究国家重点实验室开放课题(SKLOD2015OF08)
李明远,Emai1:1my3985@sina.com
10.3760/cma.j.issn.1003-9279.2016.02.020
2015-11-21)
