胸水细胞块在鉴别肺腺癌细胞和间皮细胞中抗体的选择
2016-08-19徐元成杨周亮吕可君永康市第一人民医院浙江永康321300
徐元成,杨周亮,吕可君(永康市第一人民医院,浙江 永康 321300)
胸水细胞块在鉴别肺腺癌细胞和间皮细胞中抗体的选择
徐元成,杨周亮,吕可君
(永康市第一人民医院,浙江 永康 321300)
目的探讨胸水CEA、TTF-1、MC、CR、CK7、EMA抗体在鉴别诊断肺腺癌细胞和反应性增生间皮细胞中的应用。方法选择转移性肺腺癌胸水45例及同期非肿瘤性胸水35例,所有纳入病例的胸水标准为常规涂片或液基细胞涂片中发现有较多数量的腺癌细胞或间皮细胞,离心沉淀物做成细胞块。检测细胞块中CEA、TTF-1、MC、CR、CK7、EMA抗体的表达,探讨这些抗体在鉴别诊断胸水中肺腺癌细胞和反应性增生间皮细胞的作用。结果CEA在肺腺癌细胞中的阳性率为93.3%,显著高于反应性增生间皮细胞(2.9%),差异有统计学意义(P<0.01);TTF-1在肺腺癌细胞中的阳性率为86.7%,显著高于反应性增生间皮细胞(0),差异有统计学意义(P<0.01);MC在肺腺癌细胞中的阳性率为11.1%,显著低于反应性增生间皮细胞(91.4%),差异有统计学意义(P<0.01);CR在肺腺癌细胞中的阳性率为4.4%,显著低于反应性增生间皮细胞(88.6%),差异有统计学意义(P<0.01)。CK7和EMA在肺腺癌细胞中的表达率与反应性增生间皮细胞比较,差异无统计学意义 (P>0.05)。结论TTF-1 与CEA在肺腺癌细胞中呈高表达,而CR与MC在反应性增生间皮细胞中高表达,可用于肺腺癌与反应性间皮细胞增生的鉴别诊断。
胸水;细胞块;肺腺癌细胞;间皮细胞;免疫组织化学
胸水细胞学检查是肺癌合并胸腔积液患者最常见检查项目之一,胸水中是否存在腺癌细胞,对肺腺癌患者诊断分期、化学治疗及判断预后至关重要。目前,三级乙等以下基层医院病理科胸腹水诊断大多仅仅依靠细胞学涂片,阳性率偏低,主观性强,特别是分化好的腺癌细胞与增生间皮细胞或者浆膜腔原发性间皮肿瘤细胞形态非常相似,鉴别两者一直是细胞病理诊断的难点[1-2]。近年来,细胞块技术在细胞学诊断领域取得很大进展[3-4],本实验在细胞学制片基础上,参照文献方法[5-6],通过胸水离心后细胞沉淀物包埋做成蜡块,结合免疫组织化学染色联合检测上皮细胞相关抗体和间皮细胞相关抗体,为临床鉴别肺腺癌细胞和反应性增生间皮细胞提供更可靠的依据,现报道如下。
1 资料与方法
1.1一般资料2014年1月~2015年8月选择本院转移性肺腺癌胸水45例(肺腺癌组),男19例,女26例,年龄40~79岁,中位年龄61.6岁,所有病例均经过手术、纤维支气管镜或穿刺病理确诊。同时选择同期非肿瘤性胸水35例 (反应性间皮细胞增生组),男19例,女16例,年龄35~77岁,中位年龄55.8岁。所有纳入病例的胸水标准:常规涂片或液基细胞涂片发现有较多数量的腺癌细胞或间皮细胞。
1.2方法
1.2.1仪器与试剂莱卡封闭式脱水机、安必平液基细胞制片仪、安徽中科中佳低速离心机,广州深达生物制品技术有限公司生产的免疫组化试剂。
1.2.2细胞块制作方法取新鲜胸水至少100mL,用50mL尖底离心管取两管胸水置于离心机以2500r/min离心10分钟,弃去上清液;如细胞沉淀过少,可再将剩余胸水加至离心管离心。弃去上清液,吸取少量沉淀物做常规涂片或液基细胞制片,剩余沉淀物加入4%中性甲醛10mL,室温下固定1~24小时;取出沉淀物用包埋滤纸包好,和其他组织学标本放入自动脱水机中进行处理,制成石蜡细胞块,切片,采用常规HE染色及免疫细胞化学染色,镜下分析所见细胞的性质。
1.2.3免疫组化染色所选抗体包括上皮细胞相关抗体:甲状腺转录因子-1(thyroid transcription factor-1,TTF-1)、癌胚抗原 (CEA)、细胞角蛋白-7 (cytokeratin-7,CK7)、上皮膜抗原(epithelialmembrane antigen,EMA)和间皮细胞相关抗体:间皮细胞蛋白(mesothelial cell,MC)、钙结合蛋白(calretinin,CR)作为一抗均为单克隆抗体,购自广州深达生物制品技术有限公司。所有细胞蜡块连续切片,厚度约3μm,于60℃烘干l小时,采用EnVision二步法,DAB显色,苏木精复染,中性树胶封片,置显微镜下观察。阴性对照采用PBS缓冲液代替一抗,阳性对照采用已证实为阳性的组织切片。阳性信号定位:CEA和CK7定位在细胞浆,TTF-1定位在细胞核,MC和EMA定位在细胞膜,CR定位在细胞浆或者细胞核,以染色呈黄色至棕褐色为阳性反应。腺癌细胞或间皮细胞达到10%以上细胞阳性判断为阳性。
1.3统计学处理采用SPSS11.0统计学软件对数据进行分析,计数资料采用χ2检验。

表1 各抗体在肺腺癌及反应性增生间皮细胞中的阳性表达比较(n,%)
2 结果
CEA在肺腺癌细胞中的阳性率为93.3%,显著高于反应性增生间皮细胞(2.9%),差异有统计学意义(P<0.01);TTF-1在肺腺癌细胞中的阳性率为86.7%,显著高于反应性增生间皮细胞,差异有统计学意义(P<0.01);MC在肺腺癌细胞中的阳性率为11.1%,显著低于反应性增生间皮细胞(91.4%),差异有统计学意义(P<0.01);CR在肺腺癌细胞中的阳性率为4.4%,显著低于反应性增生间皮细胞(88.6%),差异有统计学意义(P<0.01)。CK7和EMA在肺腺癌细胞中的表达与反应性增生间皮细胞比较,差异无统计学意义(P>0.05)。见表1。CEA、TTF-1、MC、CR、CK7、EMA免疫组织化学染色结果见图1~6。
3 讨论
胸腔积液中肺腺癌细胞与反应性增生的间皮细胞形态有相似之处,有时单通过形态学特征进行鉴别难以作出正确判断[1],同一标本采用单纯细胞涂片在不同病理医师之间会存在诊断结果的差异。免疫组织化学染色近年来成为胸腔积液细胞学鉴别诊断的有效辅助方法,而细胞块切片是免疫组织化学染色的良好载体。细胞块切片背景干净,较少假阳性情况,容易保存,可作多张切片,便于染色及对比分析[2]。
CEA最初发现于结肠癌和胎儿肠组织中,故名癌胚抗原,在包括肺癌在内的许多肿瘤中广泛表达,癌旁正常黏膜CEA含量很少或为阴性。虽然在一些非肿瘤病变(如肺部感染、肝炎、溃疡性结肠炎等)中CEA水平也会升高,但与恶性肿瘤相比,无论是升高的幅度还是出现的频率均远不及后者。腺癌患者CEA水平较其他病理类型肿瘤更高。本文肺腺癌细胞CEA阳性表达率93.3%,显著高于反应性增生间皮细胞的阳性表达率,可以作为肺腺癌及反应性间皮细胞增生的鉴别诊断。TTF-1属于NKx2家族成员之一,是一种核蛋白,分子量38kD,主要表达于肺及甲状腺上皮细胞以及相对应的癌细胞核,其他上皮细胞(如乳腺导管上皮细胞、胃肠道上皮细胞等)和间皮源性细胞均不表达[1],因此其可用于肺腺癌细胞与间皮细胞的鉴别诊断。本文肺腺癌细胞标本中86.7%TTF-1表达阳性,与既往研究的敏感性54%~89%相似[7],而间皮细胞内无表达,特异性达到100%。因此TTF-1对转移性肺腺癌的诊断均有较高的价值,尤其是与反应性增生间皮细胞间的鉴别诊断,特异性达到100%。
MC主要分布在间皮细胞中,定位于细胞膜,而其他腺癌主要定位在细胞浆。MC在浆膜腔内间皮细胞及其肿瘤的阳性表达率达79%[8],在鉴别肺腺癌细胞和间皮源性细胞具有重要的临床意义。本文反应性增生间皮细胞中MC的阳性表达率为91.4%,显著高于肺腺癌细胞中的阳性表达率。说明MC是增生间皮细胞的可靠标记物,可以用于鉴别增生间皮细胞和肺腺癌细胞。CR是神经特异性钙结合蛋白,属于肌钙蛋白C超家族,在增生的间皮细胞以及间皮瘤细胞中定位于细胞浆和细胞核,其在腺癌细胞中表达极低或者不表达。间皮细胞中其阳性表达率达到80%以上[8]。本文胸水细胞块中反应性增生间皮细胞CR的阳性表达率为88.6%,显著高于肺腺癌细胞,说明其鉴别诊断反应性增生间皮细胞具有较高的敏感性和特异性。
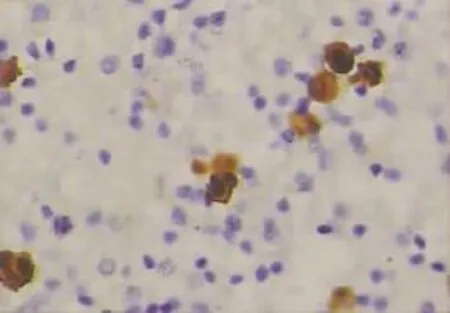
图1 CEA在腺癌细胞中的阳性表达(EnVision×400)

图2 TTF-1在腺癌细胞中的阳性表达(EnVision×400)
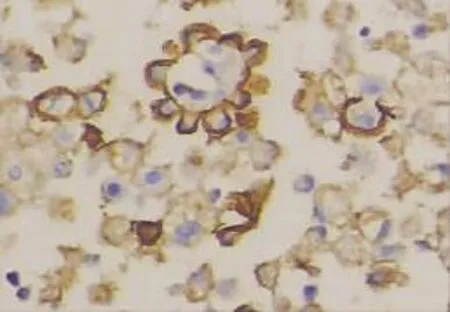
图3 MC在间皮细胞中的阳性表达(EnVision×400)
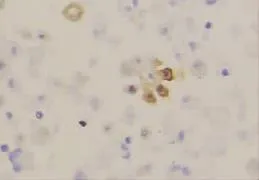
图4 CR在间皮细胞中的阳性表达(EnVision×400)
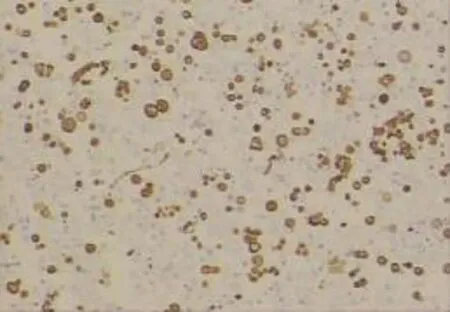
图5 CK7在腺癌细胞及背景间皮细胞中的阳性表达(EnVision×400)

图6 EMA在间皮细胞中的阳性表达(EnVision×400)
CK7属于细胞角蛋白,主要表达在肺、乳腺、胰腺等腺上皮,一般结肠腺上皮不表达。本文CK7在肺腺癌细胞和间皮细胞的阳性表达率分别为95.6%和80.0%,差异无统计学意义(P>0.05)。EMA是一种糖蛋白,主要分布于上皮细胞的腔缘表面膜,是上皮源性肿瘤标志物之一。本文肺腺癌细胞中的EMA阳性表达率和间皮细胞中的阳性表达率比较,差异无统计学意义(P>0.05)。
综上所述,胸水细胞块切片用做免疫组织化学染色的载体具有背景清晰、定位良好等优点。TTF-1 与CEA在肺腺癌细胞中呈高表达,是肺腺癌的可靠标志物;而CR与MC在反应性增生间皮细胞中高表达,是间皮细胞的可靠标志物,以上指标均可用于肺腺癌与反应性间皮细胞增生的鉴别诊断;而CK7 和EMA在肺腺癌细胞和反应性增生间皮细胞中均有阳性表达,阳性表达率差异无统计学意义。
[1]Khoor A,Byrd-Gloster AL,Nicosia SV,et al.Expression of thyroid transcription factor-1 in malignant pleural effusions. Pathol Oncol Res,2011,17(2):263
[2]Shivakumarswamy U,Arakeri SU,Karigowdar MH,et al.Diagnostic utility of the cell block method versus the conventionalsmearstudyinpleuralfluidcytology.JCytol,2012,29(1):11
[3] Köksal D,Dem1ragˇ F,Bay1z H,et al.The cell block method increases the diagnostic yield in exudative pleural effusions accompanying lung cancer.Turk Patoloji Derg,2013,29(3):165
[4]Ghosh I,Dey SK,Das A,et al.Cell block cytology in pleural effusion.J Indian Med Assoc,2012,110(6):390
[5]王守梅,杨秋红,魏静静,等.比较胸腹水液基细胞学剩余标本制作细胞块的3种方法.第二军医大学学报,2013,34 (2):160
[6] 郭以河,张闽峰,孟加榕,等.不同固定方法对胸水细胞块组织形态及免疫细胞化学的影响.现代肿瘤医学,2010,18 (10):1925
[7]雷亚丽,易红梅,李艳春,等.联合抗体在胸水细胞块肺腺癌细胞和增生性间皮细胞中的表达及意义.国际病理科学与临床杂志2013,33(6):481
[8]Su Xueying,Li Gandi,Liu Weiping,et al.Cytological differential diagnosis among adenocarcinoma,epithelial mesothelioma,and reactive mesothelial cells in serous effusions by immunocytochemistry.Diagn Cytopathol,2011,39(12):900
永康市科技计划项目(201437)
