茶树己糖磷酸转运器基因GPT的克隆及表达1)
2016-08-18张娅婷孙楠刘瑞瑞韩雅彭程琳王磊袁红雨
张娅婷 孙楠 刘瑞瑞 韩雅彭 程琳 王磊 袁红雨
(信阳师范学院,信阳,464000)
茶树己糖磷酸转运器基因GPT的克隆及表达1)
张娅婷孙楠刘瑞瑞韩雅彭程琳王磊袁红雨
(信阳师范学院,信阳,464000)
Cs-Ev17(GenBank登录号:GH618812)为一受假眼小绿叶蝉取食诱导的茶树葡萄糖-6-磷酸/磷酸转运体基因的cDNA片段,采用RACE技术克隆该基因的全长cDNA序列,命名为CsGPT(GenBank登录号:FJ648829)。其全长为1 514 bp,包含一个编码401个氨基酸的开放性阅读框,5′-UTR和3′-UTR的长度分别是27 bp和253 bp,其中,3′-UTR具有一个poly(A)加尾信号序列(AATAAA)。生物信息学分析显示,CsGPT的转运肽由78个氨基酸组成,具有8个跨膜区。序列分析显示,CsGPT与拟南芥的GPT2、可可的GPT2和蓖麻的GPT2的一致性分别为80%、80%和73%。荧光定量PCR结果显示,CsGPT在叶片中的表达受假眼小绿叶蝉取食和茉莉酸的诱导。
茶树;葡萄糖-6-磷酸/磷酸转运体基因;基因表达
Cs-Ev17 is a cDNA fragment of a tea glucose-6-phosphate/phosphate translocator gene, which was up-regulated by mild infestation of green leafhopper (EmpoascavitisGöthe). Its full-length cDNA was cloned using the strategy of RACE method. This cDNA was designated asCsGPT(GenBank accession number: FJ648829), which was 1 514 bp in length with a 27 bp 5′-UTR and a 253 bp 3′-UTR, containing an open reading frame of 401 amino acids. The 3′-UTR contains polyadenylation signal sequence (AATAAA). By bioinformatics analysis, CsGPT protein processed a transit peptide of 78 amino acid residues, and contained 8 transmembrane domains. Sequence alignment exhibited that the CsGPT protein had homology to other GPTs fromArabidopsisthaliana,TheobromacacaoandRicinuscommunisL. showing 80%, 80% and 73% in amino acid identity, respectively. By qRT-PCR, the expression ofCsGPTin leaves was induced by infestation of green leafhopper and jasmonic acid.
质体是植物细胞生物化学活动中心之一,为一种具有双层被膜的细胞器。质体与胞质代谢活动的整合是通过一组转运蛋白实现的,它们控制着代谢物的跨膜运输。质体的外膜具有β-桶状跨膜蛋白形成选择性的膜孔,而内膜对物质的通透有很强的选择性,是质体与胞质之间的功能屏障。物质通过内膜的运输由一组α-螺旋膜蛋白转运体催化,它们有高度的底物专一性。位于质体内膜上的质体磷酸转运体(plastidic phosphate translocator,pTP)催化无机磷酸与磷酸丙糖、磷酸戊糖和磷酸己糖的反向交换运输,在沟通质体和胞质碳代谢中发挥关键作用。
目前发现的质体磷酸转运体有磷酸丙糖/磷酸转运体(triose phosphate/phosphate translocator,TPT)、葡萄糖-6-磷酸/磷酸转运体(glucose-6-phosphate/phosphate translocator,GPT)、磷酸烯醇式丙酮酸/磷酸转运体(phosphoenolpyruvate/phosphate translocator,PPT)和戊糖-5-磷酸/磷酸转运体(xylulose-5-phosphate/phosphate translocator,XPT)等4种类型[1-6]。其中,GPT主要存在于非绿色组织中,负责将Glc6P运送到质体基质,用于淀粉和脂肪酸的合成,也可以作为戊糖磷酸途径的底物[7-9]。根据从拟南芥、玉米的胚乳、豌豆的根部组织和马铃薯的块茎组织中分离出编码GPT的cDNA序列,预测其GPT蛋白的氨基酸序列具有高度的一致性,并且含有6~8个跨膜区[10]。拟南芥具有两个功能性GPT基因。GPT1基因主要在气孔保卫细胞、维管束鞘细胞和根尖细胞中组成型表达,并参与配子和胚乳的发育,GPT1基因的突变有致死效应。GPT2基因突变并不影响植物正常条件下的生长发育,但该基因的表达受糖代谢的调控[10]。
本研究采用RACE技术根据一个受假眼小绿叶蝉取食诱导的茶树GPT基因的cDNA片段(GenBank登录号:GH618812)[11],克隆了该基因的全长cDNA,然后采用实时定量PCR分析了假眼小绿叶蝉取食,以及茉莉酮酸甲酯对该基因表达的影响。
1 材料与方法
1.1植物材料
以2年生茶树栽培品种‘信阳10号’营养钵扦插苗为试验材料进行假眼小绿叶蝉和JA处理。处理前先将茶树幼苗置于稳定为25~28 ℃、光照强度为160 μmol·m-2·s-1、光照时间为12 h·d-1条件下生长7 d。
假眼小绿叶蝉处理:每一茶树幼苗接种50头左右的假眼小绿叶蝉成虫,用通风良好的塑料网罩将茶树幼苗罩上。接虫12、24、36和48 h后,剪取充分伸展的茶树叶片用于试验,以不进行假眼小绿叶蝉处理的茶树幼苗作为对照。JA处理:茶树叶面喷施浓度为5 mmol·L-1的JA,分别于处理后2、3、4、6、12和24 h剪取充分伸展的叶片用于实验。对照喷施等量的蒸馏水。对照和各种处理的叶片采集后迅速用液氮处理,并置于冰箱中-80 ℃保存。
1.2RACE cDNA文库的构建
参照Qiagen公司的RNeasy Plant Mini Kit试剂盒从假眼小绿叶蝉取食32 h的茶树叶片中提取总RNA。按照Clontech公司SMARTTMRACE cDNA Amplification Kit的操作程序构建5′-ready RACE cDNA文库和3′-ready RACE cDNA文库。
1.3CsGPT基因5’端和3’端序列的克隆
根据Cs-Ev17的核苷酸序列设计一对特异性引物CsGPT-F1(5′-TCCTCAATGCCTTTCCATTC-3′)和CsGPT-R1(5′-CCAATTGTATGTGCCACAGC-3′)。以5′-ready RACE cDNA文库为模板,利用5′-通用引物和GPS2扩增该基因cDNA的5′-末端,PCR条件:94 ℃ 2 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;以3′-ready RACE cDNA文库为模板,利用3′-通用引物和GPS1扩增该基因cDNA的3′-末端,PCR条件:94 ℃ 2 min,94 ℃ 30 s,52 ℃ 30 s,72 ℃ 2 min,30个循环。
1.4Real-time qRT-PCR
利用Trizol Reagent(Invitrogen)从对照植株的叶片和不同处理植株的叶片中提取总RNA,通过琼脂糖凝胶电泳和紫外分光光度计检测RNA的完整性和浓度。用First Strand cDNA Synthesis试剂盒(Fermentas)合成第一链cDNA,以检测不同处理条件下CsGPT基因的表达水平。
利用primer premier 5.0软件设计CsGPT荧光定量RT-PCR分析引物CsGPT-F2(CTACGAAGCCCATCATGTGC)和CsGPT-R2(AGTTGAAGTGAGCCATGGGA)。采用茶树的α-tubulin基因(上游引物:5′CCACTCATTCCCTCCTTGAA3′;下游引物:5′ATGGCTCCATCAAACCTCAG3′)作为内参对不同样品cDNA的模板量进行校准。
实时荧光定量PCR反应参照SYBR®PremixExTaqTM(TaKaRa)试剂盒说明书进行,反应体系为:cDNA模板2 μL,2×SYBRPremixExTaqTM10 μL,上、下游引物(10 μmol·L-1)各0.4 μL,50×ROX Reference Dye 0.4 μL,ddH2O 6.8 μL。每个样品设3次重复。反应在ABI PRISM 7300 Real-Time PCR仪(Applied Biosystems)上进行,程序为:95 ℃ 1 min,95 ℃ 15 s,55 ℃ 15 s,72 ℃ 30 s,40个循环。设定程序,使PCR仪在扩增结束后自动运行绘制熔解曲线(95 ℃ 15 s,60 ℃ 15 s,95 ℃ 15 s)。实验组目的基因的表达相对于对照组的变化倍数按2-ΔΔCT方法[12]。
2 结果与分析
2.1CsGPT基因克隆及序列分析
基于已获得的茶树GPT基因的cDNA片段,设计一对引物。用下游引物和SMART cDNA的5′通用引物进行5′RACE扩增,获得长661 bp的DNA片段;用上游引物和3′通用引物进行3′RACE扩增,获得长1 096 bp的DNA片段(图1)。序列分析表明所克隆的两个cDNA片段为茶树GPT的两个末端序列。拼接后得到1条完整的GPTcDNA序列,长度为1 514 bp,Genbank登录号为FJ648829。该序列包含一个完整的ORF,编码一条由401个氨基酸残基组成的多肽链。茶树GPT基因的起始密码子被包含在5′-ACCAUGG-3′序列中,这是一个典型的Kozak结构。拼接cDNA的5′-UTR和3′-UTR的长度分别为27 bp和253 bp,并且在3′-UTR的末端有一多聚腺苷酸加尾信号序列(AATAAA)。
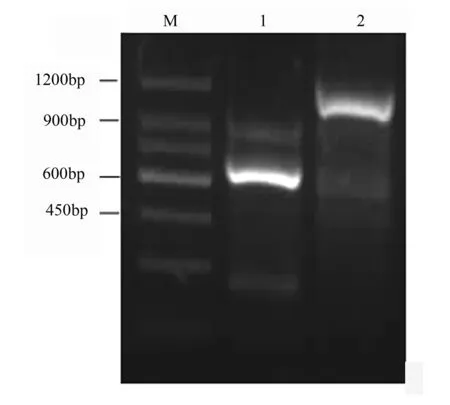
M.150 bp DNA Ladder Marker;1.CsGPT基因的5′RACE产物;2.CsGPT基因的3′RACE产物。
图1茶树CsGPT基因cDNA扩增结果
2.2CsGPT氨基酸序列同源性分析
BlastP比对发现CsGPT与多种植物的GPT蛋白的氨基酸序列具有同源性,与拟南芥、可可和蓖麻的GPT2的一致性分别为80%、80%和73%。疏水性分析显示CsGPT是高度疏水的,成熟蛋白质的总体极性指数(polarity indices)是34%,与已分离的质体磷酸转运体33%~37%的总体极性指数相一致。已分离的TPT、PPT和GPT有6~8个跨膜区,TMHMM分析显示CsGPT具有8个跨膜区,第1、第2和第8个跨膜区分别由18、22和20个氨基酸残基构成,其余5个跨膜区由23个氨基酸残基构成(图2)。ChloroP预期CsGPT的转运肽由78个氨基酸组成,磷酸转运体的转运肽由大约70~90个氨基酸组成。已研究的质体磷酸转运体第一个跨膜区距前体蛋白加工位点20~30个氨基酸残基,CsGPT蛋白的第一个跨膜区在CsGPT前体的加工位点下游30个氨基酸残基。
蛋白序列的基序分析[13]显示所有的质体磷酸转运体亚家族具有相同的基序2、基序3、基序4、基序5、基序6、基序11和基序12。不同的亚家族基序组成各有差异,其中基序1和基序7仅存在于GPT亚家族中,暗示其在植物GPT基因功能上扮演独特的作用。XPT亚家族单独具有基序8,PPT亚家族不具有特有的基序,TPT亚家族和GPT亚家族相似,也有2个特有的基序,分别是基序9和基序12(图3)。此结果可以推测,不同亚家族在基序组成上的差异很可能是造成亚家族间功能分化的一个重要原因。

黑色表示在所有的序列中都相同的氨基酸残基;灰色表示在多数序列中相同的氨基酸残基;黑线表示预测的8个跨膜α-螺旋(Ⅰ~Ⅷ)。CsGPT.茶树(FJ648829);AtGPT2.拟南芥(NP_564785);RcGPT2.蓖麻(XP_002518517);Tc_GPT2.可可(XP_007026011.1);Pt_GPT2.杨树(XP_011037695.1);Ga_GPT2.树棉(KHG03254.1);Pm_GPT2.梅花(XP_008224795.1);Eg_GPT1.桉树(XP_010060420.1)。
图2CsGPT编码产物与其他物种GPT的同源性比对
2.3CsGPT蛋白的系统发育
选取代表性植物拟南芥、杨树、蓖麻和可可中的质体磷酸转运体基因同源序列,利用邻接法构建进化树。系统进化分析结果显示茶树CsGPT与其他植物的GPT亚家族聚为一支(图3)。同时,不同亚家族的质体磷酸转运体相互聚类,最终各亚家族聚集成质体磷酸转运体家族。
2.4CsGPT基因的表达分析
荧光定量PCR分析表明,假眼小绿叶蝉取食12 h左右茶树叶片CsGPT转录水平有小幅上升,然后逐步升高,在取食48 h前后达到最大值,较对照组增加了约28倍(表1)。在茶树叶片中,CsGPT的表达受JA的诱导。在JA处理3 h左右CsGPT转录水平约为对照组的4倍,然后逐渐升高,在6 h前后达到峰值(表1)。
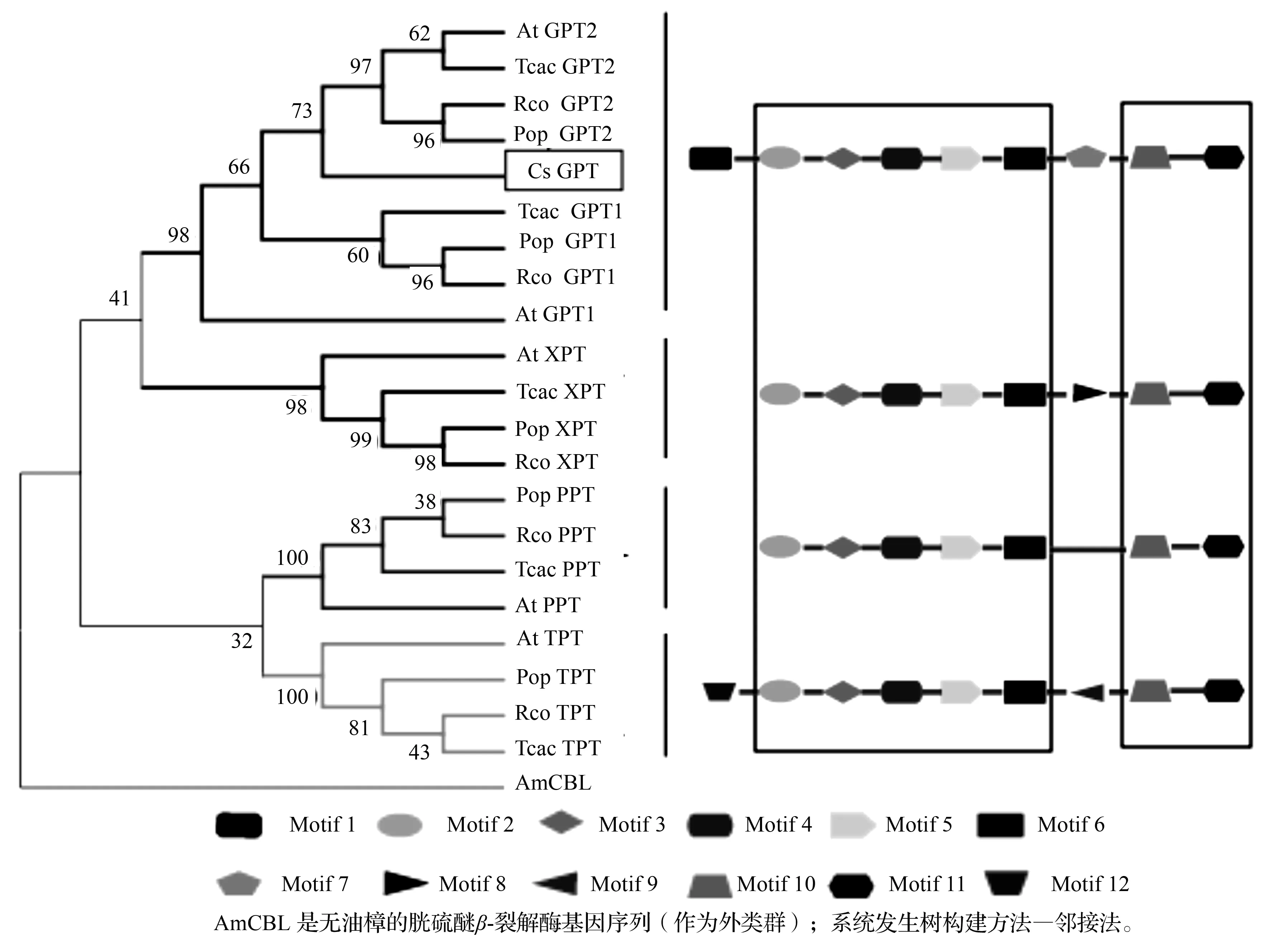
图3 茶树GPT系统进化树
表1JA处理和假眼小绿叶蝉处理对茶树幼苗CsGPT基因表达的影响
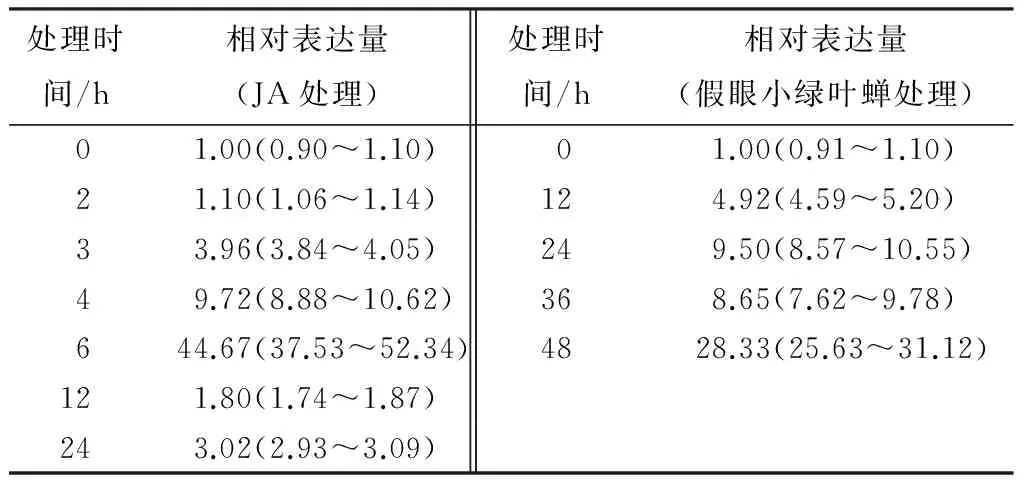
处理时间/h相对表达量(JA处理)处理时间/h相对表达量(假眼小绿叶蝉处理)01.00(0.90~1.10)01.00(0.91~1.10)21.10(1.06~1.14)124.92(4.59~5.20)33.96(3.84~4.05)249.50(8.57~10.55)49.72(8.88~10.62)368.65(7.62~9.78)644.67(37.53~52.34)4828.33(25.63~31.12)121.80(1.74~1.87)243.02(2.93~3.09)
注:表中括号内数据表示误差范围。
3 结论与讨论
本研究通过RACE技术从茶树叶片中克隆得到CsGPT基因的全长cDNA序列。序列分析显示该基因所编码的蛋白质,具有8个跨膜区和一个由78个氨基酸残基组成的转运肽区域。GPT属于质体内膜上由核基因编码的磷酸转运体家族,该家族可分为TPT、PPT、GPT和XPT 4个亚家族。
pPT表达的组织特异性与它们的功能相一致。正常情况下,GPT主要在异养组织中表达,向质体转运淀粉合成和戊糖磷酸途径所需的G6P。然而,环境因素和植物体生理状态的变化可以改变GPT的表达模式。用葡萄糖溶液处理离体的菠菜叶片可以诱导进行光合作用的叶片表达GPT基因,并导致叶片中淀粉的含量异常地升高[14]。在拟南芥pho3突变体中,由于蔗糖的积累,叶片中的GPT2基因被诱导高水平表达[15]。光照条件下,拟南芥3种淀粉合成缺陷型突变体(pgm、adg和pgi)的GPT2基因在叶片中被诱导表达,并且GPT2基因的表达与叶片中可溶性糖,尤其是葡萄糖水平的升高相关联[16]。KUNZ等[16]提出拟南芥GPT2可能在叶绿体淀粉合成受损或植物体内可溶糖浓度增加条件下起着安全阀的作用,由于淀粉的合成受阻,其底物G6P就在叶绿体中积累,根据叶绿体和胞质中G6P的浓度梯度,GPT2可以输入或者输出G6P。
假眼小绿叶叶蝉为刺吸式口器昆虫,主要吸食水稻韧皮部汁液。刺吸式口器昆虫的取食会大量消耗植物的光合产物,并影响光合产物的运转与分配。本试验采用qPCR技术分析假眼小绿叶蝉的取食对茶树叶片CsGPT基因表达的影响,结果表明该基因受假眼小绿叶蝉取食的诱导。有许多研究证明GPT基因在植物糖感知途径中的作用,假眼小绿叶蝉取食后茶树叶片CsGPT基因表达水平的改变可能是植株在受到虫害后产生的糖应答反应途径的组成部分。
植物的糖应答途径与植物激素应答途径之间存在相互作用[17]。植物的发育、生理和代谢过程受可溶性糖,例如葡萄糖和蔗糖,供应水平的调控,其中许多过程也受到植物激素的调节。茉莉酸是伤反应中重要的信号分子,昆虫取食会导致JA在伤害部位迅速积累,大多数针对昆虫的诱导抗性是由JA信号途径引发的。在本试验中,CsGPT的表达还受到茉莉酮酸甲酯的影响,说明在植物应答刺吸式口器取食的过程中,伤信号和糖两种应答途径之间存在着互作。
[1]FLÜGGE U I, FISCHER K, GROSS A, et al. The triose phosphate-3-phosphoglycerate-phosphate translocator from spinach chloroplasts: nucleotide sequence of a full-length cDNA clone and import of the in vitro synthesized precursor protein into chloroplasts[J]. EMBO Journal,1989,8(1):39-46.
[2]FISCHER K, KAMMERER B, GUTENSOHN M, et al. A new class of plastidic phosphate translocators: a putative link between primary and secondary metabolism by the phosphoenolpyruvate/phosphate antiporter[J]. The Plant Cell,1997,9:453-462.
[3]EICKS M, MAURINO V, KNAPPE S, et al. The plastidic pentose phosphate translocator represents a link between the cytosolic and plastidic pentose phosphate pathway in plants[J]. Plant Physiology,2002,128(2):512-522.
[4]KNAPPE S, FLÜGGE U I, FISCHER K. Analysis of the plastidic phosphate translocator gene family in Arabidopsis and identification of new phosphate translocator-homologous transporters, classified by their putative substrate-binding site[J]. Plant Physiology,2003,131(3):1178-1190.
[5]FLÜGGE U I, HUSLER R E, LUDEWIG F, et al. The role of transporters in supplying energy to plant plastids[J]. Journal of Experimental Botany,2011,62(7):2381-2392.
[6]WEBER A P, FISCHER K. Making the connections: the crucial role of metabolite transporters at the interface between chloroplast and cytosol[J]. FEBS Letters,2007,581(12):2215-2222.
[7]ROLLETSCHEK H, NGUYEN T H, HUSLER R E, et al. Antisense inhibition of the plastidial glucose-6-phosphate/phosphate translocator in Vicia seeds shifts cellular differentiation and promotes protein storage[J]. Plant Journal,2007,51(3):468-84.
[8]FISCHER K. The import and export business in plastids: transport processes across the inner envelope membrane[J]. Plant Physiology,2011,155(4):1511-1519.
[9]KAMMERER B, FISCHER K, HILPERT B, et al. Molecular characterization of a carbon transporter in plastids from heterotrophic tissues: the glucose 6-phosphate/phosphate antiporter[J]. Plant Cell,1998,10(1):105-117.
[10]GONZALI S, LORETI E, SOLFANELLI C, et al. Identification of sugar-modulated genes and evidence for in vivo sugar sensing in Arabidopsis[J]. Journal of Plant Research,2006,119:115-123.
[11]YANG H M, XIE S X, WANG L, et al. Identification of up-regulated genes in tea leaves under mild infestation of green leafhopper[J]. Scientia Horticulturae,2011,130(2):476-481.
[12]LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods,2001,25(4):402-408.
[13]ARNOLD K, BORDOLI L, KOPP J, et al. The SWISS-MODEL workspace: a webbased environment for protein structure homology modeling[J]. Bioinformatics,2006,22(2):195-201.
[14]QUICK W P, SCHEIBE R, NEUHAUS H E. Induction of hexose-phosphate translocator activity in spinach chloroplasts[J]. Plant Physiology,1995,109(1):113-121.
[15]LLOYD J C, ZAKHLENIUK O V. Responses of primary and secondary metabolism to sugar accumulation revealed by microarray expression analysis of the Arabidopsis mutant, pho3[J]. Journal of Experimental Botany,2004,55:1221-1230.
[16]KUNZ H H, HUSLER R E, FETTKE J, et al. The role of plastidial glucose-6-phosphate/phosphate translocators in vegetative tissues of Arabidopsis thaliana mutants impaired in starch biosynthesis[J]. Plant Biol,2010,12(Supplement s1):115-128.
[17]GIBSON S I. Sugar and phytohormone response pathways: navigating a signalling network[J]. Journal of Experimental Botany,2003,55:253-264.
Molecular Cloning and Expression Analysis of A Glucose-6-phosphate/phosphate Translocator Gene fromCamelliasinensis//
Zhang Yating, Sun Nan, Liu Ruirui, Han Yapeng, Cheng Lin, Wang Lei, Yuan Hongyu
(Xinyang Normal Univeristy, Xinyang 464000, P. R. China)//Journal of Northeast Forestry University,2016,44(2):21-25.
Camelliasinensis; Glucose-6-phosphate/phosphate translocator; Gene expression
张娅婷,女,1976年11月生,信阳师范学院生命科学学院(读硕士研究生期间参与的项目);郑州大学物理工程学院,博士研究生。E-mail:zyt@zzu.edu.cn。
袁红雨,信阳师范学院生命科学学院,教授。E-mail:yhongyu92@163.com。
2015年7月20日。
S793
1)河南省基础与前沿技术研究计划项目(092300410244);河南省教育厅科学技术研究重点项目(12B180032)。
责任编辑:潘华。
