同型半胱氨酸对冠状动脉支架内再狭窄的影响
2016-08-18陈涵王江友
陈涵 王江友
·临床研究·
同型半胱氨酸对冠状动脉支架内再狭窄的影响
陈涵王江友
目的探讨同型半胱氨酸(homocysteine,HCY)对稳定型心绞痛(stable angina pectoris,SAP)患者支架内再狭窄的影响。方法168例SAP患者成功行支架置入治疗,根据术后12~18个月冠状动脉造影结果分为再狭窄组(支架内狭窄≥50%,72例)及对照组(支架内狭窄<50%,96例);测定患者HCY水平,同时对支架置入前、置入后即刻及12~18个月后的冠状动脉造影结果进行计算机辅助的定量分析法(quantitative coronary analysis,QCA)评价。结果对照组HCY水平显著低于再狭窄组[(11.68±3.54)μmol/L比(18.54±4.39)μmol/L,P=0.012]。两组患者术前及术后即刻的最小管腔直径、狭窄程度比较,差异均无统计学意义(均P>0.05);术后12~18个月对照组狭窄程度显著低于再狭窄组[(33.24±12.52)%比(84.23±13.26)%,P=0.000];对照组的晚期管腔丢失显著小于再狭窄组[(0.36±0.21)mm比(1.82±0.68)mm,P=0.000]。多因素logistic回归分析显示,HCY与术后支架内再狭窄有关,回归系数为-0.578,P=0.023(OR0.693,95%CI0.548~0.952)。结论HCY可能是SAP患者发生支架内再狭窄的原因之一。
稳定型心绞痛;支架内再狭窄;药物洗脱支架;同型半胱氨酸
经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)是目前治疗冠心病的主要手段,尽管PCI技术及支架工艺日益改进,但支架内再狭窄仍然是PCI术后的常见不良事件[1]。支架内再狭窄的发生机制目前尚未完全明确,明确其机制可对防治支架内再狭窄的药物研究提供新的领域。支架内再狭窄是一种复杂的病理生理过程,主要涉及内膜增生、局部炎性细胞浸润及血管平滑肌细胞增生,抗细胞增殖和抗炎药物洗脱支架的临床应用,能有效减少支架内再狭窄的发生[2]。研究发现,同型半胱氨酸(homocysteine,HCY)水平升高与动脉粥样硬化组织病理学改变相关,如促进血管内膜增厚、弹性纤维破坏、平滑肌细胞增生、血小板聚集及富含血小板血栓性闭塞等[3-4]。但是,临床上关于HCY是否参与支架内再狭窄的发生尚存在争议。本研究旨在探讨HCY对稳定型心绞痛(stable angina pectoris,SAP)患者支架置入后发生支架内再狭窄的影响。
1 对象与方法
1.1研究对象
纳入2013年4月至2014年3月在武汉亚洲心脏病医院心内科住院的SAP患者168例,其中男119例,女49例,平均年龄(62.86±8.76)岁,经择期冠状动脉造影证实3支主要冠状动脉(前降支、回旋支、右冠状动脉)中至少有1支血管影像学上狭窄≥70%,并成功行PCI。成功PCI标准为冠状动脉靶部位的管腔明显扩大,残余狭窄<30%,同时达到心肌梗死溶栓试验血流分级(TIMI)Ⅲ级。纳入标准:(1)患者肝肾功能正常;(2)均为单支病变,并且仅置入1枚支架。排除标准:(1)血液病、甲状腺疾病、免疫系统疾病、感染、肿瘤等患者;(2)涉及到分叉病变需置入双支架的患者;(3)冠状动脉严重钙化病变;(4)未能按要求一年后来院复查冠状动脉造影;(5)术后一直未服用任何降低HCY的相关药物。根据术后12~18个月冠状动脉造影结果分为再狭窄组(支架内狭窄≥50%,72例)及对照组(支架内狭窄<50%,96例)。
1.2方法
所有患者在PCI术后12~18个月行冠状动脉造影前抽血,由本院检验中心测定HCY水平及血糖、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)等。采用Seldinger法穿刺桡动脉,以Judkins方法行冠状动脉造影,对存在影像学判定狭窄≥70%的血管行PCI治疗。用计算机辅助的定量分析法(quantitative coronary analysis,QCA)评价支架置入前、置入后即刻和12~18个月后造影结果的最小管腔直径(minimum lumen diameter,MLD)、狭窄程度和病变长度,并推算出晚期管腔丢失(late loss=支架置入后即刻的MLD-随访时的MLD)、即刻获得的管腔直径(acute gain=支架置入后即刻的MLD-支架置入前的MLD),净获得的管腔直径(net gain=支架置入前的MLD-随访时的MLD的绝对值),管腔丢失指数(loss index=晚期管腔丢失/即刻获得的管腔直径)。在PCI术后12~18个月行冠状动脉造影检查进行随访。根据《经皮冠状动脉介入治疗指南(2009)》[5]将病变类型分为低危、中危和高危病变。
1.3统计学分析
2 结果
2.1两组患者的一般资料和术后用药情况比较
两组患者的年龄、性别、吸烟、高血压病、糖尿病、体质量指数(BMI)以及术后用药情况[包括血管紧张素转化酶抑制药(ACEI)、血管紧张素Ⅱ受体拮抗药(ARB)、他汀类药物和β阻滞药]等分别比较,差异均无统计学意义(均P>0.05,表1)。
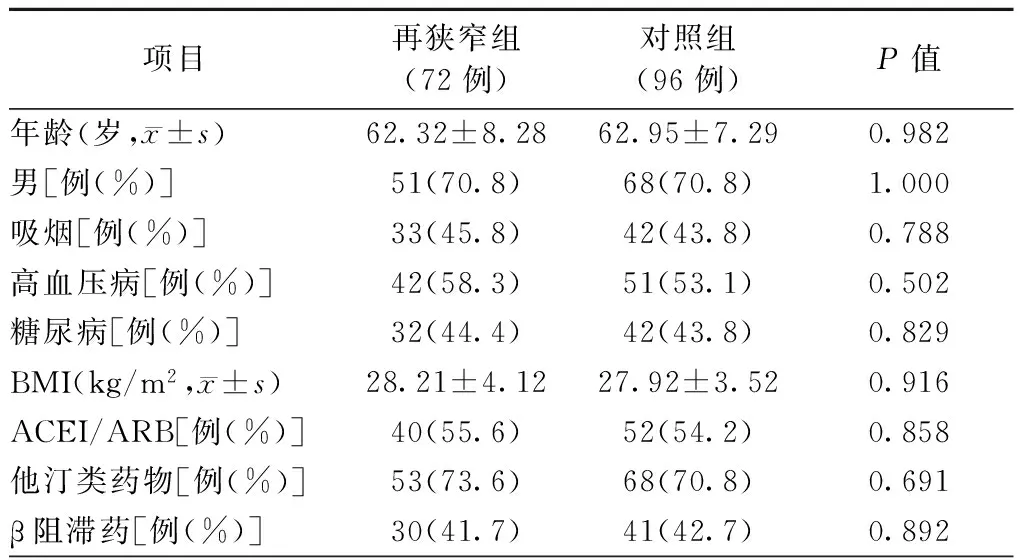
表1 两组患者的一般资料和术后用药情况比较
注:BMI,体质量指数;ACEI,血管紧张素转化酶抑制药;ARB,血管紧张素Ⅱ受体拮抗药;再狭窄组,支架内狭窄≥50%;对照组,支架内狭窄<50%
2.2两组患者的HCY、血脂、血糖水平比较
两组患者的心率、血压、血脂和血糖等各项指标分别比较,差异均无统计学意义(均P>0.05)。对照组HCY水平显著低于再狭窄组[(11.68±3.54)μmol/L比(18.54±4.39)μmol/L,P=0.012,表2]。
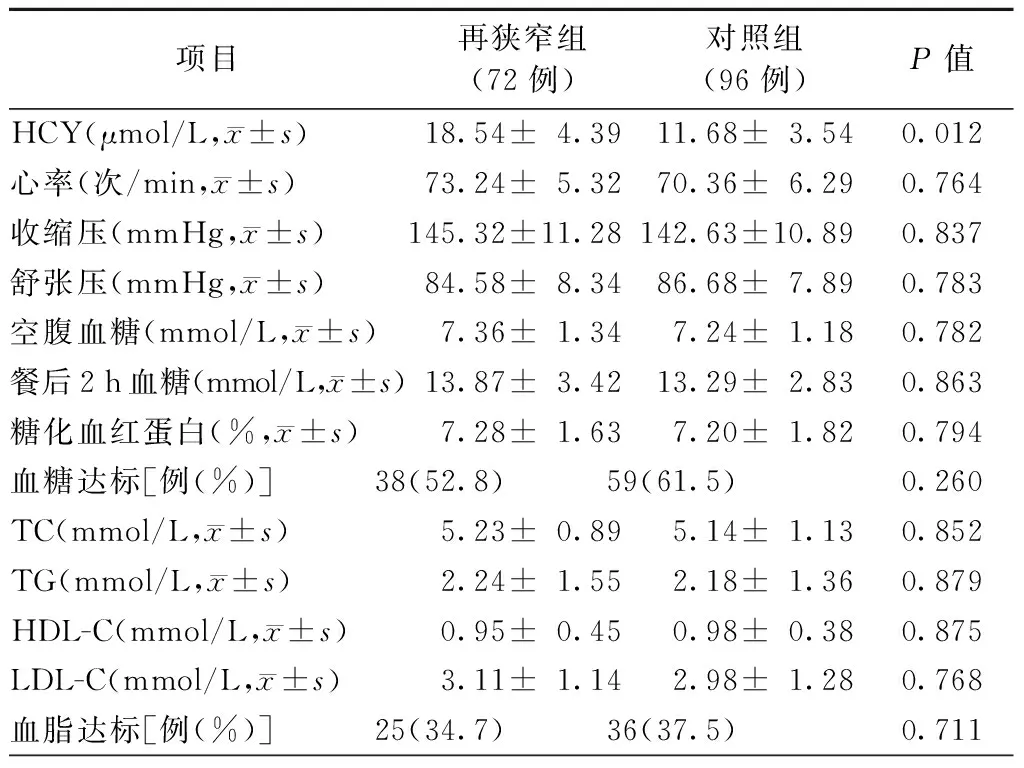
表2 两组患者HCY、心率、血压、血脂及血糖水平比较
注:HCY,同型半胱氨酸;TC,总胆固醇;TG,三酰甘油;HDL-C,高密度脂蛋白胆固醇;LDL-C,低密度脂蛋白胆固醇;1 mmHg=0.133 kPa;再狭窄组,支架内狭窄≥50%;对照组,支架内狭窄<50%
2.3两组患者的靶血管相关特征比较
两组患者的病变部位、病变类型、病变长度、支架尺寸、释放压力及置入支架类型等比较,差异均无统计学意义(均P>0.05,表3)。
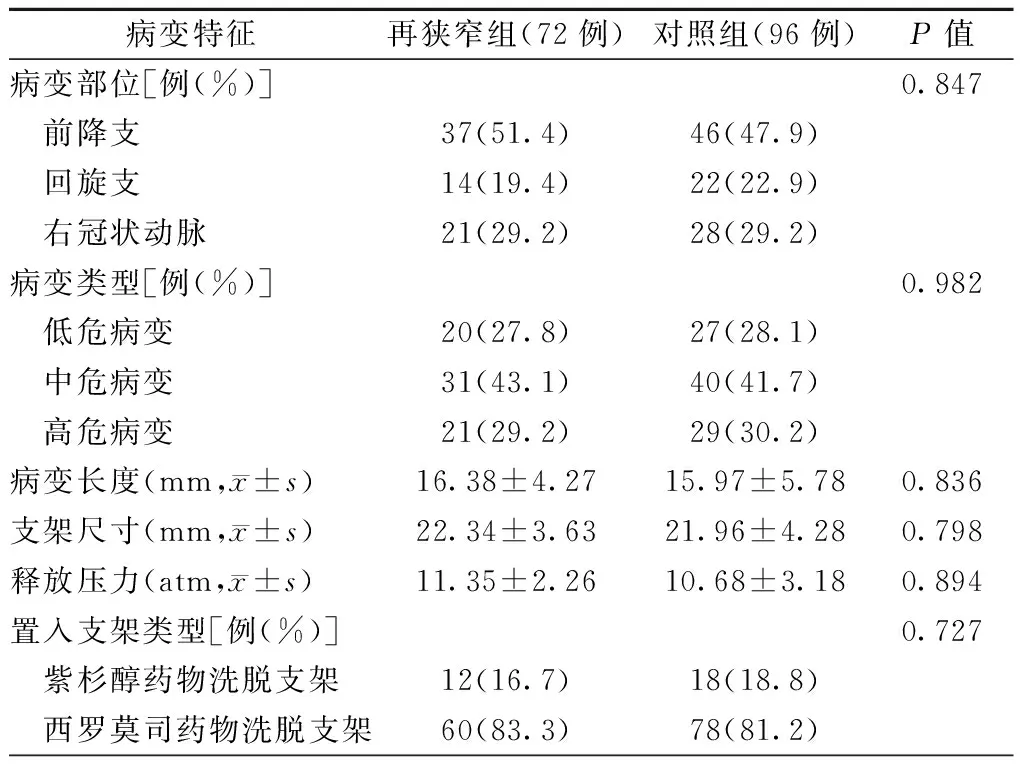
表3 两组患者的靶血管相关特征比较
注:1 atm=101.325 kPa;再狭窄组,支架内狭窄≥50%;对照组,支架内狭窄<50%
2.4两组患者PCI前后QCA指标比较
两组患者术前及术后即刻的MLD、狭窄程度比较,差异均无统计学意义(均P>0.05)。术后12~18个月对照组的MLD显著大于再狭窄组[(2.23±0.73)mm比(0.79±0.47)mm,P=0.015],狭窄程度显著低于再狭窄组[(33.24±12.52)%比(84.23±13.26)%,P=0.000]。对照组的晚期管腔丢失显著小于再狭窄组[(0.36±0.21)mm比(1.82±0.68)mm,P=0.000,表4]。
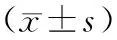
表4 两组患者PCI前后QCA指标比较
注:PCI,经皮冠状动脉介入治疗;QCA,计算机辅助的定量分析法;MLD,最小管腔直径;再狭窄组,支架内狭窄≥50%;对照组,支架内狭窄<50%
2.5多因素logistic回归分析
将有无再狭窄作为因变量,以HCY水平、性别、年龄、TC、TG、HDL-C、LDL-C、血糖为自变量做多元logistic回归分析,结果显示,HCY与术后支架内再狭窄有关,回归系数为-0.578,P=0.023(OR0.693,95%CI0.548~0.952)。
3 讨论
支架内再狭窄是PCI术后的主要不良事件,仍需不断努力攻克此难题。多种因素影响支架内再狭窄,如冠状动脉病变部位、病变长度、管腔大小、支架类型及是否合并糖尿病等。支架内再狭窄发生的机制目前尚未完全明确,可能机制包括支架置入局部的冠状动脉血管内膜过度增生以及血管壁的重构,从支架置入的即刻开始,由于球囊和支架机械性扩张,损伤内皮细胞,使其对中膜血管平滑肌细胞的接触抑制功能丧失,局部有微血栓和炎症反应,进而在众多炎性因子和组织因子的作用下发生血管平滑肌细胞的增生与趋化,细胞基质增多以及血管内皮细胞移行,促进了平滑肌细胞的增殖并向内膜迁移[6]。
HCY水平升高主要与动脉粥样硬化组织病理学改变相关,如促进血管内膜增厚、弹性纤维破坏、平滑肌细胞增生、血小板聚集及富含血小板血栓性闭塞等[3]。高HCY血症对于冠状动脉粥样硬化斑块形成、急性心肌梗死、缺血再灌注、高血压病及心室重构等心血管疾病的发生及预后有着严重不良影响。健康人体内HCY浓度较低,当其高于一定程度时可使氧自由基生成增加,对血管内皮细胞产生损伤,刺激血管平滑肌增殖及纤溶和凝血系统异常,从而导致冠状动脉粥样硬化的形成。Poddar等[7]研究发现,HCY能够通过上调单核细胞趋化因子-1及白细胞介素-8的表达及分泌,进而促进白细胞聚集至血管内皮,触发炎性反应。众所周知,炎性反应参与支架内再狭窄发生。Majors等[8]研究发现,HCY能够促进血管平滑肌细胞增生及血管胶原蛋白产生,并且血管平滑肌细胞增生亦是支架内再狭窄形成原因之一。McCully等[9]研究显示,HCY能够破坏血管内皮细胞,促进血小板聚集。但也有部分研究未提示HCY与支架内再狭窄相关[10-13]。国内存在零散研究,但均未能有效揭示HCY与支架内再狭窄的关系。
本研究分析显示,再狭窄组术后12~18个月HCY水平显著高于对照组,多因素分析提示HCY与支架内再狭窄有关,血脂和血糖与支架内再狭窄无关,可能与观察例数过少及患者观察时间较短(最短12个月)有关。另外,患者术后降糖和调脂药物干预亦有可能导致支架内再狭窄的发生率降低。提示,HCY水平与支架置入术后的支架内再狭窄有关,可能是支架内再狭窄发生的原因之一。另外,本研究观察随访人群中,支架内再狭窄的发生率为42.9%,远远高于药物洗脱支架置入后一年再狭窄发生率。分析其中原因主要考虑:(1)本院同期SAP单支病变置入支架的患者将近800例,1年后回院行冠状动脉造影的患者不到200例;(2)如患者没有症状基本不会再次行冠状动脉造影,因此研究结果高估支架内再狭窄发生率。
综上所述,HCY是心血管疾病强有力的预测因素,部分作用归结于HCY可增加炎性反应及促进平滑肌细胞增生。虽然目前研究对于HCY是否参与支架内再狭窄仍存在争议,但不可否认HCY的血管内皮损伤、诱发炎性反应及促进平滑肌细胞增殖效应,而后两者均参与支架内再狭窄的形成过程。本研究在相对大样本数据下发现HCY与支架内再狭窄存在相关性,对其进一步研究将有可能会为动脉粥样硬化的防治、降低支架术后再狭窄的发生率提供一个新的思路。另外,本研究为回顾性研究,严格纳入单支病变SAP患者,因此研究结果仅为特殊人群,现不可向以外人群推广,仍需要进一步在临床实践中开展随机对照研究予以证明。
[1] Niccoli G, Montone RA, Ferrante G, et al. The evolving role of inflammatory biomarkers in risk assessment after stent implantation. J Am Coll Cardiol, 2010, 56(22):1783-1793.
[2] Huang Y, Salu K, Wang L, et al. Use of a tacrolimus-eluting stent to inhibit neointimalhyperplasia in a porcine coronary model. J Invasive Cardiol, 2005, 17(3):142-148.
[3] Tsai JC, Perrella MA, Yoshizumi M, et al. Promotion of vascular smooth muscle cell growth by homocysteine: a link to atherosclerosis. Proc Natl Acad Sci, 1994, 91(14):6369-6373.
[4] 莫合塔伯尔·莫敏, 李建平, 张岩, 等. 急性冠状动脉综合征患者血浆同型半胱氨酸水平与左心室射血分数及心功能严重程度的相关性研究. 中国介入心脏病学杂志, 2015, 23(5): 246-253.
[5] 中华医学会心血管病分会,中华心血管病杂志编辑委员会.经皮冠状动脉介入治疗指南(2009).中华心血管病杂志,2009,37(1):4-25.
[6] Hu X, Wang Z, Wu H, et al. Ras ssDNA aptamer inhibits vascular smooth muscle cell proliferation and migration through MAPK and PI3K pathways. Int J Mol Med, 2015, 35(5):1355-1361.
[7] Poddar R, Sivasubramanian N, DiBello PM, et al. Homocysteine induces expression and secretion of monocyte chemoattractant protein-1 and interleukin-8 in human aortic endothelial cells: implications for vascular disease. Circulation, 2001,103(22): 2717-2723.
[8] Majors A, Ehrhart LA, Pezacka EH. Homocysteine as a risk factor for vascular disease: enhanced collagen production and accumulation by smooth muscle cells. Arterioscler Thromb Vasc Biol,1997, 17(10):2074-2081.
[9] McCully KS, Carvalho AC. Homocysteine thiolactone, N-homocysteine thiolactonyl retinamide, and platelet aggregation. Res Commun Chem Pathol Pharmacol, 1987,56(3): 349-360.
[10] Kosokabe T, Okumura K, Sone T, et al. Relation of a common methylenetetrahydrofolate reductase mutation and plasma homocysteine with intimal hyperplasia after coronary stenting. Circulation, 2001, 103(16): 2048-2054.
[11] Koch W, Ndrepepa G, Mehilli J, et al. Homocysteine status and polymorphisms of methylenetetrahydrofolate reductase are not associated with restenosis after stenting in coronary arteries. Arterioscler Thromb Vasc Biol, 2003, 23(12):2229-2234.
[12] Genser D, Prachar H, Hauer R, et al. Relation of homocysteine, vitamin B(12), and folate to coronary in-stent restenosis. Am J Cardiol, 2002, 89(5):495-499.
[13] Schnyder G, Roffi M, Flammer Y, et al. Association of plasma homocysteine with restenosis after percutaneous coronary angioplasty. Eur Heart J, 2002, 23(9): 726-733.
Association between homocysteine and in-stent restenosis after coronary stenting
CHENHan,WANGJiang-you.
DepartmentofCardiacSurgicalIntensiveCareUnit,WuhanAsiaHeartHospital,Wuhan430022,China
WANGJiang-you,Email:drwangjiangyou@163.com
Objective Mounting interest emerged about hyper homocystinemia as an independent risk factor for atherothrombotic disease, and several experimental studies have shown that it may affect in-stent restenosis. The purpose of the present study was to identify the relationship between the serum homocystine level and in-stent restenosis of patients with stable angina after coronary stenting. Methods The study population comprised 168 stable angina patients who underwent stent implantation with drug-eluting stents,including 96 patients without in-stent restenosis (the control group)and 72 patients with in-stent restenosis(the restenosis group).The level of serum homocystine was measured using the medical inspection center. Coronary angiography was performed immediately before and after stent implantation and 12-18 months later.Results Baseline characteristics including drug used after PCI were similar between the 2 groups.Serum homocystinelevel in patients of the control group were significantly lower than that in restenosis group [(11.68±3.54)μmol/Lvs. (18.54±4.39)μmol/L,P=0.012].The quantitative coronary angiography (QCA)showed that lesion length was similar between the 2 groups, minimumlumen diameter (MLD) and stenosis rate were also similar before and after stents implantation (allP>0.05). Restenosis rate [(33.24±12.52)%vs. (84.23±13.26)%,P=0.000] and late lumen less [(0.36±0.21)mmvs. (1.82±0.68)mm,P=0.000] were lower in the control group than in the restenosis group. Conclusions Higher serum homocystine level might be associated with in-stent restenosis after coronary stenting.
Stable angina;In-stent restenosis;Drug-eluting stent;Uric acid
10.3969/j.issn.1004-8812.2016.03.005
430022湖北武汉,武汉亚洲心脏病医院心脏外科ICU(陈涵),心内科(王江友)
王江友,Email:drwangjiangyou@163.com
R541.4
2015-10-13)
