短时间内经不同途径重复应用对比剂对患者肾功能的影响
2016-08-18张瑶田祥张旗甄利波耿巍刘倩梅杨颖宋达
张瑶 田祥 张旗 甄利波 耿巍 刘倩梅 杨颖 宋达
·临床研究·
短时间内经不同途径重复应用对比剂对患者肾功能的影响
张瑶田祥张旗甄利波耿巍刘倩梅杨颖宋达
目的探讨冠状动脉增强CT检查后1周内再次行冠状动脉造影(CAG)或经皮冠状动脉介入治疗(PCI)对患者肾功能的影响。方法选择就诊于保定市第一中心医院已行冠状动脉增强CT将进一步行CAG或PCI的患者258例,随机分为试验组132例和对照组126例,试验组为行冠状动脉增强CT检查后1周内再次行CAG或PCI,对照组的时间间隔为1~2周。监测两组患者术前和术后1、2、3 d血肌酸酐、胱抑素C水平,计算估算的肾小球滤过率(eGFR),并记录对比剂肾病(CIN)的发生率。结果两组患者的一般资料比较,差异均无统计学意义(均P>0.05)。两组患者间术前和术后1、2、3 d各时间点的血肌酸酐、胱抑素C、eGFR水平分别比较,差异均无统计学意义(均P>0.05)。试验组发生CIN 7例(5.3%),对照组发生CIN 6例(4.8%),两组比较,差异无统计学意义(P=0.843)。结论对于eGFR≥60 ml/(min·1.73 m2)的患者静脉应用对比剂行冠状动脉增强CT检查后1周内再次行CAG或PCI是安全可行的。
对比剂肾病;冠状动脉造影;经皮冠状动脉介入治疗
随着医学影像学及介入治疗的发展,接受增强影像、冠状动脉造影(coronary angiography,CAG)和经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)的患者不断增加,对比剂的临床应用日益广泛[1],而对比剂导致的肾损伤问题亦引起临床医师的极大关注。对比剂肾病(contrast induced nephropathy,CIN)是应用对比剂过程中的一种严重并发症,可能导致病死率升高、住院时间延长及住院费用增高等[1-2]。目前由于患者首次医疗接触单位、患者个体化及病情的差异,临床工作中存在短时间内重复应用对比剂的情况。而2011年欧洲泌尿生殖放射协会(ESUR)CIN指南[3]中对重复应用对比剂的最短时间间隔问题尚无明确定论,对静脉应用含碘对比剂后再次动脉应用所致肾功能损伤的情况亦未提及。本研究针对短时间内不同途径应用对比剂的安全性做进一步探索。
1 对象与方法
1.1研究对象
选取2014年11月至2015年8月就诊于保定市第一中心医院已行冠状动脉增强CT将进一步行CAG或PCI的患者258例。入选标准:(1)年龄≥18周岁;(2)有心绞痛症状,因冠状动脉增强CT结果不能满足诊断需要或冠状动脉存在严重狭窄,需进一步行CAG或PCI;(3)同意参加本研究并签署知情同意书。排除标准:(1)年龄≥75岁;(2)对含碘对比剂过敏;(3)血流动力学不稳定;(4)血肌酸酐(Scr)>1.5 mg/dl;(5)估算的肾小球滤过率(eGFR)<60 ml/(min·1.73 m2);(6)严重肝肾功能障碍;(7)近期曾使用大量肾毒性药物(氨基糖苷类抗生素、二甲双胍或其他明确的肾毒性药物);(8)怀疑左主干严重病变;(9)患者或家属拒绝参加本研究。由计算机产生随机序列,将符合入选标准的患者随机分为试验组132例和对照组126例。试验组为行冠状动脉增强CT检查后1周内[4(3,5)d]再次行CAG或PCI,对照组的时间间隔为1~2周[10(7,13)d]。本研究得到保定市第一中心医院伦理委员会的审核批准。
1.2方法
记录患者的临床资料,如年龄、性别、身高、体重、基础疾病、对比剂剂量,依据迈赫兰评分量表进行CIN危险因素的分层和评估[4-5](表1)。所有患者均使用同一种低渗性非离子型含碘对比剂[碘普罗胺注射液370(碘浓度370 mg/ml)]。静脉应用对比剂后嘱其口服补液,动脉应用对比剂造影前3~12 h至造影后6~24 h,持续静脉滴注生理盐水[1.0~1.5 ml/(kg·h)][6]。
1.3观察指标
所有患者均于术前和介入术后第1、2、3天抽取晨起空腹静脉血,进行Scr、胱抑素C检测。根据改良的简化MDRD公式计算eGFR:eGFR[ml/(min·1.73 m2)]=175×Scr(mg/dl)-1.154×年龄-0.203×(0.79女性)[6]。

表1 对比剂肾病危险因素评分量表
注:血肌酸酐1 mg/dl=88.4 μmol/L
1.4诊断标准
依据ESUR确定的CIN诊断标准[3]:使用对比剂后48~72 h,Scr绝对值升高≥0.5 mg/dl或较基础值升高≥25%,并排除其他原因的肾损伤。
1.5统计学分析
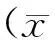
2 结果
2.1两组患者的一般资料比较
两组患者的性别、年龄、身高、体重,糖尿病、高血压病、高脂血症、轻度贫血、主动脉内球囊反搏(IABP)、慢性心力衰竭占比,对比剂用量,CAG+PCI占比、CIN风险评分等资料比较,差异均无统计学意义(均P>0.05,表2)。
2.2两组患者Scr的动态变化
两组患者间术前和术后1、2、3 d各时间点的Scr分别比较,差异均无统计学意义(均P>0.05);术后1、2、3 d的Scr与术前分别比较,差异均无统计学意义(均P>0.05,表3)。
2.3两组患者胱抑素C的动态变化
两组患者间术前和术后1、2、3 d各时间点的胱抑素C水平分别比较,差异均无统计学意义(均P>0.05);术后1、2、3 d的胱抑素C水平均较术前显著升高,差异均有统计学意义(均P<0.05,表4)。
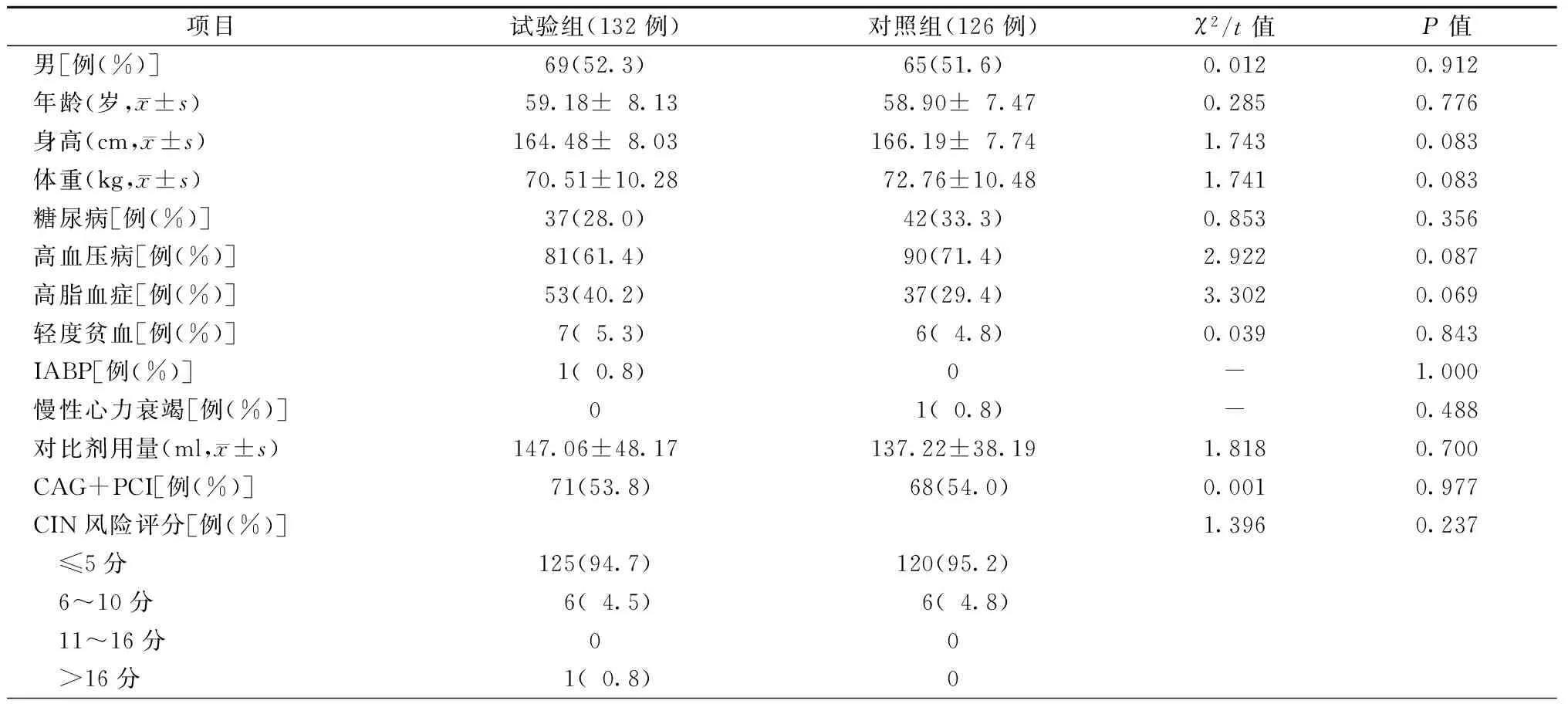
表2 两组患者的一般资料比较
注:“-”为使用Fisher确切概率法;IABP,主动脉内球囊反搏;CAG,冠状动脉造影;PCI,经皮冠状动脉介入治疗;CIN,对比剂肾病
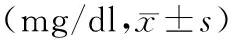
表3 两组患者的血肌酸酐值动态变化比较
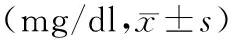
表4 两组患者的胱抑素C水平动态变化比较
注:a,与术前比较,P<0.05
2.4两组患者eGFR的动态变化
两组患者间术前和术后1、2、3 d各时间点的eGFR分别比较,差异均无统计学意义(均P>0.05);两组内术后1、2、3 d的eGFR与术前分别比较,差异均无统计学意义(均P>0.05,表5)。
2.5两组患者CIN的发病率及预后
试验组发生CIN 7例(5.3%),对照组发生CIN 6例(4.8%),两组CIN发生率比较,差异无统计学意义(P=0.843)。
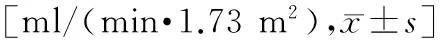
表5 两组患者估算的肾小球滤过率动态变化比较
3 讨论
CIN是指应用对比剂后引起的急性肾损伤,在基础肾功能正常的患者中发生率较低(0.6%~2.3%),但在具有危险因素的患者中发生率显著升高,可高达50%[7]。目前CIN已上升为仅次于肾血流灌注减少和肾毒性药物导致医源性肾功能衰竭的第三大原因(11.3%)[1,8]。CIN的发生是多因素共同作用的结果,具体的发病机制目前尚未完全阐明[6,9],可能的机制包括肾髓质的缺血缺氧和直接肾毒性等[10]。部分学者认为,导致对比剂的不良反应和CIN发生的重要因素是对比剂的渗透压、黏滞度及细胞毒性[6,11]。目前推荐的有效CIN预防措施为充分水化,尚无其他确切有效的预防药物[3,12]。
目前CIN的国际诊断标准仍广泛应用Scr,但部分学者认为其灵敏度偏低,试图寻找更准确的指标。胱抑素C是近年来研究较多,用于评价肾功能的一种新指标[13-14]。Briguori等[14]发现,慢性肾疾病的患者进行对比剂曝光后,胱抑素C是能够早期诊断CIN的一个可靠指标。该研究结果显示,介入术后胱抑素C水平较术前明显升高,而Scr的变化不明显,说明胱抑素C可以较早地评估使用对比剂后肾功能的状态。
在一项关于20 242例患者为期10年的回顾性研究中,对于Scr<1.5 mg/dl或eGFR>45 ml/(min·1.73 m2)的患者,静脉注射含碘对比剂后较对照组患者未发现明显肾毒性[15]。Katzberg等[16]研究发现,在慢性肾病患者中接受冠状动脉增强CT检查后CIN的发生率低至5%。Kim等[17]发现,基础eGFR分别为45~59、30~44和<30 ml/(min·1.73 m2)的患者行冠状动脉增强CT检查后CIN的发生率分别为0、2.9%和12.1%。经动脉途径应用对比剂行CAG或PCI,对比剂所致肾损伤的发生率明显升高,尤其是在慢性肾功能不全或糖尿病的人群中[3]。
接受CAG或PCI的患者均存在不同程度的CIN风险[1]。陈侃等[18]对532例行冠状动脉介入诊疗术的患者进行分析,发现冠状动脉介入诊疗术后CIN在非选择性患者中的发病率为5.5%。在一项1826例患者接受冠状动脉介入手术的研究中,CIN的独立预测因子是eGFR、糖尿病和对比剂剂量[1]。或许最可能的危险因素是基础肾功能的损害[3]。eGFR<60 ml/(min·1.73 m2)的患者更容易发生CIN[3,19]。静脉注射对比剂后,老年(年龄≥65岁)危重患者较年轻患者更易发生CIN[20]。同时有研究指出,在慢性肾功能不全患者中,CAG过程中对比剂用量与CIN的发生存在密切相关性,用量越大,CIN发生率越高[21]。著名的迈赫兰评分系统对CIN的危险因素进行了系统的评估及分层[5]。该评分系统包括低血压、IABP、慢性充血性心力衰竭、年龄>75岁、贫血、糖尿病、基础eGFR以及对比剂剂量等指标,随着分值的增高,CIN及透析的风险增加。
有研究指出,72 h内重复应用诊断剂量的对比剂是发生CIN的独立预测因子[22],临床实践中如有必要重复造影,建议两次时间间隔最好超过14 d[3,22],但具体的最优时间间隔仍不确定[3]。本研究从重复应用对比剂的时间间隔出发,探索在1周内经不同途径重复应用对比剂是否安全可行。结果发现,针对基础eGFR≥60 ml/(min·1.73 m2)的患者行冠状动脉增强CT检查后1周内再次行CAG或PCI后Scr、胱抑素C及eGFR水平与对照组比较无明显增高,同时CIN的发生率较对照组未见明显升高。
本研究存在的局限性:(1)本研究为小样本、单中心前瞻性研究,研究结果需更多临床试验进行检验;(2)纳入对象均无肾疾病且基础肾功能无明显损害[eGFR≥60 ml/(min·1.73 m2)],对存在基础肾疾病的患者不能做出进一步指导,需要进一步扩大样本量进行评价;(3)由于样本量较小,该研究对时间间隔没有进一步的分组,对于重复应用对比剂的最短时间间隔未进一步分析。
综上所述,对于eGFR≥60 ml/(min·1.73 m2)的患者静脉应用对比剂行冠状动脉增强CT检查后1周内进一步经动脉途径行CAG或PCI对肾功能的影响较小,在临床实践中是安全可行的。
[1] Seeliger E, Sendeski M, Rihal CS, et al. Contrast-induced kidney injury: mechanisms, risk factors, and prevention. Eur Heart J, 2012, 33(16):2007-2015.
[2] Ribichini F, Gambaro G, Graziani MS, et al. Comparison of serum creatinine and cystatin C for early diagnosis of contrast-induced nephropathy after coronary angiography and interventions. Clin Chem, 2012, 58(2):458-464.
[3] Stacul F, van der Molen AJ, Reimer P, et al. Contrast induced nephropathy: updated ESUR Contrast Media Safety Committee guidelines. Eur Radiol, 2011, 21(12):2527-2541.
[4] Ebru AE, Kilic A, Korkmaz FS, et al. Is cystatin-C superior to creatinine in the early diagnosis of contrast-induced nephropathy: a potential new biomarker for an old complication. J Postgrad Med, 2014, 60(2):135-140.
[5] Mehran R, Aymong ED, Nikolsky E, et al. A simple risk score for prediction of contrast-induced nephropathy after percutaneous coronary intervention: development and initial validation. J Am Coll Cardiol, 2004, 44(7):1393-1399.
[6] 中华医学会心血管病学分会, 中华心血管病杂志编辑委员会. 含碘对比剂在心血管疾病中临床应用的专家共识(2012). 中华心血管病杂志, 2013, 41(2):94-98.
[7] Neyra JA, Shah S, Mooney R, et al. Contrast-induced acute kidney injury following coronary angiography: a cohort study of hospitalized patients with or without chronic kidney disease. Nephrol Dial Transplant, 2013, 28(6):1463-1471.
[8] Nash K, Hafeez A, Hou S. Hospital-acquired renal insufficiency. Am J Kidney Dis, 2002, 39(5):930-936.
[9] Bucher AM, De Cecco CN, Schoepf UJ, et al. Is contrast medium osmolality a causal factor for contrast-induced nephropathy. Biomed Res Int, 2014, 2014:931413.
[10] Geng W, Fu XH, Gu XS, et al. Preventive effects of anisodamine against contrast-induced nephropathy in type 2 diabetics with renal insufficiency undergoing coronary angiography or angioplasty. Chin Med J (Engl), 2012, 125(19):3368-3372.
[11] 陈韵岱, 陈纪言, 傅国胜, 等. 碘对比剂血管造影应用相关不良反应中国专家共识. 中国介入心脏病学杂志, 2014, 22(6):341-348.
[12] Khwaja A. KDIGO clinical practice guidelines for acute kidney injury. Nephron Clin Pract, 2012,120(4):c179-184.
[13] Kim GS, Ko YG, Shin DH, et al. Elevated serum cystatin C level is an independent predictor of contrast-induced nephropathy and adverse outcomes in patients with peripheral artery disease undergoing endovascular therapy. J Vasc Surg, 2015, 61(5):1223-1230.
[14] Briguori C, Visconti G, Rivera NV, et al. Cystatin C and contrast-induced acute kidney injury. Circulation, 2010, 121(19):2117-2122.
[15] Andreucci M, Faga T, Pisani A, et al. Prevention of contrast-induced nephropathy through a knowledge of its pathogenesis and risk factors. Scientific World Journal, 2014, 2014:823169.
[16] Katzberg RW, Lamba R. Contrast-induced nephropathy after intravenous administration: fact or fiction. Radiol Clin North Am, 2009, 47(5):789-800.
[17] Kim SM, Cha RH, Lee JP, et al. Incidence and outcomes of contrast-induced nephropathy after computed tomography in patients with CKD: a quality improvement report. Am J Kidney Dis, 2010, 55(6):1018-1025.
[18] 陈侃, 钱菊英, 葛雷, 等. 冠状动脉介入诊疗术对肾功能影响的532例分析. 中国介入心脏病学杂志, 2009, 17(3): 153-156.
[19] Calvin AD, Misra S, Pflueger A. Contrast-induced acute kidney injury and diabetic nephropathy. Nat Rev Nephrol, 2010, 6(11):679-688.
[20] Palli E, Makris D, Papanikolaou J, et al. Contrast-induced nephropathy in aged critically ill patients. Oxid Med Cell Longev, 2014, 2014:756469.
[21] Kane GC, Doyle BJ, Lerman A, et al. Ultra-low contrast volumes reduce rates of contrast-induced nephropathy in patients with chronic kidney disease undergoing coronary angiography. J Am Coll Cardiol, 2008, 51(1):89-90.
[22] 中华医学会放射学分会对比剂安全使用工作组. 碘对比剂使用指南(第2版). 中华放射学杂志, 2013, 47(10):869-872.
The impact of repeated application of contrast media on renal function within a short period of time in different occasions
ZHANGYao,TIANXiang,ZHANGQi,ZHENLi-bo,GENGWei,LIUQian-mei,YANGYing,SONGDa.
DepartmentofCardiology,theFirstCentralHospitalofBaoding,Baoding071000,China
TIANXiang,Email: 15903126523@163.com
ObjectiveTo discuss the impact of repeated contrast media exposure on renal function in patients whon=132, patients had CAG/PCI within 1 week after CTA) and the control group (n=126, patients had CAG/PCI 1-2 weeks after CTA). Serum creatinine, cystatin C and estimated GFR were tested before and on day 1, 2 and 3 after procedures. The occurance of contrast-induced nephropathy (CIN) was recorded. ResultsThe baseline clinical characteristics of the patients between the two groups had no significant difference. Preoperative and postoperative serum creatinine, cystatin C and eGFR values on day 1, 2 and 3 had no significant difference between the two groups (allP>0.05). There was no significant difference in the incidence of CIN between two groups (5.3% in the study groupvs. 4.8% in the control group,P>0.05). ConclusionsIt is safe and feasible for patients with eGFR≥60 ml/(min·1.73 m2) to undergo CAG or PCI within 1 week after coronary CTA.
coronary angiography (CAG) or percutaneous coronary intervention (PCI) within 1 week after CTA of coronary ateries. MethodsA total of 258 patients who
CAG or PCI after coronary CTA were divided into the study group (
Contrast-induced nephropathy;Coronary angiography;Percutaneous coronary intervention
10.3969/j.issn.1004-8812.2016.03.006
071000河北保定,保定市第一中心医院心内科(张瑶、田祥、张旗、甄利波、耿巍、刘倩梅、杨颖、宋达);河北承德,承德医学院(张瑶)
田祥,Email:15903126523@163.com
R692.5R541.4
2015-10-14)
