生物电阻抗法测量的内脏脂肪面积与性别年龄及代谢性因素的相关性分析
2016-08-18杨帆李康杨颖张岩龚艳君马为蒋捷霍勇
杨帆 李康 杨颖 张岩 龚艳君 马为 蒋捷 霍勇
·临床研究·
生物电阻抗法测量的内脏脂肪面积与性别年龄及代谢性因素的相关性分析
杨帆李康杨颖张岩龚艳君马为蒋捷霍勇
目的探索生物电阻抗法测量的内脏脂肪面积(visceral fat area,VFA)在不同性别、年龄患者中的分布特点及其与代谢性因素的相关性。方法入选2014年8—10月在北京大学第一医院心内科住院的患者72例,采用欧姆龙DUALSCAN HDS-2000装置测量VFA和皮下脂肪面积(subcutaneous fat area,SFA),比较不同性别、年龄患者间VFA的差异,分析VFA与代谢性因素的相关性。结果男性患者的VFA显著高于女性患者[(114.04±38.27)cm2比(92.09±30.57)cm2,P=0.019],而SFA显著低于女性患者[(223.92±73.58)cm2比(270.35±82.13)cm2,P=0.019],差异均有统计学意义;不同年龄段间VFA比较,差异均无统计学意义(P=0.582)。Pearson分析显示,VFA与体质量指数(r=0.748,P<0.001)、腰臀比(r=0.577,P<0.001)、腹围(r=0.752,P<0.001)及糖化血红蛋白(r=0.413,P=0.001)呈正相关;无论男性患者(r= 0.777,P<0.001)还是女性患者(r= 0.601,P=0.002),SFA与VFA均呈正相关。结论生物电阻抗法测量的VFA及SFA存在性别差异,VFA可能与血糖水平以及糖尿病相关。
内脏脂肪面积;生物电阻抗法;代谢性因素
肥胖与高血压病、糖尿病、脂代谢紊乱、高尿酸血症及动脉粥样硬化性疾病的关系十分密切。有研究发现,这些疾病的发生不但与人体总的脂肪含量增加有关,与内脏脂肪含量的增加也密切相关[1-3]。通常意义上的“内脏脂肪”是指腹部脂肪。目前已有多项研究显示了腹部脂肪与动脉粥样硬化的相关性。Framingham研究发现,腹部CT扫描所测得的腹部脂肪体积与心血管疾病发病率相关[4]。另一项研究也表明,男性腹部脂肪与颈动脉粥样硬化具有良好相关性[5]。而在冠心病患者中,冠状动脉多支病变患者的内脏脂肪体积高于单支病变患者[6],这提示内脏脂肪可作为动脉粥样硬化的替代指标。部分研究结果还显示,内脏脂肪与远期心血管事件的发生相关[7]。局部脂肪含量的测量方法主要包括人体测量法、双能X线法、超声、腹部CT和核磁共振成像等[8-11]。其中人体测量和双能X线法并不能准确测定内脏脂肪含量,而腹部超声则存在可重复性差的缺点,腹部CT、核磁共振成像可准确反映内脏脂肪含量多少,但也存在辐射和检查费用昂贵等缺点。目前,国内仅有少部分研究采用定量CT进行内脏脂肪含量的测量,并对腹部脂肪分布的相关因素进行分析,发现内脏脂肪面积(visceral fat area,VFA)与血糖、血脂存在相关性[10-11]。
DUALSCAN仪器通过物理测量测出经脐平面的腹部横断面积,然后通过连接在肢体和躯干上的两组电极分别对人体施加微小电流,检测电极之间的生物阻抗,从而计算出非脂肪组织面积和皮下脂肪面积(subcutaneous fat area,SFA),最后算出VFA(VFA=腹部横断面积-非脂肪面积-SFA)。已有研究证实DUALSCAN与CT扫描测得的内脏脂肪体积具有良好的相关性[12],并具有简捷、无创、可重复的优点。本研究拟通过DUALSCAN仪器进行VFA的测量,并探讨VFA在人群中的分布特点及其相关因素。
1 对象与方法
1.1研究对象
本研究连续纳入2014年8—10月在北京大学第一医院心内科住院治疗的患者共72例。纳入标准:(1)年龄在30~90岁;(2)性别不限;(3)同意接受DUALSCAN无创检测。排除标准:(1)心脑血管病急性期(急性冠状动脉综合征、急性脑血管病);(2)症状性心力衰竭;(3)肢体残疾;(4)水肿;(5)人工永久起搏器植入术后;(6)血液透析或腹膜透析。
1.2研究方法
1.2.1收集资料记录所有患者的基线资料,包括年龄、性别,高血压病、糖尿病、脂代谢紊乱、慢性肾病、吸烟情况等。
1.2.2体格及生化检查内脏脂肪测量当日对所有患者的身高、体重、体质量指数(BMI)、腰围、臀围、腹围、腰臀比(waist-to-hip ratio,WHR)等指标进行测量,同时测量血压,共测量3次,结果取平均值。采用入院时第1次抽血检测结果,包括空腹血糖、糖化血红蛋白(HbA1c)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC)、三酰甘油(TG)、血肌酸酐(Cr)、超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)、白细胞计数(WBC)、血红白蛋(Hb)、血小板计数(PLT)等血液生化检查指标。1.2.3内脏脂肪测量使用欧姆龙DUALSCAN HDS-2000装置测量内脏脂肪,所有患者空腹至少8 h,检查前有便意或尿意的患者先排便、排尿后再进行测量。患者取仰卧位,确保安静状态,然后由专门的操作人员按照DUALSCAN HDS-2000的操作说明对VFA及SFA进行规范测量。计算VFA与SFA的比率(visceral to subcutaneous fat area ratio,VSR)。
1.3统计学分析
2 结果
2.1基线资料
72例患者中,男49例(68.1%),年龄31~85(60.31±11.23)岁。其中吸烟患者22例(30.6%),合并高血压病48例(66.7%)、糖尿病21例(29.2%)、脂代谢紊乱42例(58.3%)、脑血管疾病12例(16.7%)、外周血管疾病11例(15.3%)及慢性肾病4例(5.6%)。BMI水平18.6~38.8(26.9±3.9)kg/m2,其中BMI≥25 kg/m2(超重)的患者48例(66.7%),BMI≥28 kg/m2(肥胖)的患者25例(34.7%)。VFA 25.00~193.00(107.03±37.23)cm2,SFA 68.00~466.00(238.75±78.90)cm2,VSR 0.140~0.800(0.467±0.145)。
2.2性别与脂肪分布
不同性别患者基线资料的比较见表1。男性患者吸烟比例(40.8%比8.7%,P=0.006)、身高[(169.33±5.76)cm比(156.35±6.56)cm,P<0.001]、体重[(76.16±11.30)kg比(67.36±12.06)kg,P=0.004]、WHR[(0.95±0.05)比(0.90±0.06),P<0.001]、Cr[(88.37±16.77)μmol/L比(75.37±23.12)μmol/L,P=0.009]及Hb[(144.9±17.6)g/L比(128.8±13.1)g/L,P<0.001]显著高于女性患者,差异均有统计学意义;而HDL-C水平显著低于女性患者[(0.94±0.20)mmol/L比(1.09±0.21)mmol/L),P=0.005],差异有统计学意义。不同性别患者高血压病、糖尿病、脂代谢紊乱、慢性肾病、脑血管疾病、外周血管病、BMI、腰围、臀围、腹围、收缩压、舒张压、WBC、PLT、TG、TC、LDL-C等比较,差异均无统计学意义(均P>0.05)。
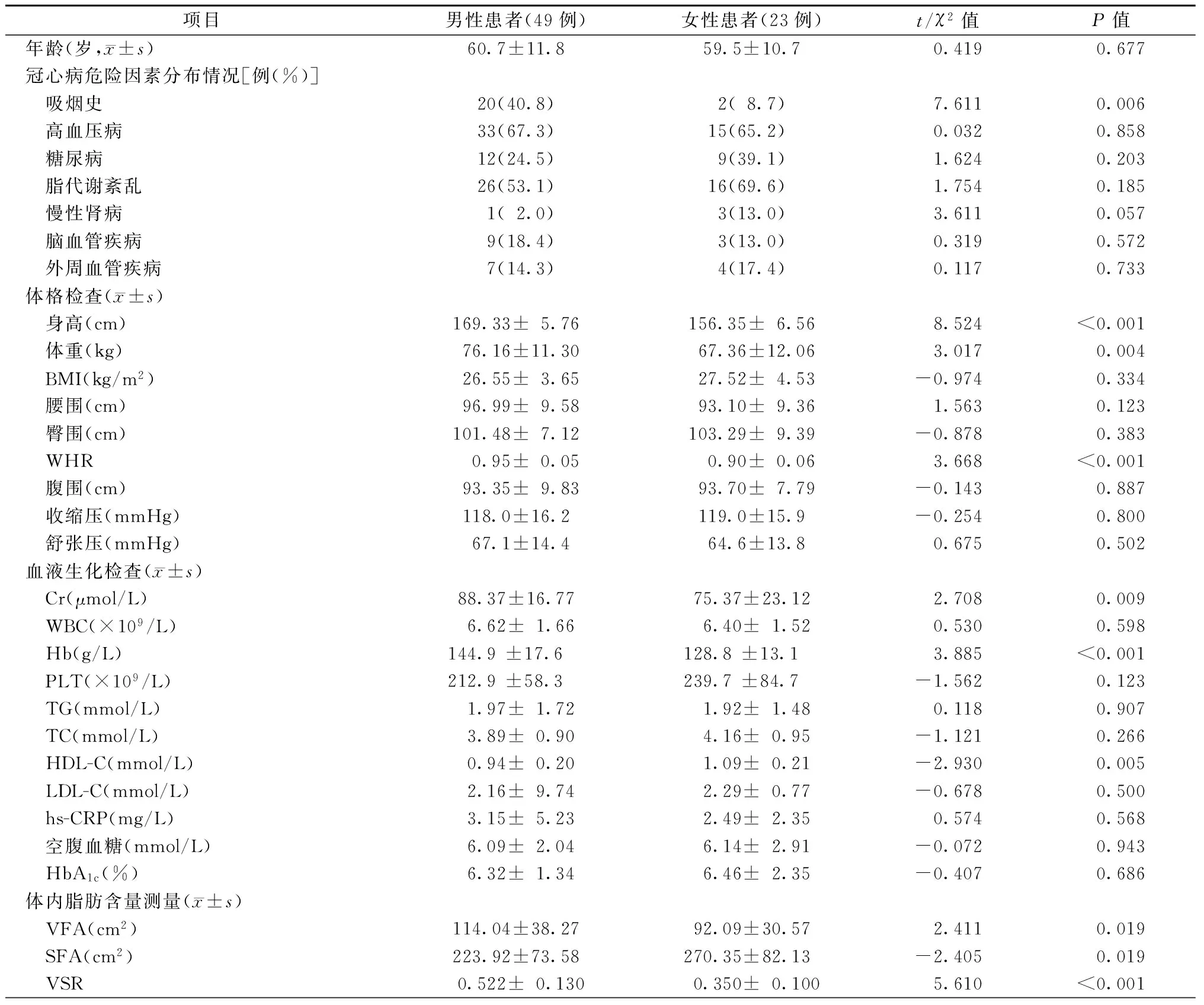
表1 基线资料
注:BMI,体质量指数;WHR,腰臀比;Cr,血肌酸酐;WBC,白细胞计数;Hb,血红蛋白;PLT,血小板计数;TG,三酰甘油;TC,总胆固醇;HDL-C,高密度脂蛋白胆固醇;LDL-C,低密度脂蛋白胆固醇;hs-CRP,超敏C反应蛋白;HbA1c,糖化血红蛋白;VFA,内脏脂肪面积;SFA,皮下脂肪面积;VSR,内脏脂肪面积与皮下脂肪面积的比率;1 mmHg=0.133 kPa
本研究发现,男性患者的VFA[(114.04±38.27)cm2比(92.09±30.57)cm2,P=0.019]、VSR[(0.522±0.130)比(0.350±0.100),P<0.001]显著高于女性患者,差异均有统计学意义;而SFA显著低于女性患者[(223.92±73.58)cm2比(270.35±82.13)cm2,P=0.019],差异亦有统计学意义。Pearson分析显示,SFA与VFA呈正相关(r=0.586,P<0.001),无论是男性患者(r= 0.777,P<0.001)还是女性患者(r= 0.601,P=0.002),SFA都与VFA呈正相关(图1~3)。
2.3年龄与脂肪分布
根据世界卫生组织(WHO)年龄段划分标准,将所有患者分为4组:44岁以下为青年患者,45~59岁为中年患者,60~74岁为年轻老人患者,75~90岁为老年人患者。各组间BMI、VFA、SFA、VSR比较,差异均无统计学意义(均P>0.05,表2)。
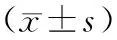
表2 年龄与脂肪分布
注:BMI,体质量指数;VFA,内脏脂肪面积;SFA,皮下脂肪面积;VSR,内脏脂肪面积与皮下脂肪面积的比率
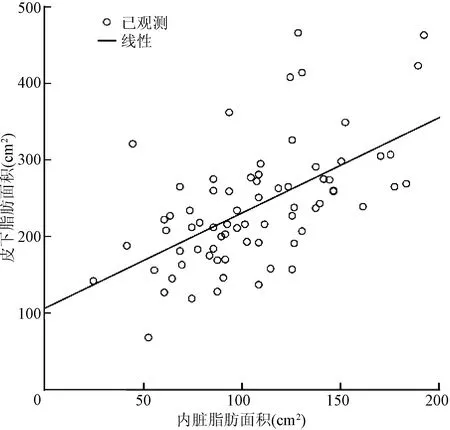
图1 72例患者皮下脂肪面积与内脏脂肪面积的相关性
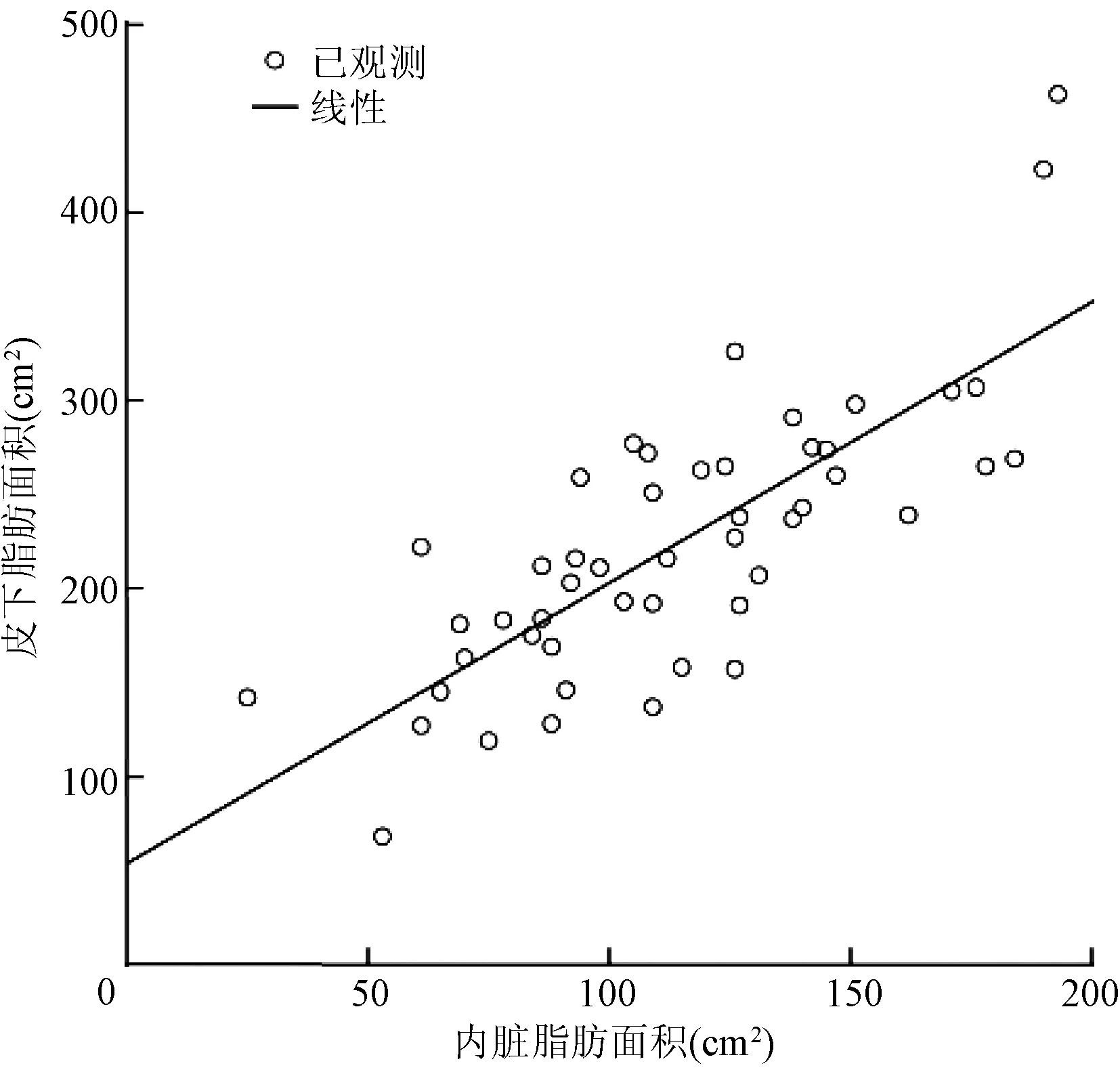
图2 49例男性患者皮下脂肪面积与内脏脂肪面积的相关性
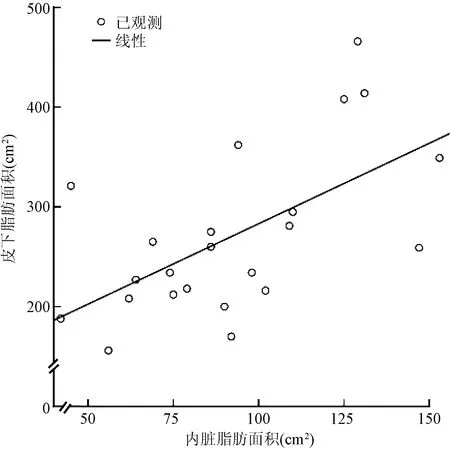
图3 23例女性患者皮下脂肪面积与内脏脂肪面积的相关性
2.4内脏脂肪与代谢性因素
根据VFA测量结果将患者分为两组:VFA正常组(VFA<100 cm2)和VFA增多组(VFA≥100 cm2)[13]。与VFA正常组比较,VFA增多组中男性患者比例(78.9% 比55.9%,P=0.036)、SFA[(273.87±78.79)cm2比(199.50±58.53)cm2,P<0.001]、VSR[(0.520±0.128)比(0.407±0.140),P=0.001]、BMI[(29.19±3.62)kg/m2比(24.25±2.33)kg/m2,P<0.001]、WHR[(0.97±0.05)比(0.91±0.05),P<0.001]、hs-CRP[(4.34±5.74)mg/L比(1.41±1.47)mg/L,P=0.005]、空腹血糖[(6.68±2.92)mmol/L比(5.46±1.17)mmol/L,P=0.026]及HbA1c[(6.81±1.61)%比(5.95±0.58)%,P=0.010]等显著增高,差异有统计学意义;PLT[(204.2±52.6)×109/L比(240.5±79.1)×109/L,P=0.025]显著降低,差异亦有统计学意义;而身高、血压、Cr、WBC、HB、TG、TC、HDL-C、LDL-C等比较,差异均无统计学意义(均P>0.05,表3)。
为探索VFA潜在的相关因素,将上述存在组间显著差异的指标分别与VFA进行Pearson相关性分析,结果显示,VFA与BMI、WHR、腹围及HbA1c有相关性;调整年龄、性别及BMI后,VFA与WHR、腹围及HbA1c仍具有良好的相关性(表4)。偏相关性分析显示,VFA与BMI(r=0.748,P<0.001)、WHR(r=0.577,P<0.001)、腹围(r=0.752,P<0.001)及HbA1c(r=0.413,P=0.001)呈正相关(图4~7)。
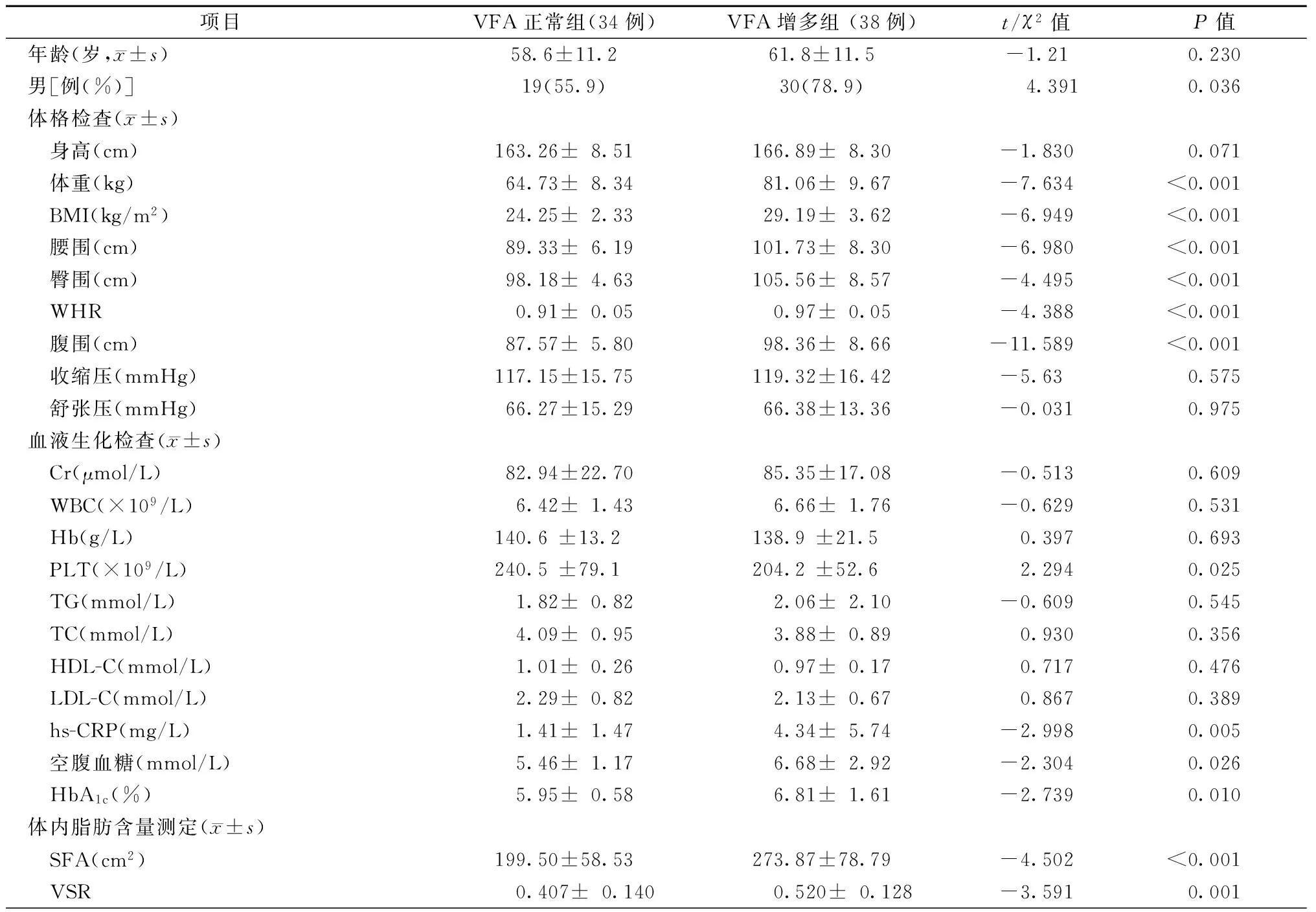
表3 VFA正常组及VFA增多组之间临床资料比较
注:BMI,体质量指数;WHR,腰臀比;Cr,血肌酸酐;WBC,白细胞计数;Hb,血红蛋白;PLT,血小板计数;TG,三酰甘油;TC,总胆固醇;HDL-C,高密度脂蛋白胆固醇;LDL-C,低密度脂蛋白胆固醇;hs-CRP,超敏C反应蛋白;HbA1c,糖化血红蛋白;VFA,内脏脂肪面积;SFA,皮下脂肪面积;VSR,内脏脂肪面积与皮下脂肪面积的比率;VFA正常组,VFA<100 cm2;VFA增多组,VFA≥100 cm2;1 mmHg=0.133 kPa
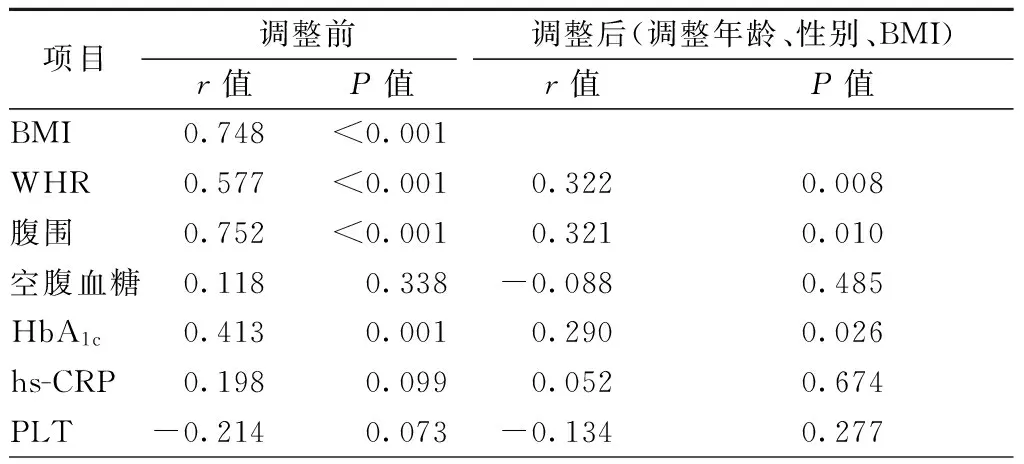
表4 VFA及其相关因素
注:BMI,体质量指数;WHR,腰臀比;HbA1c,糖化血红蛋白;hs-CRP,超敏C反应蛋白;PLT,血小板计数;VFA,内脏脂肪面积
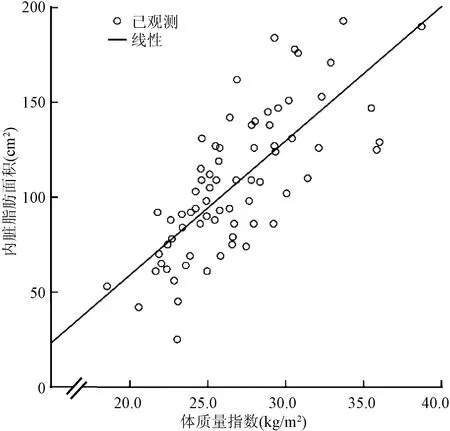
图4 内脏脂肪面积与体质量指数的相关性
2.5内脏脂肪与代谢综合征
根据2004年中华医学会糖尿病学分会建议的代谢综合征诊断标准[14],将72例患者分为非代谢综合征组(41例)和代谢综合征组(31例),对两组患者的脂肪分布进行比较。结果显示,代谢综合征组患者VFA[(125.45±30.24)cm2比(93.10±36.23)cm2,P<0.001]及SFA[(278.16±76.96)cm2比(208.95±67.00)cm2,P<0.001]显著高于非代谢综合征组,差异有统计学意义;而两组患者间年龄、性别、VSR比较,差异均无统计学意义(均P>0.05,表5)。
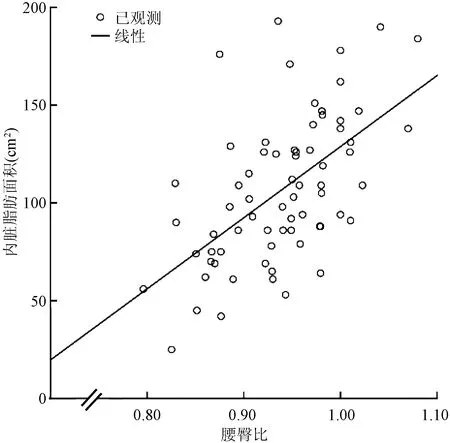
图5 内脏脂肪面积与腰臀比的相关性
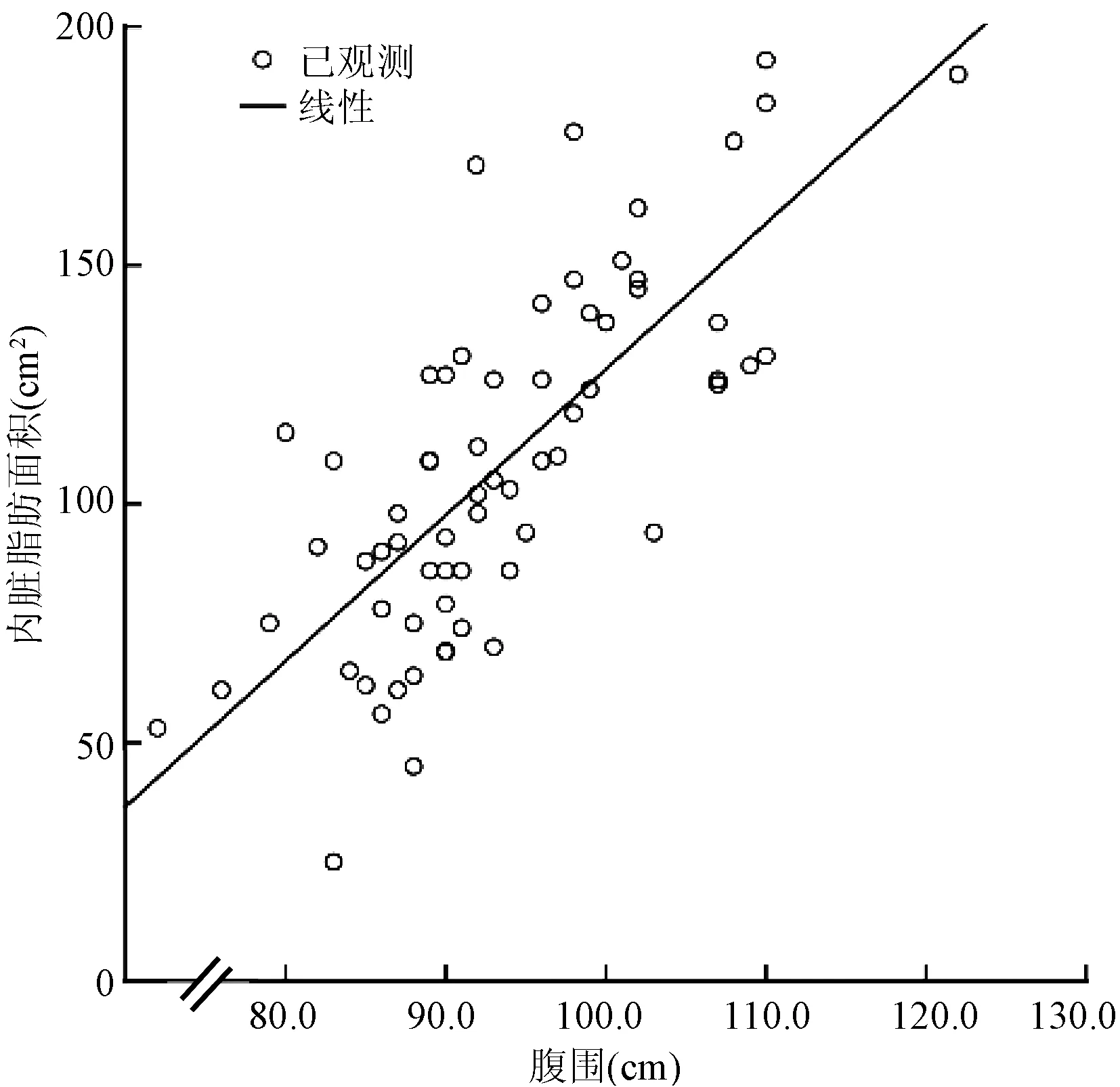
图6 内脏脂肪面积与腹围的相关性

图7 内脏脂肪面积与糖化血红蛋白的相关性
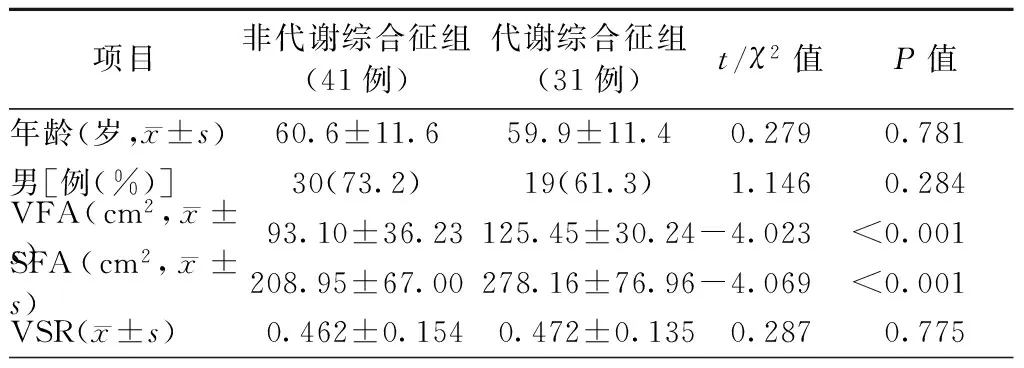
表5 代谢综合征与脂肪分布
注:VFA,内脏脂肪面积;SFA,皮下脂肪面积;VSR,内脏脂肪面积与皮下脂肪面积的比率
3 讨论
本研究中有2/3患者超重(BMI≥25 kg/m2),1/5患者达到肥胖诊断标准(BMI≥28 kg/m2)。同时超过1/2患者(38例)VFA增多(≥100 cm2),大部分患者的WHR及腹围都超过正常值。这在部分程度上反映出我国心血管疾病患者中超重及肥胖的发生率较高,并且体脂分布与西方人群有所不同,中心性肥胖的发生率较高[15]。
研究结果还显示,不同性别患者间BMI差异无统计学意义,但在脂肪分布上不同性别间存在较大差异,男性患者的VFA显著高于女性患者,而SFA显著低于女性患者。脂肪在人体中的含量和分布是存在性别差异的。通常正常成年男性的脂肪含量约占体重的15%,总体上女性的脂肪含量相对较高,占体重的22%。一般认为脂肪含量在男性超过25%,女性超过30%即为肥胖[16]。男性的脂肪更容易积累在身体中心(包括内脏脂肪和腹部皮下),而女性的脂肪更容易积累在臀部及双侧股部的皮下[17],这与本研究的结果相一致。造成不同性别之间脂肪含量和分布差异的影响因素尚不明确,可能与不同的性激素水平相关,但具体机制尚不清楚[18-19]。男性患者动脉粥样硬化性疾病的发病率高于女性患者,可能与男性内脏脂肪高于女性有关,内脏脂肪有更强的致动脉粥样硬化作用[20-22]。值得注意的是,无论是男性还是女性VFA和SFA之间呈显著正相关,提示在体内脂肪含量增多时,内脏脂肪含量及皮下脂肪含量均会有所增加。
既往研究显示,内脏脂肪含量随着年龄的增长而增长,而且随着年龄的增长,脂肪更容易积累在身体中心部位,如内脏和腹部皮下等[23]。老年女性与青年女性相比,在BMI差异无统计学意义时,老年人的内脏脂肪和皮下脂肪比显著增高,内脏脂肪的量也增加[24-25]。而本研究结果则显示,不同年龄段患者的BMI、VFA及SFA差异无统计学意义,并未观察到类似的规律。推测可能的原因有:(1)本研究样本量相对较小,鉴于目前DUALSCAN测量的精确程度有限,难以显示其中规律;(2)本研究中年龄分层参考WHO年龄分段标准,与既往研究中年龄分层标准有所不同[25]。
本研究中根据内脏脂肪含量的多少,以100 cm2为界值,将患者分为内脏脂肪正常组和内脏脂肪增多组。对两组患者比较结果显示,内脏脂肪增多组体重、BMI、腰围、臀围、WHR、腹围、hs-CRP,空腹血糖及HbA1c等指标均显著高于内脏脂肪正常组;而在身高、血压及血脂水平等方面,两组间差异无统计学意义。进一步的相关性分析则显示,VFA与BMI、WHR、腹围及HbA1c均呈正相关,提示BMI、WHR、腹围作为简易的测量手段也可以在一定程度上反映内脏脂肪含量的多少。也提示VFA可能与血糖水平和糖尿病的发生存在联系。随着肥胖的进展,脂肪组织开始出现功能失调,尤其是血液中游离脂肪酸(free fatty acid,FFA)的升高和脂肪素合成水平的变化在高血压病、糖尿病、高尿酸血症等肥胖相关代谢疾病的发病中起重要作用[26]。FFA能够刺激胰腺分泌胰岛素,减少肌肉和肝对胰岛素的敏感性,刺激肝合成的极低密度脂蛋白(very low-density lipoprotein,VLDL)分泌。而内脏脂肪容易分解产生FFA,并可以将产生的FFA直接作用于肝,因此内脏脂肪的增多更容易导致肥胖相关代谢疾病的产生[27-28]。有研究显示,内脏脂肪增多患者血糖水平高于皮下脂肪增多患者,提示腹内脂肪对糖代谢的影响较皮下脂肪更为显著[29]。多项研究结果也提示,内脏脂肪含量与2型糖尿病及胰岛素抵抗存在相关关系[30-32]。与本研究中VFA与HbA1c呈正相关的结果相一致。相关研究也表明,内脏脂肪增多的人群血压水平及TG、LDL-C等血脂水平显著高于内脏脂肪正常人群[31-32]。Kang等[33]通过生物电阻抗法对24 791例志愿者进行VFA测量,结果显示男性VFA高于女性,VFA与糖尿病、高血压病的发病率相关,并与WHR、BMI、空腹血糖、TC、TG及尿酸等代谢指标相关。而本研究中内脏脂肪增多组与内脏脂肪正常组间血压及血脂水平差异无统计学意义。但本研究为单中心研究,样本数量有限,同时受到药物治疗影响,结果可能存在一定的偏倚,需进一步研究验证。
[1] Lee MJ, Wu Y, Fried SK. Adipose tissue heterogeneity: implication of depot differences in adipose tissue for obesity complications. Mol Aspects Med,2013,34(1):1-11.
[2] Smith SR, Lovejoy JC, Greenway F, et al. Contributions of total body fat, abdominal subcutaneous adipose tissue compartments, and visceral adipose tissue to the metabolic complications of obesity. Metabolism,2001,50(4):425-435.
[3] Nguyen-Duy TB, Nichaman MZ, Church TS, et al. Visceral fat and liver fat are independent predictors of metabolic risk factors in men. Am J Physiol Endocrinol Metab,2003, 284(6):E1065-E1071.
[4] Mahabadi AA, Massaro JM, Rosito GA, et al. Association of pericardial fat, intrathoracic fat, and visceral abdominal fat with cardiovascular disease burden: the Framingham Heart Study. Eur Heart J,2009,30(7):850-856.
[5] Lear SA, Humphries KH, Kohli S, et al. Visceral adipose tissue, a potential risk factor for carotid atherosclerosis: results of the Multicultural Community Health Assessment Trial (M-CHAT). Stroke,2007,38(9):2422-2429.
[6] Lee YH, Lee SH, Jung ES, et al. Visceral adiposity and the severity of coronary artery disease in middle-aged subjects with normal waist circumference and its relation with lipocalin-2 and MCP-1. Atherosclerosis,2010,213(2):592-597.
[7] Britton KA, Massaro JM, Murabito JM, et al. Body fat distribution, incident cardiovascular disease, cancer, and all-cause mortality. J Am Coll Cardiol,2013,62(10):921-925.
[8] 王继红, 程晓光, 徐黎,等. 体脂分布与血脂代谢的相关性研究. 心肺血管病杂志, 2011, 30(3):229-231.
[9] 王继红, 张源, 赵兴山,等. 双能X线吸收法对体脂测量的应用. 中国循环杂志, 2011, 26(3):212-215.
[10] 娄路馨, 王玲, 李娜,等. 定量CT测量的腹部脂肪分布与血脂和血糖的关系. 中国骨质疏松杂志, 2012, 18(11):1004-1007.
[11] 王玲, 汪伟, 邓微,等. 定量CT测量腹部脂肪面积及分布的重复性研究. 中国骨质疏松杂志, 2012, 18(11):999-1003.
[12] Pietiläinen KH, Kaye S, Karmi A, et al. Agreement of bioelectrical impedance with dual-energy X-ray absorptiometry and MRI to estimate changes in body fat, skeletal muscle and visceral fat during a 12-month weight loss intervention. Br J Nutr,2013,109(10):1910-1906.
[13] Examination Committee of Criteria for ‘Obesity Disease’ in Japan; Japan Society for the Study of Obesity. New criteria for ‘obesity disease’ in Japan.Circ J, 2002,66(11):987-992.
[14] 中华医学会糖尿病学分会代谢综合征研究协作组. 中华医学会糖尿病学分会关于代谢综合征的建议. 中国糖尿病杂志, 2004, 12(3):156-161.
[15] 陈春明. 肥胖问题——我国公共卫生的新挑战.中华流行病学杂志, 2002,23(1):1-2.
[16] Kruger R, Shultz SP, McNaughton SA, et al. Predictors and risks of body fat profiles in young New Zealand European, Māori and Pacific women: study protocol for the women′s EXPLORE study.Springerplus, 2015,4:128.
[17] Geer EB, Shen W. Gender differences in insulin resistance, body composition, and energy balance. Gend Med, 2009,6 Suppl 1:60-75.
[18] Escobar-Morreale HF, San Millán JL. Abdominal adiposity and the polycystic ovary syndrome. Trends Endocrinol Metab, 2007,18(7):266-272.
[19] Allan CA, McLachlan RI. Androgens and obesity.Curr Opin Endocrinol Diabetes Obes,2010,17(3):224-232.
[20] Karastergiou K, Smith SR, Greenberg AS. Sex differences in human adipose tissues - the biology of pear shape. Biol Sex Differ,2012, 3(1):13.
[21] VAGUE J. The degree of masculine differentiation of obesities: a factor determining predisposition to diabetes, atherosclerosis, gout, and uric calculous disease. Am J Clin Nutr,1956,4(1):20-34.
[22] 李康,霍勇.内脏脂肪与动脉粥样硬化.中国介入心脏病学杂志,2014,22(12):801-802.
[23] Kuk JL, Saunders TJ, Davidson LE, et al. Age-related changes in total and regional fat distribution. Ageing Res Rev,2009,8(4):339-348.
[24] 李家文. 年龄、性别及肥胖等因素对人体内脂肪分布的影响. 中国社会医学杂志, 1991, 3(3):131-132.
[25] 冉兴无, 李晓松, 童南伟, 等. 中国肥胖人群体脂分布特点及其与心血管危险因素的关系. 四川大学学报:医学版, 2004, 35(5):699-703.
[26] Foster MT,Pagliassotti MJ. Metabolic alterations following visceral fat removal and expansion: Beyond anatomic location. Adipocyte,2012, 1(4): 192-199.
[27] Lee MJ, Wu Y, Fried SK. Adipose tissue heterogeneity: implication of depot differences in adipose tissue for obesity complications. Mol Aspects Med, 2013 ,34(1):1-11.
[28] Yamashita S, Nakamura T, Shimomura I, et al. Insulin resistance and body fat distribution. Diabetes Care, 1996,19(3):287-291.
[29] 邹大进, 吴鸿. 肥胖症及脂代谢紊乱的诊断. 国际内分泌代谢杂志, 2006, 26(1):1-4.
[30] 任颖, 刘伟, 陆广华, 等. 2型糖尿病病人的内脏脂肪性肥胖和胰岛素抵抗. 中国糖尿病杂志, 2003, 11(2):84-87.
[31] 谭擎缨, 姚佳琦, 王秀景, 等. 腹腔内脏脂肪面积与2型糖尿病及血清胰岛素的相关研究. 东南国防医药, 2015, 17(1):12-15.
[32] 徐永远, 李浙成, 黄金莲. 超声测量内脏脂肪厚度和胰岛素抵抗相关性研究. 中国超声医学杂志, 2008, 24(12):1105-1108.
[33] Kang SH, Cho KH, Park JW, et al. Association of visceral fat area with chronic kidney disease and metabolic syndrome risk in the general population: analysis using multi-frequency bioimpedance. Kidney Blood Press Res, 2015,40(3):223-230.
Association of visceral fat area measured by bioelectrical impedance analysis with sex,age and metabolic risk factors
YANGFan,LIKang,YANGYing,ZHANGYan,GONGYan-jun,MAWei,JIANGJie,HUOYong.
DepartmentofCardiology,PekingUniversityFirstHospital,Beijing100034,China
HUOYong,Email:huoyong@263.net.cn
ObjectiveTo investigate the differences in visceral fat area measured by bioelectrical impedance analysis in different sex and age groups, and explore the relationship between visceral fat area and other metabolic risk factors. MethodsThis study enrolled 72 in-patients in the department of cardiology in Peking University First Hospital between August, 2014 and October, 2014. The visceral fat area and the subcutaneous fat area were measured by DUALSCAN HDS-2000 in all patients. Results were compared between different sex and age groups and the relationship between visceral fat area and metabolic risk factors were analyzed.ResultsMale had larger visceral fat area than female [(114.04±38.27) cm2vs. (92.09±30.57)cm2,P=0.019], while female had larger subcutaneous fat areas than male [(223.92±73.58)cm2vs. (270.35±82.13)cm2,P=0.019]. Subcutaneous fat area and visceral fat area were positively correlated in both male (r=0.777,P<0.001) and female (r=0.601,P=0.002). There were no significant differences in visceral fat area among different age groups (P=0.582). And visceral fat area had a positive correlation with body mass index (r=0.748,P<0.001), waist-hip ratio (r=0.577,P<0.001), abdominal circumference (r=0.752,P<0.001) and HbA1clevels (r=0.413,P=0.001).ConclusionsThere are sex differences in visceral fat area and subcutaneous fat area. The visceral fat area max be related to blood glucose levels and presence of diabetes.
Visceral fat area;Bioelectrical impedance analysis;Metabolic risk factors
10.3969/j.issn.1004-8812.2016.03.003
100034北京,北京大学第一医院心内科
霍勇,Email:huoyong@263.net.cn
R589
2015-12-16)
