太平洋鳕性腺发育成熟期内分泌生理特征❋
2016-08-13李兴源李吉方温海深
王 浩, 李兴源, 李吉方, 温海深
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
太平洋鳕性腺发育成熟期内分泌生理特征❋
王浩, 李兴源, 李吉方❋❋, 温海深
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
摘要:研究了太平洋鳕(Gadus macrocephalus)繁殖期性腺发育组织学、性成熟系数(GSI)和肝重指数(HSI)、性腺抽提液中睾酮(T)和雌二醇(E2)含量,分析了这些指标在太平洋鳕繁殖过程中的生理作用。研究表明:太平洋鳕卵巢从12月开始进入Ⅳ期,精巢于11月进入Ⅳ期,两者均在翌年2月达到成熟。雌性个体中,卵巢组织中T和E2含量在12月显著升高(P<0.05),雄性个体中,精巢组织中T和E2含量在11月底显著升高(P<0.05),到12月下旬维持在稳定状态,雌雄鱼性腺中T和E2含量均在翌年1月达到峰值,在3月显著下降(P<0.05),之后一直保持较低水平直到下个性腺成熟期。研究结果表明,性腺发育成熟期,太平洋鳕性腺中T和E2含量变化显著,与GSI变化趋势呈正相关,与HSI变化趋势呈负相关,说明T和E2对太平洋鳕的性腺发育成熟具有重要作用。
关键词:太平洋鳕鱼;性腺;性类固醇激素;性成熟系数;肝重指数
引用格式:王浩,李兴源,李吉方,等. 太平洋鳕性腺发育成熟期内分泌生理特征[J]. 中国海洋大学学报(自然科学版), 2016, 46(7): 21-26.
WANG Hao, LI Xing-Yuan, LI Ji-Fang, et al. Endocrine physiological characteristics ofGadusmacrocephalusduring gonadal maturation [J].Periodical of Ocean University of China, 2016, 46(7): 21-26.
下丘脑-垂体-性腺轴(HPG)是繁殖内分泌学研究的主要内容之一,硬骨鱼类是通过HPG轴的作用来传递外界信息进而调节生殖过程。鱼类繁殖行为的达成往往受到两方面因素的影响,一是性腺分泌的类固醇激素,二是脑垂体分泌的促性腺激素(GtH)。促性腺激素又受到促性腺激素释放激素(GnRH)的控制,GnRH则由下丘脑分泌的,这就是HPG轴调节繁殖生理的3个重要环节。性类固醇激素(Sex steroid hormone)在调节脊椎动物下丘脑-垂体-性腺轴功能方面起着重要作用[1],不同物种的不同发育阶段,性腺生成类固醇激素的能力不同,进而调节性腺的发育程度,也与动物性别形成及第二性征的出现密切相关。由于芳香化酶的作用,雌雄激素在生物机体内部可以相互转化。性类固醇激素主要包括雌激素、雄激素和孕激素[2],雌激素主要是由卵巢所分泌的雌酮(CT)、雌二醇(E2)和雌三醇(E3),其中功能最强的为17β-雌二醇(E2);孕激素主要是由黄体分泌的黄体激素,例如黄体酮。雄激素则分为睾酮(T)、11-酮基睾酮(11-KT)、雄烯二酮、雄酮和脱氢异雄酮(DHEA)等,其中睾酮(T)和11-酮基睾酮(11-KT)在诱导精巢发育和成熟方面具有重要作用。
关于硬骨鱼类血浆中性类固醇激素水平的研究报道较多,例如日本鳗鲡[3](Anguillajaponica)、花尾胡椒鲷[4](Plectorhinchuscinctus)和许氏平鮋[5](Sebastesschlegelii)等,性腺类固醇激素含量基本都与GSI密切相关,表现一定的周期性。太平洋鳕鱼(Gadusmacrocephalus)又名大头鳕,属鲈形目(Perciformes)鳕科(Gadidae)鳕属(Gadus),在中国主要分布在黄海中、北部,栖息水深50~80m,为中下层冷水鱼类[6],为中国北方海域传统的捕捞鱼类,同时具备较高的水产养殖开发潜力。目前,由于海洋环境污染和过度捕捞等原因造成其种群数量正在不断下降,开展全人工繁殖是合理利用和保护鳕鱼物种资源的有效途径。由于采集的太平洋鳕均为鲜活标本,不能利用血液测定激素水平,本文探索建立性腺组织抽提液中性类固醇激素含量方法。姜志强[7]等较系统的研究了太平洋鳕的繁殖生物学特征,但关于它的繁殖内分泌机制方面研究尚无报道。
本文采用组织学和激素放射免疫测定方法(RIA)研究了青岛海域太平洋鳕性腺成熟期性腺组织学、性腺成熟系数、性腺抽提液中T和E2含量水平变化,以期通过本研究了解太平洋鳕性腺特定发育期内分泌生
理机制,为开展太平洋鳕的繁育与资源保护提供科学依据。
1 材料与方法
1.1 实验鱼来源
实验用太平洋鳕鱼于2012年10月—2013年3月采自青岛周边沿海,每15d采样1次,共采集85尾鱼,其中雌鱼52尾,雄鱼33尾。体长为41~68cm,体重635~4630g。
1.2 采样与生物学指标测定
测量实验鱼常规生物学指标,之后迅速解剖获取完整性腺和肝脏病进行称重,取少量性腺组织浸入Bouin’s液固定,用于组织学切片;另外取部分性腺组织放入灭菌分子管(DEPC处理,RNase Free)中,于-80℃冰箱保存,用以性腺抽提液类固醇激素测定。对体重、体长、肝重、性腺重和去内脏重数据进行整理,并进一步统计分析,计算性腺成熟系数(GSI)和肝重指数(HSI)。计算方法:
(GSI)=[GW/(BW-VW)]×100,
(HSI)=[(LW/(BW-VW)]×100。
式中:GW:性腺重;LW:肝脏重;BW-VW:去内脏重。
1.3 性腺组织切片和性腺分期方法
将性腺样品以Bouin’s液固定24~36h,系列酒精脱水,二甲苯透明,石蜡包埋,LEICA-RM2016切片机连续横切,厚度5 μm,HE染色,中性树胶封片,Nikon E200型光学显微镜观察及显微摄影。本研究参照刘筠[8]的标准进行性腺分期。
1.4 激素测定方法
取1g性腺加入3mL抽提液(组织抽提液采用磷酸缓冲液与纯酒精1∶1混合),组织匀浆机研磨后离心2遍,取上清液用磷酸缓冲液定容至3mL。放置-80℃超低温冰箱中储存,待测。性腺抽提方法是在不具备获得活鱼血浆的前提下采用的方法,本文抽提方法根据对斑马鱼(Daniorerio)[9]和河鲈(Percafluviatilis)[10]性腺抽提中采用的方法加以改进形成。激素测定使用了天津九鼎医学生物工程有限公司T和E2的RIA试剂盒,采用改良的RIA半微量法测定[11]。
1.5 数据统计
实验数据均表示为平均数±标准差(Mean±SE),采用SPSS 19.0软件的Duncan’s检验和单因素方差分析(one-way ANOVA)进行数据处理,差异显著时表现为P<0.05。

(A:Ⅱ期卵巢,Oc示小生长期的初级卵母细胞,比例尺=100 μm。The ovary in the stageⅡ, bar=100 μm.B: Ⅲ期卵巢,大生长期的初级卵母细胞,比例尺=100 μm。The ovary in the stageⅢ, bar=100 μm.C:IV期卵巢,c示核仁,比例尺=50 μm。The ovary in the stageIV,bar=50 μm.D:V期卵巢,y示卵黄颗粒,比例尺=50 μm。The ovary in the stageV,bar=50 μm.E:Ⅵ期卵巢,FM为排卵后剩余的滤泡膜。比例尺=100 μm。The ovary in the stageⅥ,bar=100 μm.F: Ⅱ期精巢,SgⅠ示初级精原细胞,SgⅡ示次级精原细胞,比例尺=100 μm。The testis in the stageII,bar=100 μm.G:Ⅱ期精巢放大,比例尺=50 μm。The testis in the stageII,bar=50 μm.H:Ⅲ期精巢,精小管中的初级精母细胞,比例尺=100 μm。The testis in the stage Ⅲ,bar=100 μm.I: Ⅳ期精巢,精小管壁上的精子细胞,s示精子细胞,比例尺=100 μm。The testis in the stage Ⅳ,bar=100 μm.J:Ⅳ期精巢放大,比例尺=25 μm。The testis in the stage Ⅳ,bar=25 μm.K:Ⅴ期精巢,Sz示成熟精巢中的精子,比例尺=100 μm。The testis in the stage Ⅴ,bar=100 μm.L:Ⅴ期精巢放大,比例尺=25 μm。The testis in the stage Ⅴ,bar=50 μm.M:Ⅵ期精巢,Sz示精巢排精后小叶腔中残留的精子,比例尺=100 μm。The testisin the stageⅥ,bar=100 μm.)
图1太平洋鳕性腺发育组织学
Fig. 1Developmental histological of gonad inGadusmacrocephalus
2 结果
2.1 太平洋鳕性腺组织学变化
太平洋鳕性腺发育组织学变化见图1,卵巢发育历经Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ发育期;Ⅱ期卵巢(见图1A)中主要为初级卵母细胞,此时卵黄未形成且细胞核的偏位现象较明显,Ⅲ期和Ⅳ期卵巢中的大多数为初级卵母细胞,处于大生长期,卵黄颗粒形成并最终充满胞质伴随着辐射带形成(见图1B、C),Ⅴ期卵巢中多为次级卵母细胞,细胞核分解消失,卵黄颗粒形成大的卵黄板(见图1D),Ⅵ期卵巢成熟卵已排出,滤泡膜脱离,辐射带萎缩(见图3E)。
精巢发育同样经历了Ⅱ-Ⅵ期,精巢发育到Ⅱ期时可见精小管,管壁上有大量精原细胞,同时随着精巢发育次级精原细胞开始出现(见图1F、G)。Ⅲ期精巢内已无精原细胞,精小管充满初级精母细胞(见图1H)。Ⅳ期精巢小叶腔中被精子充满(见图1I、J),Ⅴ期精巢完全成熟,精小叶之间仅有一层基膜(见图1K、L),见Ⅵ时期精巢排精完成,依然可见未完全排出的精子(见图1M)。
2.2 性腺成熟系数(GSI)变化
2012年10-11月上旬卵巢处于Ⅱ期,雌鱼GSI值较低,之后GSI不断上升,卵巢发育历经Ⅲ期到12月达到第Ⅳ期;GSI在翌年1—2月卵巢发育到V期时达到峰值37.6%±5.78%。随着成熟卵母细胞的排出、卵巢的退化,雌鱼的GSI逐渐下降,于3月初达到最小值3.11%±0.57%(见图2)。雄鱼GSI与雌鱼的GSI变化趋势相似。11-12月GSI显著上升,此时精巢大部分处于Ⅳ期,GSI基本保持在26%;随后精巢于1—2月到达V期,GSI达到最大值33.89%±8.34%;同样,3月雄鱼排精后精巢退化,GSI下降到最低值1.38%±0.11%。与雌鱼不同,雄鱼的GSI从11月中下旬-翌年1月初为平稳期,而不是持续上升(见图2)。

图2 采样期间太平洋鳕GSI变化
2.3 肝重指数(HSI)变化
HSI在太平洋鳕鱼繁殖期内呈连续下降趋势,最低值均出现在翌年3月,但与GSI相比较HSI的变化趋势并不明显(见图3)。
2.4 性腺中激素含量变动
2.4.1 雌性太平洋鳕性腺中E2与T含量变动雌性太平洋鳕性腺中E2水平在性腺成熟期变化显著。12月初卵巢发育至第Ⅳ期时其显著升高至(820±153.5)pg/mg(P<0.05);之后E2水平进一步升高,峰值出现在翌年1月的2次取样中(P<0.05),分别为(1 568.2±129.4)和(1 556.2±196)pg/mg,此时卵巢发育至V期,在翌年3月E2含量显著下降至(662.4±171.5)pg/mg(P<0.05),此时排卵已完成。卵巢组织中T含量在繁殖期间变化趋势与E2类似,与E2不同的是T水平在11月中下旬出现显著上升,含量为(306.9±38.6)pg/mg(P<0.05),T含量峰值同样出现在的翌年1月(P<0.05),2次取样均值为(512.8±76)和(515.6±86.3) pg/mg;排卵完成后的3月含量显著下降至(173.2±44.8) pg/mg(P<0.05)与10月、11月上旬处于同一水平(见图4)。
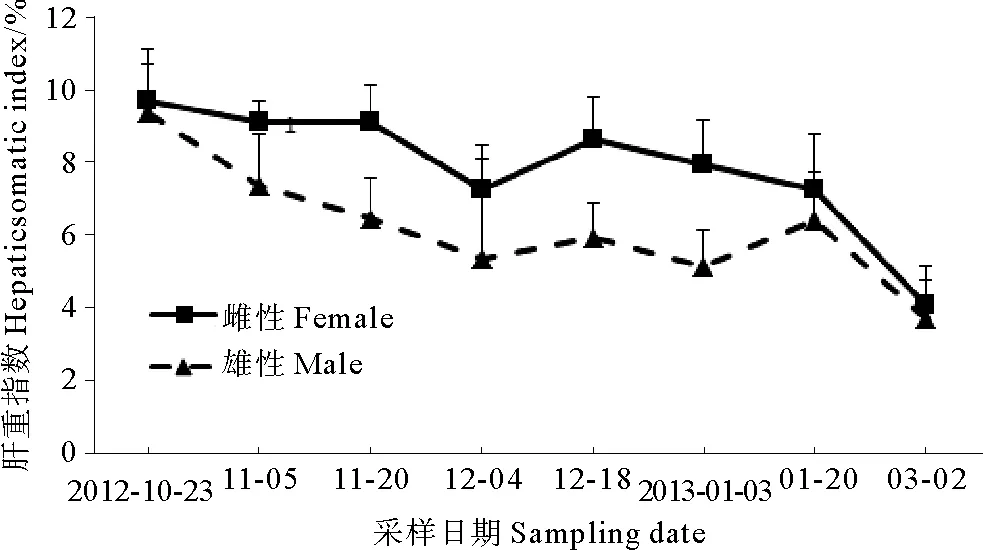
图3 采样期间太平洋鳕HSI变化
(数据均表示为平均数±标准差,图中标有不同的字母表示存在显著性差异(P<0.05,Duncan氏多重比较)。Values are expressed as mean±standard error of femean. Different letters indicate significant difference (P<0.05, one-way ANOVA, followed by Duncan’s).)
图4雌性太平洋鳕性腺中类固醇激素含量变动
Fig.4Chang of T and E2level in Gonad extraction of femaleGadusmacrocephalus
2.4.2 雄性太平洋鳕性腺中E2与T水平的含量变动11月底精巢发育到第Ⅳ期时E2含量显著升高至(993.6±2.6)pg/mg(P<0.05),12月E2含量与11月底处于同一水平。之后于翌年1月也就是精巢发育至V期时达到峰值,2次取样均值为(2 799.5±256.7)、(2 840.9±271.7)pg/mg(P<0.05);3月精子排出后E2含量显著下降至(468.4±57)pg/mg(P<0.05)。雄鱼性腺中T含量变化趋势与E2一致,T含量峰值同样出现在翌年1月,然而其含量的最低值(475.7±94)pg/mg出现在11月上旬(P<0.05)。3月T含量显著下降至(745.3±79.5)pg/mg(P<0.05),与10月和11月上旬的含量处于同一水平(见图5)。
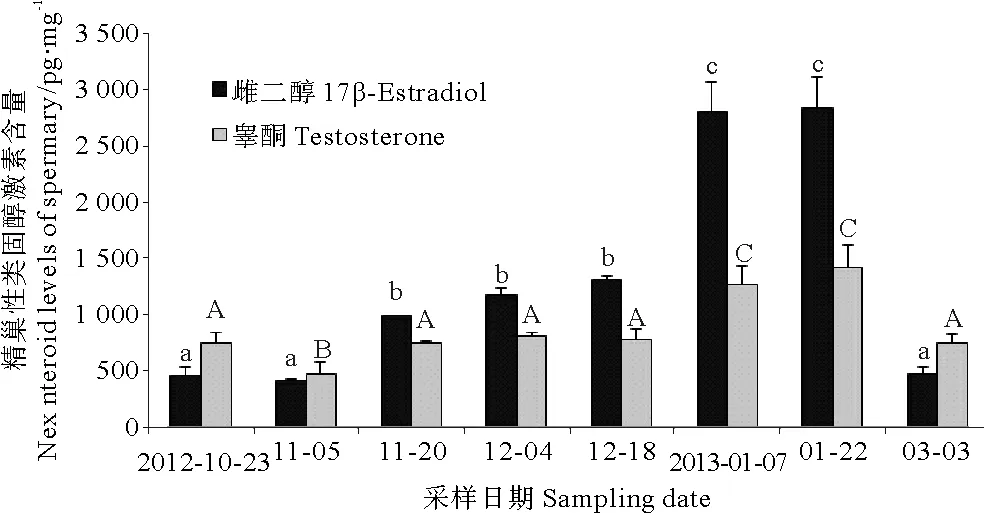
(数据均表示为平均数±标准差,图中标有不同的字母表示存在显著性差异(P<0.05,Duncan氏多重比较)。Values are expressed as mean±standard error of femean. Different letters indicate significant difference (P<0.05, one-way ANOVA, followed by Duncan’s). )
图5雄性太平洋鳕性腺中类固醇激素含量的周期变化
Fig.5Chang of T and E2level in Gonad extraction of maleGadusmacrocephalus
3 讨论
关于应用RIA对硬骨鱼类血浆中性类固醇激素T和E2含量变化的研究报道较多,结果显示这2种激素水平与性腺发育季节变化、GSI和HSI呈现相关关系,这表明血浆中T和E2在硬骨鱼类性腺发育成熟过程中起到了重要的调节作用[12-13]。周玉国将RIA用于斑马鱼(Daniorerio)性腺抽提液中性类固醇激素含量测定,实验结果很好地反映了斑马鱼性类固醇激素的繁殖周期变化规律,同时也证明了在不具备获得活鱼血浆的前提下使用性腺抽提液中性类固醇激素作为生理学指标的可行性。本研究采用RIA测定了太平洋鳕鱼性腺抽提液中T和E2的含量变化,结果显示这2种激素含量在取样期间随着性腺发育的进程,呈现有规律的变化趋势。
由于不同鱼类所处的环境和产卵方式不同,其性腺发育成熟和性激素的周年变化规律也不尽相同。在一些冷水鱼类如虹鳟(Oncorhynchusmykiss)[14]、欧洲鳇(Husohuso)、俄罗斯鲟(Acipensergueldenstaedtii)和闪光鲟(Acipenserstellatus)研究中发现,E2水平在卵黄生成期升高、卵母细胞成熟和排卵前达到峰值和排卵之后下降[15],与本实验太平洋鳕鱼卵巢中E2含量变化具有相似的现象,这说明冷水鱼类在繁殖期间类固醇激素变化方面具有较高的相似性。雌性太平洋鳕鱼的性腺发育成熟期T和E2含量的变化趋势略有不同,前者含量快速增长发生在11月中下旬而后者含量快速增长发生在12月初卵巢发育至第Ⅳ期时,表明不同种类的性类固醇激素在太平洋鳕鱼卵巢不同发育时期具有不同的生理功能,E2作为主要的雌激素可以诱导肝脏合成卵黄原蛋白,促进卵母细胞卵黄的积累,而T在芳香化酶的作用下可以转化为E2,这就要求T要积累一定的含量才能满足机体大量合成E2的需要,这也可能是雌性太平洋鳕性腺中T含量快速增长的时间节点相比E2出现早的原因,关于这方面的机制有待进一步探讨。本研究中卵巢抽提液中T水平在11月上旬出现了显著降低形成了小低峰,与此对应的是雌鱼性腺抽提液中E2含量在此时开始上升,这些现象均表明了T作为E2前体的重要作用。太平洋鳕鱼卵巢中E2含量在卵黄积累完成期即1月底略有下降,推测这可能和排卵前消除E2对GtH分泌的负反馈作用有关。
雄性太平洋鳕鱼性腺中E2含量的波动趋势不同于某些硬骨鱼雄鱼血浆内E2含量一直维持在较低的水平[16]而具有显著性的变化,说明E2对雄性太平洋鳕性成熟具有重要作用及E2对精巢促进作用的种间差异性。本研究中11月中旬精巢处于Ⅲ期时E2含量出现显著升高,说明E2可能促进了雄性太平洋鳕鱼精原细胞分裂增殖为精母细胞的过程,这与Miura等研究认为雌二醇可能促进这一过程甚至具有调节Sertoli细胞的作用相吻合[17]。精巢内E2含量在1月下旬即精巢处于第V期时达到了峰值,暗示在雄性太平洋鳕鱼精子分化成熟的过程中E2可能发挥了作用。张照斌等对西伯利亚鲟(AcipenserbaeriBrandt)的研究结果表明,雄西伯利亚鲟血浆中T含量在精子形成后和排精时达到峰值[18]。太平洋鳕雄鱼性腺中T含量峰值出现在1月下旬即精巢处于第V期时,与此对应GSI也达到最高值。T在雄鱼的精巢发育和精子成熟过程中起直接作用,只有机体内部T含量达到一定水平时精子发生和精子排放才能达成,同时有研究称T也调节精子分化和变态,表明T对雄鱼成熟具有重要意义[19-20]。总的来说,雄性太平洋鳕鱼性腺中E2和T含量的变化趋势与雌鱼的相似,两者含量均在精巢成熟时达到最高值。此外本研究对比雌雄两性可以发现,卵巢中T和E2含量基本低于同时期精巢内T和E2含量,但是前者中E2/T的比值要高于后者,尤其是1月T和E2含量达到峰值即卵巢成熟时两者差距更为显著,之前有研究认为,E2/T的比值可能才是真正决定卵巢发育成熟的最重要的因素[21],说明E2对太平洋鳕鱼卵巢发育具有重要作用,其机制有待于进一步的探讨。
据报道,大连海域太平洋鳕鱼的繁殖期1—2月,太平洋鳕卵巢在一年中大约从12月开始进入Ⅳ期,翌年1—2月达到排放,而精巢11月份就成熟,逐渐有精子排放[7]。本实验所检测的青岛海域性腺发育成熟期太平洋鳕鱼E2和T含量的变化规律支持了这些观点。值得一提的是,本研究显示雌性太平洋鳕鱼在GSI较低的时期为了储备繁殖所需的能量肝脏开始合成营养物质,此时HSI往往比较高;随着E2水平的升高促进了肝脏合成卵黄蛋白原,肝脏储存的能量用以性腺发育致使HSI呈逐渐降低的态势;在翌年1月下旬GSI达到峰值,HSI进一步下降,且在3月HSI达到最低值,呈现显著性差异,雄鱼HSI与GSI大致上也呈反相关关系。这些现象与姜志强等对大连海域太平洋鳕鱼性腺发育及营养来源的研究结果一致,同时也表明了青岛海域和大连海域的太平洋鳕鱼繁殖习性的一致性。迄今为止,国内有关太平洋鳕繁殖内分泌学研究尚未见报道,本研究首次获得了性腺发育成熟期野生太平洋鳕鱼性类固醇激素E2和T含量变化数据并结合性腺发育状况进行了初步探讨,未来可在此基础上深入研究。
4 结语
本文研究了青岛海域性腺发育成熟期太平洋鳕性腺发育组织学、性成熟系数(GSI)和肝重指数(HSI)、性腺抽提液中睾酮(T)和雌二醇(E2)含量。通过分析表明E2在太平洋鳕卵母细胞卵黄积累及卵巢成熟过程中具有重要作用,T对精子发生和精巢成熟起直接作用,同时这2种激素水平与GSI变化趋势呈正相关,与HSI变化趋势呈负相关。通过研究,初步掌握了中国海域太平洋鳕性腺发育成熟期内分泌生理机能变化规律,为进行鳕鱼全人工繁殖提供科学参考。
参考文献:
[1]李文笙, 林浩然.性类固醇激素对鲤鱼脑垂体生长激素基因表达的影响[J] . 动物学报, 2000, 46(2): 175-182.
LI Wen-Sheng, LIN Hao-Ran. Effects of sex steroid on the growth hormone(GH)gene expression in the pituitary of common carp(Cyprinuscarpio) [J]. Acta Zoologica Sinica, 2000, 46(2): 175-182.
[2]林浩然. 鱼类生理学[M]. 广州: 广东高等教育出版社,1999: 146-240.
LIN Hao-Ran. Fish Physiology[M]. Guangzhou: Guangdong Higher Education Press, 1999: 146-240.
[3]邓岳松,林浩然. 埋植雄烯二酮一次诱导雄性日本鳗鲡性腺发育成熟的研究[J]. 海洋科学,2000,24(4): 34-37.
DENG Yue-Song, LIN Hao-Ran. Induced gonadal maturation by single implantation of androstenedione in maleAnguillajaponica[J]. Marine Sciences, 2000,24 (4): 34-37.
[4]唐啸尘,刘楚吾,刘丽. 花尾胡椒鲷血清睾酮的双抗体测定法及对外源激素的反应[J]. 海洋通报, 2002,21(5): 90-95.
TANG Xiao-Chen, LIU Chu-Wu, LIU Li . Investigation on the testosteone inPlectorhynchuscinctusSerum by RIA with Bi-antibody and the testosteronal esponses to exogenous hormones[J]. Marine Science Bulleten,2002,21(5): 90-95.
[5]史丹, 温海深, 杨艳平. 许氏平鲉卵巢发育的周年变化研究[J]. 中国海洋大学学报(自然科学版), 2011, 41(9): 25-30.
SHI Dan, WEN Hai-Shen, YANG Yan-Ping. The annual change of ovarian development in femaleSebastesschlegei[J]. Periodical of Ocean University of China, 2011, 41(9): 25-30.
[6]赵传絪, 刘效舜, 曾炳光, 等. 中国海洋渔业资源[M]. 杭州: 浙江科学技术出版社, 1990.
ZHAO Chuan-Yin, LIU Xiao-Shun, ZENG Bing-Guang ,et al. Marine Fishery Resources of China[M]. Hangzhou: Zhejiang Science and Technology Press, 1990.
[7]姜志强,张志明,赵翀,等. 太平洋鳕性腺发育及营养来源的初步研究[J]. 大连海洋大学学报, 2012, 27(4): 315-320.
JIANG Zhi-Qiang,ZHANG Zhi-Ming,ZHAO Chong,et al. The gonad development and nutrition source of pacific codGadusmacrocephalus[J]. Journal of Dalian Ocean University, 2012,27(4): 315-320.
[8]刘筠. 中国养殖鱼类繁殖生理学[M]. 北京: 农业出版社, 1993: 29-42, 42-46,53-55.
LIU Yun. Farmed Fish Reproduction Physiology Of China[M]. Beijing: Agriculture Press, 1993: 29-42, 42-46,53-55.
[9]周玉国. 斑马鱼 (Daniorerio)繁殖生理机能及其调控研究[D]. 青岛: 中国海洋大学, 2008.
Zhou Yu-Guo. Studies on the function of the reproductive and manipulation of zebrafish (Daniorerio)[D]. Qingdao: Ocean University of China, 2008.
[10]Rougeot C, Krim A, Mandiki S N M, et al. Sex steroid dynamics during embryogenesis and sexual differentiation in eurasian perch,Percafluviatilis[J]. Theriogenology, 2007, 67(5): 1046-1052.
[11]陈彩芳. 四种细胞色素P450酶在半滑舌鳎繁殖生理机能中的作用研究[D]. 青岛: 中国海洋大学, 2010.
CHEN Cai-Fang. Studies on reproduction physiological function of four cytochrome p450 enzymes in half-smooth tongue sole(Cynoglossussemilaevis)[D]. Qingdao: Ocean University of China, 2010.
[12]洪万树,吴秋艳,张其永. 中华乌塘鳢血清性类固醇激素含量与性腺发育的关系及其季节变化[J]. 厦门大学学报(自然科学版), 2009, 48(2): 274-277.
HONG Wan-Shu , WU Qiu-Yan , ZHANG Qi-Yong. Changes of serum sex steroids levels with gonadal development and seasons inBostrichthyssinensis[J]. Journal of Xiamen University (Natural Science), 2009, 48(2): 274-277.
[13]温海深, 王连顺,牟幸江. 大六泷六线鱼睾酮和雌二醇及其受体在精巢发育中的生理作用[J]. 中国海洋大学学报(自然科学版), 2009, 39(5): 903-907.
WEN Hai-Sheng, WANG Lian-Shun, MOU Xing-Jiang. Studies on physiology function on testosterone and 17β-estradiol and it's receptors during test is development ofHexagrammosotakii. [J]. Periodical of Ocean University of China, 2009, 39(5): 903-907.
[14]赵维信. 虹鳟排卵前后血清中性类固醇激素浓度变化的研究 [J]. 水产学报, 1987, 11(3): 205-213.
ZHAO Wei-Xin. Changes of serum steroid levels during ovulation in rainbow trout (Salmogairdneri) [J]. Journal of Fisheries of China, 1987, 11(3): 205-213.
[15]Baranni Kova Ia, Bayunova L V, Se Menkova T B. Serum levels of testosterone, 11-ketotestosterone and oestradio- l 17 in three species of sturgeon during gonadal development and final maturation induced by hormonal treatment[J]. Journal of Fish Biology, 2004, 64: 1330-1338.
[16]张冬茜. 绿鳍马面鲀繁殖生理及性激素合成关键酶的分子表达机制[D]. 青岛: 中国海洋大学, 2013.
ZHANG Dong-Qian. Reproductive Physiology and Molecular Expression Mechanism of Key Enzyme for Sex Hormone Synthesis inNavodonseptentrionalis[D]. Qingdao: Ocean University of China, 2013.
[17]Miura T,Miur C, Ohta T, et al. Estradiol-17βstimulates the renewal of spermatogonial stem cells[J]. Bionchem Biophys Res Commun,1999, 264: 230-234.
[18]张照斌,牛翠娟,朱华,等. 室内饲育西伯利亚鲟的血清性类固醇激素的周年变化[J]. 北京师范大学学报(自然科学版), 2003, 39(4): 519-524.
ZHANG Zhao-Bin, NIU Cui-Juan, ZHU Hua, et al. Seasonal changes of plasma sex steroid levels in laboratory reared Siberian sturgeon (Acipenserbaeri) [J]. Journal of Beijing Normal University(Natural Science), 2003, 39(4): 519-524.
[19]Billard R. Spermatogenesis and spermatology of some teleost fish species[J]. Reprod Nutr Develop, 1986, 26(4): 877-920.
[20]Crim L W, Evans D M. StimμLation of pituitary gonadotropin by testosterone in juvenile rainbow trout (Salmogairgneri) [J]. Gen Comp Endocrinol, 1979, 37: 192-196.
[21]孙鹏, 尤锋, 李军, 等. 对照组和雌核发育牙鲆血清中睾酮与雌二醇水平的比较[J].海洋科学, 2011, 3(12): 1-5.
SUN Peng, YOU Feng, LI Jun, et al. Comparison of the levels of T and E2 in normal and gynogeneticParalichthysolivaceus[J]. Marine Sciences, 2011, 3(12): 1-5.
责任编辑朱宝象
基金项目:❋ 国家高技术研究发展计划项目(2011AA10A413)资助
收稿日期:2015-05-01;
修订日期:2015-11-11
作者简介:王浩(1992-),男,硕士生,研究方向: 鱼类生理学。E-mail: 984455167@qq.com ❋❋通讯作者: E-mail:lijf@ouc.edu.cn
中图法分类号:S945.4; S955.486
文献标志码:A
文章编号:1672-5174(2016)07-021-06
DOI:10.16441/j.cnki.hdxb.20150141
Endocrine Physiological Characteristics ofGadusmacrocephalusDuring Gonadal Maturation
WANG Hao, LI Xing-Yuan, LI Ji-Fang, WEN Hai-Shen
(The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China)
Abstract:Pacific cod (Gadus macrocephalus)is an important economic species, which has great potential for aquaculture. Chinese scholars have studied the biology and morphology of Pacific cod. However, systematic researches of its reproductive endocrinology like the change of sex steroids level have not been reported yet, which could be critical to the breakthrough of its artificial breeding technology. This study was the first for the introducing sex steroids level in maturation period of Pacific cod. This study used Pacific cod captured form yellow sea of Qingdao area as researching objects. Histology of gonadal development, gonadosomatic index (GSI), hepaticsomatic index (HSI), levels of two sex steroid-17β-estradiol (E2) and testosterone (T) of Pacific cod in the maturation period were studied aiming to explore the relation between gonadal development and sex steroids in Pacific cod. It is worthy to mention that we measured the extracts of gonads with RIA instead of serum due to the high mortality rate of the captured Pacific cod. Results showed that levels of 17β-estradiol and testosterone at different stages of gonadal development during the maturation period of Pacific cod changed significantly. In ovary, 17β-estradiol increased significantly at stage Ⅳ (P <0.05), reached the highest at stageⅤand significantly decreased (P <0.05) at stage Ⅵ, which meant that 17β-estradiol played an important role in the accumulation of yolk protein and maturation of ovary. Testosterone increased significantly at stage Ⅲ, indicating that testosterone is precursor of estradiol synthesis in Pacific cod. In spermary, testosterone increased significantly at stage Ⅲ (P <0.05) and reached the highest at stageⅤand significantly decreased (P <0.05) at stage Ⅵ, which meant that testosterone was the promoting factor of spermary de velopment and played direct role in the process of sperm maturation. In addition, E2/T ratio in ovary was higher than that in spermary in the same period, especially at stage Ⅴ, which meant E2/T ratio might be the most important factor of ovarian maturation. These findings also showed a positive or negative correlation between level of sex steroid and GSI or hsi, and E2and T played important roles in the gonadal development during maturation of G. microcephalus. Anyway, the artificial breeding technology of Pacific cod need innovating and consummating and the reproductive endocrinology in Pacific cod will be the key ones in our future work.
Key words:Gadus macrocephalus; gonad; sex steroid; gonadosomatic index; hepaticsomatic index
Supported By National High-tech Research and Development Projects (2011AA10A413)
