不同光周期条件对罗非鱼生长及性腺发育的影响
2020-03-20唐瞻杨张旭罗永巨肖俊周毅郭忠宝钟欢梁军能周磊
唐瞻杨 张旭 罗永巨 肖俊 周毅 郭忠宝 钟欢 梁军能 周磊

摘要:【目的】筛选出适宜尼罗罗非鱼生长及性腺发育成熟的最适光周期,为其工厂化养殖生产提供科学依据。【方法】以雌性尼罗罗非鱼为研究对象,设12 L∶12 D、14 L∶10 D、16 L∶8 D和18 L∶6 D 4个不同的光周期,饲养30 d后比较分析不同光周期条件下尼罗罗非鱼生长阶段的形态指标、体内激素水平及性腺发育差异情况。【结果】尼罗罗非鱼的相对增重率随光照时间的延长呈先降后升再降的变化趋势,在16 L∶8 D光周期条件下达最大值;体长相对增长率随光照时间的延长整体上呈下降趋势,而体宽和体高的相对增长率随光照时间的延长呈不同程度的上升趋势。尼罗罗非鱼血清中促性腺激素释放激素(GnRH)、雌二醇(E2)和褪黑素(MT)3种激素含量随光照时间的延长均呈上升趋势,且在18 L∶6 D光周期条件下达最大值。适当延长光照时间能有效促进尼罗罗非鱼性腺发育,在16 L∶8 D光照周期条件下促进作用最强,而在18 L∶6 D光照周期下其性腺发育受抑制。【结论】16 L∶8 D是尼罗罗非鱼生长及性腺发育的最适光周期,在实际生产中适当延长光照时间可提高罗非鱼产量并促进其性腺发育成熟。
关键词: 尼罗罗非鱼;光周期;生长发育;性腺;激素
中图分类号: S965.125 文献标志码: A 文章编号:2095-1191(2020)01-0217-07
Abstract: 【Objective】In this study, the optimal photoperiod of growth and gonadal maturation for tilapia was selec-ted. The results provided scientific basis for tilapia breeding. 【Method】In this study, female Nile tilapia was studied, four photoperiod conditions of 12 L∶12 D, 14 L∶10 D, 16 L∶8 D and 18 L∶6 D were designed, and the morphological inde-xes, serum hormones and gonad development were analyzed after feeding for 30 d. 【Result】The relative weight gain rate of Nile tilapia was decreased at the beginning, then increased with the increase of photoperiod, which was the largest in the 16 L∶8 D. The relative growth rate of body length was decreased with the increase of light duration. The relative growth rate of body width and relative growth rate of body height increased with the increase of photoperiod. The levels of gonadotropin-releasing hormone(GnRH), estradiol (E2) and melatonin (MT) in Nile tilapia serum increased with the extension of photoperiod, which were the largest in the 18 L∶6 D photoperiod. The results showed that prolongation of photoperiod could effectively promote gonadal development in Nile tilapia, and the effect was the best in the photoperiod of 16 L∶8 D, but inhibited in the photoperiod of 18 L∶6 D. 【Conclusion】The 16 L/8 D photoperiod condition is the optimal illumination condition for the growth and gonad development of Nile tilapia. Prolonging photoperiod increases the yield of Nile tilapia and promotes the maturation of gonads in actual production.
Key words: Nile tilapia; photoperiod; growth and development; gonad; hormone
Foundation: Guangxi Innovation-driven Development Special Project(Guike AA17204094-2)
0 引言
【研究意義】罗非鱼具有食性杂、生长快、产量高、抗病力强及易饲养等特点,是联合国粮农组织(FAO)向全世界推广养殖的重要对象之一(王金,2014)。罗非鱼也是我国重要的养殖出口水产品,2018年我国罗非鱼产量为162.4万t,加工量达69.7万t,已扩大到非洲、墨西哥等其他海外市场,其产量及出口量较2017年分别增长2.52%和4.45%,在2018年水产品出口品种中位居第三位(农业农村部渔业渔政管理局等,2019)。当前针对罗非鱼的研究主要集中在养殖方式(张金宗,2011;Roriz et al.,2017)、营养饲料(Zahran et al.,2014;何凌云等,2018)、病害防治(黎炯,2011;Barato et al.,2015)及杂交新品种开发选育(Lago et al.,2016)等方面,而有关环境因子变化对罗非鱼产生影响的研究较少。光照作为调控水生动物生长发育、能量代谢及繁殖等生命活动的重要环境因子之一,其变化直接或间接影响水生动物的某些生理机制。因此,研究光周期变化对罗非鱼的影响,可为探索罗非鱼生长及性腺发育的最适光周期提供科学依据。【前人研究进展】目前,利用光周期变化对水产养殖对象带来的效应,在提高养殖对象生长速度及促进性腺发育成熟等领域已得到广泛应用(祝斐等,2016)。叶乐等(2014)研究表明,光周期和光照强度对克氏双锯鱼仔鱼发育变态均有重要影响,仔鱼发育速率随光周期的延长而加快,当光周期为16 L∶8 D时达最大值。祝斐等(2016)研究证实,在松江鲈鱼的幼鱼至成鱼阶段,即生殖洄游阶段适当延长光周期对其性腺发育及肝脏能量储备均有显著影响。周胜杰等(2018)研究发现,尖吻鲈稚鱼阶段其消化酶对光周期变化的反应小于仔鱼期,适当延长光周期有助于提高尖吻鲈的生长速度。在罗非鱼养殖方面,Ridha和Cruz(2000)在研究光照强度和光周期对尼罗罗非鱼繁殖力的影响时发现,长光周期(18 L∶6 D)在提高罗非鱼繁殖力的同时能促使其同期产卵;Biswas和Takeuchi(2002)指出缩短光周期能使罗非鱼仔鱼生长发育出现迟缓现象;Campos-Mendoza等(2004)在研究罗非鱼繁殖力时发现,长光周期(18 L∶6 D)条件下罗非鱼的一些重要繁殖性状得到改善,即该光周期可提高其繁殖力,在罗非鱼生产中具有较高的应用价值;Rad等(2006)研究发现,连续延长光周期可有效促进罗非鱼幼鱼期的生长发育;Liang和Chien(2013)在鱼菜混养的研究中发现长光周期可提高罗非鱼产量;刘曾宇等(2019)研究指出外源性光周期是调剂罗非鱼昼液节律的主要影响因子。【本研究切入点】上述研究结果表明,长光周期条件在罗非鱼幼鱼、繁殖力和苗种繁育等方面均具有促进作用,但针对罗非鱼生长发育阶段的研究甚少,尤其是光周期对罗非鱼生长及性腺发育成熟影响等方面的研究鲜见报道。【拟解决的关键问题】比较分析不同光周期条件下尼罗罗非鱼生长阶段的形态指标、体内激素水平及性腺发育差异情况,筛选出适宜尼罗罗非鱼生长及性腺发育成熟的最适光周期,为其工厂化养殖生产提供科学依据。
1 材料与方法
1. 1 试验材料
供试雌性尼罗罗非鱼由广西水产科学研究院国家级广西南宁罗非鱼良种场提供,试验前在水温(28.0±0.5)℃、pH 8.0、养殖水体用遮光布遮光处理过的水池中暂养1周,以LED灯为唯一光源,光照强度1000 lx,光周期为12 L∶12 D。
1. 2 试验方法
参照陈文银(2006)的研究方法,共设4个不同光周期,分别为12 L∶12 D、14 L∶10 D、16 L∶8 D和18 L∶6 D,每个光周期设3个平行,通过设定计时装置严格控制光照时间。试验开始时在各处理组中分别投放10尾罗非鱼,记录其初始体重、体长、体宽和体高(表1)。试验期间保持光周期为唯一变量,采用加热棒维持水温(28.0±0.5)℃,每3 d换水1次,每天上午8:30和下午17:30各饱食投喂1次。养殖周期30 d(2018年11月3日—12月4日)。
养殖试验结束后用MS-222麻醉剂对罗非鱼进行麻醉,测量其体重、体长、体宽和体高。从各处理组中分别随机选取5尾罗非鱼在冰盘上进行尾静脉采血,血样置于4 ℃环境中静置12 h,然后4 ℃下4000 r/min离心10 min,收集上清液,用于促性腺激素释放激素(GnRH)、雌二醇(E2)和褪黑素(MT)的含量测定。另取剩余罗非鱼置于冰盘上进行剖解,将性腺完整分离,置于Bouins液中进行固定,固定后进行梯度浓度酒精脱水,二甲苯透明,石蜡包埋,组织切片机连续切片(5~6 μm),苏木精—伊红(HE)染色,中性树胶封片,烘干后在显微镜下观察并记录性腺发育的组织学特征(黄福江等,2013;李春涛等,2014)。
1. 3 统计分析
利用Excel 2007进行试验数据整理,通过SPSS 17.0进行单因素方差分析(One-way ANOVA)。计算各处理组罗非鱼的相对增重率及体高、体长和体宽的相对增长率,具体公式如下:
相对增重率WG(%)=(Wt-Wo)/Wo×100
相对增长率LG(%)=(L2-L1)/L1×100
式中,Wo为试验开始时罗非鱼平均鲜重(g/尾);Wt为试验结束时罗非鱼平均鲜重(g/尾);L1为试验开始时罗非鱼平均长度(cm);L2为试验结束时罗非鱼平均长度(cm)。
2 结果与分析
2. 1 不同光周期对尼罗罗非鱼生长形态指标的影响
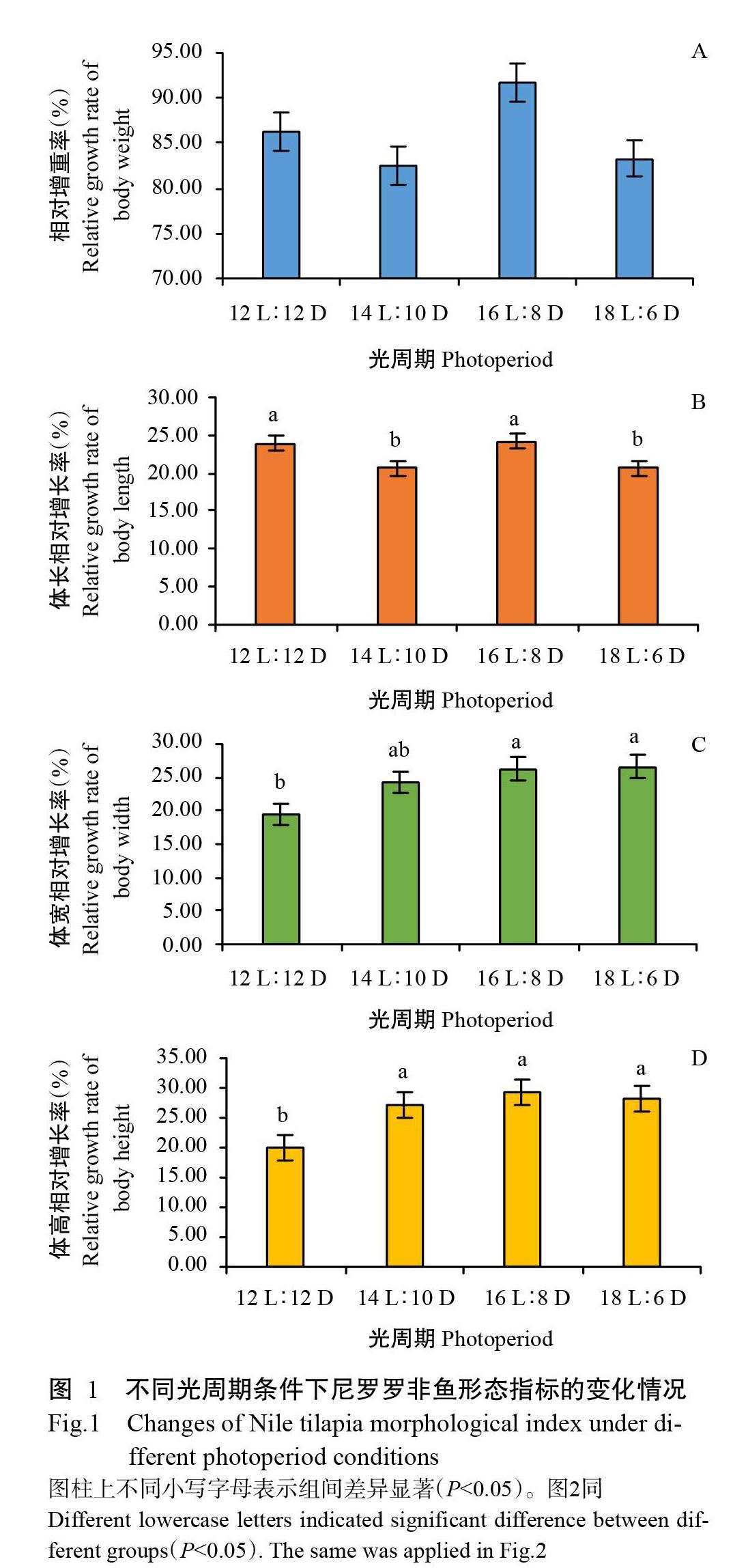
不同光周期条件下尼罗罗非鱼试验前后的形态指标变化如表1所示。不同光周期处理条件下,罗非鱼的相对增重率为79.37%~98.17%,体长相对增长率为20.13%~26.89%,体宽相对增长率为15.93%~28.57%,体高相对增长率为16.75%~33.08%,说明不同光周期对罗非鱼的体重、体高、体长和体宽均产生了影响,但不同形态指标的增长率变化趋势各不相同。其中,罗非鱼的相对增重率随光照时间的延长呈先降后升再降的变化趋势(图1-A),在16 L∶8 D光周期条件下达最大值,即对罗非鱼生长起促进作用;体长相对增长率随光照时间的延长整体上呈下降趋势(图1-B),而体宽(图1-C)和体高(图1-D)的相對增长率随光照时间的延长呈不同程度的上升趋势。
2. 2 不同光周期对尼罗罗非鱼激素含量的影响
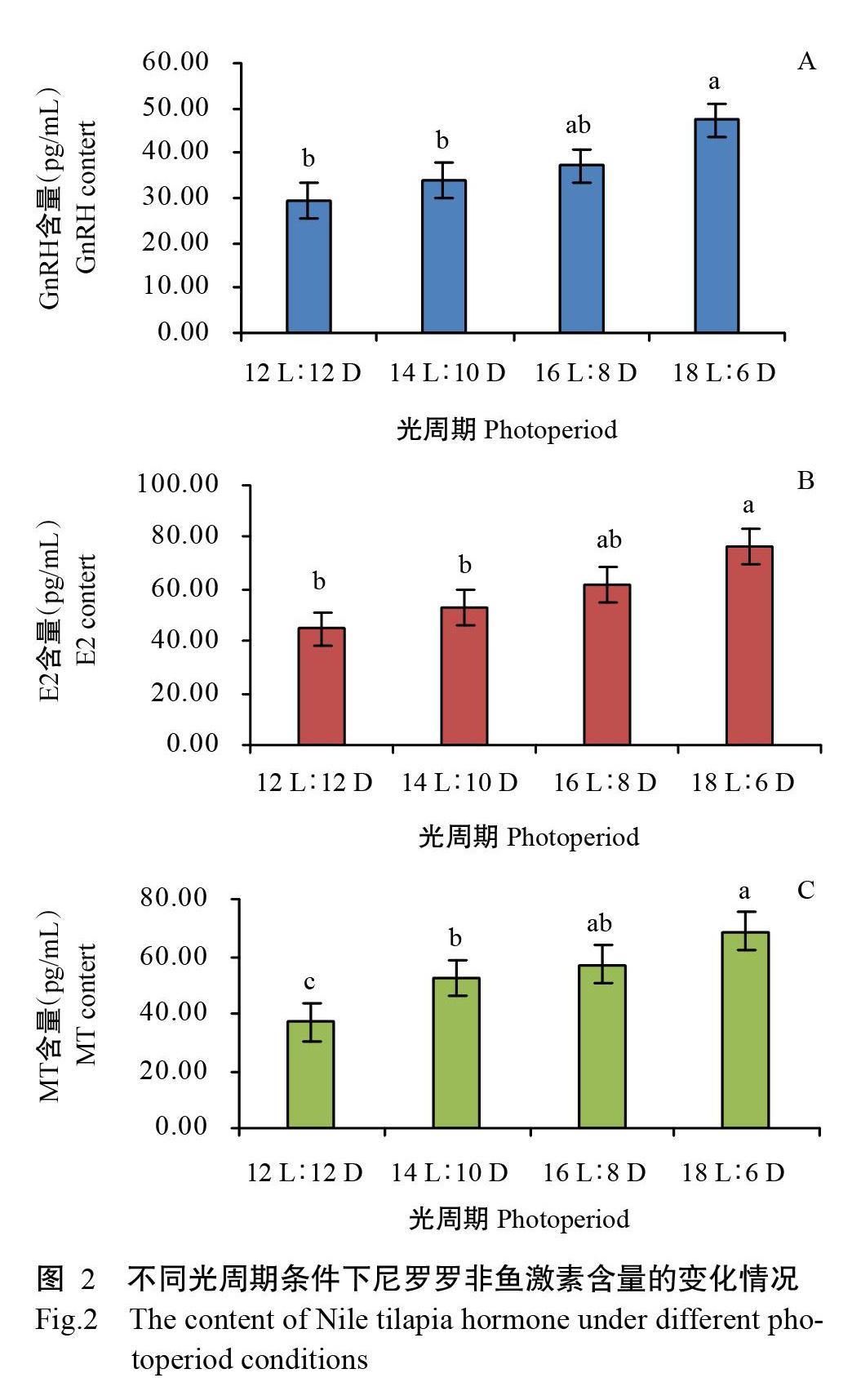
GnRH可激活垂体并释放促性腺激素(GtH),是调节机体性腺发育的重要信号分子(刘闯等,2019);E2作为睾酮芳香化产物,其含量能反映机体性腺的发育情况;MT主要参与鱼类生殖发育等生命活动,其含量受光周期等因素的影响(温海深,2009)。对不同光周期条件下尼罗罗非鱼血清中的GnRH、E2和MT 3种激素含量进行测定,可揭示光周期对罗非鱼性腺发育的影响。由图2可知,随着光照时间的延长,GnRH、E2和MT 3种激素含量呈不同幅度的上升趋势,均在18 L∶6 D光照周期条件下达最大值,显著高于12 L∶12 D和14 L∶10 D光照周期条件下的含量(P<0.05,下同)。其中,GnRH含量(图2-A)和E2含量(图2-B)随光照时间的延长呈逐渐上升趋势,MT含量(图2-C)在14 L∶10 D光照周期条件下出现大幅增长,随后呈缓慢上升趋势,在18 L∶6 D光照周期条件下再次大幅增长。
2. 3 不同光周期对尼罗罗非鱼性腺发育的影响
根据祝斐等(2016)的方法,对尼罗罗非鱼的性腺进行分期。至试验结束时,12 L∶12 D光周期条件下的尼罗罗非鱼卵巢呈囊状,其卵粒清晰可见,呈浅黄色(图3-A);组织切片放大20倍后发现卵母细胞增大,且胞内含有细小卵黄粒,细胞核变大位于正中位置(图3-B),处于卵巢发育第Ⅳ期的早期阶段。14 L∶10 D光周期条件下的尼罗罗非鱼卵巢呈黄色,卵粒增大增多(图3-C);组织切片放大4倍后发现卵黄在细胞内呈放射状分布,细胞核因卵黄挤压而变形(图3-D),处于卵巢发育第Ⅳ期的中期阶段。16 L∶8 D光周期条件下的尼罗罗非鱼卵巢呈深黄色,卵粒饱满易分离,卵巢表面分布有粗血管(图3-E);组织切片放大20倍后发现核膜开始消失、核仁溶解,卵黄均匀分布于整个细胞内,脂肪粒体积最大化(图3-F),处于卵巢发育第Ⅳ期的后期阶段。18 L∶6 D光周期条件下的尼罗罗非鱼卵巢呈肉色,与Ⅱ期相比卵巢变大变粗,可见微细卵粒零星分布在卵巢表面(图3-G);组织切片放大4倍后发现脂肪粒开始在胞内沉积,胞外被滤泡细胞包围(图3-H),处于性腺发育第Ⅲ期。综上所述,适当延长光照时间能有效促进尼罗罗非鱼性腺发育,在16 L∶8 D光照周期条件下促进作用最强,而在18 L∶6 D光照周期下罗非鱼性腺发育受抑制。
3 讨论
光照是自然环境中重要的调控因子,随昼夜和四季的变化而变化,对鱼类发育及繁殖等行为具有显著调控作用(逯尚尉,2010)。光周期变化会导致鱼类的生物节律发生变化,间接影响其摄食行为、新陈代谢和生长发育等系列生命活动。刘宇航等(2010)在对叉尾斗鱼(Macropodus opercularis)的研究中发现,自然条件下叉尾斗鱼在午后会出现明显的摄食高峰,而在24 L∶0 D和0 L∶24 D光周期条件下未出现上述情况。本研究结果表明,不同光周期条件对尼罗罗非鱼的生长发育均产生影响,其中,在14 L∶10 D光周期条件下尼罗罗非鱼的相对增重率与12 L∶12 D光周期条件下相比呈下降趋势,对罗非鱼生长起抑制作用,而在16 L∶8 D光周期条件下罗非鱼的相对增重率出现大幅度上升,对罗非鱼生长起促进作用。这与梁国栋(2014)研究发现延长光照时间能促进尼罗罗非鱼生长发育的结论不一致,因此今后需设计更多光周期条件进行验证。而在18 L∶6 D光周期条件下,尼罗罗非鱼的相对增重率达最低值,体高、体宽和体长的相对增长率均呈下降趋势,表明尼罗罗非鱼在该光周期条件下其生长发育受抑制。可见,16 L∶8 D是尼罗罗非鱼生长的最适光周期,即在生产中适当延长光照时间能促进尼罗罗非鱼生长,但光周期对罗非鱼生长的影响机制还需进一步探究。
光照也是调控水生动物内源性节律发生变化的主要调控因子,鱼类体内激素分泌活动随光周期的变化而变化(逯尚尉,2010)。Biswas等(2004)研究表明,在6 L∶6 D光周期条件下尼罗罗非鱼体内的皮质醇、葡萄糖和Cl?水平远低于应激条件下的尼罗罗非鱼。章龙珍等(2010)比较了3种不同光周期条件下的中华鲟(Acipenser sinensis)幼鱼,结果证实光周期不同显著影响了中华鲟幼鱼的新陈代谢,各项血清生化指标变化差异显著。本研究通过对4种不同光周期条件下的尼罗罗非鱼血清进行分析,结果发现GnRH、E2和MT随光照时间的延长其分泌量不断增多,在18 L∶6 D光周期条件下这3种激素的含量均达最大值,但在该光周期条件下尼罗罗非鱼的生长发育受抑制。究其原因可能是激素分泌过多触发Wnt、Hedgehog和MAPK等信号通路的反馈抑制作用,而导致罗非鱼在18 L∶6 D光周期条件下的生长发育及性腺发育受抑制,但具体原因有待进一步探究。
4 结论
不同光周期会显著影响尼罗罗非鱼的生长及性腺发育,其中16 L∶8 D是尼罗罗非鱼生长及性腺发育的最适光周期,在实际生产中适当延长光照时间可提高罗非鱼产量并促进其性腺发育成熟。
参考文献:
陈文银. 2006. 光周期对黄金鲈鱼生长的影响[J]. 上海海洋大学学报,15(3):303-307. [Chen W Y. 2006. Effects of photoperiod on the growth of yellow perch Perca flavescens[J]. Journal of Shanghai Ocean University,15(3):303-307.]
何凌云,周铭文,孙云章,宋凯,叶继丹. 2018. 饲料牛磺酸含量对不同生长阶段尼罗罗非鱼生长性能的影响[J]. 饲料工业,39(22):14-20. [He L Y,Zhou M W,Sun Y Z,Song K,Ye J D. 2018. Effect of dietary taurine level on growth performance of Nile tilapia(Oreochromis niloticus) at different growth stages[J]. Feed Industry,39(22):14-20.]
黄福江,马秀慧,叶超,刘明典,刘绍平. 2013. 中国结鱼性腺发育的组织学观察[J]. 四川动物,32(3):406-409. [Huang F J,Ma X H,Ye C,Liu M D,Liu S P. 2013. Observation on the gonadal development of Tor(Tor) sinensis[J]. Sichuan Journal of Zoology,32(3):406-409.]
黎炯. 2011. 罗非鱼无乳链球菌的分离、鉴定及重组表面免疫原性蛋白His-Sip的免疫效果初步研究[D]. 上海:上海海洋大学. [Li J. 2011. Isolation and identification of Streptococus agalactiae from tilapia and immunogenicity of protein His-Sip recombinant protein[D]. Shanghai:Shanghai Ocean University.]
李春涛,李雪,赵益群,曾伯平. 2014. 新棘衣棘头虫形态特征及其感染黄鳝的肠道组织病理变化[J]. 南方农业学报,45(10):1881-1885. [Li C T,Li X,Zhao Y Q,Zeng B P. 2014. Morphological characteristics of Pallisentis celatus and pathological changes of the intestine in Monopterus allbus infected by Pallisentis celatus.[J]. Journal of Sou-thern Agriculture,45(10):1881-1885.]
梁国栋. 2014. 几个重要环境因子对罗非鱼生长和发育的联合效应[D]. 湛江:广东海洋大学. [Liang G D. 2014. The combined effect of several important environmental factors on the growth and development of tilapia[D]. Zhan-jiang:Guangdong Ocean University.]
刘闯,李楠,魏巧莉,房晓欢,田见晖,翁士乔,刘彦,李俊杰. 2019. 促性腺激素释放激素及其类似物在母猪繁殖中应用的研究进展[J]. 中国畜牧兽医,46(2):512-518. [Liu C,Li N,Wei Q L,Fang X H,Tian J H,Weng S Q,Liu Y,Li J J. 2019. Research progress on application of gonadotropin-releasing hormone and its analogues in porcine reproduction[J]. China Animal Husbandry & Veterinary Medicine,46(2):512-518.]
劉宇航,陈国柱,林小涛. 2010. 不同光照条件下叉尾斗鱼仔鱼摄食节律[J]. 生态学杂志,29(6):1161-1166. [Liu Y H,Chen G Z,Lin X T. 2010. Feeding rhythms of Macropodus opercularis larvae under different light condition[J]. Chinese Journal of Ecology,29(6):1161-1166.]
刘曾宇,周志成,吕为群. 2019. 光照周期对尼罗罗非鱼幼鱼昼夜节律调节的作用[J]. 上海海洋大学学报,28(2):180-189. [Liu Z Y,Zhou Z C,Lü W Q. 2019. Effects of light cycle on the circadian rhythm of juvenile Nile tilapia Oreochromis niloticus[J]. Journal of Shanghai Ocean University,28(2):180-189.]
逯尚尉. 2010. 不同饵料、密度和光周期对点带石斑鱼(Epinephelus malabaricus)幼鱼的影响[D]. 南京:南京农业大学. [Lu S W. 2010. Effect of different diets,stocking densities and photoperiods on juvenile Epinephelus malabaricus[D]. Nanjing:Nanjing Agricultural University.]
农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会. 2019. 中国渔业统计年鉴[M]. 北京:中国农业出版社. [Fishery and Fishery Administration of Ministry of Agriculture and Rural Affairs, National Fisheries Technology Extension Center, China Society of Fisheries. 2019. China fishery statistical Yearbook[M]. Beijing: China Agriculture Press.]
王金. 2014. 尼罗罗非鱼cyp19a1a多克隆抗体制备及高温诱导对其表达的影响[D]. 南昌:南昌大学. [Wang J. 2014. Polyclonal antibody preparation of cyp19a1a gene in the Nile tilapia(Oreochromis niloticus) and the influence by high temperature induced[D]. Nanchang:Nanchang University.]
温海深. 2009. 水产动物生理学[M]. 青岛:中国海洋大学出版社:296-323. [Wen H S. 2009. Aquatic animal physio-logy[M]. Qingdao:China Ocean University Publishing House:296-323.]
叶乐,胡静,王雨,吴开畅. 2014. 光周期和光照强度对克氏双锯鱼仔鱼存活、生长和发育的影响[J]. 琼州学院学报,21(5):78-86. [Ye L,Hu J,Wang Y,Wu K C. 2014. Effects of light on survival,development and growth of larvae of Amphiprion clarkii[J]. Journal of Qiongzhou University,21(5):78-86.]
张金宗. 2011. 罗非鱼安全越冬管理措施[J]. 农村新技术,(19):34. [Zhang J Z. 2011. Tilapia winter safety management measures[J]. New Rural Technology,(19):34.]
章龙珍,王妤,庄平,刘鉴毅,赵峰,冯广朋,刘健. 2010. 光照对中华鲟幼鱼生长及血液生化指标的影响[J]. 海洋渔业,32(2):141-147. [Zhang L Z,Wang Y,Zhuang P,Liu J Y,Zhao F,Feng G P,Liu J. 2010. The influences of illumination on growth,haematological and biochemical indices of juvenile Chinese sturgeon Acipenser sinensis[J]. Marine Fisheries,32(2):141-147.]
周胜杰,胡静,于刚,杨其彬,杨蕊,刘亚娟,马振华. 2018. 光周期对尖吻鲈仔稚鱼消化酶活性的影响[J]. 海洋科学,42(6):63-69. [Zhou S J,Hu J,Yu G,Yang Q B,Yang R,Liu Y J,Ma Z H. 2018. Effects of photoperiod on digestive enzyme activity in larval and juvenile barramundi Lates calcarifer(Bloch)[J]. Marine Sciences,42(6):63-69.]
祝斐,张志勇,徐献明,張志伟,陈淑吟,贾超峰. 2016. 光周期对松江鲈鱼生长和性腺发育影响的初步研究[J]. 海洋科学,40(9):32-38. [Zhu F,Zhang Z Y,Xu X M,Zhang Z W,Chen S Y,Jia C F. 2016. Preliminary study on growth and gonadal development of reared under diffe-rent photoperiods[J]. Marine Sciences,40(9):32-38.]
Barato P,Martins E,Melo-Cristino J,Iregui C A, Ramirez M. 2015. Persistence of a single clone of Streptococcus agalactiae causing disease in tilapia(Oreochromis sp.) cultured in Colombia over 8 years[J]. Journal of Fish Disea-ses,38(12):1083-1087.
Biswas A K,Maita M,Yoshizaki G,Takeuchi T. 2004. Physiological responses in Nile tilapia exposed to different photoperiod regimes[J]. Journal of Fish Biology,65(3):811-821.
Biswas A K,Takeuchi T. 2002. Effect of different photope-riod cycles on metabolic rate and energy loss of fed and unfed adult tilapia Oreochromis niloticus:Part II[J]. Fishe-ries Science,68(3):543-553.
Campos-Mendoza A,McAndrew B J,Coward K,Bromage N. 2004. Reproductive response of Nile tilapia(Oreochromis niloticus) to photoperiodic manipulation,effects on spaw-ning periodicity,fecundity and egg size[J]. Aquaculture,231(1-4):299-314.
Lago A D A,Rezende T T,Dias M A D,Freitas R T F,Hilsdorf A W S. 2016. The development of genetically improved red tilapia lines through the backcross breeding of two Oreochromis niloticus strains[J]. Aquaculture,472(S1):17-22.
Liang J Y,Chien Y H. 2013. Effects of feeding frequency and photoperiod on water quality and crop production in a tilapia-water spinach raft aquaponics system[J]. International Biodeterioration & Biodegradation,85:693-700.
Rad F,Bozao?lu S,G?zükara S E,Karahan A,Kurt G. 2006. Effects of different long-day photoperiod ds on somatic growth and gonadal development in Nile tilapia(Oreochromis niloticus L.)[J]. Aquaculture,255(1-4):292-300.
Roriz G D,Delphino M K D V C,Gardner I A,Gon?alvesa V S P G. 2017. Characterization of tilapia farming in net cages at a tropical reservoir in Brazil[J]. Aquaculture Reports,6:43-48.
Ridha M T,Cruz E M. 2000. Effect of light intensity and photoperiod on Nile tilapia Oreochromis niloticus L. seed production[J]. Aquaculture Research,31(7):609-617.
Zahran E,Risha E,Abdelhamid F,Mahgoub H A,Ibrahim T. 2014. Effects of dietary Astragalus polysaccharides(APS) on growth performance,immunological parameters,digestive enzymes,and intestinal morphology of Nile tilapia(Oreochromis niloticus)[J]. Fish & Shellfish Immunology,38(1):149-157.
(責任编辑 兰宗宝)
