力竭运动对大鼠肾脏的影响①
2016-08-12陈丽娜周刚吴乐梅雨
陈丽娜,周刚,吴乐,梅雨
力竭运动对大鼠肾脏的影响①
陈丽娜,周刚,吴乐,梅雨
目的观察力竭运动对大鼠肾脏的影响及其机制。方法雄性Sprague-Dawley大鼠14只分为对照组(C组,n=7)和力竭运动组(E组,n=7)。测量定运动后大鼠尿蛋白、尿酸、葡萄糖,血尿素氮;荧光探针法检测肾脏活性氧物质(ROS),Western blotting检测肾脏诱导型一氧化氮合酶(iNOS)、硝基酪氨酸(3-NT)和nephrin蛋白含量;Harris染色观察肾组织形态变化。结果E组大鼠尿蛋白、尿酸、葡萄糖,血尿素氮,及肾ROS、iNOS、3-NT和nephrin蛋白含量均与对照组有显著性差异(P<0.05),肾小球形态改变,毛细血管基底膜增厚变形。结论力竭运动可通过氧化应激机制,导致肾组织结构损伤。
力竭运动;肾;活性氧物质;nephrin;大鼠
[本文著录格式]陈丽娜,周刚,吴乐,等.力竭运动对大鼠肾脏的影响[J].中国康复理论与实践,2016,22(7):789-792.
CITED AS:Chen LN,Zhou G,Wu L,et al.Effect of exhaustive exercise on kidney in rats[J].Zhongguo Kangfu Lilun Yu Shijian,2016,22(7):789-792.
足细胞(pedocyte)是维持肾小球滤过屏障结构和功能正常的主要细胞之一。足细胞足突紧邻肾小球基底膜的裂孔隔膜,裂孔隔膜是肾小球滤过屏障通透性的关键屏障,裂孔蛋白与蛋白尿的产生密切相关[1]。nephrin是维持足细胞结构和功能的主要裂孔隔膜蛋白,nephrin缺乏可导致裂孔膜丧失。
目前对于病理性nephrin异常导致蛋白尿增加已有很多研究。本研究观察大鼠力竭运动后肾组织肾小球细胞变化及nephrin蛋白表达。
1材料与方法
1.1实验动物及分组
PSF级雄性Sprague-Dawley大鼠14只,体质量240~260 g,购于湖南斯莱克景达实验动物有限公司,动物许可证号SCXK(湘)2011-0003。分笼饲养,每笼3~4只,饲养温度20~25℃,自由进食、饮水,自然昼夜光照。
大鼠正常饲养3 d后,按随机数字表法分为安静对照组(C组)和力竭运动组(E组),每组7只。
1.2运动方案
E组采用中等强度力竭跑台运动[2]。采用ZH-PT跑台(淮北正华生物仪器设备有限公司),先进行适应性运动3 d,速度5 m/min,无坡度,每天1次。正式运动3 d,从20 m/min、坡度5%、5 min开始,逐渐增加至24 m/min、坡度10%,直到力竭。运动过程用电刺激进行强迫,刺激强度<1 mA。观察到大鼠汗毛竖起,四肢瘫软,眼神无光,翻转后无法进行翻正反射,电刺激无法继续运动即为达到力竭状态。运动时间多为120~150 min。
1.3样本的采集与处理
正式运动前2 d,运动后将大鼠置于代谢笼6 h禁食,收集尿液,检测尿蛋白、尿糖、尿酸。最后一次力竭运动后立刻取样。
1.3.1血液
末次运动后,大鼠立即腹腔注射10%水合氯醛350 mg/kg,待大鼠出现四肢无力、昏迷、心跳缓慢,掐尾部无反应时取出。固定大鼠四肢,迅速自腹部向上剪开胸腔,暴露心脏,5 ml一次性无菌注射器左心室取血,立刻测定血尿素氮、血糖。
1.3.2尿样
前2次正式运动后置于代谢笼中禁食6 h,收集尿液,检测尿糖、尿酸。末次运动取血后用微量注射器抽取膀胱尿液,分装于试管中,检测尿蛋白。
1.3.3肾组织
迅速取出两侧肾脏,冰上去除脂肪及结缔组织,生理盐水冲洗余血,滤纸吸干。左肾置于1.5 ml离心管,-20℃保存,以备制作显微镜切片;右肾立即密封放入-158℃液氮中冷冻,取出后保存在-80℃超低温冰箱中以备匀浆。
称取右肾组织1 g左右冰上剪碎。每mg组织加入PBS匀浆液(pH=7.4,含5 mmol/L磷酸、250 mmol/L蔗糖、0.1 mmol/L乙二胺四乙酸、1 mmol/L苯甲基磺酰氟和1 mmol/L二硫苏糖醇)10 μl,匀浆后分装两个离心管,一管以3000 r/min离心10 min,取上清液分装后-80℃保存,用于活性氧物质(reactive oxygen species,ROS)、蛋白定量测定;另一管以12,000 r/min离心25 min,取上清液分装-80℃保存,用于诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、硝基酪氨酸(nitrotyrosine,3-NT)、nephrin测定。
1.4测量
1.4.1血尿生化
尿蛋白、尿素氮、尿酸试剂盒购于南京建成生物工程研究所,葡萄糖试剂盒购于上海荣盛生物药业有限公司。常规测定。
1.4.2ROS
采用DCFH-DA荧光探针检测[3]。试剂购于碧云天生物技术研究所。96孔板中测定孔每孔加入肾组织匀浆液200 μl和烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide-adenine dinucleotide phosphate,NADPH)100 µm,对照孔加入等量超氧化物歧化酶(superoxide dismutase,SOD)及DCFH-DA 10µm,混匀,37℃恒温孵育30 min,多功能酶标仪检测,激发波长485 nm,发射波长525 nm。
1.4.3iNOS、3-NT、nephrin
采用Western blotting法,以磷酸甘油醛脱氢酶(glyceradehyde-3-phosphate dehydrogenas,GAPDH)为内参。GAPDH抗体购于杭州贤至生物科技有限公司,iNOS、nephrin抗体购于武汉博士德生物工程有限公司,3-NT抗体购于美国SIGMA-ALDRICH公司。
肾组织蛋白定量采用BCA蛋白浓度测定法,试剂盒购于碧云天生物技术研究所。
采用ImageJ 1.43b软件计算灰度值。
1.4.4肾组织形态
剪取左肾组织2.5~3.5 mm,除去多余组织及脂肪,置于样品托,OCT包埋,PE键迅速冷冻,CM1850冷冻切片机切片,厚0.5µm。常规Harris染色,甲醛固定2 min,二甲苯透明10 min,无水乙醇、95%乙醇、80%乙醇、70%乙醇逐级脱水1 min,Harris苏木紫染色10 min,1%酸性酒精脱色15 s,10× 40光学显微镜下观察,摄片。
1.5统计学分析
2结果
2.1血尿生化
与C组比较,E组尿糖、尿液尿酸升高(P<0.05),尿蛋白、血尿素氮明显升高(P<0.01),血糖显著降低(P<0.001)。见表1。
2.2ROS
E组大鼠肾ROS较C组升高近5倍(P<0.01)。见表1。
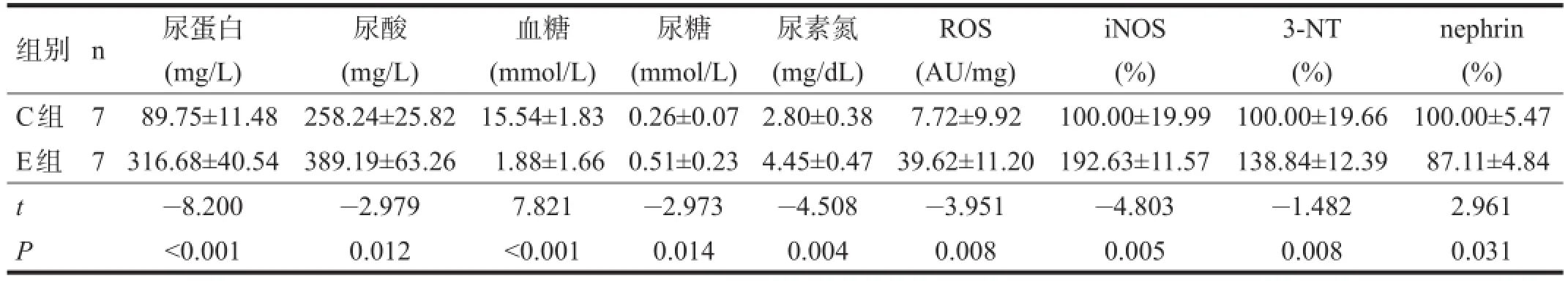
表1 各组生化及蛋白表达比较
2.3iNOS、3-NT、nephrin
E组iNOS明显升高(P<0.01),3-NT含量明显增加(P<0.01),nephrin表达降低(P<0.05)。
2.4形态学观察
C组肾小球形态正常均匀,排列规则。E组肾小球球体肥大,分布减少;毛细血管基底膜增厚,系膜基质增生。见图1。
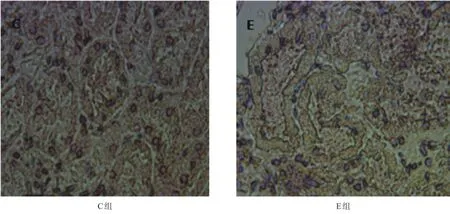
图1 各组大鼠肾组织形态变化(Harris染色,400×)
3讨论
肾小球滤过屏障主要由三层结构组成,由内向外分别为毛细血管内皮细胞、肾小球基底膜以及足细胞。肾小球滤过膜中限制血浆蛋白通过的部位主要为肾小球基底膜和脏层上皮细胞,其中肾小球足细胞及其足突的裂孔隔膜是肾小球的最后一道滤过屏障,并起关键作用。裂孔隔膜的完整性是决定肾小球滤过屏障通透性的关键屏障,而裂孔隔膜上的裂孔蛋白与蛋白尿的发生密切相关[4]。近年关于足细胞裂孔蛋白的研究越来越受到重视,先后发现了nephrin、podocin、CD2相关蛋白等蛋白分子。其中nephrin在维持足细胞形态和足突裂孔隔膜的结构和功能中起重要作用;nephrin表达变化也是蛋白尿生成的一个重要因素[5]。
已有研究表明,剧烈运动时血液重新分配,骨骼肌血流量增加,肾脏血流量降低。肾血流量减少导致肾小球滤过膜和近曲小管出现缺血性改变。扈诗兴等发现,长期有氧训练可致肾组织滤过屏障产生适应性变化,适应增强肾脏功能;而过度训练使有孔内皮变薄,足细胞足突融合成片,滤过屏障面积减小,形态结构受损[6]。在糖尿病肾病模型中,足细胞相关蛋白表达异常可导致足细胞结构和功能的变化,而nephrin是足细胞损伤的早期标志。FoxO1表达上调可以提高PCX、nephrin和desmin表达,并减少糖尿病大鼠肾小球足细胞损伤[7]。
运动性蛋白尿是肾功能不全的早期表现。运动后尿蛋白量可以作为评定运动员身体状态和运动负荷的指标。力竭运动,体内糖原迅速消耗,肾小管重吸收功能下降,葡萄糖随尿排出,而血糖迅速降低。郑伟华等认为,运动训练后尿蛋白、尿酸阳性更容易阻塞肾小管,引起肾内梗阻,而导致运动性肾损害发生[8]。均与本研究结果一致。
NADPH氧化酶大量表达于肾血管、肾小球系膜、足细胞致密斑、后升支段、远端小管和集合管内。生理状态下,NADPH氧化酶活性很低;而在各种生长因子、细胞因子、高血糖和脂质代谢障碍的刺激下,NADPH氧化酶活性升高,导致氧化应激,产生ROS。ROS属于活性高的自由基,极不稳定,可通过脂质过氧化作用造成严重损害[9]。
ONOO-是酪氨酸硝基化形成的终末产物,是蛋白质硝基化的特异性标志物,是氧化应激损伤的重要性环节[10]。由于ONOO-在体内的半衰期极短,研究中通常采用其反应物3-NT来替代。
本实验室前期研究已发现,力竭运动可致ROS生成增加,NADPH氧化酶抑制剂可明显减少ROS的生成,从而减少ONOO-的生成。本研究同样检测到力竭运动后大鼠ROS明显增加;同时大鼠肾组织iNOS、3-NT生成明显增加。提示力竭运动可增加肾组织NADPH氧化酶活性,产生O2-,并与iNOS催化生成的NO反应,产生大量的ONOO-。
有研究认为,NADPH氧化酶4(NOX4)衍生的ROS增加在足细胞中起至关重要的作用,并在糖尿病患者的蛋白尿变化中至关重要。糖尿病诱导nephrin表达减少,足细胞损伤,与糖尿病型蛋白尿相关[11]。ROS通过增强NADPH氧化酶依赖的超氧阴离子生成,增加细胞色素P450 4A家族(CYP4A)和NADPH氧化酶表达,在糖尿病型足细胞损伤和蛋白尿的生成中发挥重要作用[12]。Whaley-Connell认为,NADPH氧化酶活性增加,导致ONOO-生成增加,ONOO-形成稳定的3-NT共轭分子,伴随肾小球纤维化过程[13]。林喜秀等电镜观察发现,急性力竭运动后,肾小球内皮细胞肿胀、成对,胞质连拱状,基膜扭曲塌陷,足细胞胞体脱落,足突融合并出现变异,分布减少,滤过屏障结构破坏明显[14]。可能与NOS的缺乏或过多表达有关。
本研究显示,力竭运动致nephrin蛋白表达减少,ROS、iNOS增加,导致ONOO-生成增加,造成肾滤过屏障破坏,与运动性蛋白尿的生成密切相关。
[1]王岩,吴任宏,陶洪涛.过度运动与肾脏损伤的机制探讨[J].现代预防医学,2013,40(17):3303-3306.
[2]Oner G,Cirrik S.The nephrotoxicity risk in rats subjected to heavy muscle activity[J].J Sports Sci Med,2009,8(3): 481-488.
[3]Zhou G,Kamenos G,Pendem S,et al.Ascorbate protects against vascular leakage in cecal ligation and puncture-induced septic peritonitis[J].Am J Physiol Regul Integr Comp Physiol,2012,302(4):R409-R416.
[4]Pavenstadt H,Kriz W,Kretzler M.Cell biology of the glomerular podocyte[J].Physiol Rew,2003,83(1):253-307.
[5]Langham RG,Kelly DJ,Cox AJ,et al.Proteinuria and the expression of the podocyte slit diaphragm protein,nephrin,in diabetic nephropathy:effects of angiotensin converting enzyme inhibition[J].Diabetologia,2002,45(11):1572-1576.
[6]扈诗兴,胡亚哲,王和平,等.不同负荷游泳运动对大鼠肾脏滤过屏障形态结构和功能影响的研究[J].体育科学,2007,27 (2):42-45.
[7]Guo F,Zhang Y,Wang Q,et al.Effect of FoxO1 on podocyte injury in diabetic rats[J].Biochem Biophys Res Commun,2015,466(2):260-266.
[8]郑伟华,黄学忠,刘瑾,等.运动训练后尿蛋白阳性组与阴性组尿液中尿酸水平的分析[J].检验医学与临床,2014,11(1): 97-98.
[9]束长城,魏万林,高进.ROS在肾性高血压大鼠左室肥厚中的表达及意义[J].中国实用医学,2011,6(1):26-28.
[10]李丽,常波.过度训练导致大鼠运动性蛋白尿机制的研究[J].西安体育学院学报,2007,24(3):80-83.
[11]Jha JC,Thallas-Bonke V,Banal C,et al.Podocyte-specific NOX4 deletion affords renoprotection in a mouse model of diabetic nephropathy[J].Diabetologia,2016,59(2):379-389.
[12]Eid AA,Gorin Y,Fagg BM,et al.Mechanisms of podocyte injury in diabetes:role of cytochrome P450 and NADPH oxidases[J].Diabetes,2009,58(5):1201-1211.
[13]Whaley-Connell A,Habibi J,Nistala R,et al.Attenuation of NADPH oxidase activation and glomerular filtration barrier remodeling with statin treatment[J].Hypertension,2008,51(2): 474-480.
[14]林喜秀,邱继旺,罗自强,等.急性力竭运动模型大鼠鱼腥草干预后的肾滤过屏障变化[J].中国组织工程研究,2014,18 (36):5793-5798.
Effect of Exhaustive Exercise on Kidney in Rats
CHEN Li-na,ZHOU Gang,WU Le,MEI Yu
College of Sport,Hunan University,Changsha,Hunan 410082,China
Correspondence to ZHOU Gang.E-mail:zg460@126.com
Objective To observe the effect of exhaustive exercise on the function of the kidney in rats and explore the mechanism. Methods Fourteen male Sprague-Dawley rats were divided into sedentary control group(group C)and exhaustive exercise group(group E). They were measured the urine protein,uric acid,glucose,and blood urea nitrogen after exercise.The reactive oxygen species,inducible nitric oxide synthase,nitro tyrosine in kidney,and nephrin protein in the kidney were detected with fluorescent probe and Western blotting,respectively,and observed under Harris staining.Results There were significant differences between groups C and E in urine protein,uric acid,glucose,blood urea nitrogen,reactive oxygen species,inducible nitric oxide synthase,nitrotyrosine and nephrin protein(P<0.05).The glomerular morphology and the deformation of capillary basement membrane were found under the fluorescence microscope in group E. Conclusion Exhaustive exercise may damage the structure of kidney in rats,which may associate with oxidative stress.
exhaustive exercise;kidney;reactive oxygen species;nephrin;rats
10.3969/j.issn.1006-9771.2016.07.010
R873
A
1006-9771(2016)07-0789-04
湖南省自然科学基金项目(No.12JJ3093)。
湖南大学体育学院,湖南长沙市410082。作者简介:陈丽娜(1990-),女,汉族,河南商城县人,硕士研究生,主要研究方向:运动氧应激。通讯作者:周刚,男,博士,副教授。E-mail:zg460@126.com。
2016-01-29
2016-03-14)
