NAD+对tMCAO小鼠的脑保护作用
2016-11-11陈昕魏珍玉岳丹丹潘杰钟萍吴丹红
陈昕 魏珍玉 岳丹丹 潘杰 钟萍 吴丹红
NAD+对tMCAO小鼠的脑保护作用
陈昕魏珍玉岳丹丹潘杰钟萍吴丹红
目的探讨烟酰胺腺嘌呤二核苷酸(NAD+)对大脑中动脉短暂阻塞再灌注(tMCAO)小鼠的脑保护作用。方法实验分为正常组、假手术组,缺血2 h再灌注模型组和烟酰胺腺嘌呤二核苷酸组;采用线栓法制作tMCAO小鼠模型;2 h后再灌注时立即腹腔注射NAD+建立tMCAO+ NAD+组;48 h后观察以上4组小鼠行为学的差异,采用苏木素-伊红(HE)染色法对小鼠脑组织进行染色,观察其病理变化及计算梗死体积,利用尼氏染色法检测尼氏小体的变化。结果与正常组及假手术组相比较,tMCAO组出现明显神经损伤性异常行为;tMCAO组脑组织出现严重病理变化,脑梗死体积增大,单位体积脑组织内神经细胞数量减少,尼氏小体减少。tMCAO+NAD+组与tMCAO组比较,神经功能缺损程度明显减轻(P<0.05),梗死体积减小(P<0.01),单位体积脑组织内神经细胞数量多,尼氏小体多。结论NAD+对tMCAO小鼠的脑损伤有一定的保护作用。
缺血再灌注损伤NAD+保护
当急性缺血性脑卒中发生后脑组织出现氧化应激、炎症反应、内皮功能受损、血脑屏障破坏、纤溶系统失平衡、细胞死亡等多种病理生理变化[1-2],在细胞的代谢反应中发挥重要作用的烟酰胺腺嘌呤二核苷酸 (Nicotinamide adenine dinucleotide, NAD+)是脱氢酶的辅酶,其分子式为C21H27N7O14P2,是一种质子传递辅酶,在糖酵解、糖异生、三羧酸循环及呼吸链中发挥着不可替代的作用,同时NAD+作为经典的能量代谢调控分子在维持线粒体功能、能量代谢、钙盐平衡、基因表达等生物学功能中发挥重要作用[3-6]。
由于缺血性脑卒中有效治疗方法的匮乏,探索缺血性脑损伤新的治疗方法及药物一直是脑卒中研究的焦点。近年研究发现NAD+可能是拥有多个靶点的神经保护剂[7]。国外学者发现在暂时性局部脑缺血的大鼠模型中给予NAD+能有效减少水肿形成,提示NAD+对缺血性脑损伤有保护作用[8]。目前国内尚无NAD+与缺血性脑损伤的相关研究,本研究将应用小鼠大脑中动脉短暂阻塞再灌注(temporary middle cerebral artery occlusion,tMCAO)模型进一步证实在急性缺血性脑卒中发生早期给予NAD+是否具有脑保护作用。
1 材料与方法
1.1实验动物
成年健康雄性ICR小鼠32只,体重约(25~30 g),由斯莱克(SLAC)实验动物中心提供。分笼以标准鼠饲料喂养,自由饮水。
1.2主要试剂及试剂盒:
1.2.1NAD+试剂由西格玛公司(Sigma Chemical Co)提供。
1.2.2苏木素-伊红(HE)染色试剂盒、尼氏染色试剂盒由碧云天生物技术研究所提供。
1.2.3其他试剂均为市售分析纯产品。
1.3ICR小鼠中动脉阻塞是再灌注模型制作
1.3.1分组:将小鼠随机分为4组:正常组(control 组),假手术组( sham组),缺血2 h再灌注模型组(tMCAO 组)和烟酰胺腺嘌呤二核苷酸组(tMCAO+NAD+组)。
1.3.2建模:采用线栓法制作小鼠大脑中动脉短暂阻塞(temporary middle cerebral artery occlusion,tMCAO)模型。每组各8只;首先将老鼠仰卧位固定在手术台上,然后腹腔注射氯胺酮(100 mg/kg)和甲苯噻嗪(10 mg/kg)来实现麻醉;然后在手术显微镜下游离左侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA);用6-0线栓穿入颈外动脉残端,结扎分叉处缝线后剪断血管,进入颈内动脉(ICA)颅内段,阻断大脑中动脉(MCA)起始段,线头位于大脑前动脉;用激光多普勒血流仪测量并记录双侧大脑中动脉血流(位置大约在前囟旁3 mm左右处),以降低至基础血供10%以下为建模成功的标准。120 min后将线栓抽回至颈外动脉,以恢复颈内-大脑中动脉的血供,实现再灌注。
1.3.3给药:将NAD+溶解于0.9%的生理盐水中,其中tMCAO+NAD+组在再灌注后立即腹腔注射NAD+生理盐水溶液,给药剂量为50 mg/kg。tMCAO组同时注射同容积生理盐水。
1.3.4行为学评分:tMCAO模型建立后饲养48 h,采用神经损伤行为学评分(LONGA分级法)对4组小鼠术后行为进行评分[9]。具体评分准则如下:0分为无缺陷;1级为不能伸展对侧前肢;2分为对侧前肢屈曲;3分为轻度向对侧转圈;4分为严重向对侧转圈;5分为向对侧跌倒。
1.3.5组织取材及大脑梗死体积计算:四组小鼠在tMCAO模型建立后饲养48 h进行行为学评分后,通过注射水合氯醛处死,取出大脑,冰冻切片,H-E染色观察脑组织损伤。具体步骤如下:先用多聚甲醛固定,然后用苏木素染色液染色,之后用自来水冲洗染液,95%乙醇洗涤,伊红染色液染色,再经过梯度酒精脱水和二甲苯透化,行封片处理,晾干之后,再放于显微镜下进行观察。利用扫描仪拍下切片的H-E全局图片,无着色或者着色浅为梗死区。利用Image Pro Plus计算每个切片梗死对侧半脑面积和梗死区未梗死区面积,差值即为梗死面积,得出每片脑组织的梗死面积、梗死侧脑片的总面积、梗例对侧脑片的总面积,计算梗死体积:总梗死体积=总梗死面积×脑片厚度,并计算单位体积脑组织内神经细胞数量。
1.3.6尼氏染色:用多聚甲醛固定冰冻切片,采用尼氏染色液染色,再用蒸馏水洗涤,再经过梯度酒精脱水、二甲苯透化、封片、晾干之后,放于显微镜下观察分析。
1.3.7统计学处理:应用Graphpad Prism 6软件进行统计分析。采用t检验对4组数据进行比较。
2 结 果
1.神经损伤评分:正常组与假手术组之间(神经损伤评分、大脑梗死体积、尼氏染色)无统计学差异(P>0.05)。与正常组比较,tMCAO组小鼠出现严重程度的神经缺损性症状,表现在小鼠行走严重障碍,向对侧倾倒,缺血对侧前后肢屈曲,按照LONGA法评分,tMCAO模型组得分(3.40±0.24)分(n=8)。与tMCAO组比较,tMCAO+NAD+组小鼠神经缺损性症状明显减轻,小鼠可曲线行走,仅向对侧转圈,行为学评分显著下降至(2.10±0.33)分(n=8)。
2.大脑梗死体积及细胞数量:我们利用脑切片HE染色法评价大脑组织坏死情况。正常组小鼠大脑无损伤,HE着色均匀(图2);tMCAO组脑组织出现严重坏死,缺血区细胞核急剧减少,HE着色淡(图2);NAD+组脑组织坏死体积显著减少(图2)。利用数学模型估算出小鼠脑梗死的体积(图2),tMCAO组小鼠脑梗死体积约为43.26 mm3,NAD+组小梗死体积下降至25.69 mm3。正常组小鼠大脑神经细胞丰富,尼氏染色显示较多神经细胞(图3组);tMCAO组脑组织出现严重坏死,尼氏染色显示神经细胞明显减少(图3组);tMCAO+NAD+组脑组织神经细胞明显增加(图3组)。利用数学模型估算出小鼠脑组织神经细胞存活数量(图3),正常组小鼠脑组织单位体积神经细胞存活数量约为1.48×105/mm3;tMCAO组小鼠脑组织单位体积神经细胞存活数量约为0.65×105/mm3;NAD+组小鼠脑组织单位体积神经细胞存活数量约为1.25×105/mm3。
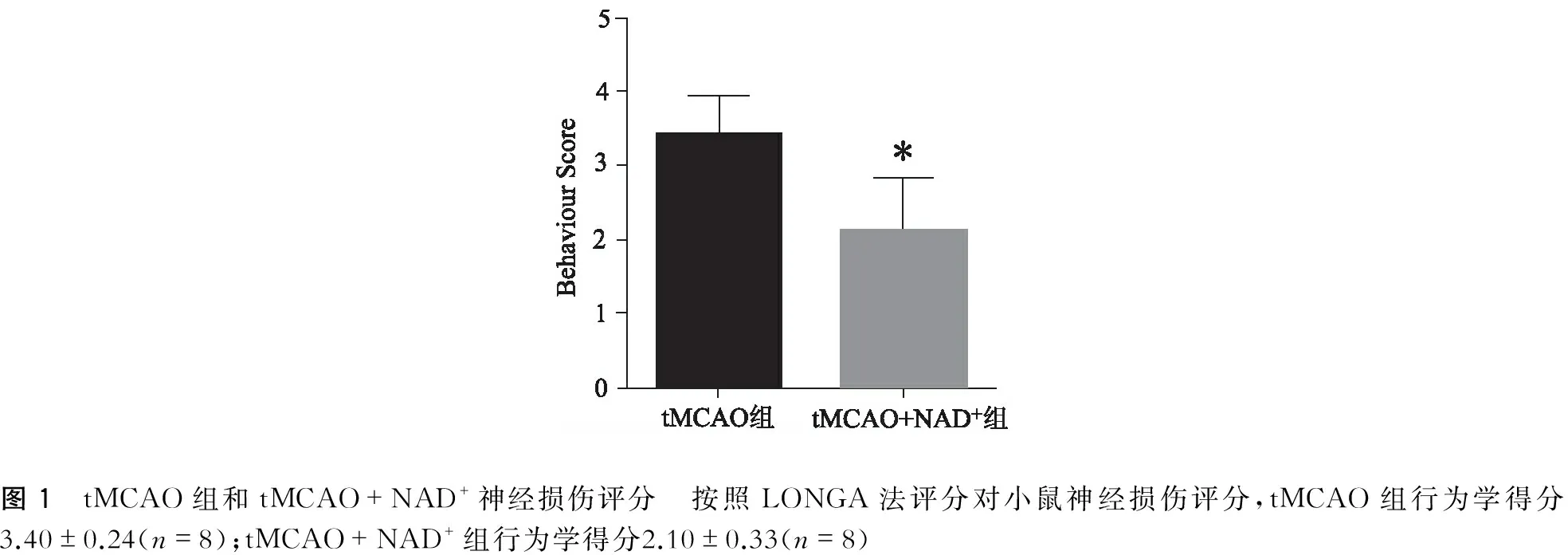
图1 tMCAO组和tMCAO+NAD+神经损伤评分 按照LONGA法评分对小鼠神经损伤评分,tMCAO组行为学得分3.40±0.24(n=8);tMCAO+NAD+组行为学得分2.10±0.33(n=8)

图2 tMCAO组和tMCAO+NAD+组梗死体积 A:正常组小鼠脑切片;B:tMCAO组,着色淡;C:tMCAO+NAD+组,梗死组织明显减少;D:数学模型计算出的2组的梗死体积;与tMCAO+NAD+组比较,*P<0.01
3.尼氏小体:结果发现,tMCAO小鼠梗死核心区尼氏小体急剧减少(图2B,2b),在其半暗带区,尼氏小体数量较正常组显著减少(如图2D,2d),表明蛋白合成能力下降,意味着神经细胞受到严重损伤。

图3 正常组、tMCAO组和tMCAO+NAD+组单位体积内神经细胞数量 A:正常组小鼠脑切片神经细胞数量(HE染色×40倍);tMCAO组单位体积内神经细胞数量明显减少(HE染色×40倍);tMCAO+NAD+组单位体积内神经细胞数量较tMCAO组明显增加(HE染色×40倍);B:数学模型计算出的三组的神经细胞存活数量;与tMCAO组比较,*P<0.01
我们进一步发现给药NAD+,梗死核心区细胞数高于tMCAO模型组,低于正常组(图2C,2c),在半暗带区尼氏小体细胞数高于tMCAO组,低于正常组(图2E,2e);结果提示,缺血再灌注损伤对神经细胞蛋白合成功能有严重影响,NAD+对蛋白功能损伤有保护效果。

图4 正常组、tMCAO组和tMCAO+NAD+组尼氏小体数目 A,B,C,D,E为5X物镜,a,b,c,d,e为20X物镜。A,a为正常组,尼氏小体丰富;B,b为tMCAO组缺血核心区,尼氏小体急剧减少;C,c为tMCAO+NAD+组缺血核心区,尼氏小体数目上调;D,d为tMCAO组半暗带区域,靠近缺血测尼氏小体数目减少;E,e为tMCAO+NAD+组半暗带区域,尼氏小体数目较tCMAO组回调
3 讨 论
NAD+不仅是经典的能量代谢调控分子[10-11],而且还参与介导细胞死亡和其他多种生物学过程,由于 NADH/NAD+是细胞还原势能的标识,因此它在细胞许多氧化还原反应中扮演重要的作用[12]。有研究提示NAD+对脑卒中后的脑损伤具有保护作用,也研究证明NAD+能够减少氧化应激诱导的神经元和星形胶质细胞的死亡[13-14]。有关脑缺血的动物模型研究发现在暂时性局部脑缺血的动物模型中通过鼻腔给予NAD+能显著减少缺血性脑损伤:在缺血开始2 h后给予NAD+能有效减小水肿形成,并且可以抑制脑缺血诱导的皮质和海马细胞自噬作用,从而可以减轻缺血性脑损伤[15]。同时也有研究表明NAD+能减少由于DNA烷化试剂、轴突损伤、OGD和锌离子等刺激导致的神经细胞死亡[14]。
本研究重点探讨NAD+对成年雄性小鼠发生脑缺血再灌注后的脑保护作用。
通过选取易于麻醉和控制、脑血管解剖和生理机能和人类相似、实验重复性好的小鼠作为实验对象,建立小鼠短暂性局灶性脑缺血再灌注模型来探讨脑血管疾病的发病早期内NAD+对脑组织的保护作用。tMCAO模型有不开颅、准确控制缺血和再灌注时间等优点,目前普遍认为是短暂性局灶性脑缺血再灌注模型的标准模型。
为了探讨NAD+对tMCAO小鼠模型的脑保护作用,本研究采用观察神经损伤行为学评分、脑组织梗死体积、单位体积脑组织内神经细胞数量、尼氏染色后尼氏小体数量等评估不同处理小鼠的脑损伤程度。
本实验建立小鼠tMCAO模型,观察到缺血性脑卒中发生早期(48 h),与正常组比较,tMCAO组小鼠出现严重的神经缺损症状,同时脑组织出现严重病理变化,脑梗死体积增大,单位体积脑组织内神经细胞数量减少,尼氏小体减少;tMCAO+NAD+组与tMCAO组比较,小鼠神经功能缺损程度明显减轻,梗死体积减小,单位体积脑组织内神经细胞数量增多,尼氏小体较多。这与其他关于NAD+脑保护作用的研究结果[15]基本一致,也再次证明了NAD+对缺血性脑损伤有保护作用。
脑缺血过程是一个复杂的病理过程,它会导致脑内发生多种变化,如氧化应激的产生、能量的耗竭、离子流的平衡被打破等。通常活性氧(ROS)和自由离子的不平衡导致的氧化应激被认为是导致缺血性脑损伤的主要因素之一。在脑缺血再灌注过程中 ROS可通过多个途径产生。NAD+不仅是经典的能量代谢调控分子[10-11],还参与介导细胞死亡和其他多种生物学过程。研究表明细胞内NAD+的剥夺可以介导 RARP-1 诱导的细胞死亡,NAD+的水平也影响细胞抗氧化能力和氧化应激的产生。由于 NADH/NAD+是细胞还原势能的标识,因此它在细胞许多氧化还原反应中扮演重要的作用[12]。此外, NAD+可以通过丙酮酸脱氢酶来抑制 ROS 的产生。有研究证明NAD+能够减少氧化应激诱导的神经元和星形胶质细胞的死亡[13-14]。
本研究结果证明了NAD+对缺血性脑损伤有保护作用。NAD+有可能成为治疗缺血性脑卒中的一个新靶点。今后需在NAD+对缺血性脑损伤保护作用的具体机制研究方面进一步深入。
[1]Whiteley W,Wardlaw J,Dennis M,et al.The use of blood biomarkers to predict poor outcome after acute transient ischemic attack or ischemic stroke[J].Stroke,2012,43(1):86-91.
[2]Whiteley W,Jackson C,Lewis S,et al.Inflammatory markers and poor outcome after stroke: a prospective cohort study and systematic review of interleukin-6[J].PLoS Med,2009,6(9):e1000145.
[3]Ziegler M.New functions of a long-known molecule[J].Emerging roles of NAD in cellular signaling.Eur J Biochem,2000,267(6):1550-1564.
[4]Rutter J, Reick M, Wu LC, et al. Regulation of clock and NPAS2 DNA binding by the redox state of NAD cofactors[J].Science,2001,293(5529):510-514.
[5]Imai SI.The NAD world: a new systemic regulatory network for metabolism and Aging-Sirt1, systemic NAD biosynthesis, and their importance[J].Cell Biochem Biophys,2009,53(2):65-74.
[6]Wang JY,Dennert G.Regulation of cytotoxic T cells by ecto-nicotinamide adenine dinucleotide(NAD)correlates with cell surface GPI-anchored/arginine ADP-ribosyltransferase[J].J Immunol,1994,153(9):4048-4058.
[7]Alano CC,Garnier P,Ying W,et al.NAD+ depletion is necessary and sufficient for poly(ADP-ribose) polymerase-1-mediated neuronal death[J].J Neurosci,2010,30(8):2967-2978.
[8]Liu D, Pitta M, Mattson MP.Preventing NAD(+)depletion protects neurons against excitotoxicity:bioenergetic effects of mild mitochondrial uncoupling and caloric restriction[J].Ann N Y Acad Sci,2008,1147:275-282.
[9]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[10]Virag L,Szabo C.The therapeutic potential of poly(ADP-ribose)polymerase inhibitors[J].Pharmacol Rev,2002,54(3):375-429.
[11]Ying W, Garnier P, Swanson RA.NAD+repletion prevents PARP-1-induced glycolytic blockade and cell death in cultured mouse astrocytes[J].Biochem Biophys Res Commun,2003,308:809-813.
[12]Starkov AA,Fiskum G, chinopoulos C, et al. Mitochondrial alpha-ketoglutarate dehydrogenase complex generates reactive Oxygen species[J].J Neurosci,2004,24(36):7779-7788.
[13]Alano C, Ying W, Swanson RA.Polymerase-1-mediated cell death in astrocytes requires NAD+depletion and mitochondrial permeability transition[J].J Biol Chem,2004,279(18):18895-18902.
[14]Ying W,Wei G, Wang D, et al. Intranasal administration with NAD+profoundly decreases brain injury in a rat model of transient focal ischemia[J].Front Biosci,2007,12:2728-2734.
[15]Zheng C,Jin H,Xia WL,et al.Weihai Ying NAD+administration decreases ischemic brain damage partially by blocking autophagy in a mouse model of brain ischemia[J].Neurosci Lett,2012,512(2):67-71.
(2016-03-01收稿)
Treatment of NAD+protects transient middle cerebral artery occlusion in the mouse model of tMCAO
ChenXin,WeiZhenyu,YueDandan,etal.
DepartmentofNeurology,theThirdPeople'sHospitalAffiliatedtoShanghaiJiaotongUniversitySchoolofMedicine,Shanghai201999
ObjectiveTo explore the effect of NAD+treatment for AIS in the mouse model of transient focal brain ischemia(tMCAO). MethodsAnimals was divided into control group, sham group, tMCAO group and tMCAO+NAD+group. tMCAO model was generated by nylon suture method. We built the tMCAO+NAD+group by the intra-peritoneal injection NAD+50 mg/kg immediately after reperfusion. The behaviour was quantified 48hours later. HE-staining was performed to compared pathological changes and infarct volumes by, meanwhile, nissl staining was used to detect the Nissl changes. ResultsCompare to the sham group, 48hours after ischemia, severe damages were determined in tMCAO group, including pathological changes, increasing infarct volumes, decreaseing of neurones and Nissl signals. compared to the the tMCAO group,the tMCAO+NAD+group had significant decreases of infarct volumes(P<0.01), less neurological deficits(P<0.05) and more neurones and the Nissl signals. ConclusionOur study indicated the protective effort of NAD+for brain after transient middle cerebral artery occlusion.
Reperfusion injuryNAD+Protection
宝山区科委基金(11-E-3);上海交通大学医学院基金(13×J10030)
201999上海交通大学医学院附属第九人民医院神经内科[陈昕魏珍玉岳丹丹潘杰吴丹红(通信作者)];上海市中西医结合医院脑病科(钟萍)
R743
A
1007-0478(2016)05-0318-05
10.3969/j.issn.1007-0478.2016.05.003
