复方脑肽节苷脂注射液激活线粒体自噬改善脑缺血再灌注损伤①
2016-08-12王明洋冯璐范姝婕郑吉李冬梅杨楠左萍萍刘雁勇
王明洋,冯璐,范姝婕,郑吉,李冬梅,杨楠,左萍萍,刘雁勇
复方脑肽节苷脂注射液激活线粒体自噬改善脑缺血再灌注损伤①
王明洋,冯璐,范姝婕,郑吉,李冬梅,杨楠,左萍萍,刘雁勇
目的观察复方脑肽节苷脂注射液(CPCGI)对大鼠脑缺血再灌注损伤的保护作用并探讨其机制。方法Sprague-Dawley大鼠随机分成假手术组、模型组、CPCGI低剂量治疗组、CPCGI高剂量治疗组、阳性药金纳多组,每组10只。线栓法制备大鼠大脑中动脉梗阻2 h后复灌模型,即刻给药,连续14 d。术后1 d、3 d、7 d和14 d行神经功能症状缺损评分,术后14 d行贴纸去除及平衡木行走实验,Western blotting检测损伤周围脑组织Beclin1、PINK1及Parkin的表达。结果术后14 d,与模型组相比,各给药组大鼠神经功能缺损评分降低(P<0.05),大鼠过杆时间明显缩短(P<0.01),CPCGI给药组去除两侧前肢贴纸的时间缩短(P<0.05)。模型组皮层组织中Beclin1及Parkin蛋白表达明显下降(P<0.01),PINK1蛋白表达明显上升(P<0.01),CPCGI各组均能逆转该作用(P<0.05)。结论CPCGI的神经保护作用机制之一可能与激活线粒体自噬,改善线粒体功能有关。
脑缺血再灌注损伤;复方脑肽节苷脂注射液;线粒体自噬;大鼠
[本文著录格式]王明洋,冯璐,范姝婕,等.复方脑肽节苷脂注射液激活线粒体自噬改善脑缺血再灌注损伤[J].中国康复理论与实践,2016,22(7):750-753.
CITED AS:Wang MY,Feng L,Fan SJ,et al.Effect of Compound Porcine Cerebroside and Ganglioside Injection on cerebral ischemia-reperfusion injury in rats[J].Zhongguo Kangfu Lilun Yu Shijian,2016,22(7):750-753.
脑卒中是目前全球第二大致死性疾病,且致残率最高[1-2]。神经保护剂对脑卒中患者的恢复有重要作用[3]。复方脑肽节苷脂注射液(Compound Porcine Cerebroside and Ganglioside Injection,CPCGI)是一复方制剂,其主要成分为多肽、多种神经节苷脂、次黄嘌呤等。临床研究显示,CPCGI对阿尔茨海默病有明显改善作用[4],并可用于脑缺血等脑部疾病引起的功能障碍的治疗。但其药理作用机制有待进一步探讨。
缺血再灌注损伤是脑卒中重要的病理生理机制之一,而线粒体功能障碍在此过程中发挥着重要作用[5]。由于神经元的正常生理活动依赖于线粒体产生的ATP作为能量供体[6],调控并维持线粒体的正常功能对神经系统功能的执行至关重要[7-8]。本研究采用大鼠大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)模型,从改善线粒体功能方面对CPCGI的抗脑缺血再灌注损伤机制进行药效学评价。
1材料和方法
1.1试剂
CPCGI(国药准字H22026472):吉林步长制药有限公司。银杏叶提取物注射液(金纳多):中豪国际有限公司。硅胶线栓:北京西浓科技有限公司。戊巴比妥钠:SIGMA公司。小鼠抗Parkin抗体、兔抗Beclin1抗体:CST公司。兔抗PINK1抗体:SANTA CRUZ公司。小鼠抗β-actin抗体、辣根酶标记山羊抗小鼠二抗及辣根酶标记山羊抗兔二抗:北京中杉金桥生物技术有限公司。Western blotting实验相关材料:北京普利莱生物技术有限公司。
1.2实验动物及分组
健康雄性Sprague-Dawley大鼠,体质量260~280 g,由中国人民解放军军事医学科学院实验动物中心提供,质量合格证号SCXK(军)2012-0004。SPF级环境饲养,光照12 h/12 h明暗交替,自由饮食。大鼠适应环境7 d后,线栓法制备大鼠脑缺血再灌注模型。将模型制作成功的大鼠采用随机数字表法随机分成模型组、CPCGI低剂量治疗组(0.5 ml/kg,相当于多肽1.6 mg/kg,腹腔注射)、高剂量治疗组(1 ml/kg,相当于多肽3.2 mg/kg,腹腔注射)、金纳多组(50 mg/kg,腹腔注射),每组大鼠10只。各组大鼠缺血2 h后再灌注即开始给药。假手术组和模型组大鼠给生理盐水1 ml/kg腹腔注射。连续给药14 d。
1.3模型制备
参照Longa法[9]建立大鼠MCAO模型。术前12 h禁食不禁水。大鼠1%戊巴比妥钠50 mg/kg腹腔注射麻醉,仰卧位固定于手术台上。备皮,碘伏消毒。沿颈正中线切开皮肤,钝性分离右侧颈部肌肉,暴露右侧颈总动脉、颈外动脉及颈内动脉。结扎颈总动脉近心端及颈外动脉,在距分支5 mm处用动脉夹夹闭颈总动脉远心端。在颈总动脉远心端结扎处与动脉夹之间剪一小口,插入直径0.26 mm的圆头硅化栓线(用0.1%多聚赖氨酸包被)至颈内动脉,最终栓线头部膨大端进入大脑中动脉阻断血流供应。2 h后小心抽出栓线。手术过程注意大鼠保温。
假手术组只进行手术过程而不插线。
1.4行为学评价
1.4.1神经功能缺损评分
各组动物分别在术后1 d、3 d、7 d和14 d进行神经功能缺损评分[10],包括运动、感觉、反射和平衡能力测试等[11]。分数越高,损伤越严重。
1.4.2贴纸去除实验
各组动物术后14 d行贴纸去除实验[12]。用2片边长10 mm的正方形粘性纸将大鼠2个前肢掌面粘住(粘性程度以正常大鼠10 s内将粘性纸咬掉为佳),将大鼠置于测试圆筒中,大鼠会本能地将纸片咬掉。观察并记录大鼠去除两侧纸片的总时间,若120 s内未去除纸片,记为120 s。
1.4.3平衡木行走实验
各组动物术后14 d行平衡木行走实验[13]。平衡木为105×4×3 cm木条,两端固定使木条离地80 cm。起始点为陡峭平台,终点为一平台。记录大鼠四肢均通过整个平衡木的时间;超过120 s未通过整个平衡杆记为120 s,大鼠从平衡杆跌落记为超过120 s未通过。测试前大鼠每天训练1次,共训练2 d。
1.5Western blotting
除金纳多组外,各组动物于行为学评价结束后立即断头处死,分离脑组织,于液氮中猝冷。取损伤侧大脑皮层组织50 mg左右,置于冰上的EP管中,加入10倍体积组织裂解液(RIPA∶蛋白酶抑制剂∶蛋白磷酸酶抑制剂=100∶1∶1),冰浴中超声破碎仪破碎1 min,充分匀浆后冰上裂解20 min;4℃12000 r/min离心15 min,取上清。Bradford法测定蛋白浓度。4∶1比例加入5×蛋白上样缓冲液,97℃变性6 min,取蛋白样品50 μg行SDS-PAGE电泳。80 V恒压电泳至样品进入分离胶后调整为110 V恒压电泳,直至溴酚蓝条带接近电泳槽底部;200 mA恒流电转将蛋白印迹转移到PVDF膜上;加入5%脱脂奶粉封闭1 h;去除封闭液,加入稀释好的一抗(小鼠抗Parkin抗体,1 ∶1000;兔抗PINK1抗体,1∶200;兔抗Beclin1抗体,1∶1000;小鼠抗β-actin抗体;1∶1000),4℃过夜;洗膜后加入稀释好的二抗(辣根过氧化物酶标记山羊抗小鼠、山羊抗兔二抗,1∶5000),室温孵育1h;膜清洗后置于ECL发光液中显色,ECL荧光检测仪中显影。Gelpro软件灰度扫描,采用百分比归一法比较各组之间目的蛋白的表达。
1.6统计学分析
2结果
2.1神经功能缺损评分
假手术组无明显神经功能损伤。与假手术组相比,模型组大鼠神经功能缺损评分在术后1 d、3 d、7 d和14 d均显著增加(P<0.001),各给药组大鼠经过治疗14 d后,与模型组相比降低(P<0.05)。见表1。
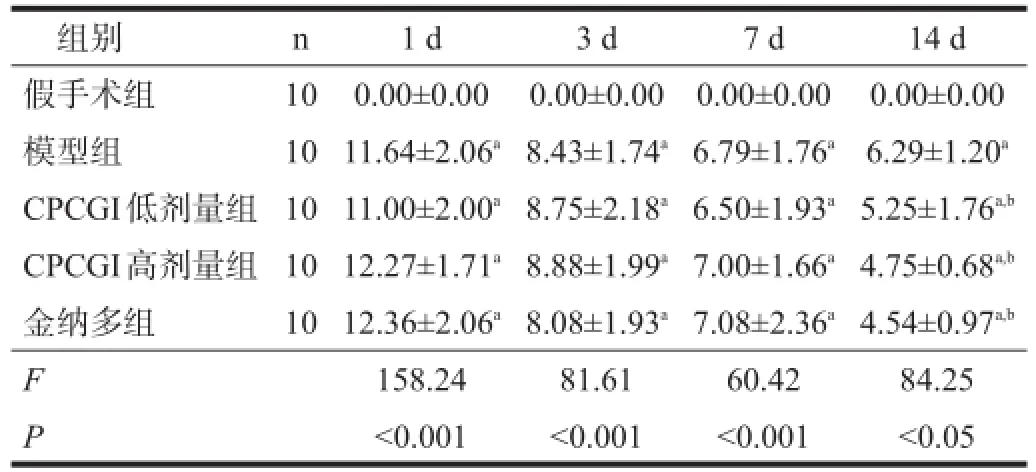
表1 各组神经功能缺损评分比较
2.2贴纸去除实验
模型组去除贴纸时间与假手术组相比显著延长(P<0.001)。CPCGI低、高剂量组去除贴纸时间均较模型组缩短(P<0.05)。见表2。
2.3平衡木行走实验
模型组过杆时间与假手术组大鼠相比显著延长(P<0.001)。CPCGI低、高剂量组,金纳多组过杆时间与模型组相比明显缩短(P<0.01)。见表2。

表2 各组感觉及运动功能比较(s)
2.4Western blotting
模型组Beclin1的表达较假手术组明显降低(P<0.01),而CPCGI低、高剂量组均能提高其表达(P<0.05)。
模型组PINK1的表达较假手术组明显升高(P<0.01),Parkin表达明显降低(P<0.01)。CPCGI低、高剂量组PINK1表达较模型组降低(P<0.05),CPCGI高剂量组Parkin表达升高(P<0.05)。见表3。
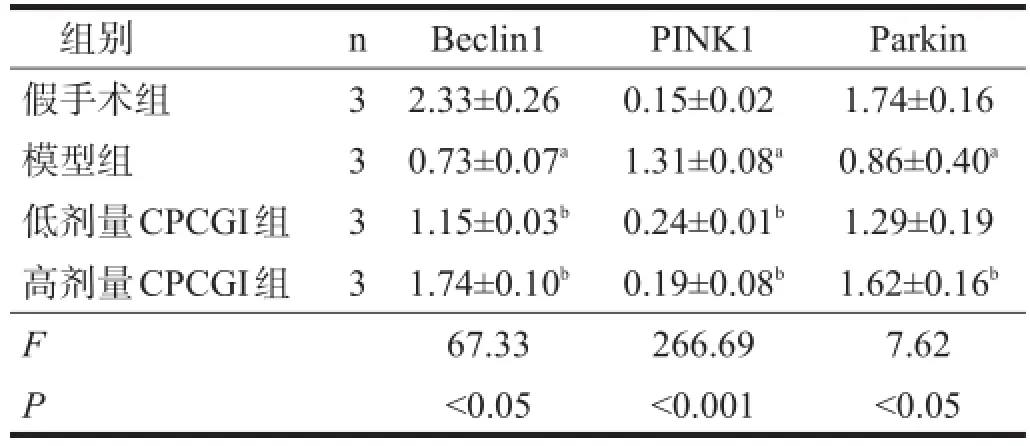
表3 各组脑组织Beclin1、PINK1及Parkin蛋白表达
3讨论
本研究显示,CPCGI对脑缺血再灌注损伤的治疗作用与阳性药金纳多疗效相当,能促进模型大鼠的感觉功能及躯体运动协调功能的恢复。
脑缺血再灌注损伤使脑神经元内线粒体膜通透性改变及线粒体通透性转换孔开放,细胞色素C大量释放等,导致线粒体功能障碍[14]。受损线粒体不仅无法产生足够能量供给神经元,还会生成活性氧、自由基,导致氧化损伤进一步加重[15]。
自噬的主要功能是将胞质中一些损坏的细胞器通过溶酶体途径降解,实现能量的再循环,以维持细胞自身的稳定[16]。Beclin1是哺乳动物细胞自噬的标记性蛋白,主要调控自噬体的形成与成熟,属特异性基因[17-18]。我们检测到模型组大鼠损伤侧皮层组织蛋白中Beclin1表达显著下调,说明细胞自噬水平明显下降,经CPCGI治疗可剂量依赖地恢复Beclin1表达,使细胞恢复自噬能力。
线粒体选择性自噬机制的PINK1/Parkin通路在清除受损线粒体过程中也发挥重要作用[19-22]。正常情况下,PINK1表达于所有线粒体上,并由蛋白水解酶降解;而受损的线粒体由于蛋白水解酶活性被抑制,PINK1会持续累积[23]。本研究显示,模型组大脑皮层组织中PINK1的表达显著升高,说明线粒体自噬功能障碍,CPCGI治疗可逆转这一变化。此外,Parkin参与的泛素蛋白酶体系统对于体内毒素和代谢物的清除以及细胞修复起到重要作用[24-25]。本研究显示,模型组大脑皮层组织中Parkin蛋白表达降低,CPCGI则可以逆转该损伤,激活线粒体自噬,有利于清除受损线粒体,保护正常线粒体功能,从而改善缺血再灌注损伤。
综上所述,CPCGI对急性脑缺血再灌注损伤大鼠的神经功能、感觉及运动功能均有较好的保护作用,其作用机制之一可能是通过激活线粒体自噬功能发挥的。详细作用机制尚待进一步探讨。
[1]Donnan GA,Fisher M,Macleod M,et al.Stroke[J].Lancet,2008,371(9624):1612-1623.
[2]Moskowitz MA,Lo EH,Iadecola C.The science of stroke: mechanisms in search of treatments[J].Neuron,2010,67(2): 181-198.
[3]Patyar S,Prakash A,Modi M,et al.Role of vinpocetine in cere
brovascular diseases[J].Pharmacol Rep,2011,63(3):618-628.
[4]王虹,姜慧强,李军,等.复方脑肽节苷脂注射液治疗阿尔茨海
默病临床研究总结[J].中国社区医师:医学专业,2010,12 (254):127-128.
[5]Anne Stetler R,Leak RK,Gao Y,et al.The dynamics of the mitochondrial organelle as a potential therapeutic target[J].J Cereb Blood Flow Metab,2013,33(1):22-32.
[6]Court FA,Coleman MP.Mitochondria as a central sensor for axonal degenerative stimuli[J].Trends Neurosci,2012,35(6): 364-372.
[7]Liu W,Tian F,Kurata T,et al.Dynamic changes of mitochondrial fusion and fission proteins after transient cerebral ischemia in mice[J].J Neurosci Res,2012,90(6):1183-1189.
[8]Besancon E,Guo S,Lok J,et al.Beyond NMDA and AMPA glutamate receptors:emerging mechanisms for ionic imbalance and cell death in stroke[J].Trends Pharmacol Sci,2008,29(5): 268-275.
[9]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91.
[10]Chen J,Li Y,Wang L,et al.Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats[J].Stroke,2001,32(4):1005-1011.
[11]Germano AF,Dixon CE,d'Avella D,et al.Behavioral deficits following experimental subarachnoid hemorrhage in the rat[J]. J Neurotrauma,1994,11:345-353.
[12]Zhang L,Chen J,Li Y,et al.Quantitative measurement of motor and somatosensory impairments mild(30 min)and severe (2 h)transient middle cerebral artery occlusion in rats[J].J Neurol Sci,2000,174(2):141-146.
[13]Altumbabic M,Peeling J,Del Bigio MR.Intracerebral hemorrhage in the rat:effects of hematoma aspiration[J].Stroke,1998,29(9):1917-1923.
[14]Gu L,Xiong X,Zhang H,et al.Distinctive effects of T cell subsets in neuronal injury induced by cocultured splenocytes in vitro and by in vivo stroke in mice[J].Stroke,2012,43(7): 1941-1946.
[15]Federico A,Cardaioli E,Da Pozzo P,et al.Mitochondria,oxidative stress and neurodegeneration[J].J Neurol Sci,2012,322 (1-2):254-262.
[16]Liu K,Sun Y,Gu Z,et al.Mitophagy in ischaemia/reperfusion induced cerebral injury[J].Neurochem Res,2013,38(7): 1295-1300.
[17]McKnight NC,Zhenyu Y.Beclin 1,an essential component and master regulator of PI3K-III in health and disease[J].Curr Pathobiol Rep,2013,1(4):231-238.
[18]Cao Y,Klionsky DJ.Physiological functions of Atg6/Beclin1: a unique autophagy-related protein[J].Cell Res,2007,17(10): 839-849.
[19]Wang X,Winter D,Ashrafi G,et al.PINK1 and Parkin target Miro for phosphorylation and degradation to arrest mitochondrial motility[J].Cell,2011,147(4):893-906.
[20]Poole AC,Thomas RE,Andrews LA,et al.The PINK1/Parkin pathway regulates mitochondrial morphology[J].Proc Natl Acad Sci U SA,2008,105(5):1638-1643.
[21]Eiyama A,Okamoto K.PINK1/Parkin-mediated mitophagy in mammalian cells[J].Curr Opin Cell Biol,2015,33:95-101.
[22]Hattori N,Saiki S,Imai Y.Regulation by mitophagy[J].Int J Biochem Cell Biol,2014,53:147-150.
[23]Vives-Bauza C,Zhou C,Huang Y,et al.PINK1-dependent recruitment of Parkin to mitochondria in mitophagy[J].Proc NatlAcad Sci USA,2010,107(1):378-383.
[24]Zhang CW,Hang L,Yao TP,et al.Parkin regulation and neurodegenerative disorders[J].Front Aging Neurosci,2016,7: 248.
[25]Hamacher-Brady A,Brady NR.Mitophagy programs:mechanisms and physiological implications of mitochondrial targeting by autophagy[J].Cell Mol Life Sci,2016,73(4):775-795.
Effect of Compound Porcine Cerebroside and Ganglioside Injection on Cerebral Ischemia-reperfusion Injury in Rats
WANG Ming-yang,FENG Lu,FAN Shu-jie,ZHENG Ji,LI Dong-mei,YANG Nan,ZUO Ping-ping,LIU Yan-yong
Department of Pharmacology,Institute of Basic Medical Sciences,Neuroscience Center,Chinese Academy of Medical Sciences&School of Basic Medicine,Peking Union Medical College,Beijing 100005,China
Correspondence to LIU Yan-yong.E-mail:liuyanyong@126.com
Objective To investigate the neuroprotective effect and possible mechanism of Compound Porcine Cerebroside and Ganglioside Injection(CPCGI)on cerebral ischemia-reperfusion injury in rats.Methods Healthy adult male Sprague-Dawley rats were divided into sham group(n=10),model group(n=10),CPCGI low dosage group(n=10)and high dosage group(n=10),and control group(Ginkgo biloba extract,n=10).All the rats was subjected to middle cerebral artery occlusion(MCAO)for two hours and reperfusion except sham group,and received treatment for fourteen days once reperfusion started.They were tested with modified Neurological Severity Score one,three,seven and fourteen days after MCAO,and adhesive-removal test and beam-walking test fourteen days after MCAO.The expression of Beclin1,PINK1 and Parkin were detected with Western blotting.Results Compared with the model group,the Neurological Severity Score reduced (P<0.05)and the time crossing the beam reduced(P<0.01)in all the medical groups fourteen days after MCAO,and the time removing the adhesive paper reduced in the CPCGI groups(P<0.01).The expression of Beclin1 and Parkin decreased and the PINK1 level increased in the model group(P<0.01),and it was reversed in all the CPCGI groups(P<0.05).Conclusion CPCGI could relieve the cerebral ischemia-reperfusion injury in rats through the regulation in mitophagy.
cerebral ischemia-reperfusion injury;Compound Porcine Cerebroside and Ganglioside Injection;mitophagy;rats
10.3969/j.issn.1006-9771.2016.07.002
R743.32
A
1006-9771(2016)07-0750-04
北京协和青年基金(No.3332015113)。
中国医学科学院基础医学研究所药理室,北京市100005。作者简介:王明洋(1990-),女,汉族,河南新密市人,博士研究生,主要研究方向:神经药理学。通讯作者:刘雁勇(1972-),男,博士,研究员,主要研究方向:神经药理学。E-mail:liuyanyong@126.com。
2016-03-01
2016-03-18)
