miR-202调控GLI-2干预肺癌A549细胞的增殖和凋亡
2016-08-12杨丽王霞杨永静罗莉李长桂孙晓容胡明冬
杨丽 王霞 杨永静 罗莉 李长桂 孙晓容 胡明冬
miR-202调控GLI-2干预肺癌A549细胞的增殖和凋亡
杨丽王霞杨永静罗莉李长桂孙晓容胡明冬
400037 重庆,第三军医大学新桥医院呼吸内科
【摘要】目的探讨miR-202对肺癌A549细胞增殖和凋亡的调控作用及其相关机制。方法培养肺腺癌A549细胞和肺正常上皮BEAS-2B细胞,利用Real time-PCR检测miR-202在上述细胞中的表达水平;合成并将miR-202 minic和miR-NC转染进入A549细胞后,应用MTT检测12、24、48 h时细胞的抑制率,使用流式细胞术检测转染后48 h细胞的凋亡情况,利用western blot检测GLI-2蛋白的表达情况;构建野生型和突变型GLI-2 3′UTR 插入pMIR-REPORTTMluciferase vector载体,并将其与pRL-TK质粒共转染进入A549细胞,之后分别将等量的pre-miR-202和miR-NC再转染进入A549细胞,利用双荧光素酶报告基因检测试剂盒检测萤火虫和海肾荧光素酶活性。结果miR-202在A549细胞中的相对表达量显著低于在BEAS-2B细胞中的表达量(P<0.01);miR-202 minic组在12、24、48和72 h的细胞抑制率显著高于对照组和miR-NC组(P<0.01);miR-NC组在72 h时细胞抑制率显著高于对照组(P<0.01)。此外, miR-202 minic组细胞凋亡率显著高于miR-NC和对照组(P<0.01),并且miR-NC组的细胞凋亡率显著高于对照组(P<0.01)。荧光素酶报告基因结果说明GLI-2是miR-202的靶基因。miR-202minc转染A549细胞后可显著降低GLI-2蛋白的表达,而miR-NC组与对照组相比较,GLI-2蛋白表达无显著差异。结论miR-202通过下游靶基因GLI-2调控肺癌A549细胞的增殖和凋亡,其可作为治疗肺癌的潜在靶点。
【关键词】miR-202;支气管肺癌;GLI-2;细胞增殖;细胞凋亡
肺癌严重威胁着人类的生命健康,在过去的几十年,随着人口老龄化、污染以及各种致癌物质的被动摄入增加,导致肺癌的发生率逐年升高[1-3]。尽管近年来诊疗手段的不断发展,但是肺癌患者5年生存率仍低于15%[4-5]。因此,亟待探索新的治疗策略和方法。
microRNAs (miRNAs)是普遍存在于细胞内、仅有18-25bp的非编码RNA。miRNA主要功能是通过与其mRNA的3′端非编码区(untranslated region, UTR)结合,抑制靶mRNA的翻译或直接降解mRNA,从而抑制靶蛋白的表达及其功能[6]。近年来对miRNA的研究表明,其在肺癌的发生发展中发挥着重要作用[7]。既往研究表明,上调miR-202可抑制LRP6蛋白的表达,进而抑制肝细胞癌的增殖[8]。在多发性骨髓瘤中,miR-202发挥着负性调节细胞生存、增殖和粘附的功能[9],但是miR-202在肺癌中发挥何种作用尚不清楚。本研究旨在探讨miR-202在肺癌A549细胞中的作用及其可能的机制,为肺癌的治疗提供新的靶点和策略。
材料与方法
一、实验材料
DMEM培养基、 F12K培养基和胎牛血清购自GIBCO公司;TRIzol、lipofectamine 2000购自Invirogen公司;miR-NC、miR-202 minic和pre-miR-202 minic购自广州锐博生物公司;逆转录试剂盒、M-PER细胞裂解液、T4连接酶、HindⅢ和Spe I限制性内切酶购自Thermo Fisher scientific 公司;实时定量试剂盒购自Roche公司;凋亡试剂盒购自江苏凯基生物技术公司;GLI-2单克隆抗体均购自abcam公司,GAPDH购自北京天德悦公司;CKK-8试剂盒购自日本同仁公司;pMIR-REPORTTMluciferase和pRL-TK 质粒载体购自ABI生物技术公司;荧光素酶报告基因检测试剂盒购自peromega公司。
二、实验方法
1. 非小细胞肺癌细胞A549和支气管上皮细胞BEAS-2B的培养: A549细胞培养于含有10%胎牛血清的F12K培养基中,BEAS-2B细胞培养于含有10% 胎牛血清的DMEM培养基中。两种细胞置于37 ℃、5% CO2、饱和湿度下的培养箱中传代培养,取对数生长期的细胞进行实验。
2. miR-202表达的检测: 按照TRIzol提取总RNA试剂盒说明书提取细胞的总RNA。miR-202逆转录引物为5′- CTCAACTGGTGTCGTGGAGTCGG CAATTCAGTTGAGCAAAGAAG-3′, 内参U6的逆转录引物为5′- CAAAATATGGAACGCTTC-3′, 逆转录条件为42 ℃ 60 min,72 ℃ 10 min。 cDNA采用BIO-RAD CFX96系统进行实时荧光定量PCR检测miR-202的表达,以U6作为内参(表1)。每个待测基因设4个复孔。数据通过BIO-RAD CFX96系统进行处理,按照公式RQ=2-ΔΔCT计算各组间的倍数关系。
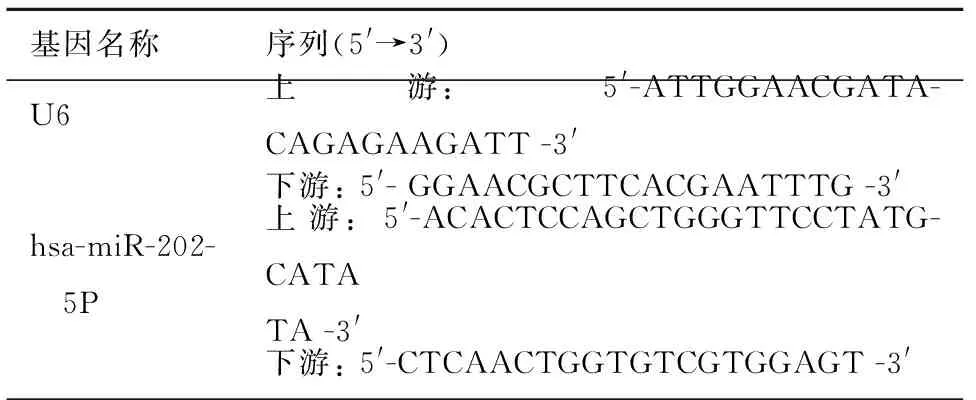
表1 基因序列及扩增片段长度
3. miR-202 模拟物(minic)、miR-202前体(pre-miR-202)及miR-NC的转染: 将miR-202 minic、pre-miR-202及miR-NC干粉用RNase-free H2O 配制成20 μmol/L的储存液后,分装、冻存备用。miR-202 minic转染细胞的简要操作如下:①将A549细胞球用胰酶消化,并将细胞球体吹散成为单个细胞,离心洗涤后用SFM重悬,在每孔含有440 μl SFM培养基的24孔板中接种约2×105个/孔的细胞;②将5 μl浓度为20 μmol/L 的miR-202 minic加入到50 μl opti-MEM中,轻轻混匀,室温孵育5 min;③在上述混合液中加入5 μl转染试剂lipofectamine 2000,轻轻吹打混匀,室温孵育15 min;④将60 μl转染试剂-抑制物混合试剂加入含有细胞的孔板中,轻轻混匀,miR-202 minic的转染终浓度为100 nmol/L;⑤将培养板置于37 ℃、5% CO2、饱和湿度下的培养箱中培养48 h后进行PCR和Western blot等检测。pre-miR-202及miR-NC的转染同miR-202 minic的转染步骤。
4. 荧光素酶报告基因检测: 首先,利用点突变技术扩增出含有HindⅢ和Spe Ⅰ酶切位点的GLI-2 突变位点的3′UTR。然后分别将野生型和突变型GLI-2 3′UTR 插入pMIR-REPORTTMluciferase vector载体;其次分别将含有野生型和突变型GLI-2 3′UTR的 pMIR- luciferase质粒载体与pRL-TK质粒共转染进入A549细胞,然后分别将等量的pre-miR-202和miR-NC再转染进入A549细胞;最后,转染48 h后,利用双荧光素酶报告基因检测试剂盒检测萤火虫和海肾荧光素酶活性。
5. 流式细胞术检测细胞凋亡: 收集107个细胞后用含有2% FBS的PBS(buffer)重悬,300×g离心10 min后弃去上清,加入80 μl Buffer后,再加入 5 μl的 Annexin V-FITC混匀后室温避光孵育15 min,上机前加入 5 μl 的 PI 染色,室温避光孵育 10 min,使用流式细胞仪检测。
6. Western blot检测GLI-2蛋白的表达: 收集细胞,加入350 μL M-PER蛋白裂解液,置于冰上15 min,然后4 ℃、以离心半径8 cm,12 000 r/min离心15 min,取上清液。调整浓度后,沸水中将蛋白煮10 min使其变性。制备SDS-PAGE凝胶,每孔加样40 μg进行电泳。300 mA湿转120 min,将PVDF膜室温封闭1 h后分别加入GLI-2(1︰1 000)及兔抗β-actin抗体(1︰10 000)的抗体稀释液中4 ℃过夜,TBST洗3次,每次10 min,再放入辣根酶标记山羊抗兔的二抗(1︰50 000)中室温孵育1 h,TBST洗3次,每次10 min,用ECL化学发光法检测GLI-2和β-actin蛋白的表达水平。所得蛋白条带图片,使用Quality one软件对图像进行分析,以β-actin的光密度值作为内参来校正各自目的蛋白的光密度值。
7. MTT检测细胞增殖: 取对数生长期的A549细胞消化后制成细胞悬液,计数并将细胞浓度调整到5×103/孔,接种于96孔板上。培养48 h后换液,每孔加入10 μl(5 mg/ml)的MTT溶液,孵育4 h后,每孔加入100 μl Formanzan溶液,继续孵育直至显微镜下观察到Formanzan全部溶解。用酶标仪在570 nm处检测各孔吸光度(OD值),空白孔调零。
三、统计学方法
各实验至少重复3次,使用SPSS 17.0对数据进行分析,两组间进行t检验,多组之间进行单因素方差分析。
结 果
一、miR-202在A549细胞和肺上皮细胞BEAS-2B细胞中的表达
本研究利用qPCR检测了miR-202在A549细胞和肺上皮细胞BEAS-2B细胞中的表达。发现miR-202在A549细胞中的相对表达量仅为BEAS-2B细胞的40±4.5%,miR-202在A549细胞中的相对表达量显著低于在BEAS-2B细胞中的表达量(P<0.01),见图1。

图1qPCR检测miR-202在A549细胞和肺上皮细胞BEAS-2B细胞中的表达;注:*与BEAS-2B细胞比较P<0.01
二、转染miR-202 minic对 A549细胞增殖凋亡的影响
分别将miR-202 minic和miR-NC 转染进入A549细胞48 h后,利用qPCR检测A549细胞中的miR-202表达水平,发现miR-202 minic和miR-NC组中miR-202的相对表达量分别是对照组的3.04±0.13和1.11±0.02倍,miR-202 minic和miR-NC组中miR-202的相对表达量显著高于对照组(P<0.01),并且miR-202 minic 组中miR-202的表达较miR-NC中的显著升高(P<0.01) (见图2A)。利用MTT检测转染miR-202 minic和miR-NC后72 h内,其对细胞活力的抑制情况(见图2B),发现miR-202 minic在12、24、48和72 h的细胞抑制率分别0.8± 0.05%、3.7±0.60%、24.5±3.40%、47.3±5.60%和59.8±4.90%。miR-NC组各时间点的细胞抑制率分别0.9±0.02%、2.5±0.30%、4.3±0.80%、5.6±0.78%和7.8±0.90%。对照组各时间点的细胞抑制率分别0%、1.3±0.02%、3.5±0.03%、4.1±0.70%和4.7±0.50%。miR-202 minic组在12、24、48和72 h的细胞抑制率显著高于对照组和miR-NC组(P<0.01)。miR-NC组在72 h时细胞抑制率显著高于对照组(P<0.01)。此外,使用流式细胞术检测了转染48 h后的miR-202 minic和miR-NC对细胞凋亡的影响(见图2C), 发现miR-202 minic组、 miR-NC组和对照组的细胞凋亡率分别为54.20±5.68%、12.51±4.39%和2.53±1.03%。miR-202 minic组细胞凋亡率显著高于miR-NC和对照组(P<0.01),并且miR-NC组的细胞凋亡率显著高于对照组(P<0.01)。上述研究说明上调miR-202的表达可显著抑肺癌A549细胞的增殖、诱导其凋亡。

图2上调miR-202对A549细胞增殖和凋亡的影响;注: A. qPCR检测A549细胞转染miR-202 minc和miR-NC后的miR-202的表达;B. MTT检测A549细胞转染miR-202 minc和miR-NC后,其对细胞增殖抑制的作用。*, 与对照组比较P<0.01;^, 与miR-NC组比较P<0.01;C. 流式细胞术检测A549细胞转染miR-202 minc和miR-NC后,其诱导细胞凋亡的作用
三、GLI-2是miR-202的下游直接靶点
通过miRNA预测软件DIANA-MICROT、targetscan以及MIRDB进行分析,推测GLI-2为miR-202的靶基因。分别构建GLI-2 野生型和突变型3′UTR质粒载体(模式图见图3A),与pRL-TK质粒、pre-miR-202或miR-NC一起转染到A549细胞中后检测荧光素酶活性,发现野生型GLI-2 3′UTR质粒和pre-miR-202共转染组,其荧光素酶活性显著低于野生型GLI-2质粒和miR-NC共转染组(P<0.01)。而突变型GLI-2 3′UTR质粒和pre-miR-202共转染组与突变型GLI-2 3′UTR质粒和miR-NC共转染组的荧光素酶活性无显著差异(P>0.05),说明GLI-2是miR-202的直接靶点(见图3B)。此外,我们还检测了A549细胞转染miR-202minc 和miR-NC后GLI-2蛋白的表达情况,发现miR-202minc转染A549细胞后可显著降低GLI-2蛋白的表达(P<0.05),而miR-NC组与对照组相比较,GLI-2蛋白表达无显著差异(P>0.05) (见图3C)。进一步说明GLI-2是miR-202的直接靶点。

图3GLI-2是miR-202的下游直接靶点;注:A. miR-202与GLI-2 3′UTR端结合以及构建突变型GLI-2 3′UTR端的模式图;B.荧光素酶报告基因检测miR-202与GLI-2 3′UTR端的结合情况;*, 与野生型GLI-2 3′UTR质粒和pre-miR-202共转染组P<0.01;C. western blot检测转染miR-202与miR-NC 48 h后,A549细胞中GLI-2蛋白的表达情况
讨 论
本研究发现上皮来源的肺癌A549细胞中miR-202的表达显著低于正常肺上皮BEAS-2B细胞。我们应用miR-202 minic 转染A549细胞后,发现其能下调GLI-2的表达,能有效抑制A549的增殖并诱导其凋亡。此外,本研究还发现在A549细胞中GLI-2是miR-202的直接靶点。因此,推测miR-202通过调控GLI-2,进而可影响A549细胞的增殖和凋亡。
最近的研究表明,miRNA的紊乱在肺癌的发生和发展中发挥着重要作用[10]。miR-21在肺癌组织中显著上调[11],并且通过抑制抑癌基因APaf1、Fas1g、RhoB和PTEN,从而促进肺癌的进展[12]。miR-17/92a簇,包含miR-17-3p、miR-17-5p、miR-18a、miR-19a、miR-20a、 miR-19b-1和 miR-92a等同样也在肺癌中呈高表达。通过调控HIF-1a、PTEN、BCL2L11、CDKNA、TSP-1等基因,从而促进血管的生成、促进细胞增殖和抑制细胞凋亡[13]。其他研究也同样发现Lethal-7 (let-7)在肺癌组织中呈低表达,并且其表达水平与肺癌预后密切相关[14-15]。Let-7主要通过下调K-RAS、MYC和HMGA2等癌基因,进而发挥抑制肺癌发生、发展的作用[16]。近期对肺癌组织的miRNA芯片筛查中,发现miR-202在肺癌组织中较正常肺组织中表达显著下调[17]。本实验同样发现,肺癌A549细胞中miR-202的表达明显低于正常肺上皮细胞的表达。我们通过miR-202 minic上调A549细胞中miR-202的表达,发现其能有效的抑制A549细胞的增殖。同样,miR-202也可抑制肝癌细胞、多发性骨髓瘤细胞的增殖、促进其凋亡[8-9]。但其精确的作用机制尚不清楚。
本研究通过生物信息学分析对miR-202的下游靶点进行预测,并利用荧光素酶报告基因,在A549细胞中验证了胶质瘤相关癌基因家族锌指蛋白-2 (glioma-associated oncogene family zinc figure 2, GLI-2)是miR-202的靶基因。GLI-2是GLI家族成员之一,也被称为HPE9、THP,是由1586个氨基酸组成的核蛋白,主要作为转录激活子发挥作用。进一步研究表明,GLI-2是hedgehog (Hh) 信号通路的重要效应分子,Hh信号通路可通过GLI-2,进而激活转录因子,上调各种靶蛋白从而发挥功能[18]。Im等发现,乳腺癌和肝癌组织中GLI-2阳性表达的患者总体生存率显著低于肺癌组织中GLI-2阴性表达患者的生存率[19-20]。An等[21]研究发现上调GLI-2可促进胰腺癌细胞的增殖以及降低细胞对吉西他滨的敏感性。相反,采用siRNA敲除骨肉瘤细胞中GLI-2的表达,可显著抑制细胞增殖活性,诱导其凋亡[22]。本研究发现上调miR-202可显著降低GLI-2的表达,并且抑制细胞的增殖并诱导凋亡。因此,我们推测miR-202可能通过抑制GLI-2,进而抑制细胞的增殖、诱导其凋亡,但其具体机制仍不清楚。
本研究仅证实miR-202具有调控A549细胞短期增殖和凋亡的能力,尚未对调控长期增殖的能力以及体内miR-202是否发挥作用进行验证。虽然观察到上调miR-202可抑制GLI-2的表达,但GLI-2如何影响增殖和凋亡的具体机制尚不清楚。
综上所述,miR-202可调控下游靶基因GLI-2,从而发挥调控A549细胞增殖、凋亡的作用,其可作为治疗肺癌的潜在靶点。
参考文献
1钱桂生. 为提高我国呼吸系统疾病的诊治水平而努力[J/CD]. 中华肺部疾病杂志: 电子版, 2012, 5(1): 1-3.
2Han HS, Yun J, Lim SN, et al. Downregulation of cell-free miR-198 as a diagnostic biomarker for lung adenocarcinoma-associated malignant pleural effusion[J]. Int J Cancer, 2013, 133(3): 645-652.
3Cazzoli R, Buttitta F, Di Nicola M, et al. microRNAs derived from circulating exosomes as noninvasive biomarkers for screening and diagnosing lung cancer[J]. J Thorac Oncol, 2013, 8(9): 1156-1162.
4Ulivi P, Zoli W. miRNAs as non-invasive biomarkers for lung cancer diagnosis [J]. Molecules, 2014, 19(6): 8220-8237.
5Wang Y, Gu J, Roth JA, et al. Pathway-based serum microRNA profiling and survival in patients with advanced stage non-small cell lung cancer [J]. Cancer Res, 2013, 73(15): 4801-4809.
6Baek D, Villén J, Shin C, et al. The impact of microRNAs on protein output [J]. Nature, 2008, 455(7209): 64-71.
7Garzon R, Calin GA, Croce CM. MicroRNAs in Cancer [J]. Annu Rev Med, 2009, 60: 167-179.
8Zhang Y, Zheng D, Xiong Y, et al. miR-202 suppresses cell proliferation in human hepatocellular carcinoma by downregulating LRP6 post-transcriptionally [J]. FEBS letters, 2014, 588(10): 1913-1920.
9Shen X, Guo Y, Yu J, et al. miRNA-202 in bone marrow stromal cells affects the growth and adhesion of multiple myeloma cells by regulating B cell-activating factor [J]. Clin Exp Med, 2015.
10Du L, Schageman JJ, Irnov, et al. MicroRNA expression distinguishes SCLC from NSCLC lung tumor cells and suggests a possible pathological relationship between SCLCs and NSCLCs [J]. J Exp Clin Cancer Res, 2010, 29: 75.
11Gao W, Yu Y, Cao H, et al. Deregulated expression of miR-21, miR-143 and miR-181a in non small cell lung cancer is related to clinicopathologic characteristics or patient prognosis [J]. Biomed Pharmacother, 2010, 64(6): 399-408.
12Hatley ME, Patrick DM, Garcia MR, et al. Modulation of K-Ras-dependent lung tumorigenesis by MicroRNA-21 [J]. Cancer cell, 2010, 18(3): 282-293.
13Matsubara H, Takeuchi T, Nishikawa E, et al. Apoptosis induction by antisense oligonucleotides against miR-17-5p and miR-20a in lung cancers overexpressing miR-17-92 [J]. Oncogene, 2007, 26(41): 6099-6105.
14Yanaihara N, Caplen N, Bowman E, et al. Unique microRNA molecular profiles in lung cancer diagnosis and prognosis [J]. Cancer cell, 2006, 9(3): 189-198.
15Xia Y, Zhu Y, Zhou X, et al. Low expression of let-7 predicts poor prognosis in patients with multiple cancers: a meta-analysis [J]. Tumour Biol, 2014, 35(6): 5143-5148.
16Naidu S, Garofalo M. microRNAs: An Emerging Paradigm in Lung Cancer Chemoresistance [J]. Front Med (Lausanne), 2015, 2: 77.
17Wang R, Chen XF, Shu YQ. Prediction of non-small cell lung cancer metastasis-associated microRNAs using bioinformatics [J]. Am J Cancer Res, 2015, 5(1): 32-51.
18Fan P, Fan S, Wang H, et al. Genistein decreases the breast cancer stem-like cell population through Hedgehog pathway [J]. Stem Cell Res Ther, 2013, 4(6): 146.
19Im S, Choi HJ, Yoo C, et al. Hedgehog related protein expression in breast cancer: gli-2 is associated with poor overall survival [J]. Korean J Pathol, 2013, 47(2): 116-123.
20Zhang D, Cao L, Li Y, et al. Expression of glioma-associated oncogene 2 (Gli 2) is correlated with poor prognosis in patients with hepatocellular carcinoma undergoing hepatectomy [J]. World J Surg Oncol, 2013, 11: 25.
21An Y, Cai B, Chen J, et al. MAP3K10 promotes the proliferation and decreases the sensitivity of pancreatic cancer cells to gemcitabine by upregulating Gli-1 and Gli-2 [J]. Cancer Lett, 2013, 329(2): 228-235.
22Yang W, Liu X, Choy E, et al. Targeting hedgehog-GLI-2 pathway in osteosarcoma [J]. J Orthop Res, 2013, 31(3): 502-509.
(本文编辑:王亚南)
杨丽,王霞,杨永静,等. miR-202调控GLI-2干预肺癌A549细胞的增殖和凋亡[J/CD]. 中华肺部疾病杂志: 电子版, 2016, 9(3): 252-257.
DOI:10.3877/cma.j.issn.1674-6902.2016.03.004
基金项目:国家自然科学基金资助项目(30801366)
通讯作者:胡明冬,Email: huhanshandd@aliyun.com
中图法分类号:R563
文献标识码:A
Corresponding author:Hu Mingdong, Email: huhanshandd@aliyun.com
(收稿日期:2016-04-13)
miR-202 regulation proliferation and apoptosis of lung cancer A549 cells via target gene GLI-2
YangLi,LuoLi,LiChanggui,SunXiaorong,HuMingdong.Desect1mentofRespiratoryDiseases,XinQiaoHospital,ThirdMilitaryMedicalUniversity,Chongqing400037,China
【Abstract】ObjectiveTo explore the mechanism and effect of miR-202 regulation the proliferation and apoptosis of A549 cells. MethodA549 cells and lung epithelial BEAS-2B cells were cultured, and then miR-202 level of A549 and BEAS-2B cells was analyzed by realtime-PCR. The sequence of miR-202 and miR-NC was synthesized. They were transfected into A549 cells, the rate of proliferation inhibition was detected by MTT at 12, 24, and 48 h, cellular apoptosis rate of A549 cells and the GLI-2 protein expression was measured by FACS and western blot at 48 h, respectively. The wild-type and mutation of GLI-2 3′UTR was inserted into the plasmid of pMIR-REPORTTMluciferase vector, which was cotransfected into A549 with pRL-TK plasmid. pre-miR-202 and miR-NC was transfected into these cells, which had been transfected pMIR-REPORTTMluciferase vector and pRL-TK plasmid. Firefly and Renilla reniformis luciferase activities were measured 48 h later. Result the expression of miR-202 was lower in A549 cells than in BEAS-2B cells (P<0.01). The cellular inhibition rate was higher in miR-202 minic group than in miR-NC and control group at 12, 24, 48, and 72 h (P<0.01), and the cellular inhibition rate was significant higher in miR-NC group than control group (P<0.01). Moreover, the apoptosis of A549 cells was higher in miR-202 minic group than in miR-NC and control group at 72 h (P<0.01). Luciferase assay showed GLI-2 was a direct target gene of miR-202. Up-regulation of miR-202 was significant decreased the expression of GLI-2 while miR-202 minic was transfected into A549 cells. GLI-2 protein expression was no significant difference between miR-NC group and control. ConclusionmiR-202 regulated the proliferation and apoptosis of A549 cells through directed mediated target gene GLI-2, and it would as a novel target for lung cancer treatment.
【Key words】miR-202;bronchus lung cancer;GLI-2;Proliferation;Apoptosis
