TGF-β1诱导的肺泡上皮细胞间质转化及其机制探讨
2016-08-12黄振杰曾彤华蔡文华欧盛敬陈文海李斐
黄振杰 曾彤华 蔡文华 欧盛敬 陈文海 李斐
TGF-β1诱导的肺泡上皮细胞间质转化及其机制探讨
黄振杰曾彤华蔡文华欧盛敬陈文海李斐
536000 广西北海市人民医院呼吸内科
【摘要】目的探讨转化生长因子β1(TGF-β1)诱导的肺泡上皮细胞-间质细胞转化(EMT)过程及信号传导通路。 方法体外培养肺腺癌细胞系A549细胞,以TGF-β1进行干预;采用Western blot免疫印迹法检测干预前后细胞标志物蛋白及信号传导蛋白P-Smad2/3、Snail1、Snail2的表达;采用RT-PCR检测干预前后细胞标志物mRNA表达;采用倒置相差显微镜观察细胞形态学变化。 结果TGF-β1干预后,随着时间的延长,A549细胞上皮细胞标志物E-cad和CK19蛋白及mRNA表达下调(P<0.05);间质细胞标志物α-SMA、Vimentin蛋白及mRNA表达上调(P<0.05);信号传导蛋白P-Smad2/3、Snail1表达上调(P<0.05);倒置相差显微镜观察TGF-β1干预后A549细胞由干预前的鹅卵石状变为梭形,如同肌纤维母细胞。 结论TGF-β1可诱导肺泡上皮细胞向间质细胞转化,其机制可能与P-Smad2/3、Snail1信号传导通路有关;TGF-β1可能是通过诱导肺泡上皮细胞间质转化的细胞效应,最终导致肺泡上皮细胞凋亡和纤维组织形成。
【关键词】肺纤维化;转化生长因子β1;A549细胞;上皮细胞间质转化;信号传导通路
肺纤维化是临床常见的呼吸疾病,其发病机制至今尚未完全清楚[1-3]。以往,多数观点认为其与进行性炎症导致的肺间质细胞激活增殖有关[4]。但近年来,越来越多的研究发现炎症不一定是诱导纤维化的必要条件,尤其是特发性肺纤维化及寻常型间质性肺炎[5]。近年来,肺泡上皮细胞-间质转化(epithelial-mesenchymal transition, EMT)及其信号传导通路理论在肺纤维化中的作用逐渐获得认可[6]。本研究通过采用转化生长因子β1(transforming growth factor-β1, TGF-β1)诱导肺腺癌细胞系A549细胞发生EMT,旨在诠释和论证EMT是否为肺纤维化发病的一个重要的新模式。并探讨转化过程中信号传导途径的作用。
资料与方法
一、主要试剂
A549细胞株(中国典型培养物保藏中心)、胎牛血清、低糖DMEM培养基(Hyclone公司)、TGF-β1(Hyclone公司)、β-actin鼠抗人一抗、E-cad羊抗人一抗、CK19鼠抗人一抗、α-SMA鼠抗人一抗、Vimentin鼠抗人一抗、p-Smad2/3羊抗人一抗、Snail1兔抗人一抗、Snai2兔抗人一抗(Sigma公司)
二、实验方法
1. 细胞培养及干预: 用10%胎牛血清的低糖DMEM培养基将A549细胞常规培养于37 ℃,5%CO2恒温培养箱内。当细胞生长融合至70%~80%,用无血清培养基饥饿24 h,换新鲜培养液,随机把细胞分组,于培养液中加入TGF-β1储液至终浓度5 ng/ml。
2. 观察细胞形态: 倒置相差显微镜观察A549细胞在TGF-β1刺激下出现的肺泡EMT过程中细胞形态的变化,在0、24和48 h拍照记录。
3. Westernblot免疫印迹: 于TGF-β1干预后0、3、6、12、24、48、72 h裂解并提取细胞蛋白,分装冻于-70 ℃备用。采用BCA法测定标本蛋白浓度,取50 μg样品蛋白进行SDS-PAGE凝胶变性电泳,然后转至PVDF膜上封闭,加入E-cad、CK19、α-SMA、Vimentin p-Smad2/3、Snail1、Snail2一抗,以β-actin作为内参,洗涤后加荧光标记的二抗,37 ℃下,放置1 h。采用红外成像系统扫描图像,以随机附带软件计算荧光强度。
4. 实时荧光定量PCR
(1)总RNA抽提及逆转录反应:当A549细胞生长融合至70%~80%,用无血清培养基饥饿24 h, 加入至TGF-β1终浓度5 ng/ml。在刺激后0、3、6、12、24 h抽提总RNA, 取2 μl RNA样品, MOPS琼脂糖凝胶电泳,证实,具有清晰18S和28S条带的RNA用于逆转录实验,取1 μg RNA逆转录成cDNA,于-20 ℃下保存。
(2)RT-PCR:RT-PCR检测上皮细胞标志物E钙黏蛋白(E-cadherin, E-cad)、细胞角蛋白19(cytokeratin19, CK19)和间质细胞标志物α平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)、间质细胞的波形蛋白(vimentin)的mRNA表达,以GAPDH做内参,所用引物由上海生工生物工程公司合成,见表1。反应条件为95 ℃/5 min,1个循环;95 ℃/20 s、62 ℃/30 s、72 ℃/30 s,40个循环,随机软件计算Ct值和拷贝数。

表1 RT-PCR所用引物
注:CK19:细胞角蛋白19;E-cad: E钙黏蛋白;VIM: 波形蛋白; α-SMA:α平滑肌肌动蛋白
三、统计学方法
采用SPSS14.0版统计学软件进行处理,计量资料以均数加减标准差表示,组间比较采用t检验,多组间比较采用方差分析,以P<0.05表示差异具有统计学意义。
结 果
一、细胞形态学变化
倒置相差显微镜观察,TGF-β1干预后A549细胞由干预前的鹅卵石状变为梭形及纺锤形,细胞间隙变大,细胞之间连接变得松散,如肌纤维母细胞,见图1。

图1TGF-β1诱导A549细胞EMT过程中发生的细胞形态学变化;注:A1,B1,C1 200×;A2,B2,C2 400×
二、TGF-β1对A549细胞上皮和间质细胞标志物及信号传导蛋白表达的影响
Wseternblot免疫印迹结果显示:TGF-β1干预后,随着时间的延长,A549细胞上皮细胞标志物E-cad和CK19蛋白表达下调(P<0.05);间质细胞标志物α-SMA、Vimentin蛋白表达上调(P<0.05),见图2。信号传导蛋白P-Smad2/3、Snail1表达上调(P<0.05);而Snail2呈弱表达,各时段无明显变化(P>0.05),见图3。
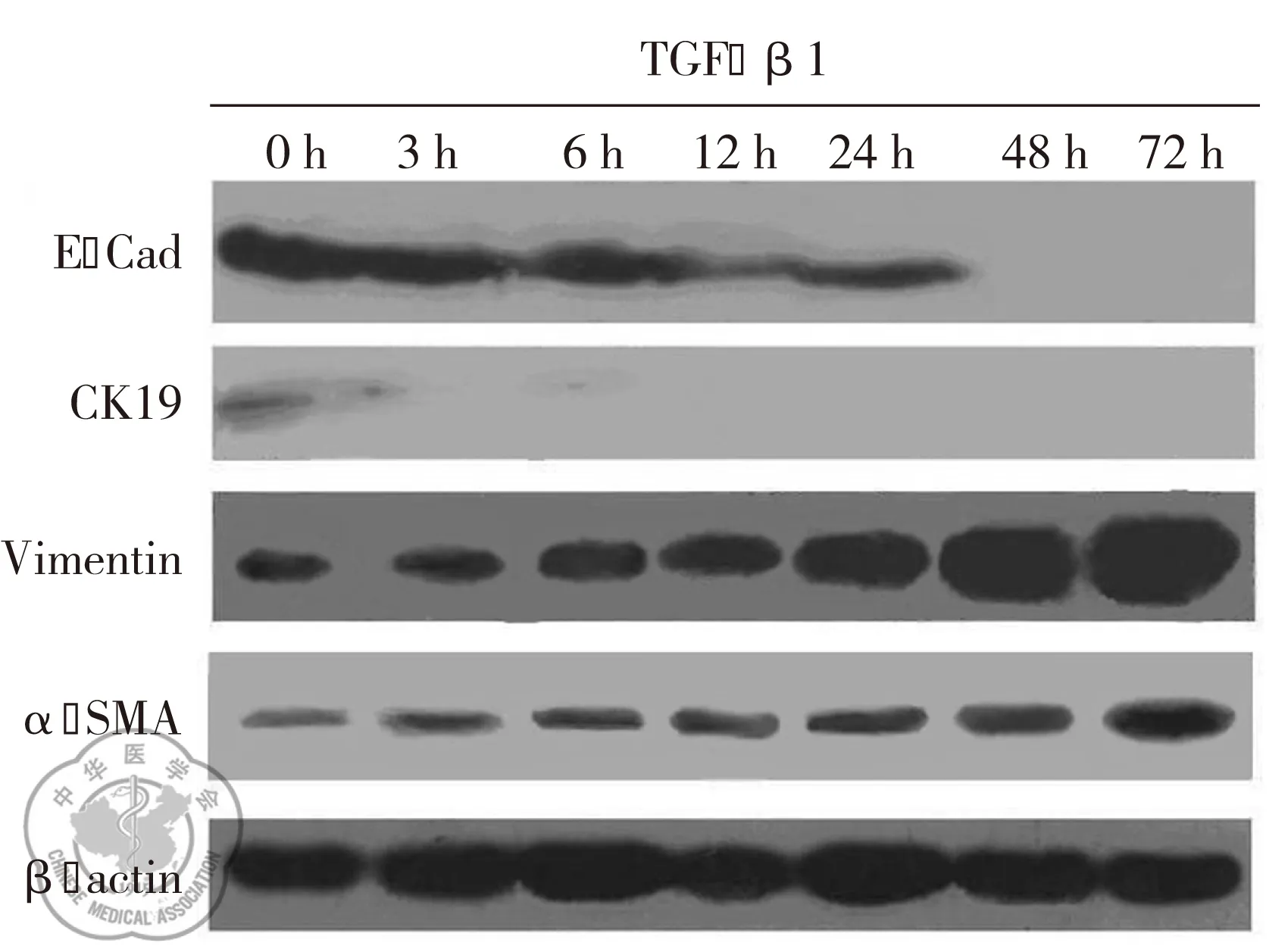
图2TGF-β1诱导A549细胞EMT过程中上皮和间质细胞标志物的蛋白表达变化
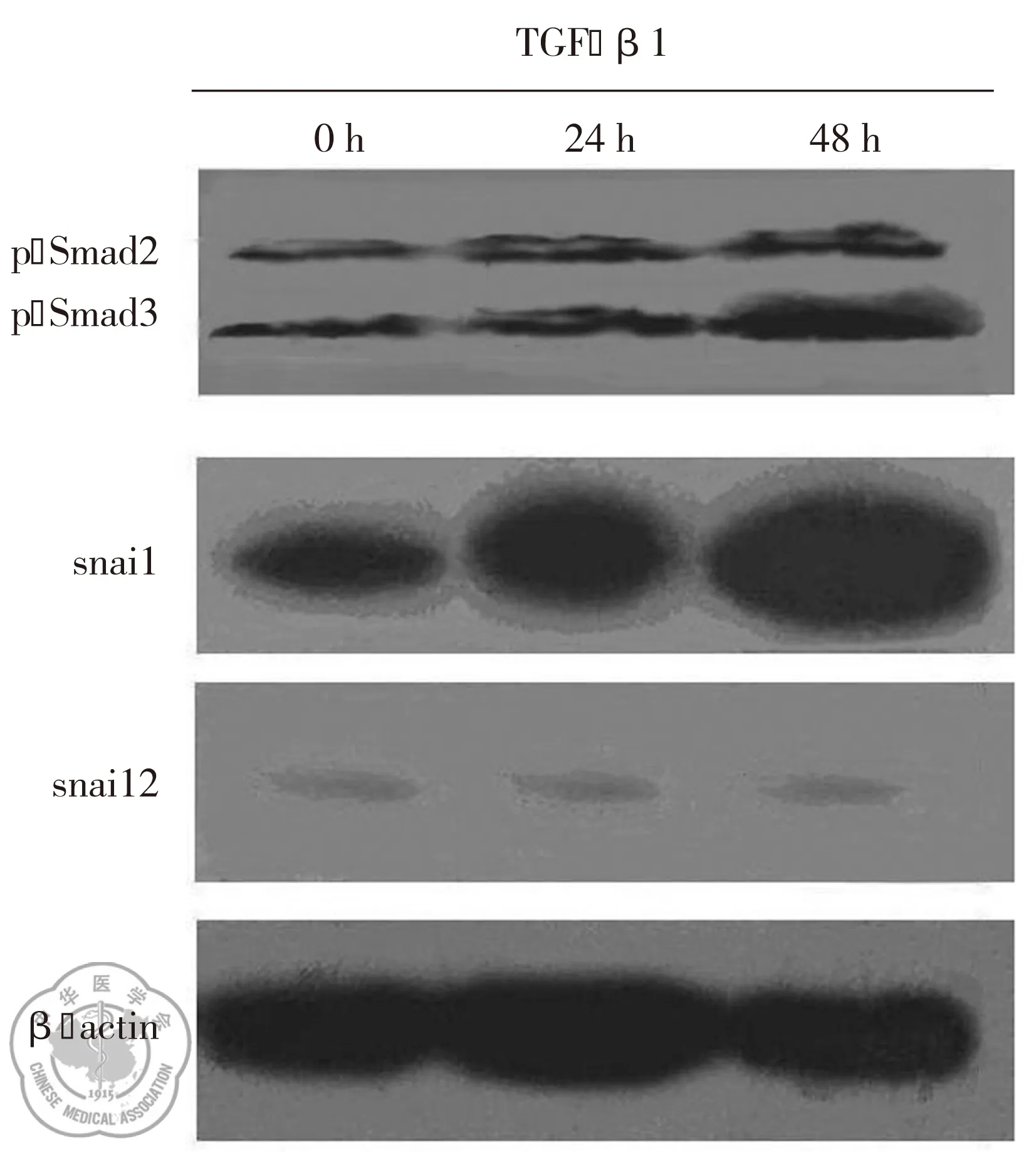
图3TGF-β1诱导A549细胞EMT过程中信号传导蛋白表达的变化
三、TGF-β1对A549细胞上皮和间质细胞标志物mRNA的影响
实时荧光定量PCR结果显示,TGF-β1干预后,随着时间的延长,A549细胞上皮细胞标志物E-cad和CK19的mRNA表达下调(P<0.05);间质细胞标志物α-SMA、Vimentin的mRNA表达上调(P<0.05),见图4。


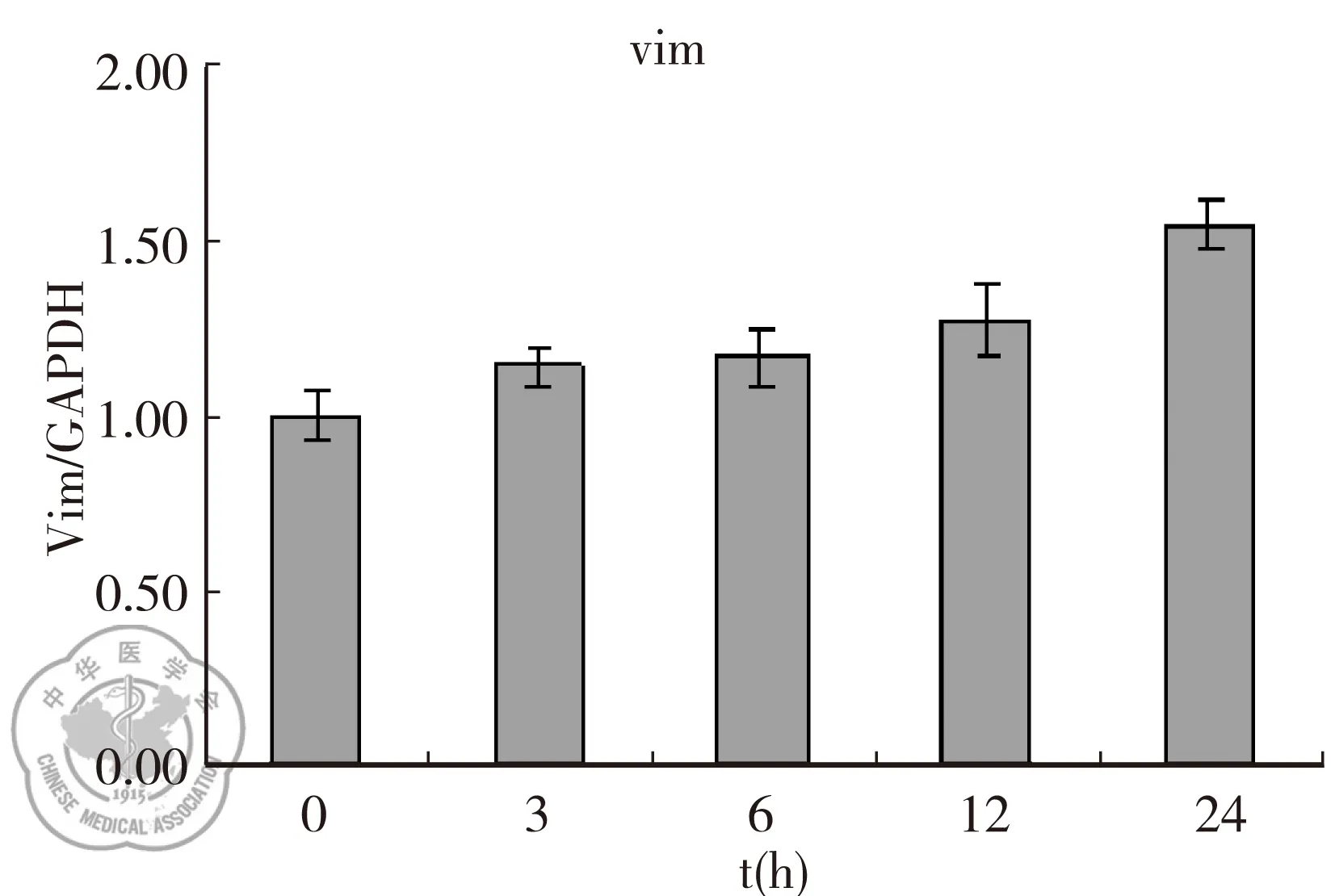
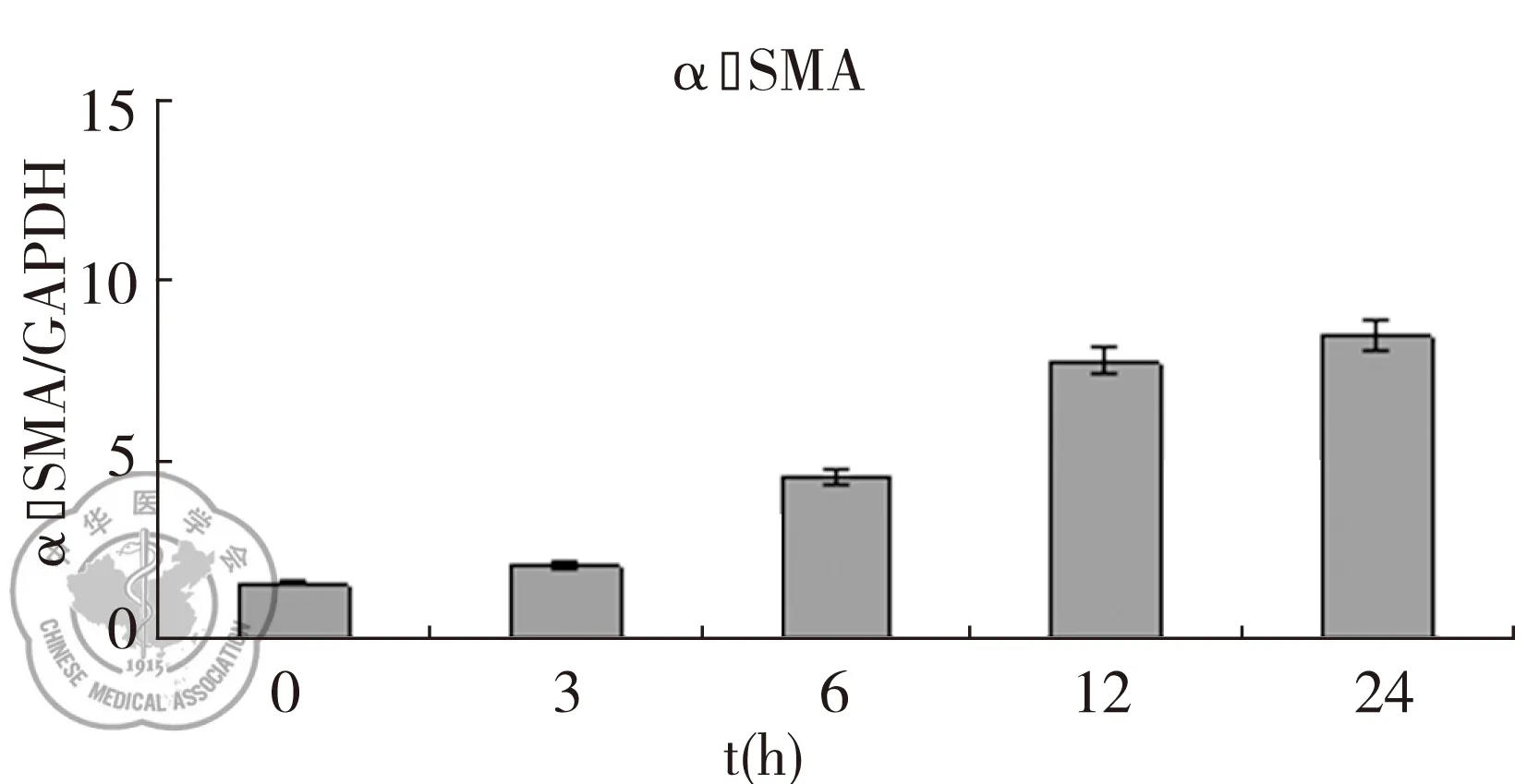
图4TGF-β1诱导A549细胞EMT过程中上皮和间质细胞标志物的mRNA表达变化
讨 论
上皮细胞-间质转化(EMT)是由完全分化的上皮细胞历经细胞表型改变而转化为完全分化的间充质细胞的过程,一般会转化为成纤维细胞或肌纤维母细胞[7]。在正常情况下细胞间黏附机制将上皮细胞紧密的连接在一起,其中E-cad蛋白是促成上皮细胞间紧密连接的主要成分之一,在保持细胞的完整性和极性中起着重要作用[8]。研究发现,TGF-β1诱导的EMT过程中的早期变化就是E-cad蛋白的表达受到抑制,破坏了细胞间的紧密连接,从而使上皮细胞丧失其黏附特性,逐渐的从基底膜上脱落;随后胞质内的细胞骨架进行重新排列,表达新的表型蛋白α-SMA,同时胞质内肌丝也由上皮型角蛋白(cytokeratin)转化为间充质细胞的vimentin[9]。此过程中细胞形态由干预前的鹅卵石状变成梭形,如成纤维细胞或肌纤维母细胞。通过电镜观察可见细胞的极性发生了改变,细胞微绒毛消失,细胞内出现密体及大量的肌动蛋白微丝,这为细胞迁徙及收缩能力增强等变化提供了形态学基础[10]。本研究发现,TGF-β1干预后, 随着时间延长,A549细胞的上皮细胞标志物E-cad、CK 19蛋白及mRNA表达呈现下调趋势,而间质细胞标志物α-SMA、Vimentin蛋白及mRNA表达呈现上调趋势,这说明TGF-β1可直接诱导肺泡EMT的发生,且存在一定的时间依赖性。
关于TGF-β1如何诱导EMT的下游信号传导通路,目前完全尚未清楚[11]。大多数学者认为Smads家族蛋白介导的信号传导在TGF-β1诱导的EMT过程中起着关键作用[12]。Smad蛋白既是转录因子同时也是其他转录因子的诱导物,能够将TGF-β1信号从上皮细胞表面受体传导至细胞核内,导致“蛋白质组”表达,导致包括上皮细胞连接处分解、细胞支架结构重建等[13]。Yamada等[14]用博莱霉素诱导小鼠肺纤维化,发现博莱霉素刺激后3、6、12、24 d,Smad3蛋白在肺组织中的表达增加,P-Smad2/3在胞核提取液中升高,并一直伴随肺纤维化进程至第7天达到高峰。本研究中, TGF-β1诱导后A549细胞EMT发生后,p-smad2/3表达明显上调,说明肺泡上皮细胞发生EMT与p-smad2/3信号传导途径密切相关。
研究发现,TGF-β1诱导的EMT,不仅可通过Smad途径,也可通过非Smad途径实现[15]。本研究发现,在TGF-β1诱导的A549细胞EMT中,Snail1蛋白表达明显上调, Snail2蛋白表达不明显,说明肺泡EMT过程与Snail1介导的信号传导途径关系密切。Snail1和Snail2是一组锌指蛋白,在对胚胎发育的研究中发现, Snail1和Snail2作为转录因子在调控胚胎EMT的过程中起着至关重要的作用[16]。Choi等[17]研究发现Snail1和Snail2可被TGF-β1通过Smad途径激活,抑制上皮细胞E-cad蛋白转录, 但具有细胞类型依赖性,在本研究中,Snail2表达不明显,也证明了这种特异性。
综上所述,TGF-β1可在体外诱导肺泡EMT,其机制与p-Smad 2/3、Snail1介导的信号传导通路相关,提示TGF-β1可能是通过诱导肺泡上皮细胞间质转化的细胞效应,最终导致肺泡上皮细胞凋亡和纤维组织形成。肺泡EMT可能是肺纤维化发病的机制之一,而p-Smad 2/3、Snail1信号传导通路是其中的关键环节,通过阻断此信号传导通路是否可起到抑制或治疗肺纤维化的作用,还有待进一步研究。
参考文献
1任成山, 钱桂生. 特发性间质性肺炎的现代概念及研究进展[J/CD]. 中华肺部疾病杂志: 电子版, 2010, 3(4): 276-280.
2崔社怀. 间质性肺病诊治中几个值得注意的问题[J/CD]. 中华肺部疾病杂志: 电子版, 2014, 7(1): 1-4.
3杨海萍, 姚丽. 支气管肺发育不良新生鼠肺上皮细胞标志物的表达及意义[J]. 中华实用儿科临床杂志, 2015, 30(2): 122-126.
4邓海静, 李世峰, 张丽娟, 等. Ac-SDKP 经HSP27调节锌指蛋白而抑制肺上皮细胞-间质转化[J]. 中国病理生理杂志, 2015, 31(1): 1-7.
5邹勇. JNK对TGF-β1诱导的人肺上皮-间质转分化的调控作用[J]. 华中科技大学学报:医学版, 2014, 43(6): 658-662.
6Mo XT, Zhou WC, Cui WH, et al. Inositol-requiring protein 1-X-box-binding protein 1 pathway promotes epithelial-mesenchymal transition via mediating snail expression in pulmonary fibrosis [J]. Int J Biochem Cell Biol, 2015, 65: 230-238.
7冯文英, 马希涛. 结缔组织生长因子在特发性肺纤维化患者肺泡上皮细胞中的表达[J]. 中华结核和呼吸杂志, 2011, 34(10): 785-786.
8Li LC, Li DL, Xu L, et al. High-mobility group box1 mediates epithelial-to-mesenchymal transition in pulmonary fibrosis involving transforming growth factor-β1/Smad2/3 signaling [J]. J Pharmacol Exp Ther, 2015, 354(3): 228-233.
9李敏, 李新强, 付琳琳, 等. 靶向沉默转化生长因子β1表达的短发夹RNA的筛选[J]. 郑州大学学报:医学版, 2015, 50(1): 61-65.
10杨海萍, 姚丽. 支气管肺发育不良新生鼠肺上皮细胞标志物的表达及意义[J]. 中华实用儿科临床杂志, 2015, 30(2): 122-126.
11杨磊, 吕嘉春. 上皮细胞间质性转化调控子Snail基因外显子Val118Ala(c.353 T>C)变异能降低中国人群肺癌和慢性阻塞性肺疾病[J]. 中华预防医学杂志, 2014, 48(8): 706.
12岳喜磊, 成莹, 许继德. TRPC1在TGF-β1诱导支气管上皮细胞间充质转化中的作用[J]. 中国病理生理杂志, 2015, 31(3): 492-498.
13Liu GL, Yang HJ, Liu T, et al. Expression and significance of E-cadherin, N-cadherin, transforming growth factor-β1 and Twist in prostate cancer[J]. Asian Pac J Trop Med, 2014, 7(1): 76-82.
14Yamada A, Aki T, Unuma K, et al. Paraquat induces epithelial-mesenchymal transition-like cellular response resulting in fibrogenesis and the prevention of apoptosis in human pulmonary epithelial cells[J]. PLoS One, 2015, 10(3): 192-195.
15邹潇. PI3K/Akt信号通路对转化生长因子β1诱导的人肺上皮-间质细胞转分化的影响[J]. 实用医学杂志, 2012, 28(3): 358-360.
16Tang H, He H, Ji H, et al. Tanshinone IIA ameliorates bleomycin-induced pulmonary fibrosis and inhibits transforming growth factor-beta-β-dependent epithelial to mesenchymal transition [J]. J Surg Res, 2015, 197(1): 167-175.
17Choi SH, Hong ZY, Nam JK, et al. A Hypoxia-Induced Vascular Endothelial-to-Mesenchymal Transition in Development of Radiation-Induced Pulmonary Fibrosis [J]. Clin Cancer Res, 2015, 4(24): 65-68.
(本文编辑:王亚南)
黄振杰,曾彤华,蔡文华,等. TGF-β1诱导的肺泡上皮细胞间质转化及其机制探讨[J/CD]. 中华肺部疾病杂志: 电子版, 2016, 9(3): 292-296.
DOI:10.3877/cma.j.issn.1674-6902.2016.03.013
基金项目:广西卫生厅科研自筹基金资助项目(Z2011063)
通讯作者:黄振杰,Email: hzj1974bh@126.com
中图法分类号:R563
文献标识码:A
Corresponding author:Huang Zhenjie, Email: hzj1974bh@126.com
(收稿日期:2015-07-18)
Exploration of the process and mechanism for the epithelial mesenchymal cell transformation of pulmonary alveoli induced by TGF-β1
HuangZhenjie,ZengTonghua,CaiWenhua,OuShengjing,ChenWenhai,LiFei.RespiratoryMedicineDesect1mentofBeihaiPeople′sHospitalofGuangXi,Beihai536000,China
【Abstract】ObjectiveTo explore the process of Epithelial mesenchymal cell transformation (EMT) of pulmonary alveoli induced by transforming growth factorβ1 (TGF-β1) and its signal transduction pathways. MethodCultivated the adenocarcinoma cells of lung A549 in vitro, intervented by TGF-β1, using Westernblot method to detect the expression of the cell markers protein and signal transduction protein P-Smad2/3, Snail1, Snail2 before and after the intervention, using RT-PCR to detect the mRNA expression of the cell markers before and after the intervention. Observed the cell morphology by inverted phase contrast microscope. ResultsAfter the TGF-β1 intervention, with the extension of time, the protein and mRNA expression of the A549 cells epithelial markers E-cad and CK19 were low-regulation (P<0.05); The protein and mRNA expression level of the interstitial cell markers α-SMA, Vimentin were up-regulation (P<0.05); The expression of the signal transduction protein P-Smad2/3, Snail1 were up-regulation (P<0.05); Inverted phase contrast microscope observation: The A549 cells turn into spindle shape of after TGF-β1 intervention from pebble shape pre-intervention, like a muscle fiber mother cell. ConclusionTGF-β1 can induce alveolar epithelial turn into mesenchymal cells and its mechanism may be related to P-Smad2/3, Snail1 signal transduction pathways. TGF-β1 may result in the apoptosis of alveolar epithelial cells and fibrogenesis just by inducing epithelial-mesenchymal transition-like cellular response.
【Key words】Pulmonary fibrosis;Transforming growth factor beta 1;A549 cells;Epithelial mesenchymal cell transformation;Signal transduction pathways
北海市科研自筹基金项目资助(北科合201109002)
