磁示踪法在脑纹状体及黑质细胞间隙成像中的应用
2016-08-11董艳超DONGYanchao石春彦SHIChunyan吕德勇LVDeyong刘兰祥LIULanxiang韩鸿宾HANHongbin
董艳超DONG Yanchao石春彦SHI Chunyan吕德勇LV Deyong刘兰祥 LIU Lanxiang韩鸿宾HAN Hongbin
作者单位1.北京大学第三医院放射科 北京 1001912.磁共振成像设备与技术北京市重点实验室北京 1001913.河北医科大学附属秦皇岛市第一医院河北秦皇岛 066000
实验研究
磁示踪法在脑纹状体及黑质细胞间隙成像中的应用
董艳超1,2,3DONG Yanchao石春彦1,2SHI Chunyan吕德勇1,2LV Deyong刘兰祥3LIU Lanxiang韩鸿宾1,2HAN Hongbin
作者单位
1.北京大学第三医院放射科 北京 100191
2.磁共振成像设备与技术北京市重点实验室北京 100191
3.河北医科大学附属秦皇岛市第一医院河北秦皇岛 066000
Department of Radiology, Peking University Third Hospital, Beijing 100191, China
Address Correspondence to: HAN Hongbin E-mail: hanhongbin@bjmu.edu.cn
国家自然科学基金项目(61450004,81471633);高等学校博士学科点专项科研基金项目(20130001130013)。
R-33;R445.2
2016-01-13
中国医学影像学杂志2016年 第24卷 第6期:401-406
Chinese Journal of Medical Imaging 2016 Volume 24 (6): 401-406
目的 探讨脑深部区域纹状体及黑质的脑细胞间隙(ECS)的形态结构与生理特征,检测磁示踪法探测脑深部结构的准确性,发展新型脑深部结构成像技术。材料与方法 20只雄性SD大鼠随机分为纹状体、黑质两组,每组10只,分别在2个脑区ECS内注入示踪剂钆喷酸葡胺,应用MRI仪探测示踪剂扩散过程图像,利用自主研发的软件计算有效扩散系数(D*)、清除率(k')、示踪剂最大扩散范围(Vd-max%)及半衰期(t1/2)等ECS扩散参数。结果 纹状体区D*为(3.23±0.60)×10-4mm2/s,高于黑质区的(2.24±0.54)×10-4mm2/s,差异有统计学意义(t=3.842,P<0.05);两组k'值分别为(0.69±0.93)×10-4/s、(0.82±0.20)×10-4/s,差异无统计学意义(t=-1.823,P>0.05);纹状体区Vd-max%值及t1/2分别为(8.91±0.66)%、(84.57±2.62)min,均较黑质区的(3.49±0.32)%、(70.95±2.08)min大,差异有统计学意义(t=7.390、4.069,P<0.05)。结论 应用新型磁示踪法可以在全脑尺度动态显示细胞间隙内组织液的运动、分布与清除过程,并对脑深部组织的细胞间隙进行成像与定量分析。
纹状体;细胞外隙;磁共振成像;图像处理,计算机辅助;造影剂;模型,动物;大鼠,Sprague-Dawley
【Abstract】Purpose To investigate the morphological structure and physiological properties of extracellular space (ECS) of striatum and substantia nigra, and test the accuracy of the magnetic tracer-based method so as to develop a new imaging technology to detect deep brain structure. Materials and Methods Twenty male Sprague-Dawley rats were randomly divided into two groups: striatum and substantia nigra (n=10, respectively). As a tracer, gadolinium-diethylene triaminepentaacetic acid was injected into the ECS, then rats were scanned by MRI to detect the process of the tracer diffusion. The diffusion parameters including effective diffusion coeffcient (D*), clearance rate (k'), the maximal distribution volume ratio (Vd-max%) and half-life (t1/2) were calculated by using selfdeveloped software. Results Compared with substantia nigra group, D*, Vd-max% and k' were signifcantly larger in striatum group [(3.23±0.60)×10-4mm2/s vs. (2.24±0.54)×10-4mm2/s; (8.91±0.66)% vs. (3.49±0.32)%; (84.57±2.62) min vs. (70.95±2.08) min](t=3.842, 7.390 and 4.069, P<0.05), but there was no signifcant difference of the k' value between two groups [(0.69±0.93)×10-4/s vs. (0.82±0.20)×10-4/s] (t=-1.823, P>0.05). Conclusion These results suggest that the novel magnetic tracer-based method can show the movement, distribution and drainage process of interstitial fluid in the whole brain ECS,image and quantitatively analyze the deep brain region ECS.
【Key words】Corpus striatum; Extracellular space; Magnetic resonance imaging; Image processing, computer-assisted; Contrast media; Models, animal; Rats, Sprague-Dawley
脑细胞间隙(extracellular space,ECS)位于毛细血管及邻近神经细胞之间,是由壁结构围成的一个不规则、狭小、纡曲的间隙,大小仅38~64 nm[1],与血管系统共同构成脑微环境。对脑ECS进行深入研究需要一种针对ECS的精准测量方法,但如此狭小的空间导致测量难度加大,测量范围局限。目前,能够准确定量分析活体脑ECS的测量方法分为电化学方法(real-time iontophoresis,RTI-TMA+)[2]和荧光示踪法(integrative optical imaging,IOI)[3],但以上两种方法均存在探针在脑ECS与壁结构结合或转运进入血管、探测深度或距离小(<200 μm)、无法三维显示脑ECS测量图像等局限。为了解决上述问题,本研究提出并建立一种能够实现全脑尺度、探针精准分布、实时监测脑ECS内源性水分子扩散的新方法——磁示踪法。
本方法首先需要对脑ECS进行生物物理建模,理论上,如果要建立精准的脑ECS内物质转运模型,则需要充分考虑对此模型所有可能的影响因素。然而,由于大脑是一个极其复杂的系统,导致全面考虑所有可能影响因素较困难。因此,目前所有的测量方法均是建立在刚性细胞模型的基础上,即假设细胞是各种形式的刚性球体或多面体[4]。
应用钢性细胞模型,并结合计算方案(如有限元计算或蒙特卡罗模拟法)[3],有关的生物物理学参数几乎可以求解得出。目前,上述方法均采用修改的对流扩散方程,求解出扩散参数,见公式(1)。
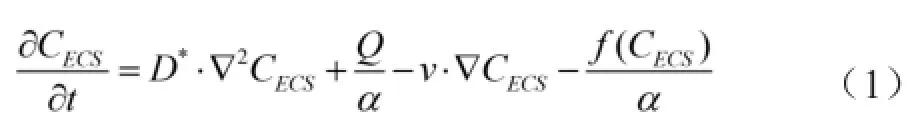
其中,方程左边表示CECS与时间的函数,CECS表示脑ECS中探针的实际浓度。这个函数会受到扩散相(D*·CECS)、流动相(v·CECS)及清除相[f(CECS)/α)这3种运动形式的影响。而Q/α表示探针注入脑ECS内对扩散的贡献。
公式(1)中有效扩散系数(D*)、α、v、f(CECS)为脑ECS待求解的特征性扩散参数,分别代表探针在脑ECS内扩散系数单位(mm2/s)、脑ECS在全脑容积分数、探针流动速度(mm/s)及清除速度。因此,必须引入数据源CECS与Q,分别为预设的探针信号源及探针导入源项。
1 材料与方法
1.1 探针的选择 基于MR成像仪对脑ECS进行特异性显像,需要能够对间隙内水分子进行标记探针。本方法采用钆喷酸葡胺(Gd-DTPA)作为探针,其具有高度生物医学惰性、热稳定性、分子量较小及特异性细胞外分布等[5]优点,并且可以“点亮”周围0.25 nm范围内的水分子,在MRI中呈现高信号,达到探测脑ECS的目的[6]。此外,脑ECS内Gd-DTPA浓度(CECS)与MRI图像上信号强度值(ΔSI)存在线性关系[7](图1),见公式(2)。

本课题组前期研究证明,注入示踪剂的有效浓度约为10 mmol/L,由Gd-DTPA溶于生理盐水中制备可得,此浓度不会影响脑ECS的渗透压[5-6]。
1.2 MRI扫描序列设计 采用Siemens 3.0T Trio扫描仪,应用8通道腕线圈,采用快速采集磁化准备梯度回波序列(MP-RAGE)T1加权成像。扫描参数:TR 3.7 ms,TE 1500 ms,反转时间900 ms,翻转角12°,视野267 mm,体素0.5 mm×0.5 mm×0.5 mm,矩阵512×512,平均次数2,相位编码步数96。每只大鼠扫描时间约为290 s。T1 MP-RAGE属于快速容积扫描序列,扫描图像空间分辨率好、信噪比高、伪影小、对比度高,并且能够三维显示鼠脑的精细结构信息,上述优点均满足本成像方法的需求[8]。
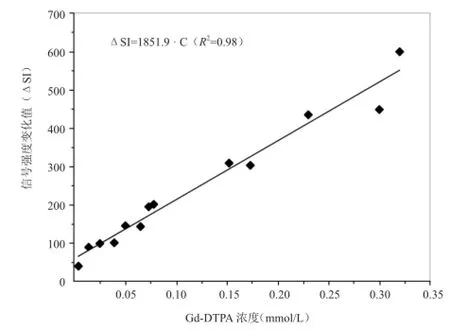
图1 Gd-DTPA浓度与信号强度的关系
1.3 琼脂糖凝胶模型制备 利用琼脂糖凝胶模型模拟自由扩散过程,将Gd-DTPA溶液2 μl注射到琼脂糖模型中,速度0.2 μl/min,注射完成后留针5 min防止反流。注射后,在保证模型37℃情况下,每30 min行MRI扫描1次,扫描获得 ΔSI,求得自由扩散参数D。
1.4 实验动物准备 选取250~300 g成年雄性SD大鼠20只,7周龄。随机分为纹状体、黑质两组,每组10只,分别选择纹状体、黑质作为注射部位。实验方案由北京大学生物医学伦理委员会实验动物福利伦理分会审批 (批准号LA 2009-008)。
将实验大鼠通过腹腔注射水合氯醛、戊巴比妥、乙醇、丙二醇和硫酸镁的混合溶液(剂量0.3 ml/kg)进行麻醉[5],实验过程中可以补充注射(每小时≤0.2 ml/kg)维持麻醉状态,并用电热垫维持体温在(38.0±0.5)℃。大鼠采用俯卧位进行MRI预扫描,获得示踪剂注入前参考图像,并确定穿刺部位,准备进行大鼠手术及示踪剂注射。首先,刮去大鼠头顶鼠毛,酒精消毒。从双耳区至两眼间线区,沿正中矢状缝切开皮肤,剥离肌肉、骨膜,暴露前囟。以前囟为坐标原点,确定2个穿刺点分别在纹状体区(1.0 mm, -3.2 mm,-4.8 mm)及黑质区(-4.8 mm,-1.9 mm, -8.5 mm)。将大鼠固定于立体定位仪(Lab Standard Stereotaxic-Single,Stoelting Co,Illinois,美国),并根据两组各自的坐标,在颅骨上进行钻孔。将10 μl微量进样器立体定位后,以0.2 μl/min向注射位点自动推入Gd-DTPA溶液(10 mmol/L)2 μl,留针5 min防止反流。迅速将大鼠置于MRI中进行扫描。其余大鼠均重复此步骤。
1.5 MR扫描图像后处理 注射Gd-DTPA示踪剂后,分别于第15、30分钟及其后每小时用上述MP-RAGE T1加权序列进行扫描,直至药物完全清除。注药前后获得的MR图像,采用以MATLAB(Matrix Laboratory,矩阵实验室软件)为基础自主研发的软件进行配准。所有示踪剂注射后的MR图像经自动刚性变换、相似性测量、高阶内插,以及自适应随机梯度下降优化后,与注射前参考图像进行剪影,获得剪影后图像(图2)。此软件可将原始图像转化为一套新的、层厚为1 mm的包含矢状位、轴位和冠状位处理后的MR图像。在新生成的图像感兴趣区(ROI)内设定1个或多个种子点及阈值,即可自动获得与示踪剂扩散相关的“明亮区域”,测量出MR图像ROI的ΔSI,所得数值将用于进一步计算鼠脑ECS的扩散参数。

图2 整体实验流程及软件配准
1.6 脑ECS微观扩散参数提取 本方法中Q/α远小于扩散范围容积,可以被忽略;实验测量时将测量区域尽量靠近示踪剂注射点(距离为2 mm),且认为局部脑组织间液并非直线流动,因此可以将流动相忽略。经过上述简化得出公式(3)。
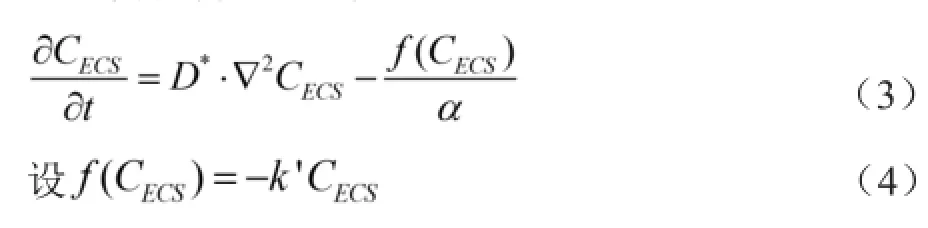
其中,k'代表一级清除速率常数(单位为/s)。如前所述,CECS与ΔSI呈线性关系,因此,将公式(2)、(3)、(4)结合,并进一步推导可得公式(5)。
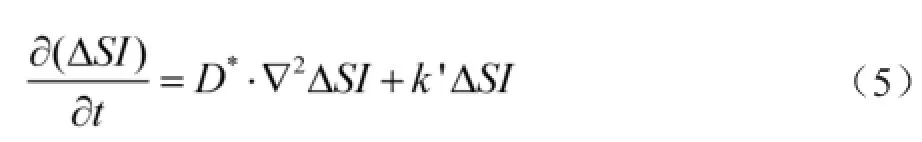
所有扩散参数计算均采用标准最小二乘方程,见公式(6)。
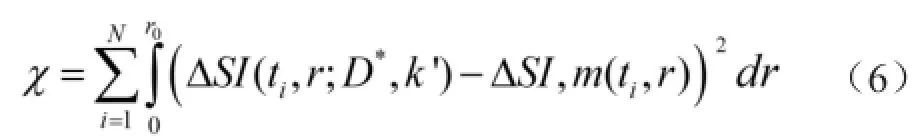
其中ΔSI,m(ti,r)表示ti时刻测得的扩散的径向范围,由于MR图像是在一系列预设好的时间间隔ti(i=1,2,…,n)内采集的,因此每一张MR图像上沿一条指定的径向路径均可测得ΔSI随距离变化分布情况。扩散参数D*和清除率k'可以通过ti时刻自由扩散模型及实测曲线的匹配测得。本研究中,曲线拟合采用标准最小二乘法,使方程中χ最小,求解出D*和k'。曲线上所有数据点的测量误差相同。在计算χ时,沿半径r测量径线的累加是用其沿特定测量路径上(从注射原点到测量点的特殊轴线)的加和来替代,数值最小化的计算采用单纯下行计算方法。
将运算好的公式编程进入自主研发的软件内。仅需将经过后处理的3D MR图像传输到工作站中。选择Gd-DTPA扩散区域的中央作为起始点,然后在MR图像上Gd-DTPA分布区域内,对距离扩散起始点2 mm内每个像素的扩散参数进行自动计算,并在转换后的图像上逐像素显示结果。选择3个正交坐标轴的平行方向和相反方向计算参数值。由于针道的干扰,故舍弃+y方向。5个方向上所有参数均用x±s表示。每个方向路径中点的测量值计算扩散参数(如距离扩散起始点2 mm)。实际上任意方向的扩散参数均可用于分析,而本研究仅选取标准解剖学方向呈现参数值。
1.7 脑ECS宏观扩散参数计算 将处理后图像分别每个时间点的处理后图像上设置种子点和阈值,可以获得处理后图像上每个时间点的示踪剂扩散范围,用示踪剂最大扩散范围(maximal distribution volume ratio,Vd-max%)代表示踪剂所有时间点内最大扩散范围占鼠脑总体积的百分比;应用此软件获得每一时刻最大扩布范围值的同时,也将获得图像上加权Vd值(带有信号强度与扩散范围的信息),由于脑ECS内探针清除符合一级动力学方程,将获得的加权Vd值输入MATLAB内同样采用最小二乘拟合,进一步得到示踪剂浓度衰减的半衰期(t1/2),见公式(7)。

1.8 统计学方法 采用SPSS 21.0软件,两组动物D*、λ、k'、Vd-max%及t1/2比较采用成组资料t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 脑内不同区域微观扩散参数比较 根据上述方法,得出琼脂糖模型中,水分子自由扩散系数D为5.18×10-4mm2/s。脑内不同区域扩散参数存在明显差异。纹状体区有效扩散参数D*值较黑质区高,差异有统计学意义(t=3.842,P<0.05),故对应的λ值黑质区比纹状体区大。而两组清除率k'值比较,差异无统计学意义(P>0.05),见表1。
2.2 脑内不同区域宏观扩散参数比较 纹状体区与黑质区宏观扩散参数Vd-max%值及t1/2比较,差异均有统计学意义(t=7.390、4.069,P<0.05),见表1。
本研究发现,探针在脑ECS内扩散并非设想的可以扩散到整个大脑半球中,而是在某一特定的区域,并慢慢被清除。本研究中,纹状体区探针会缓慢地扩散至同侧纹状体、基底节区向大脑皮层扩散,而黑质区示踪剂扩散仅局限于中脑内小部分区域,并且被迅速清除,见图3。
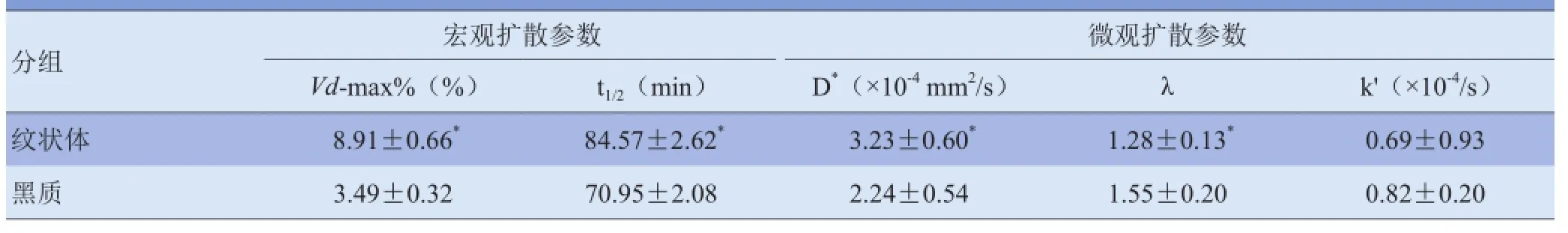
表1 纹状体与黑质区微观扩散参数和宏观扩散参数比较
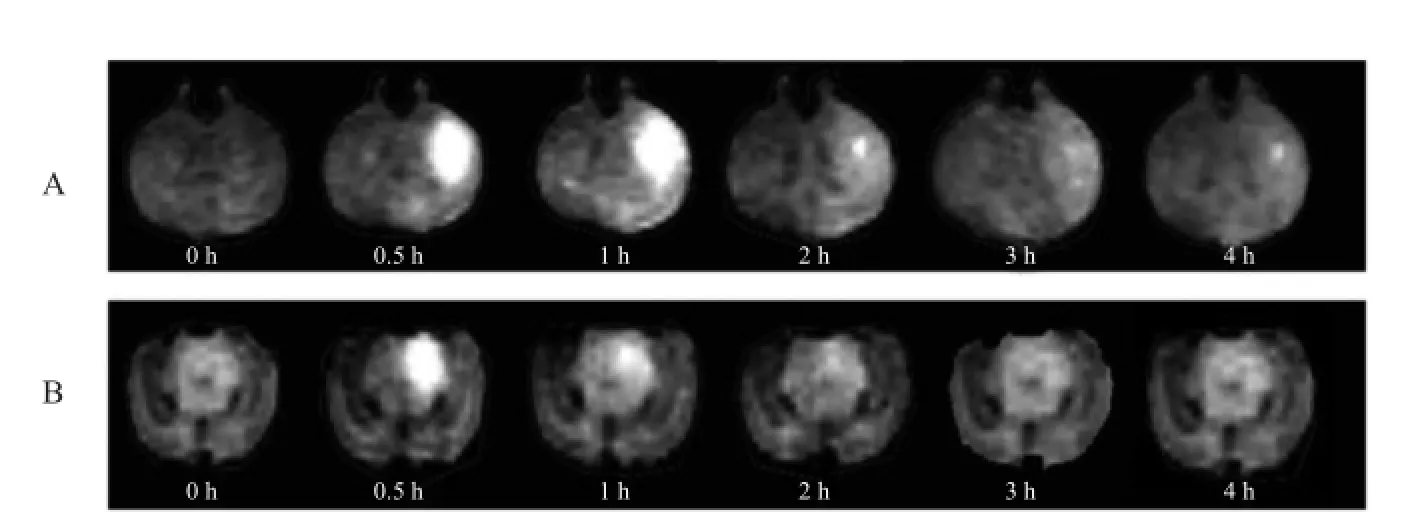
图3 纹状体区(A)与黑质区(B)探针扩散过程
3 讨论
3.1 磁示踪法测量脑ECS扩散参数的优势 脑ECS占全脑容量的17%~20%,是将血液系统和神经细胞紧密联系在一起的动态变化的复杂区域[3],它在实现许多脑功能中具有重要作用,包括神经元间的信息传递、处理与整合,协调大脑对内、外环境的变化等[9]。此外,脑ECS在许多脑病的发病机制中起到推进作用。目前,神经学家们也已认识到单纯从神经细胞及脑血管方面无法完全解释疾病发生的原因。例如,当发生阿尔茨海默病(Alzheimer's disease,AD)、缺血-再灌注损伤和帕金森病(Parkinson's disease,PD)等时,由于脑ECS内的化学成分及几何结构改变,会导致纡曲度(λ)的变化。Armstrong[10]研究发现,发生AD时,位于大脑皮层的神经元丢失,ECS内淀粉样蛋白(Aβ蛋白)沉积,导致脑ECS的λ增加,进一步阻碍Aβ蛋白的清除,加快疾病进展;发生缺血-再灌注脑损伤时,由于神经细胞毒性水肿,直接改变脑ECS的几何结构,损伤的脑皮层ECS的λ值从1.5增加到2.1,更加不利于细胞毒性物质的清除;同样发生PD时,黑质区λ会降低,而纹状体区λ会升高[3]。因此,对脑ECS进行深入研究,将会更有助于从新的角度阐明脑病的病理与病理生理学机制。
因此,对于脑ECS的精准测量方法是不可或缺的。既往研究曾尝试利用水分子作为内源性探针,利用扩散加权成像对细胞间隙进行测量。但细胞内外水分子存在动态交换过程,这使得区分两房室内水分子扩散十分困难。因此,探测脑ECS中水分子扩散不得不引入Gd-DTPA作为探针进行MRI探测成像。
引入的探针性质需要相当稳定,只有这样才能反映脑ECS的精细结构,而以往的监测手段RTI-TMA+、IOI,由于选择的探针或能进入血液或与细胞膜上带负电荷的透明质酸结合,影响其测量精度,并且只能得到D*、k',难以从整体上获得探针在脑ECS中扩散运动的信息。此外,本研究利用磁示踪法针对2个深部脑区进行研究,D*、k'、Vd-max%及t1/2分别与以往研究结果相近[5,11-14],表明磁示踪法具有稳定性好、可重复性高等优点。
本研究结果显示纹状体与黑质微观扩散参数D*存在明显差异,纹状体区有效扩散参数D*值较黑质区高,λ值黑质区较纹状体区大,此结果与以往研究报道一致[3]。有研究认为黑质区多巴胺神经元的存在是造成λ值升高的主要原因,多巴胺神经元较脑内的胶质细胞长,其长度是星形胶质细胞的5倍,其较长的神经纤维造成细胞间隙内水分子扩散受限,即λ增加[15]。纹状体及黑质区宏观扩散参数之间差异均有统计学意义,纹状体区Vd-max%及t1/2均较黑质区大,黑质区Vd-max%较小的原因与该区域的细胞组成及排列结构也密切相关,其细胞间隙内水分子扩散相对受限,导致其难以扩散呈纹状体区如此大的范围。而纹状体区t1/2值较大的原因很可能与该区域内水通道蛋白(AQP4)成分较少有关,既往研究表明纹状体区t1/2值较丘脑明显增大,其原因与纹状体区AQP4量较少存在明显相关性[14]。
本研究中,单次注射Gd-DTPA后进行MRI扫描不仅能够“一站式”获得D*、k'、Vd-max%及t1/2,并且能够对脑ECS内水分子扩散过程及脑ECS内细胞间液(interstitial fluid,ISF)转运进行三维可视化成像。该方法可以沿靠近注射点的任意方向多点测量扩散参数。磁示踪法应用修改后的扩散方程为基础计算局部扩散参数。由于本方法中ROI非常接近探针注射部位(距注药点2 mm),可以满足修改的对流扩散方程的基本需要;并且可以动态观察脑ISF的流动情况。通过量化测量脑ISF的引流清除过程,获得Vd-max%与t1/2药代动力学参数,为建立经脑ECS给药治疗脑病成为可能,这较其他两种方法更具实用价值。
3.2 脑ECS扩散参数差异及脑ISF引流分区现象 通过上述成像方法,本研究同时证实脑ECS是一个非均一同质的系统,如位于中脑黑质区ECS的λ为1.36~1.84,较纹状体区λ仅为1.10~1.42,可以认为脑内不同区域的扩散参数不同,使人们对脑内不同部位的解剖结构认识更加深入。
人们普遍认为脑组织间液系统是一个互联管道系统[3],即某个部位的脑ECS也许可以有多种通路。然而,本研究结果显示脑ECS是一个存在生理分区的系统,每个区均具有独特的ISF分布特点及引流速度。示踪剂在纹状体区脑ISF分布更为广泛,而在中脑黑质区内仅在局部引流清除。ISF引流特性不仅会改变人们对在体脑微环境的认识,而且能够为优化经脑局部给药提供有价值的参考。总之,此方法可以精确测量局部脑ECS中水分子扩散参数,并且可以实现在体、实时、全脑尺度脑ISF流动监测。
目前,经脑ECS途径给药在治疗脑肿瘤、PD及AD中显示出极大的前景[16]。然而,在脑微环境研究领域,科学家还有许多工作需要进行,包括建立脑ECS物质转运模型,预测中枢神经系统治疗药物的动态分布,进一步评价上述经脑ECS进行的药物治疗方法的疗效。如果能够在全脑尺度更加深入地了解脑ECS治疗药物扩散及分布特性,则能够对药物注射部位、速度、导管设计和药物选择等治疗的操作参数进行优化配置,将为人类战胜脑病提供新方向。
然而,本实验尚存在一些不足,实验大鼠数量较少,可能造成统计时系统误差。此外,本实验未做基础病理学实验,上述实验结果分析难以在实验结果的支持下给出,仅在以往实验报道的基础上做出结论,因此在以后的实验研究中需要制订更完善的方案,做出更加具有说服力的结论。
[1]Thorne RG, Lakkaraju A, Rodriguez-Boulan E, et al. In vivo diffusion of lactoferrin in brain extracellular space is regulated by interactions with heparan sulfate. Proc Natl Acad Sci U S A,2008, 105(24): 8416-8421.
[2]Cserr HF, Depasquale M, Nicholson C, et al. Extracellular volume decreases while cell volume is maintained by ion uptake in rat brain during acute hypernatremia. J Physiol, 1991,442: 277-295.
[3]Syková E, Nicholson C. Diffusion in brain extracellular space. Physiol Rev, 2008, 88(4): 1277-1340.
[4]Rusakov DA, Kullmann DM. Geometric and viscous components of the tortuosity of the extracellular space in the brain. Proc Natl Acad Sci U S A, 1998, 95(15): 8975-8980.
[5]Han H, Shi C, Fu Y, et al. A novel MRI tracer-based method for measuring water diffusion in the extracellular space of the rat brain. IEEE J Biomed Health Inform, 2014, 18(3): 978-983.
[6]Han H, Li K, Yan J, et al. An in vivo study with an MRI tracer method reveals the biophysical properties of interstitial fluid in the rat brain. Sci China Life Sci, 2012, 55(9): 782-787.
[7]Xu F, Han H, Zhang H, et al. Quantification of Gd-DTPA concentration in neuroimaging using T13D MP-RAGE sequence at 3.0 T. Magn Reson Imaging, 2011, 29(6): 827-834.
[8]He QY, Han HB, Xu FJ, et al. Imaging and quantitative measurement of brain extracellular space using MRI Gd-DTPAtracer method. Beijing Da Xue Xue Bao, 2010, 42(2): 188-191.
[9]Kastellakis G, Cai DJ, Mednick SC, et al. Synaptic clustering within dendrites: an emerging theory of memory formation. Prog Neurobiol, 2015, 126: 19-35.
[10]Armstrong RA. Laminar distribution of β-amyloid (Aβ) peptide deposits in the frontal lobe in familial and sporadic Alzheimer's disease. Folia Neuropathol, 2015, 53(1): 15-23.
[11]韩鸿宾. 应用磁共振成像技术定量测量活体大鼠脑细胞外间隙的扩散参数. 北京大学学报(医学版), 2012, 44(5): 770-775.
[12]王帅文, 石春彦, 左龙, 等. 老年SD大鼠脑组织间液内MR示踪剂扩散特征的研究. 中国医学影像学杂志, 2015,23(6): 409-412.
[13]左龙, 雷易鸣, 闫军浩, 等. 基于脑局部给药的药物分布与清除大鼠模型的建立. 中国微创外科杂志, 2015, 15(4): 360-365.
[14]Zuo L, Li K, Han HB. Comparative analysis by magnetic resonance imaging of extracellular space diffusion and interstitial fluid flow in the rat striatum and thalamus. Appl Magn Reson, 2015, 46(6): 623-632.
[15]Ren R, Shi C, Cao J, et al. Neuroprotective effects of a standardized flavonoid extract of safflower against neurotoxininduced cellular and animal models of parkinson's disease. Sci Rep, 2016, 6: 22135.
[16]Barua NU, Gill SS, Love S. Convection-enhanced drug delivery to the brain: therapeutic potential and neuropathological considerations. Brain Pathol, 2014, 24(2): 117-127.
(本文编辑 张春辉)
Magnetic Tracer-based Method to Image the Extracellular Space of Striatum and Substantia Nigra
韩鸿宾
2015-10-12
10.3969/j.issn.1005-5185.2016.06.001
