幼年特发性关节炎的影像学研究进展
2016-08-11袁新宇
刘 明 袁新宇
幼年特发性关节炎的影像学研究进展
刘 明 袁新宇
关节炎;滑膜炎;腱鞘炎;骨髓疾病;水肿;放射摄影术;超声检查;磁共振成像;儿童;综述
幼年特发性关节炎(juvenile idiopathic arthritis,JIA)是一组16岁之前发病、持续6周以上的不明原因的慢性全身性疾病,以慢性关节滑膜炎为主要特征,或伴有各组织、器官不同程度的损害[1]。儿童骨骺的血供丰富,主要由受干骺端血管和穿越生长板的骨骺血管供血。干骺端血管吻合了穿越生长板的骨骺血管。因此,累及骺软骨的炎症也可累及骨化中心,引起过度生长、畸形、骨骺侵蚀破坏,而边缘侵蚀很少见。JIA首先侵犯软骨表面,再扩展到骨化中心。关节狭窄出现早,很快进展为关节强直,而晚期才会出现骨侵蚀[2]。慢性关节炎症可以改变其生理过程,从而引起影像学变化,如过度充血可引起骨早熟和干骺端过度生长、软骨和骨损伤可引起生长迟滞等。本文拟对JIA最常用的影像学检查的表现特点及研究进展做一综述。
1 X线
JIA的X线特点[3]:①早期非特异性表现:软组织肿胀;骨量减少,骨质疏松。②晚期不可逆表现:关节间隙变窄、不规则;骨侵蚀;关节强直;关节对位异常。③生长发育期关节炎的特异性表现,局部生长障碍或过度。④其他表现:骨膜炎,常见于指骨、掌骨和跖骨近端骨干;钙化,关节内、关节囊、关节周围的钙化常发生于1次或多次关节注射激素治疗后。
X线评估儿童骨和软骨受累非常困难,儿童的关节软骨比成人厚,而且会随生长发育而变化,因此Breton等[2]建议双侧对比观察。Magni-Manzoni等[4]研究表明,JIA常累及掌指关节、近端指间关节、腕关节。Devauchelle-Pensec等[5]建议进行手、足正位片检查,侧位片是否有效仍未知。复查手、足X线的适应证包括[2,5-6]:①评估临床治疗效果,治疗1年后进行复查;②进行了新治疗,1年后复查,如治疗有效第2年继续复查;③临床症状缓解,没有不良预后因素可不复查;④严重、难以控制的疾病,6个月复查1次。
然而,X线对软组织分辨率差,难以早期发现病变,而超声和MRI在JIA中的应用正逐渐受到重视。
2 超声
JIA的超声征象为[3]:①关节积液:关节内可移动、可压缩的异常低回声或无回声区(相对皮下脂肪,偶见等回声或高回声),但不能探及多普勒信号;②滑膜增厚:关节内不能移动、不能压缩的异常低回声(相对皮下脂肪,可为等回声或高回声),可探及多普勒信号;③关节软骨变薄和破坏:软骨表面不光滑,慢性病程可见骨侵蚀;④腱鞘炎:腱鞘表现为至少2个垂直平面上增厚的低回声或无回声区,内部可探及多普勒信号;⑤增生性黏液囊病:不规则增厚的滑膜襞包绕渗出的黏液囊表现为低回声;⑥骨侵蚀:2个垂直平面可观察到关节内骨面不连续。
2.1 滑膜炎 超声适合诊断和评估关节滑膜炎,彩色多普勒和能量多普勒更适合诊断活动性疾病[7]。灰阶多普勒观察到的异常(如关节积液和滑膜增生)并不能反映疾病目前的活动性。彩色多普勒能监测血流,血流增多是滑膜血管增生的标志。然而,健康儿童发育过程中的生理性血流增加与多普勒滑膜炎的征象不易区分[8]。Beitinger等[9]提出对比增强超声能区分活动性和非活动性滑膜炎,但注射对比剂不但增加成本,还使该检查成为有创检查。
2.2 亚临床滑膜炎 超声比临床更能准确地检测出关节炎症[10],有助于提高JIA亚型分类的准确性。多关节型临床用药优先选择二线药物或生物制剂,确诊亚临床疾病不但可以改变患儿的临床分型,更能改变患儿的临床治疗和预后。在国际风湿病学联盟分类中,少关节型受累关节≤4个,多关节型受累关节≥5个,临床体格检查容易漏诊亚临床关节炎,将多关节型误诊为少关节型,超声更有助于临床准确判断关节受累的数量。
2.3 腱鞘炎 腱鞘受累可发生于JIA的任何阶段,然而对于弥漫性关节肿胀而言,脂肪分布、缺乏明显的解剖标志、合作性差等原因,使依靠临床体格检查区分幼儿关节滑膜炎和腱鞘炎非常困难。Rooney等[11]的研究表明,超声是一种评估JIA患儿肿胀踝关节解剖结构非常有效的方法,能准确地判断炎症发生部位,特别是在复杂和临床难以评估的关节中可发挥重要作用。
2.4 软骨侵蚀和骨侵蚀 超声可以评估未成熟骨骼的软骨完整性,显示未骨化的骨骺软骨,早于X线平片数周发现骨化核。Spannow等[12]测量了多个关节的关节软骨厚度,用变异系数(coeffcient of variation,CV)表示观察者间的一致性,结果发现膝关节CV<10%,掌指关节CV<13%,踝关节和远节指骨CV<20%,腕关节CV>26%。Spannow等[13]的超声研究建立了7~16岁正常儿童膝、踝、腕、掌指、远节指骨等关节软骨厚度的区间,更有助于评估JIA患儿关节软骨的改变。
【作者单位】 首都儿科研究所放射科 北京 100020
超声评估儿童骨侵蚀非常困难,因为生长发育中的骨化结构可见生理性不规则,容易被误认为皮质缺损[14]。
3 MRI
JIA的MRI征象特点[3]:①关节积液(图1、2):T1WI低信号,T2WI高信号;②滑膜炎(图2B):滑膜增厚,增强扫描后可见强化;③骨髓水肿(图1):骨小梁区域内边界不清、含水量增多信号;④骨侵蚀(图1、3):骨骼表面至少2个层面可见边界清晰的液性区或滑膜信号区;⑤软骨损伤:软骨变薄,边缘不规则或缺失,深部的软骨缺失主要表现为质子密度加权成像或T2WI上异常低信号;⑥腱鞘炎:腱鞘滑膜渗出,增强扫描可见强化;⑦附着点炎:肌腱附着部位的炎症信号,常见于附着点炎症相关型JIA。附着点炎可引起骨膜炎改变。
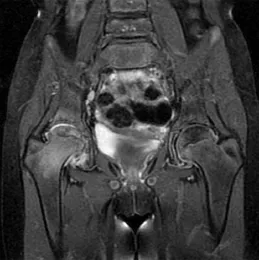
图1 女,11岁,RF(—)多关节型。冠状位质子密度加权成像示右侧股骨颈高信号,提示骨髓水肿。右侧股骨头骨骺变扁,信号增高。右侧少量关节积液
3.1 滑膜炎 MRI增强扫描可区分活动性增生性血管翳和非活动性纤维性血管翳[15],在脂肪抑制的T1WI增强序列中,活动性增生性血管翳明显强化呈高信号,非活动性纤维性血管翳不强化或弱强化。MRI还能评估炎症的程度和部位(如滑膜炎与腱鞘滑膜炎),发现亚临床滑膜炎[2]。Malattia等[16]的研究证明,OMERACT半定量的成人类风湿MRI评分系统能有效地定量评估JIA患儿腕关节滑膜炎的严重程度。
计算机测量滑膜体积是一项定量评估JIA关节疾病活动的精确方法,其原理为在可视分析图像上,在计算机协助下,人工描述出基本的滑膜轮廓。
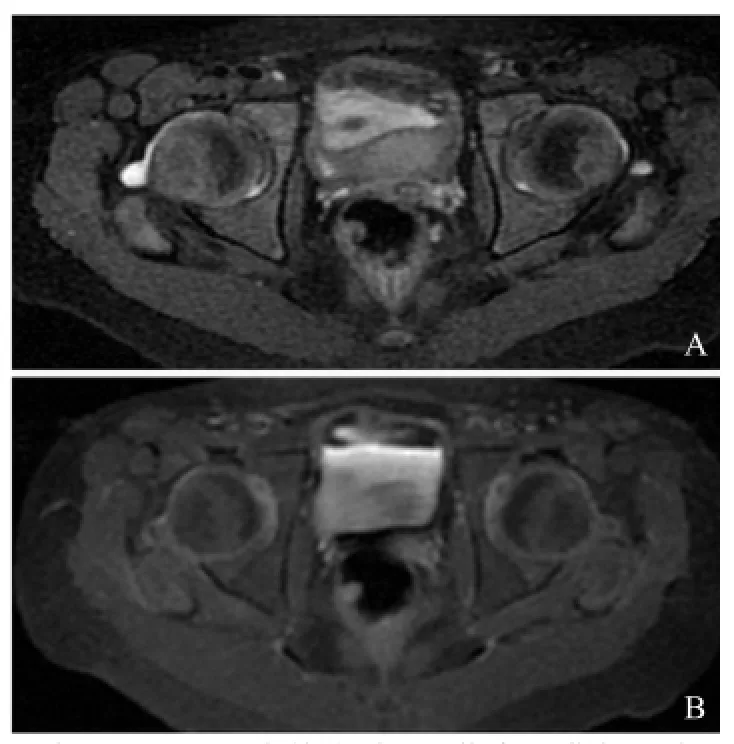
图2 女,7岁,RF(+)多关节型,亚临床滑膜炎。质子密度加权成像示双侧髋关节少量积液,右侧显著(A);T1WI增强扫描可见双侧髋关节滑膜强化(B)
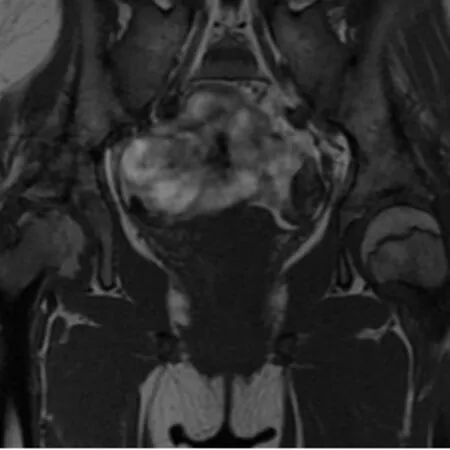
图3 女,13岁,少关节型。冠状位T2WI示右侧股骨头变扁,形态异常,股骨头骨骺、股骨颈骨形态异常
另一种定量评估关节炎症的方法是MRI动态增强扫描,其原理为注射钆对比剂后,分析信号强度随时间变化的规律。滑膜囊的早期强化率是由局部组织血管化程度和毛细血管通透性决定的,它们均是炎性活动度的指标。对RA患者而言,MRI动态增强扫描是一种敏感、准确地评估滑膜炎、反映疗效的方法,也可以预测远期骨破坏;该技术对JIA腕关节炎患儿同样有效[17]。在MRI动态扫描层面上,利用全自动基于像素的信号强度分析法可以有效克服动态时间曲线中ROI方法的缺点,同时呈现出一幅真实客观的整体组织图[18]。在计算机辅助监测系统下,计算每个像素的动态参数,形成整体的彩色参数图,提供了一种先进且可视的评估受累关节严重和进展程度的方法。
3.2 骨髓水肿 外周关节骨髓水肿是成人RA侵袭性关节损害和功能不良的主要预测指标[19]。然而,JIA患儿的预后与这种表现关系不大。55.8%的健康儿童腕骨有类似骨髓水肿的表现,与JIA患儿的表现一致[20];健康成人的类似研究却未发现此现象[21],表明生长发育的骨关节具有特殊性,建立与年龄、性别相匹配的健康儿童MRI正常标准非常必要,并应进行长期随访研究,探讨骨髓水肿能否预测JIA患儿的骨侵蚀。
3.3 关节软骨侵蚀 MRI可直接观察关节软骨,并区分生长发育中不同时期的关节软骨类型(关节软骨、骺软骨、骨干软骨)[22]。对JIA患儿膝关节软骨损伤的评估,MRI增强扫描比超声和X线更敏感[23]。
超短TE序列,如驱动平衡傅里叶转换成像和稳态自由进动成像,在监测关节软骨表面轻微的不规则和局部缺陷方面很有前景[22]。三维图像资料能提供关节表面轮廓图,三维体积定量测量关节软骨可用于评估慢性关节炎患者的进展和疗效,该技术有助于监测JIA患儿关节软骨体积随病程进展而发生的改变。
Kim等[23]提出,利用T2弛豫时间测定关节软骨中水的迁移率能很敏感地反映细胞外间质中胶原蛋白的完整性。在与性别、年龄匹配的健康儿童对照研究中,T2-map可以反映JIA患儿关节软骨的微观改变。Reiter等[24]的研究已经证实横向弛豫率和胶原基质中胶原浓度之间的相关性。T2-map序列可以评估细胞外软骨生化和生理学的改变,在形态学改变之前即可以定量测量,早期提示软骨损伤(相对于传统成像技术)。
扩散加权成像测定水迁移率的微观改变,可以间接评估组织的完整性。通过反映胶原纤维降解程度,该技术可以早期评估关节软骨异常[25]。
软骨磁共振延迟增强扫描是一种静脉注射阴离子MRI对比剂(钆)后评估软骨黏多糖(GAGs)含量的技术。对比剂在软骨内的分布与带负电荷黏多糖的固定电荷浓度相反:GAGs含量低的区域(相对多的正电荷),集聚高浓度的钆;GAGs含量高的区域,集聚低浓度的钆(同性电荷相斥)。钆浓度是GAGs含量的间接标志物,通过T1WI信号强度的变化体现。因为钆具有缩短T1值的效应,软骨内GAGs含量少的区域T1值短。因此T1值与GAGs间几乎呈线性相关[25]。
3.4 骨侵蚀 MRI对RA患者腕关节的骨侵蚀最敏感,其敏感性是超声和X线的2倍[26]。MRI能准确地发现病程较短患者的骨侵蚀,在病程较短(<3年)的患者中有显著差异。然而,这些发现受到Müller等[19]研究的挑战,该研究发现88名健康儿童(年龄5~15岁)腕关节MRI的骨凹陷类似骨侵蚀,所有儿童均有上述表现且随着年龄而增加。这项研究表明,评估生长发育中的骨骼非常困难,骨表面这种明显改变是病理性的还是正常发育的一部分,有待于长期对JIA患儿和健康儿童进行研究评估。
综上所述,影像学在评估JIA中发挥非常重要的作用。尽管X线有很多缺陷,但其仍是长期监测JIA患儿慢性改变和生长缺陷的重要方法。超声在评估关节炎症、腱鞘炎、关节破坏程度等方面很有优势,但目前仍缺乏诊断标准及有效可行的评分方法。MRI是评估JIA患儿炎症和关节破坏最有前景的影像学技术,可以大大提高JIA的诊断率。然而,利用成人已有的研究结果应用于儿童疾病研究,可能会过高或过低地评估该病。因此,以正常发育的儿童研究(健康儿童的骨缺损、骨髓信号转化特点、关节液体的量等)为基础,建立JIA患儿的评分标准至关重要。新的影像学技术为临床提供了丰富的形态学、功能学和生物化学资料。通过结合影像学表现、临床表现、遗传学和免疫学资料,能进一步提高临床医师对JIA发病机制的认识。
[1] 《中华儿科杂志》编辑委员会, 中华医学会儿科学分会免疫学组. 幼年特发性关节炎(多/少关节型)诊疗建议. 中华儿科杂志, 2012, 50(1): 20-26.
[2]Breton S, Jousse-Joulin S, Finel E, et al. Imaging approaches for evaluating peripheral joint abnormalities in juvenile idiopathic arthritis. Semin Arthritis Rheum, 2012, 41(5): 698-711.
[3]Damasio MB, Malattia C, Martini A, et al. Synovial and inflammatory diseases in childhood: role of new imaging modalities in the assessment of patients with juvenile idiopathic arthritis. Pediatr Radiol, 2010, 40(6): 985-998.
[4]Magni-Manzoni S, Epis O, Ravelli A, et al. Comparison of clinical versus ultrasound-determined synovitis in juvenile idiopathic arthritis. Arthritis Rheum, 2009, 61(11): 1497-1504.
[5]Devauchelle-Pensec V, Josseaume T, Samjee I, et al. Ability of oblique foot radiographs to detect erosions in early arthritis: results in the ESPOIR cohort. Arthritis Rheum, 2008, 59(12): 1729-1734.
[6]Van Nies JA, Van Steenbergen HW, Krabben A, et al. Evaluating processes underlying the predictive value of baseline erosions for future radiological damage in early rheumatoid arthritis. Ann Rheum Dis, 2015, 74(5): 883-889.
[7]李拾林, 吕国荣, 肖进益, 等. 超声检查类风湿关节炎踝关节病变的应用价值. 中国医学影像学杂志, 2010, 18(3): 223-224.
[8]Breton S, Jousse-Joulin S, Cangemi C, et al. Comparison of clinical and ultrasonographic evaluations for peripheral synovitis in juvenile idiopathic arthritis. Semin Arthritis Rheum, 2011, 41(2): 272-278.
[9]Beitinger N, Ehrenstein B, Schreiner B, et al. The value of colour Doppler sonography of the knee joint: a useful tool to discriminate inflammatory from non-inflammatory disease? Rheumatology (Oxford), 2013, 52(8): 1425-1428.
[10]Filer A, De Pablo P, Allen G, et al. Utility of ultrasound joint counts in the prediction of rheumatoid arthritis in patients with very early synovitis. Ann Rheum Dis, 2011, 70(3): 500-507.
[11]Rooney ME, Mcallister C, Burns JF. Ankle disease in juvenile idiopathic arthritis: ultrasound fndings in clinically swollen ankles. J Rheumatol, 2009, 36(8): 1725-1729.
[12]Spannow AH, Pfeiffer-Jensen M, Andersen NT, et al. Inter-andintra-observer variation of ultrasonographic cartilage thickness assessments in small and large joints in healthy children. Pediatr Rheumatol Online J, 2009, 7(1): 858.
[13]Spannow AH, Pfeiffer-Jensen M, Andersen NT, et al. Ultrasonographic measurements of joint cartilage thickness in healthy children: age-and sex-related standard reference values. J Rheumatol, 2010, 37(12): 2595-2601.
[14]Tămaş MM, Filippucci E, Becciolini A, et al. Bone erosions in rheumatoid arthritis: ultrasound fndings in the early stage of the disease. Rheumatology (Oxford), 2014, 53(6): 1100-1107.
[15]Kan JH, Graham TB. Combined pre-injection wrist and ankle MRI protocol and steroid joint injections in juvenile idiopathic arthritis. Pediatr Radiol, 2011, 41(10): 1326-1332.
[16]Malattia C, Damasio MB, Pistorio A, et al. Development and preliminary validation of a paediatric-targeted MRI scoring system for the assessment of disease activity and damage in juvenile idiopathic arthritis. Ann Rheum Dis, 2011, 70(3): 440-446.
[17]Malattia C, Damasio MB, Basso C, et al. Dynamic contrastenhanced magnetic resonance imaging in the assessment of disease activity in patients with juvenile idiopathic arthritis. Rheumatology (Oxford), 2010, 49(1): 178-185.
[18]Kubassova O, Boesen M, Cimmino MA, et al. A computer-aided detection system for rheumatoid arthritis MRI data interpretation and quantifcation of synovial activity. Eur J Radiol, 2010, 74(3): e67-72.
[19]Müller LS, Avenarius D, Damasio B, et al. The paediatric wrist revisited: redefning MR fndings in healthy children. Ann Rheum Dis, 2011, 70(4): 605-610.
[20]Schett G, Gravallese E. Bone erosion in rheumatoid arthritis: mechanisms, diagnosis and treatment. Nat Rev Rheumatol, 2012,8(11): 656-664.
[21]Olech Ewa, Crues JV, Yocum DE, et al. Bone marrow edema is the most specifc fnding for rheumatoid arthritis (RA) on noncontrast magnetic resonance imaging of the hands and wrists: a comparison of patients with RA and healthy controls. J Rheumatol, 2010,37(2): 265-274.
[22]Mcmahon CJ, Madhuranthakam AJ, Wu JS, et al. High-resolution proton density weighted three-dimensional fast spin echo(3D-FSE)of the knee with IDEAL at 1.5 Tesla: comparison with 3D-FSE and 2D-FSE--initial experience. J Magn Reson Imaging, 2012, 35(2): 361-369.
[23]Kim HK, Laor T, Graham TB, et al. T2 relaxation time changes in distal femoral articular cartilage in children with juvenile idiopathic arthritis: a 3-year longitudinal study. Am J Roentgenol,2010, 195(4): 1021-1025.
[24]Reiter DA, Irrechukwu O, Lin PC, et al. Improved MR-based characterization of engineered cartilage using multiexponential T2 relaxation and multivariate analysis. NMR Biomed, 2012, 25(3): 476-488.
[25]Singh A, Haris M, Cai K, et al. High resolution T1ρ mapping of in vivo human knee cartilage at 7T. PLoS One, 2014, 9(5): e97486.
[26]Laurell L, Court-Payen M, Nielsen S, et al. Comparison of ultrasonography with Doppler and MRI for assessment of disease activity in juvenile idiopathic arthritis: a pilot study. Pediatr Rheumatol Online J, 2012, 10(1): 23.
(本文编辑 张春辉)
R684.3;R445
10.3969/j.issn.1005-5185.2016.06.021
北京市市委、市政府重点工作及区县政府应急项目(Z141100006014 004)。
袁新宇 E-mail: xinyu_y@sina.com
2015-11-16
2015-12-10
