扩散加权成像表观扩散系数值在不同类型肺癌鉴别中的价值
2016-08-11库雷志KULeizhi马明平MAMingping顺YUShun郑雪萍ZHENGXueping马小静MAXiaojing
库雷志KU Leizhi马明平MA Mingping 俞 顺YU Shun郑雪萍ZHENG Xueping马小静MA Xiaojing
作者单位1. 武汉亚洲心脏病医院放射科 湖北武汉4300222. 福建省立医院放射科 福建福州 350000
扩散加权成像表观扩散系数值在不同类型肺癌鉴别中的价值
库雷志1KU Leizhi马明平2MA Mingping 俞 顺2YU Shun郑雪萍2ZHENG Xueping马小静1MA Xiaojing
作者单位
1. 武汉亚洲心脏病医院放射科 湖北武汉430022
2. 福建省立医院放射科 福建福州 350000
Department of Radiology, Fujian Provincal Hospital, Fuzhou 350000, China
Address Correspondence to: MA Mingping E-mail: 15859043670@qq.com
福建省卫生系统中青年骨干人才培养项目资助计划(2013-ZQN-JC-5)。
R445.3;R734.2
2015-11-25
中国医学影像学杂志
2016年 第24卷6期:459-463
Chinese Journal of Medical Imaging 2016 Volume 24(6): 459-463
目的 分析肺癌MRI图像特点及表观扩散系数(ADC)值在不同类型肺癌鉴别中的价值。资料与方法 前瞻性选取经手术病理证实为肺癌的33例患者,均行常规MRI平扫及扩散加权成像(DWI)扫描,b 值取50、500、1000 s/mm2。分析病灶部位、数目及形态、平扫T1WI、T2WI 及DWI、ADC图信号特点,比较不同类型肺癌的ADC值。结果 33例患者中,腺癌18例,鳞癌8例,小细胞肺癌7例,非小细胞肺癌26例;中央型肺癌12例,周围型肺癌21例。肿瘤大小为1.3~6.6 cm;病灶不规则形、分叶状或斑片状12例,结节状6例,肿块状15例;边界不清26例,边界相对较清7例。肺癌实性成分在T1WI上呈等或稍低信号,在T2WI上呈等或稍高信号;腺癌在DWI 图呈等或高信号,ADC图呈不均匀稍低信号;鳞癌与小细胞癌在DWI图呈高信号,ADC图呈明显低信号;若肿瘤伴有坏死、囊变时,坏死区在DWI图上为稍低或低信号,在ADC图上呈高信。b值取1000 s/mm2时,腺癌、鳞癌、小细胞肺癌平均ADC 值比较差异有统计学意义(P<0.05),腺癌平均ADC 值高于鳞癌和小细胞肺癌(P<0.05),鳞癌平均ADC 值低于小细胞癌(P<0.05)。中央型与周围型肺癌、小细胞和非小细胞肺癌平均ADC 值差异无统计学意义(P>0.05)。结论 当b=1000 s/mm2时,DWI成像在肺腺癌、鳞癌及小细胞癌鉴别诊断中具有重要价值。
肺肿瘤;磁共振成像,弥散;扩散加权成像;表观扩散系数;病理学,外科;诊断,鉴别
Materials and
【Abstract】Purpose To analyze the characteristics of MRI images of lung cancer and to evaluate apparent diffusion coeffcient (ADC) values in differentiating different types of pulmonary carcinoma. Methods Totally 33 patients with different subtypes of pulmonary carcinoma confrmed by pathology were recruited. All patients underwent conventional MRI and diffusion-weighted imaging with different b values (50, 500, 1000 s/mm2). The sites, numbers, morphologies, and the signal intensity of the lesions were analyzed. The ADC values of different types of pulmonary carcinoma were analyzed. Results In 33 patients, there were 18 cases of adenocarcinoma, 8 cases of squamous cell carcinoma, 7 cases of small cell carcinomas; 26 cases of nonsmall cell carcinomas. Twelve cases were central type, and 21 cases were peripheral type. The size of tumors ranged 1.3-6.6 cm, with irregular shape, lobulated or patchy in 12 cases, nodular in 6 cases, and mass of 15 cases. Twenty-six cases revealed ill-defned boundary, and 7 cases of relative welldefned boundary. The solid components of tumors showed iso- or slightly hypointensity on T1WI, iso- or slightly hyperintensity on T2WI. The adenocarcinomas showed isoor hyperintnsity on DWI, while heterogeneous low signal intensity on ADC maps. The squamous cell carcinomas and small-cell carcinomas showed high signal intensity on the DWI maps, while signifcant low signal intensity on ADC maps. The necrosis and cystic degeneration showed the hypointensity on DWI and hyperintensity on ADC map. There were significant differences on mean ADC values of adenocarcinoma, squamous cell carcinoma and small cell carcinoma at b value =1000 s/mm2(P<0.05). The mean ADC value of adenocarcinoma was higher than that of squamous cell carcinoma and small cell carcinoma (P<0.05). The mean ADC value of squamous cell carcinoma was lower than that of small cell carcinoma (P<0.05). There was no significant difference of the mean ADC value among the central type, peripheral type, small cell and non small cell lung carcinomas (P>0.05). Conclusion DWI plays an important role in differential diagnosis of pulmonary adenocarcinomas, squamous cell carcinomas and small cell carcinomas at b value =1000 s/mm2.
【Key words】Lung neoplasms; Diffusion magnetic resonance imaging; Diffusion weighted imaging; Apparent diffusion coefficient; Pathology, surgical; Diagnosis,differential
肺癌是全球癌症相关死亡的首要原因之一,尽管约75% 的肺癌晚期患者接受了手术切除、放化疗及基因治疗,但其总5年生存率仅为5%。提高肺癌患者生存率的关键是早期发现、诊断和治疗[1]。肺癌组织学分型和分期是决定其治疗方案的基础,不同病理类型肺癌的治疗方案不同,疗效、预后及生存期也不同。扩散加权成像(DWI)可以通过表观扩散系数(ADC)定量检测细胞内外及其他组织间隙水分子运动,反映细胞增殖或抑制[2]。通常肿瘤组织细胞异常增殖,这些异常增殖细胞间隙较小,水分子自由运动受限,ADC值降低[3];而在肿瘤坏死部位,细胞凋亡、坏死,正常细胞结构消失、破坏,水分子运动扩散自由度加快,ADC 值增高,因此通过测量ADC 值可以反映细胞生长、增殖与凋亡的过程。本研究探讨DWI 及ADC 值在不同类型肺癌鉴别中的价值,为肺癌诊断、治疗及预后提供指导。
1 资料与方法
1.1 研究对象 前瞻性收集2014 年5 月—2015 年2 月福建省立医院经手术病理证实为肺癌的33 例患者,年龄30~86岁,平均(62.0±11.9)岁。其中男20例,年龄30~86岁,平均(63.0±12.4)岁;女13例,年龄37~71岁,平均(59.0±11.5)岁。纳入标准:①胸部CT扫描后发现有肺部结节、肿块状影;病变内毛玻璃混浊区范小于病变的50%;②胸部CT示肺内病变最长横截面直径≥ 1 cm;③患者一般情况良好,无严重心血管疾病,无肝、肾功能障碍。排除标准:①装有心脏起搏器、心脏瓣膜、动脉瘤夹或体内有金属、其他不能接近强磁场的植入物等MRI检查禁忌证者;②1次屏气时间<16 s,致图像伪影无法进行数据测量;③有对比剂过敏史、支气管哮喘史者。18例有吸烟史,临床症状:咯血或痰中带血14例,咳痰17例,发热1例,胸痛、胸闷19例,骨折破坏或骨代谢异常14例;实验检查:癌胚抗原升高3例,CA199升高4例。本研究经本院医学伦理委员会审核批准,所有患者均签署知情同意书。
1.2 仪器与方法 采用Siemens 1.5T超导型MRI扫描仪,18通道体部高分辨相控阵线圈。患者取仰卧位,头部先进。扫描范围自双肺尖至膈肌水平。扫描参数:T2WI冠状位扫描:TR 1400 ms,TE 92 ms,层厚6.0 mm,层间距1.2 mm,视野380 mm×380 mm,激励次数1,矩阵256×256,扫描时间39 s ;T1WI横断位扫描:TR 172 ms,TE 4.86 ms,层厚6 mm,层间距1.2 mm, 视野380 mm×296 mm,激励次数1,矩阵320×224,扫描时间34 s;T2WI横断位扫描:TR 2000 ms,TE 100 ms,层厚6.0 mm,层间距1.2 mm,视野380 mm×296 mm, 激励次数1,矩阵448×314,扫描时间2 min 55 s;DWI横断位扫描采用EPI序列,采用呼吸导航回波技术进行DWI序列图像扫描,b值取50、500、1000 s/mm2。DWI:TR 5800 ms,TE 57 ms,层厚6.0 mm, 层间距1.2 mm,激励次数1,视野380 mm×296 mm,矩阵166×132,扫描时间3 min 6 s。
1.3 图像后处理
1.3.1 客观评价 将DWI序列MRI图像传输至Siemens syngo MRD13工作站,由1名副主任医师和1名研究生分别独立测量,结合常规T2WI轴位图像及DWI图像,在ADC图上选取病灶最大横截面设置3个感兴趣区(ROI),置于病变的实性部位且信号较均匀处,尽量避开钙化、血管、坏死、囊变区域,ROI大小为0.3~0.5 cm2。分别测量3 个ROI内的ADC 值,取其平均值。
1.3.2 主观分析 由1名副主任医师及1名研究生采用独立双盲法分析图片,结果不一致时协商统一。分析病灶部位、数目及形态特点,病灶平扫T1WI、T2WI、DWI 及ADC 信号特点。以胸壁肌肉及胸髓信号为参考标准,选取病变最大层面图像,记录病灶在T1WI、T2WI、DWI及ADC图上的信号强度,分为4个等级:①低信号:小于或等于相应平面肌肉的信号;②稍低信号:介于肌肉与胸髓信号之间;③等信号:与胸髓的信号相等;④高信号:大于胸髓的信号。
1.4 手术与病理检查 33例患者中,24例行活检穿刺术,5例行手术,4例行纤维支气管镜检查。将所得标本在肿瘤实质的无坏死区取材,4 μm 层厚连续切片,分别行HE 染色及免疫组织化学染色。
1.5 肿瘤分级与分类标准 肺癌不同组织病理分型参照2004 年WHO肺、胸膜肿瘤组织病理学标准[4]。按组织学表现与细胞学表现分为腺癌、鳞癌、小细胞癌与非小细胞癌;根据肿瘤发生的部位分为中央型肺癌与周围型肺癌。
1.6 统计学方法 采用SPSS 18.0软件,按照肺癌组织病理类型分组,采用Komogorov-Smirnov 法进行正态分布检验,用Leneve法进行方差齐性检验,如符合正态分布且方差齐性,采用t检验比较中央型与周围型肺癌组、小细胞与非小细胞肺癌ADC 值的比较,如不符合正态分布,则采用非参数法;采用单因素方差分析比较不同肺癌病理类型组间ADC值,方差齐性采用LSD检验,方差不齐采用Dunett T3法,P<0.05 表示差异有统计学意义。
2 结果
2.1 手术与病理结果 33例患者中,腺癌18例,鳞癌8例,小细胞癌7例,非小细胞26例;中央型肺癌12例,周围型肺癌21例。
2.2 MRI表现 33例患者病灶大小为1.3~6.6 cm,平均(3.6±1.3)cm。病灶位于右肺上叶9例,中叶4例,下叶7例,左肺上叶8例,下叶5例;中央型12例,周围型21例。病灶呈不规则形、分叶状或斑片状12例,结节状6例,肿块状15例。病灶边界不清26例,边界相对较清7例;有肋骨或脊柱转移14例;邻近肿瘤的胸膜增厚2例,肿块包绕支气管或有支气管征8例;肺不张3例,有胸水2例。在33例患者中,瘤实性部分在T1WI上呈等信号或稍低信号,T2WI呈高或不均匀高信号;腺癌在DWI上呈等或高信号,ADC呈相对低或稍低信号(图1),若伴有阻塞性肺炎或肺不张,在T2WI呈高信号,在DWI呈低或稍低信号,在ADC呈高信号(图2);鳞癌与小细胞肺癌在DWI呈高信号,ADC呈低信号(图3)。肿瘤内出现坏死、囊变区在DWI呈低或稍低信号,在ADC则呈高信号。
2.3 不同类型肺癌ADC值比较
2.3.1 不同病理类型肺癌ADC值比较 当b为1000 mm2/s时,肺腺癌、鳞癌与小细胞癌ADC 值见表1。3 组ADC值比较差异有统计学意义(F=44.415,P<0.05)。腺癌ADC值高于鳞癌(t=1.083,P<0.05),腺癌的ADC值高于小细胞肺癌(t=1.126,P<0.05),鳞癌的ADC值低于小细胞癌(t=0.098,P<0.05)。
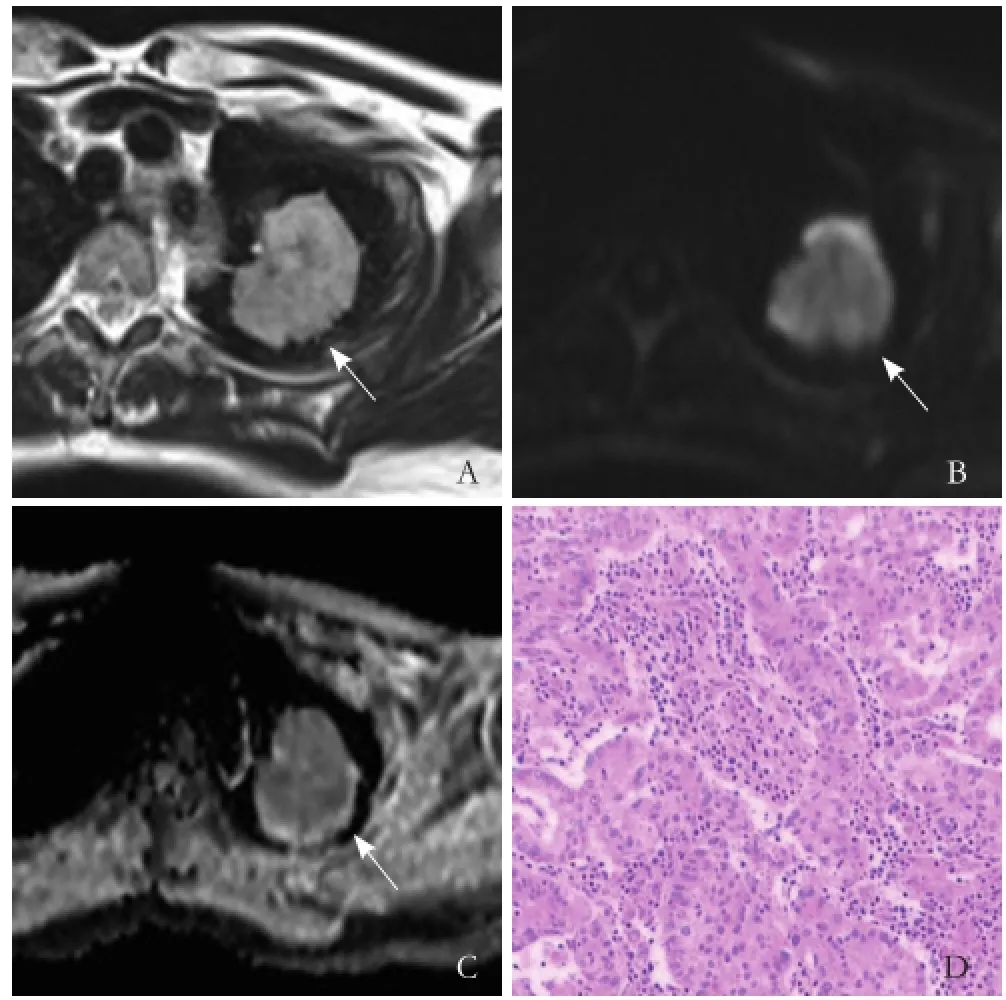
图1 女,37岁,左肺上叶腺癌。T2WI示左肺上叶尖后段类圆形肿块(箭,A);DWI 图示肿瘤呈高信号(箭,B);b=1000 s/mm2时,肿瘤ADC 图呈低信号(箭,C);ADC值为1.116×10-3/mm2/s;病理镜下见细胞呈空泡状,核仁明显,细胞核挤压到细胞的一侧,部分核大深染(HE,×40,D)
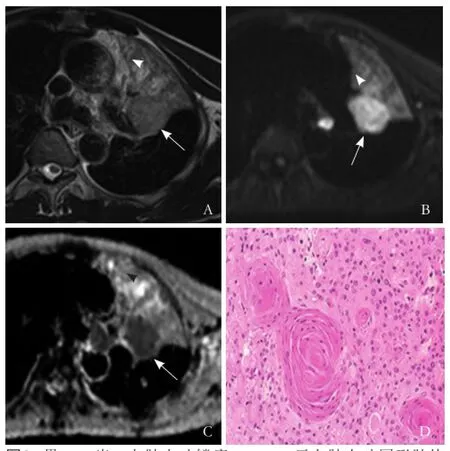
图2 男,60岁,左肺上叶鳞癌。T2WI 示左肺上叶圆形肿块(箭),伴阻塞性肺炎、肺不张(箭头,A);DWI 图示肿瘤呈明显高信号(箭,B),阻塞性肺炎、肺不张呈不均匀稍高或低信号(箭头,B);b=1000 s/mm2时相应肿瘤部分ADC图呈低信号(箭,C),阻塞性肺炎、肺不张呈不均匀高信号(箭头,C),ADC 值为0.906×10-3mm2/s ;病理镜下见细胞呈乳头状,巢状,细胞体积增大,核分裂多见,胞核较大、深染(HE,×100,D)
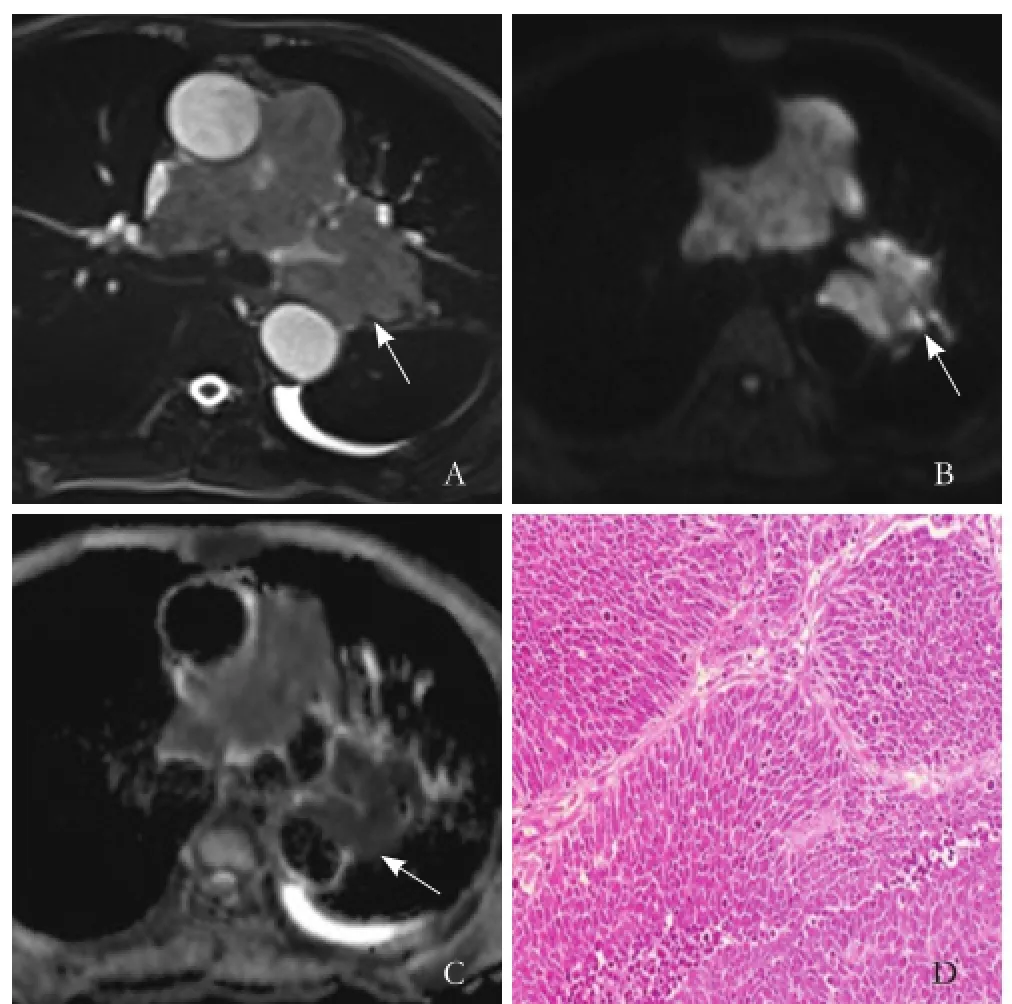
图3 男,57 岁,左肺中央型小细胞癌。T2WI示左肺上叶尖段类圆形肿块(箭,A);DWI 图上肿瘤呈明显高信号(箭,B);b=1000 s/mm2时相应肿瘤部分ADC图呈明显低信号(箭,C),ADC值为0.975×10-3mm2/s;病理镜下见细胞质稀少,细胞边界不清,核染色质细颗粒状,无核仁或不明显,细胞呈卵圆形或梭形(HE,×40,D)

表1 不同病理类型肺癌ADC值比较(×10-3mm2/s)
2.3.2 周围型与中央型肺癌ADC值比较 b值取1000 s/mm2时,中央型肺癌和周围型肺癌的平均ADC 值分别为(1.170±0.080)×10-3mm2/s、(1.130±0.082)×10-3mm2/s,两组比较差异无统计学意义(t=1.365,P>0.05)。
2.3.3 小细胞与非小细胞肺癌ADC值比较 当b值取1000 s/mm2时,非小细胞与小细胞肺癌ADC值分别为(1.045±0.186)×10-3mm2/s、(1.006±0.057)×10-3mm2/s,两组比较差异无统计学意义(t=0.925,P>0.05)。
3 讨论
3.1 DWI 成像特点及影响因素 DWI是通过检测人体内部水分子的布朗运动,定性及定量地评价生理及病理状态下组织中以水分子扩散的差异为基础的结构对比,反映在DWI图像为不同组织之间的信号衰减差异[5-7]。这种信号强度改变与组织内水分子扩散敏感系数b值关系密切,b值越大,扩散权重越大,ADC值越接近组织的真实扩散系数值,不同组织之间的对比度也越大,诊断敏感度越高,但同时磁敏感伪影和图像几何变形将会导致DWI图像的信噪比和对比噪声比降低,不利于小病灶的检测。但b 值减小,组织微灌注对ADC值影响较大,不能真实客观反映组织内本质结构。计算b值公式为:b=r2×G2×d2(s-d/3),因此,b值的变化可通过调整G、d和s来实现[8]。肿瘤组织具有增殖旺盛、细胞密度高、细胞内蛋白含量高、细胞外空间小的特性[9],与正常组织相比,肿瘤组织ADC通常相对较低。此外,DWI信号强度还与T2透过效应、呼吸心跳等生理运动相关。传统DWI通常在屏气下扫描完成,但大多数肺部疾病患者的肺功能都较差,无法长时间屏气合作,因此限制了其在肺部的应用。近年来,将分段读出平面回波成像技术与呼吸触发、相位导航及并行成像等快速成像技术联合应用,不仅允许患者在自由呼吸状态下扫描,还明显减少了磁敏感伪影,提高了空间分辨率、小病灶检出率与诊断准确度[10]。因此,DWI 在肺部的应用越来越广泛。
3.2 肺部DWI 成像最佳b值选择及意义 多数关于DWI在肺部疾病应用的研究[11-13]通常选择b =1000 s/mm2,认为采用高b值可以鉴别肺部恶性和良性结节,且DWI的敏感度和特异度近似于或高于PET/CT。刘海东等[14]对62例肺部疾病患者在自由呼吸状态下行DWI检查,当b值取500 s/mm2时测得ADC鉴别诊断效能最大。Liu等[15]对27例孤立肺结节患者行DWI检查,当b值取300、500、800 s/mm2时对良恶性病变的ADC值进行比较,发现以b=800 s/mm2时差异最显著。但DWI影响因素相对较多,因此最佳b值选择可能还需要大样本、多中心进一步研究。
3.3 ADC 值在不同类型肺癌诊断及鉴别诊断中的价值本研究结果显示,腺癌平均ADC值高于鳞癌及小细胞癌(P<0.05),鳞癌平均ADC值低于小细胞癌(P<0.05)。中央型与周围型肺癌、小细胞肺癌和非小细胞肺癌平均ADC 值无显著差异(P>0.05)。陈利华等[16]对58例肺癌患者行DWI检查,其腺癌与鳞癌ADC值分别为(1.10±0.14)×10-3mm2/s、(0.89±0.090)×10-3mm2/s,小细胞与非小细胞肺癌的ADC 值分别为(1.02±0.24)×10-3mm2/s、(1.03±0.24)×10-3mm2/s 腺癌的平均ADC值显著高于鳞癌,差异有统计学意义(P<0.001)。陈光祥等[17]采用DWI对肺内64例直径>1 cm的结节、肿块或实性病变检查发现,中央型与周围型肺癌的ADC值分别为(1.237±0.251)×10-3mm2/s、(1.254±0.196)×10-3mm2/s,差异无统计学意义(P>0.05)。本研究结果与以上研究基本一致,提示ADC 值差异主要与不同肿瘤病理类型与级别有关。肿瘤组织增殖旺盛,细胞数量增多、排列致密、胞外间隙减小,使细胞外水分子运动受限;肿瘤细胞内胞核增大、细胞器增多、胞质减少,使细胞内水分子运动减慢。而不同病理类型及分化程度肺癌之间的肿瘤细胞生长方式、细胞数目、周围结构环境均存在差异,从而造成ADC 值不同。Cheng等[18]用平均核浆比代替肺癌细胞构成,研究ADC值与肺癌细胞构成关系,发现鳞癌核浆比明显高于腺癌,且ADC值与核浆比呈负相关,进一步证明鳞癌ADC值低于腺癌与两者细胞构成有关。Koyama等[19]研究发现高分化腺癌表现为肿瘤细胞沿原有肺泡壁生长,而保留下面正常结构的替代方式生长,鳞癌表现为实体性团块状破坏正常肺泡结构非替代生长模式,肿瘤细胞大量繁殖;另一方面,腺癌组织的腺腔及细胞的胞质内含有黏液成分,其自由水分子含量较鳞癌高,因此腺癌的平均ADC 值多高于鳞癌。而小细胞肺癌通常由小圆形或卵圆形癌细胞组成,与淋巴细胞类似,分布广泛,细胞密集程度高,细胞外空间相对较小[20],因此小细胞肺癌ADC 值较腺癌略低。但贺伟等[21]研究显示小细胞肺癌的ADC值高于非小细胞肺癌(P<0.05、P<0.01), 腺癌ADC值低于类癌(P<0.05),腺癌的ADC值低于小细胞肺癌(P<0.05),其他类型肺癌ADC值未见显著差异(P>0.05)。本研究结果与之有一定差异,原因可能是并非所有肿瘤的ADC值均与细胞密度呈负相关,除肿瘤细胞构成比以外还存在其他影响ADC值的因素,如细胞外间隙间质的黏滞性、分隔空间的屏障作用、主动转运、微循环及扩散范围等,而核质比只能说明扩散的屏障性及组织细胞的拥挤程度,不能用来解释其他原因。此外,不同实验研究选择的病例数的差异,病例纳入及排除标准、厂家仪器设备及扫描方法等不同,也可能对实验结果造成一定影响。
3.4 本研究的局限性 本研究病例数相对较少,尤其是鳞癌与小细胞癌,这可能对结果造成一定影响。患者的选择存在一定偏倚,本研究未纳入直径<1 cm 的肺内病灶,原因是<1 cm的结节在测量ADC值时存在部分容积效应、图像空间分辨率较差、ROI勾画等因素,可导致ADC测量值不准,同时呼吸、心脏搏动导致的运动伪影以及气体- 病变界面导致的磁敏感伪影也能影响ADC值的测量;本研究未对患者年龄、性别分组,对不同病理类型肺癌患者ADC测量值可能存在一定影响。
总之,当b=1000 s/mm2时,DWI定量ADC值对不同肺癌肿瘤组织病理类型具有重要鉴别诊断价值,随着功能MRI的深入研究,DWI在肺部疾病诊断、治疗方案选择及肿瘤治疗效果评价等将发挥重要作用。
[1]Zhang Q, Zhang M, Liu Z, et al. Role of MR-DWI and MRPWI in the radiotherapy of implanted pulmonary VX-2 carcinoma in rabbits. Chin J Cancer Res, 2014, 26(5): 532-542.
[2]Zhang Y, Chen J, Shen J, et al. Apparent diffusion coeffcient values of necrotic and solid portion of lymph nodes: differential diagnostic value in cervical lymphadenopathy. Clin Radiol,2013, 68(3): 224-231.
[3]Naganawa S, Sato C, Kumada H, et al. Apparent diffusion coefficient in cervical cancer of the uterus: comparison with the normal uterine cervix. Eur Radiol, 2005, 15(1): 71-78.
[4]Travis WD, Brambilla E, Muller-Hermelink HK, et al. Pathologyand genetics tumour of the lung, pleura, thymus and heart. 3rd ed. Lyon: Iarc Press, 2004.
[5]Ichikawa T, Haradome H, Hachiya J, et al. Diffusion-weighted MR imaging with a single-shot echoplanar sequence: detection and characterization of focal hepatic lesions. Am J Roentgenol,1998, 170(2): 397-402.
[6]Namimoto T, Yamashita Y, Sumi S, et al. Focal liver masses: characterization with diffusion-weighted echo-planar MR imaging. Radiology, 1997, 204(3): 739-744.
[7]Yamashita Y, Tang Y, Takahashi M. Ultrafast MR imaging of the abdomen: echo planar imaging and diffusion-weighted imaging. J Magn Reson Imaging, 1998, 8(2): 367-374.
[8]Moteki T, Horikoshi H, Oya N, et al. Evaluation of hepatic lesions and hepatic parenchyma using diffusion-weighted reordered turboFLASH magnetic resonance images. J Magn Reson Imaging, 2002, 15(5): 564-572.
[9]齐丽萍, 张晓鹏, 唐磊, 等. 扩散加权成像用于中央型肺癌与肺不张鉴别的初步研究. 中国医学影像技术, 2007,23(10): 1486-1490.
[10]Holdsworth SJ, Yeom KW, Antonucci MU, et al. Diffusionweightedimaging with dual-echo echo-planar imaging for better sensitivity to acute stroke. Am J Neuroradiol, 2014,35(7): 1293-1302.
[11]Mori T, Nomori H, Ikeda K, et al. Diffusion-weighted magnetic resonance imaging for diagnosing malignant pulmonary nodules/masses: comparison with positron emission tomography. J Thorac Oncol, 2008, 3(4): 358-364.
[12]Uto T, Takehara Y, Nakamura Y, et al. Higher sensitivity and specificity for diffusion-weighted imaging of malignant lung lesions without apparent diffusion coefficient quantification. Radiology, 2009, 252(1): 247-254.
[13]Kanauchi N, Oizumi H, Honma T, et al. Role of diffusionweighted magnetic resonance imaging for predicting of tumor invasiveness for clinical stage IA non-small cell lung cancer. Eur J Cardiothorac Surg, 2009, 35(4): 706-710;discussion 710-711.
[14]刘海东, 于铁链, 刘颖, 等. 肺恶性肿瘤和实性良性病变扩散加权成像技术初探. 国际医学放射学杂志, 2010, 34(3): 240-244.
[15]Liu H, Liu Y, Yu T, et al. Usefulness of diffusion-weighted MR imaging in the evaluation of pulmonary lesions. Eur Radiol,2010, 20(4): 807-815.
[16]陈利华, 陈永峰, 张久权, 等. 表观扩散系数值在鉴别不同组织学类型肺癌中的价值. 中国医学影像技术, 2012, 28(8): 1541-1545.
[17]陈光祥, 屈春晖, 郑婷, 等. MR 扩散加权成像鉴别肺良恶性病变. 放射学实践, 2013, 28(7): 763-766.
[18]Chen L, Zhang J, Chen Y, et al. Relationship between apparent diffusion coefficient and tumour cellularity in lung cancer. PLoS One, 2014, 9(6): e99865.
[19]Koyama H, Ohno Y, Aoyama N, et al. Comparison of STIR turbo SE imaging and diffusion-weighted imaging of the lung: capability for detection and subtype classifcation of pulmonary adenocarcinomas. Eur Radiol, 2010, 20(4): 790-800.
[20]Brambilla E, Travis WD, Colby TV, et al. The New World Health Organization classifcation oflung tumours. Eur Respir J,2001, 18(6): 1059-1068.
[21]贺伟, 徐金萍, 谢汝明, 等. 肺癌MR 表观弥散系数及最佳b值的初步研究. 临床放射学杂志, 2014, 33(11): 1656-1660.
(本文编辑 冯 婕)
Apparent Diffusion Coeffcient in Differential Diagnosis of Different Types of Lung Cancer Malignant Obstruction in Metal Biliary Stents
马明平
2015-10-17
10.3969/j.issn.1005-5185.2016.06.016
