超声在类风湿关节炎中的应用
2016-08-11蔡晓菡杨舒萍陈宏浦吕国荣
蔡晓菡杨舒萍陈宏浦吕国荣
超声在类风湿关节炎中的应用
蔡晓菡1杨舒萍1陈宏浦2吕国荣3
关节炎,类风湿;滑膜炎;超声检查;超声检查,多普勒;成像,三维;超声造影;弹性成像技术;磁共振成像;诊断,鉴别;综述
1 RA的影像学检查比较
1.1 X线与CT检查 RA的传统影像学诊断方法主要是X线检查,骨质疏松、骨质破坏、关节间隙变窄、关节畸形、骨性强直等均是诊断RA的重要依据[3]。然而,X线检查对于早期的骨侵蚀和软组织病变的诊断敏感性和特异性均很低,无法直接观察滑膜、软骨和骨髓水肿情况,无法早期诊断RA,当X线检查上有特异性表现时,大多数患者已经进入疾病的中晚期,错过了治疗的最佳时期。在美国风湿病学院(ACR)联合欧洲抗风湿病联盟(EULAR)公布的新的RA分类标准[4]中,不包括X线检查和骨侵蚀,但是首次提到关节炎需经超声或MRI证实,并排除其他疾病为前提。
与X线检查相比,CT具有较高的分辨率,但仍然很难显示RA的滑膜病变和骨髓水肿,对于软组织病变的诊断也有一定的难度,而且价格昂贵、检查时间长,临床上应用很少。
1.2 MRI MRI对于软组织具有极高的分辨率,可以清晰地显示关节的滑膜、肌腱和软骨。MRI可以全面显示整个关节包括所有的关节面,已经成为确诊RA关节病变的“金标准”之一,MRI不仅可以观察滑膜和肌腱,还可以对滑膜进行定量测量,即OMERACT-RAMRIS评分系统。该评分系统对于评估RA具有很好的敏感性[5]。然而,MRI检查费用高、检查时间长,如患者关节畸形无法摆好体位将影响检查结果,而且体内有金属的患者也为检查禁忌。因此,MRI不可能成为RA的一项常规检查。von Mühlenen[6]研究表明,仅约10%的RA患者有机会进行MRI检查。
1.3 高频超声表现
1.3.1 滑膜炎和血管翳 滑膜炎是RA的基本病理改变,也是早期诊断RA的关键,其早期诊断对于RA的治疗及预后均至关重要。滑膜炎主要表现为滑膜水肿、增厚、炎症细胞浸润和血管增生,超声表现为滑膜增厚,为低回声或无回声,难以压缩、不可移动(图1)。Cyteval[7]研究表明,超声对于滑膜炎的检查较MRI具有更高的敏感性。血管翳的形成是一个重要特征,是造成关节破坏、畸形和功能障碍的重要病理基础。血管翳是一种以炎症细胞浸润和血管增生为主要特征的肉芽组织增生,可导致关节软骨变性和降解,从而引起骨质侵蚀和破坏。Dougados等[8]研究发现,滑膜内血管过度增生是滑膜增生活跃的标志。滑膜的厚度及血流信号的丰富程度可在一定程度上反映RA疾病的活动度。
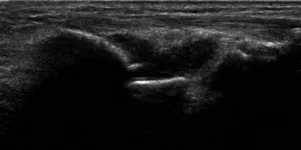
图1 女,42岁,RA。左侧腕关节滑膜增厚,滑膜厚度1.9 mm(箭)
1.3.2 关节腔积液 正常关节腔内有3~5 ml液体起润滑作用。当发生RA时,关节腔内液体增多,超声表现为液性无回声区,可移动、可压缩,无血流信号(图2)。增生的滑膜有时回声很低,应注意与关节腔积液鉴别:①加压探头时,积液可被压缩,而增生的滑膜不被压缩;②增生的滑膜有血流信号,而关节腔积液无血流信号。关节腔积液量与RA疾病炎症的活动度密切相关[9]。RA患者关节的滑膜增生与关节腔积液多为双侧对称性的。关节腔积液按照关节的部位和大小判定标准不同[10]:膝关节暗区>4 mm判定为积液,肘关节、腕关节>2 mm判定为积液。关节腔积液是超声诊断RA的主要指标之一,也是判断疾病活动度的重要指标。
【作者单位】 1.福建医科大学附属漳州市医院超声科 福建漳州363000;2.福建医科大学附属漳州市医院血液科 福建漳州 363000;3.泉州医学高等专科学校 福建泉州 362000
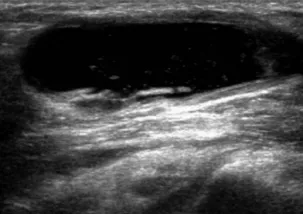
图2 女,50岁。右侧膝关节积液,积液前后径4.2 mm(箭)
1.3.3 骨侵蚀及骨破坏 RA滑膜炎症越明显,发生骨侵蚀的几率就越大。RA滑膜炎早期且重要的病理特征是血管增生,其与骨质破坏密切相关。骨侵蚀首先发生于关节软骨变薄或缺失的关节裸区,而骨破坏的典型超声表现为骨皮质不连续、中断,局部出现“火山口”样缺损或“虫蚀样”改变。大多数患者的骨质破坏直到疾病晚期才被X线检查发现。而超声检查可以发现深度1 mm、宽度1.5 mm以上的骨侵蚀[11],并且检出率明显高于X线检查,与MRI相当。
1.3.4 关节旁肌腱等软组织受累 肌腱是一种纤维组织,由于RA滑膜炎的反复刺激,肌腱、腱鞘水肿、增厚、纤维化甚至撕裂,腱鞘炎也是RA的早期表现,是由于滑膜增生所致。在超声图像上正常的肌腱长轴表现为细纤维状束带形的中等回声,有腱鞘的肌腱,周边有一薄层低回声包绕,边界清晰。RA患者肌腱显示回声减低、增厚和不均匀,腱鞘多为双侧对称性、回声减低增厚,彩色多普勒血流显像可见增多的血流信号。Hoving等[12]研究显示超声在诊断RA肌腱病变方面比MRI更加敏感。
1.4 超声新技术
【设计意图】复习点到直线距离的垂线段定义法,同时引出广义定义法,即点到直线上所有点距离的最小值,为后续目标函数的推导方法的展开埋下伏笔.
1.4.1 能量多普勒超声(PDUS) PDUS与RA疾病的活动性相关,而且比临床指标更加敏感[13],PDUS能够检测到微血管水平的低速血流信号,与彩色多普勒血流显像相比,其敏感性明显增高[14],但是PDUS仅能反映小动静脉血流的相关信息,却无法显示滑膜的微循环情况。
1.4.2 超声造影 超声造影由于增加了信噪比,故提高了血管的成像水平,更加容易显示微小低速血流,可以动态观察组织器官的血流灌注情况。目前临床上使用的第二代造影剂SonoVue是一种血池造影剂,其血流动力学效应与红细胞相似,无法自由通过血管壁,可充填到微小的血管甚至是毛细血管。常帅等[15]的研究显示,超声造影比二维超声和能量多普勒超声可以更好地区别活动性或非活动性滑膜炎。张英娟等[16]的研究结果表明,超声造影比二维超声更加客观地反映滑膜增厚情况。超声造影对于血管翳血供的评价主要包括定性评价和定量评价,定性评价可以快速、直观地判断滑膜的血供情况,但主观性太强,主要包括造影剂到达时间、增强需要时间、造影剂消退时间等;定量评价主要是通过分析应用软件,绘制时间-强度曲线来定量分析造影剂的达峰时间、峰值强度、曲线下面积等,定量分析较为客观、准确。Song等[17]研究显示,超声造影在诊断关节的血管方面比增强MRI敏感性更高。
1.4.3 三维超声和三维能量多普勒超声 三维超声可以缩短检查时间,对检查者个人经验的依赖较小。三维能量多普勒超声可以较好地评估滑膜内的血管形成和血管翳形态学结构,可以显示整个血管树和细小的血管以及不同关节疾病在不同病理条件下滑膜血管构造的改变,可用于诊断和检测RA疾病的活动性,并可进行定量分析[18]。
1.4.4 超声引导下关节腔内注射药物 该方法主要应用于大关节,如膝关节、骶髂关节,向关节腔内注射玻璃酸钠、皮质类固醇激素等药物,超声引导可以提高操作的准确性和安全性,选择准确的注药位置将大大改善临床治疗结果。
1.4.5 超声弹性成像 超声弹性成像可以获得组织内部的弹性分布的定量信息,目前的研究主要集中于乳腺、甲状腺、血管壁等部位的病变。作为一种超声成像新技术,瞬时波强技术能够评估RA患者动脉弹性功能的变化,更早期提示动脉硬化的可能[19]。
2 RA疾病活动性的评估方法
RA早期即发生不可逆的骨侵蚀[20],因此对RA的治疗提倡早期诊断、及时干预和病情检测。
2.1 DAS28评分 目前临床上常用的反映RA疾病活动程度和治疗反应的指标主要为DAS28评分,计算方法:①触痛关节数t28:检查双侧掌指关节、近端指间关节、腕关节、肘关节、肩关节及膝关节计28个关节,得出关节触痛或被动活动时的关节触痛数;②肿胀关节数sw28:检査上述28个关节是否肿胀,得出肿胀关节数;③根据公式(1)利用红细胞沉降率(ESR)计算出疾病活动度评分(DAS28)。DAS28值>5.1表示疾病活动,DAS28值为2.6~3.2时表示病情活动性低,DAS28值<2.6表示疾病缓解[21]。
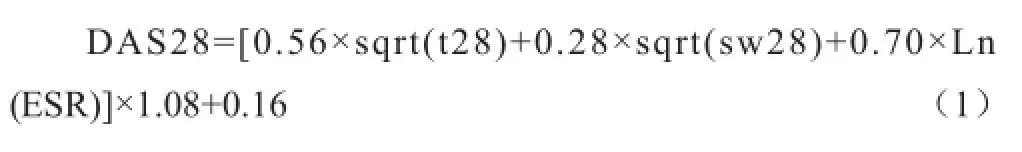
2.2 超声评分法 目前高频超声评估主要有7关节评分、12关节评分、28关节评分、44关节评分等,较常使用的是Szkudlarek等[22]的4级半定量方法,探讨滑膜厚度、滑膜血流、关节积液、骨侵蚀在RA中的诊断价值。半定量的超声评分法较临床更加能够反映RA的滑膜炎症[23]。
2.3 生化检查 ESR和C反应蛋白是反映炎症活动最重要的实验室检查指标,两者临床意义相似,在RA活动期,C反应蛋白显著升高,与ESR增高相平行,但比ESR增高出现早,消失也快[24]。
3 超声在RA鉴别诊断中的应用
3.1 痛风性关节炎 本病好发于第一跖趾关节,也可发生于腕关节、肘关节、膝关节、踝关节等。典型的超声表现为关节软骨“双边征”[25],即在正常的关节软骨表面出现一条高回声线,其原因为尿酸盐结晶沉积在关节软骨的表面。
3.2 骨性关节炎 本病中老年人多见,好发于膝关节、髋关节等负重的关节,也可累及手指关节,临床表现为关节肿胀、疼痛,基本病理改变为透明软骨的退行性病变。超声表现为关节软骨厚薄不均,回声弥漫性增强或不均匀,滑膜增生,关节腔积液[26];部分患者可以观察到关节囊的炎症。
综上所述,RA是一种慢性、进行性、致残性疾病,超声不仅为临床提供了一项诊断RA的实用的影像学方法,也为RA的研究提供了一个可靠的工具。超声检查费用低廉、无辐射、操作简便、具有可重复性,但是对操作者的经验和技术水平均有一定的依赖性。因此,尚需不断规范超声检查技术,使超声成为诊断RA的一项行之有效的影像学检查方法。
[1]李拾林, 吕国荣, 肖进益, 等. 超声检查类风湿关节炎踝关节病变的应用价值. 中国医学影像学杂志, 2010, 18(3): 223-224.
[2] Falgarone G, Boissier MC. Rheumatoid arthritis. Rev Prat, 2011,61(1): 119-126.
[3]Wakefield RJ, O'connor PJ, Conaghan PG, et al. Finger tendon disease in untreated early rheumatoid arthritis: a comparison of ultrasound and magnetic resonance imaging. Arthritis Rheum,2007, 57(7): 1158-1164.
[4]李拾林, 吕国荣, 胡麦果, 等. 超声评分法评价类风湿关节炎活动性的意义. 中国超声医学杂志, 2014, 30(3): 266-269.
[5]Kubassova O, Boesen M, Peloschek P, et al. Quantifying disease activity and damage by imaging in rheumatoid arthritis and osteoarthritis. Ann N Y Acad Sci, 2009, 1154(2): 207-238.
[6]von Mühlenen MI. Rheumatoid arthritis--new perspectives in its diagnosis. Ther Umsch, 2005, 62(5): 273-279.
[7]Cyteval C. Doppler ultrasonography and dynamic magnetic resonance imaging for assessment of synovitis in the hand and wrist of patients with rheumatoid arthritis. Semin Musculoskelet Radiol, 2009, 13(1): 66-73.
[8]Dougados M, Jousse-Joulin S, Mistretta F, et al. Evaluation of several ultrasonography scoring systems for synovitis and comparison to clinical examination: results from a prospective multicentre study of rheumatoid arthritis. Ann Rheum Dis, 2010,69(5): 828-833.
[9]Botar-Jid C, Bolboaca S, Fodor D, et al. Gray scale and power Doppler ultrasonography in evaluation of early rheumatoid arthritis. Med Ultrason, 2010, 12(4): 300-305.
[10]Walther M, Harms H, Krenn V, et al. Synovial tissue of the hip at power Doppler US: correlation between vascularity and power Doppler US signal. Radiology, 2002, 225(1): 225-231.
[11]Koski JM, Alasaarela E, Soini I, et al. Ability of ultrasound imaging to detect erosions in a bone phantom model. Ann Rheum Dis, 2010, 69(9): 1618-1622.
[12]Hoving JL, Buchbinder R, Hall S, et al. A comparison of magnetic resonance imaging, sonography, and radiography of the hand in patients with early rheumatoid arthritis. J Rheumatol, 2004, 31(4): 663-675.
[13]游岚岚. 类风湿关节炎的超声评分研究进展. 临床超声医学杂志, 2014, 16(4): 256-258.
[14]王丽萍, 刘艳芳, 李应强, 等. 类风湿性关节炎手部小关节病变的声像图表现. 中华医学超声杂志(电子版), 2010, 7(3): 450-455.
[15]常帅, 赵亮, 陈丹, 等. 超声造影判断类风湿性关节炎膝滑膜炎活动性的价值. 中国超声医学杂志, 2014, 30(5): 444-448.
[16]张英娟, 刘健, 刘晓玲, 等. 类风湿关节炎:膝关节高频超声及超声造影表现与实验室检查的相关性. 中国医学影像学技术,2012, 28(5): 986-989.
[17]Song IH, Althoff CE, Hermann KG, et al. Knee osteoarthritis. Efficacy of a new method of contrast-enhanced musculoskeletal ultrasonography in detection of synovitis in patients with knee osteoarthritis in comparison with magnetic resonance imaging. Ann Rheum Dis, 2008, 67(1): 19-25.
[18]Naredo E, Möller I, Acebes C, et al. Three-dimensional volumetric ultrasonography. Does it improve reliabililty of musculoskeletal ultrasound? Clin Exp Rheumatol, 2010, 28(1): 79-82.
[19]郑宝群, 伍卫如, 姚怀齐. 瞬时波强技术在评价类风湿关节炎患者心血管功能的应用价值. 汕头大学医学院学报, 2014,27(1): 45-46.
[20]Robinson AJ, Taylor DH, Wright GD. Infliximab therapy reduces periodontoid rheumatoid pannus formation. Rheumatology (Oxford), 2008, 47(2): 225-226.
[21]栗占国, 张奉春, 鲍春德. 类风湿关节炎. 北京: 人民卫生出版社, 2009: 278-279.
[22]Szkudlarek M, Court-Payen M, Jacobsen S, et al. Interobserver agreement in ultrasonography of the finger and toe joints in rheumatoid arthritis. Arthritis Rheum, 2003, 48(4): 955-962.
[23]Mandl P, Naredo E, Wakefield RJ, et al. A systematic literature review analysis of ultrasound joint count and scoring systems to assess synovitis in rheumatoid arthritis according to the OMERACT flter. J Rheumatol, 2011, 38(9): 2055-2062.
[24]Bíró A, Rovó Z, Papp D, et al. Studies on the interactions between C-reactive protein and complement proteins. Immunology, 2007,121(1): 40-50.
[25]Perez-Ruiz F, Dalbeth N, Urresola A, et al. Imaging of gout: fndings and utility. Arthritis Res Ther, 2009, 11(3): 232.
[26]Naredo E, Acebes C, Möller I, et al. Ultrasound validity in the measurement of knee cartilage thickness. Ann Rheum Dis, 2009,68(8): 1322-1327.
(本文编辑 张春辉)
R593.22;R445.1
10.3969/j.issn.1005-5185.2016.06.019
2014年福建省卫生计生委青年科研课题项目(2014-2-46)。
吕国荣 E-mail: Lgr_feus@sina.com
2015-10-20
2015-12-28
