NaOH-Fenton试剂预处理桑木的纤维素酶分段酶水解研究
2016-08-10王燕云雷福厚
王燕云, 吴 凯, 雷福厚, 杨 静*
(1. 西南林业大学 云南省木材胶黏剂及胶合制品重点实验室,云南 昆明 650224; 2. 西南林业大学 材料工程学院,云南 昆明 650224; 3. 广西林产化学与工程重点实验室,广西 南宁 530006)
NaOH-Fenton试剂预处理桑木的纤维素酶分段酶水解研究
王燕云1,2, 吴 凯1,2, 雷福厚3, 杨 静1,2*
(1. 西南林业大学 云南省木材胶黏剂及胶合制品重点实验室,云南 昆明 650224; 2. 西南林业大学 材料工程学院,云南 昆明 650224; 3. 广西林产化学与工程重点实验室,广西 南宁 530006)
摘要:采用分段酶水解木质纤维原料的方法,以NaOH-Fenton试剂预处理桑木为原料,通过在反应过程中及时移除葡萄糖和纤维二糖,减轻产物的抑制作用,最终达到提高酶水解得率和缩短酶解反应时间的目的。实验结果表明:纤维素酶用量为15 FPIU/g(以纤维素计,下同)时,在三段(8+8+8 h)水解过程中,经第一段水解,纤维素酶反应速率从1.25 g/(L·h)提高到2.21 g/(L·h),第二段水解后,酶反应速率为1.54 g/(L·h),比未分段水解的酶反应速率提高了73 %;当纤维素酶用量为40 FPIU/g时,三段(8+8+8 h)水解得率增至88.08 %;三段(8+8+8 h)水解充分利用了酶解残渣上的结合酶进行后续水解。对纤维素酶在预处理桑木上的吸附情况进行研究,发现桑木经NaOH-Fenton试剂预处理后,对纤维素酶的最大吸附量为8.08 mg/g,预处理增加了纤维素酶与桑木间的吸附位点。
关键词:纤维素酶;酶水解;酶反应速率;纤维素吸附
云南是我国第二大桑蚕产业基地,桑树栽培历史悠久,品种十分丰富[1]。为了提高桑木的叶产量,通常每年对桑木进行修剪,大量修剪的桑枝常作为薪柴烧掉,未被充分利用,而快速增长的、含丰富纤维素的桑木是一种有前景的制备燃料乙醇的木质纤维原料。木质纤维原料制备燃料乙醇主要经过原料预处理、纤维素酶制备和水解、糖液(戊糖、己糖)乙醇发酵和酒精蒸馏、脱水等技术。木质纤维原料在酶水解前需要经过预处理,预处理方法主要有物理法、化学法、生物法和联合法。褐腐菌降解木质纤维素是常用的生物预处理方法,但存在天然微生物菌株的活力限制,且处理周期长,导致生产效率较低,不适宜大规模工业化。本研究所采用的NaOH-Fenton试剂预处理方法是借鉴褐腐菌降解木材的研究思路,利用Fenton反应产生的外源羟基自由基(OH·),模拟褐腐菌体外解聚纤维素的过程[2],有望解决现有预处理方法存在的高能耗、高污染等问题。纤维素酶水解是利用纤维素酶或半纤维素酶降解纤维素或半纤维素为六碳糖或五碳糖的过程。在木质纤维原料酶水解过程中,产物抑制是限制酶解速率的一个重要因素[3]。酶水解液中纤维二糖和葡萄糖的存在,抑制纤维素酶的活性,并且使得酶反应速率降低和纤维素完全水解的时间延长,增加纤维素酶用量可以提高酶水解反应的速率且缩短纤维素完全水解的时间,但增加了水解反应的成本。国内外对纤维素酶水解的重点均放在对酶水解性能的提高上[4],而忽视了长的水解时间将降低纤维素酶各组分的协同水解活性及制备燃料乙醇的劳动生产率。因此,本研究针对水解液中葡萄糖、纤维二糖对酶水解反应的抑制作用,研究了终产物对纤维素酶分段水解NaOH-Fenton试剂预处理桑木的平均酶反应速率和水解得率的影响,以期为建立氢氧化钠-芬顿试剂预处理及分段酶水解集成技术提供参考。
1材料与方法
1.1原料与试剂
桑木采自云南陆良县,经粉碎过筛后,得到粒径为0.30~0.45 mm的桑木粉,备用。里氏木霉纤维素酶,丹麦诺维信(Novozyme)公司生产,Sigma公司提供,其滤纸酶活为125 FPIU/mL,β-葡糖苷酶酶活为27 IU/mL。过氧化氢(H2O2),质量分数≥30 %,分析纯,天津市风船化学试剂科技有限公司。七水合硫酸亚铁(FeSO4·7H2O),淡蓝绿色结晶,分析纯,国药集团化学试剂有限公司。Avicel PH-101微晶纤维素,Fluka公司提供。
1.2NaOH-Fenton试剂预处理桑木
将桑木在20 g/L的NaOH 溶液、底物质量浓度100 g/L和65 ℃下处理2 h,待反应结束后,用蒸馏水洗涤固体残渣至中性,备用。取绝干质量1 g的NaOH预处理后的桑木,加入质量分数30 %H2O24 mL、 16 mmol/L Fe2+溶液,使溶液中桑木的质量浓度为100 g/L,并于pH值3.0和150 r/min的条件下反应12 h。反应结束后,用蒸馏水洗涤固体渣,得预处理料,作为纤维素酶水解反应的底物。
1.3预处理桑木的酶水解
1.3.1纤维素酶一段水解取绝干质量为10 g的经氢氧化钠-芬顿预处理后的桑木(预处理料)置于250 mL三角瓶中,加入一定量的水、柠檬酸缓冲液和纤维素酶液,使底物质量浓度为100 g/L,酶用量为15 FPIU/g(以纤维素计,下同)。充分搅拌均匀后,置于50±1 ℃、150 r/min的摇床中反应,分别于2、 4、 8、 12、 24、 48、 60、 72 h取样,于3 000 r/min下离心10 min,取清液适当稀释后用高效液相色谱(HPLC)测定反应液中葡萄糖和纤维二糖的浓度变化,并计算酶解得率[5-6]。
1.3.2纤维素酶分段水解取绝干质量为10 g的预处理料于250 mL三角瓶中,加入一定量的水、柠檬酸缓冲液和纤维素酶液,使底物质量浓度100 g/L,酶用量为15 FPIU/g。充分搅拌均匀后,置于50 ℃、150 r/min摇床中反应一定时间后,采用固液分离将反应产物移走;洗涤酶解残渣,并补加一定量的酶液(用超滤的方法回收上清液中的纤维素酶,测定酶活力,根据酶活力决定补充的酶量)、缓冲液和水继续下一段的反应。根据酶反应速率把24 h等分,水解方案分别为(12+12 h)、(8+8+8 h)和(6+6+6+6 h)。
1.3.3纤维素酶的Langmuir等温吸附曲线和动力学方程为确定纤维素酶在不同底物上的等温吸附曲线,以0.1 g样品(微晶纤维素Avicel、NaOH-Fenton试剂预处理的Avicel、桑木和NaOH-Fenton试剂预处理的桑木)为底物,分别加入不同质量浓度的纤维素酶溶液(0.01~1.0 g/L),一定量的水和柠檬酸缓冲液,充分搅拌均匀后,置于4 ℃、150 r/min的摇床中反应3 h,达到平衡后,进行固液分离。用Bradford方法测定上清液中蛋白质浓度,并作为游离酶浓度;底物上的结合酶浓度为初始纤维素酶蛋白浓度与上清液中游离酶蛋白浓度之差[7]。
1.4分析方法
1.4.1水分的测定水分的测定采用红外线水分计FD-720测定。
1.4.2纤维素、半纤维素和木质素的测定样品的纤维素、半纤维素和木质素的组成按美国可再生能源实验室公布的方法测定[8]。
1.4.3蛋白质的测定蛋白质浓度采用Bradford法测定,以牛血清蛋白作为标准蛋白[7]。
1.4.4酶水解液中糖组分的测定采用高效液相色谱(HPLC,Agilent technology 1100 series,Palo Alto,CA)法测定酶水解液中的糖组分。酶水解后的上清液经0.45 μm 滤膜过滤后,用Bio-Rad Aminex HPX-87H(300 mm×7.8 mm)色谱柱,以0.005 mol/L 的硫酸作为流动相,流速为0.6 mL/min,在示差折光检测器(RI)上进行检测。纤维素水解得率计算如式(1)所示:

(1)
式中:Y—纤维素水解得率,%;C1、C2、C3、C4—分别表示第一、二、三、四段水解液及洗液中还原糖质量浓度,g/L;V1、V2、V3、V4—分别表示第一、二、三、四段水解液及洗液的体积,L;m—原料质量,g;w—原料中纤维素的质量分数,%; 1.1 — 纤维素和葡萄糖之间的转换系数。
1.4.5纤维素酶的Langmuir等温吸附曲线用Langmuir等温吸附方程拟合不同底物对纤维素酶的吸附性能[9-10],方程如下所示,Γmax和K值可由Langmuir线性方程拟合得出式(2),并由式(3)计算得到分配系数(R)。
Γ=KCΓmax/(1+KC)
(2)
R=Γmax×K
(3)
式中:C—平衡时,上清液中的自由酶质量浓度,g/L;Γ—平衡时,底物上结合酶的吸附量,mg/g;Γmax—底物上纤维素酶的最大吸附量,mg/g;K—Langmuir常数,反映纤维素酶亲和力的大小,L/g;R—分配系数,反映纤维素与底物的相对亲和力,L/g。
2结果与分析
2.1桑木预处理
为了解NaOH-Fenton预处理方法对桑木化学组成的影响,分别测定了桑木预处理前后的化学组成,预处理前的原料中含纤维素37.54 %、半纤维素21.33 %和木质素27.79 %, NaOH-Fenton预处理后样品中含纤维素53.99 %、半纤维素7.91 %和木质素30.12 %。与桑木原料相比,经NaOH-Fenton预处理,半纤维素质量分数明显降低,从21.33 %降低至7.91 %,纤维素和木质素质量分数相对增加,主要是由于经过NaOH-Fenton预处理后,破坏了桑木原本的天然高分子结构,使得部分半纤维素糖溶出,导致纤维素和木质素在固体残渣中的含量相对增加。同时,NaOH-Fenton预处理对纤维素起到润胀作用,有利于后续酶水解过程中纤维素与纤维素酶的结合。

图 1 纤维素酶一段水解预处理桑木的得率 和平均反应速率Fig. 1 One-stage enzymatic hydrolysis yield and average reaction rate of pretreated mulberry wood
2.2预处理桑木的纤维素酶水解
2.2.1纤维素酶一段水解桑木按1.3.1节操作,纤维素酶一段水解NaOH-Fenton试剂预处理的桑木,反应过程中平均酶反应速率和酶水解得率的变化如图1所示。由图1可知:经NaOH-Fenton试剂预处理桑木纤维素酶一段水解,在水解初期,水解速度很快,6 h时,纤维素酶水解得率为18.99 %;而在6~24 h内,水解速度逐渐减慢,24 h时,纤维素酶水解得率为39.84 %;24~48 h后速度更为缓慢,水解48 h,纤维素酶水解得率为48.73 %,延长水解时间到72 h,纤维素酶水解得率的增加不明显,水解得率为55.54 %。从图中可以看出,平均酶反应速率随反应时间的延长衰减很大,在反应的初始2 h,平均酶反应速率最高,为3.73 g/(L·h);反应8 h,平均酶反应速率大幅降低,为1.34 g/(L·h),仅为2 h时的35.92 %;当反应到24 h时,平均反应速率为0.55 g/(L·h),仅为2 h时的14.75 %;延长水解时间到72 h,酶平均反应速率降为0.25 g/(L·h)。
造成这种现象的可能原因是纤维素酶是一种受反馈抑制的水解酶类,根据纤维素酶水解协同作用机理,终产物葡萄糖反馈抑制β-葡萄糖苷酶,β-葡萄糖苷酶受抑制后导致体系中纤维二糖浓度提高,纤维二糖的累积反馈抑制外切和内切葡聚糖酶,从而导致酶水解效率的降低;其次,纤维素酶水解速度与纤维素的超分子结构有关,水解初期,主要是纤维素无定形区的水解,随着无定形区纤维素被水解,底物的结晶度逐渐增大,主要是结晶纤维素表面的水解,故水解速度减慢,到水解后期,剩下的高结晶纤维素更难水解,故水解速度缓慢。有研究[11]表明:可通过及时除去生成的葡萄糖来解除产物抑制作用,如采用真空抽滤和超滤间歇除去葡萄糖,同时回收了纤维素酶。酶水解过程中简单的固液分离就能使终产物浓度下降,从而可提高后续反应的酶平均反应速率。
2.2.2纤维素酶水解分段方式的选择实验选择的不同分段方案对纤维素酶水解得率的影响结果如
表 1纤维素酶分段水解NaOH-Fenton试剂预处理桑木的水解得率
Table 1Multi-stage hydrolysis yield of NaOH-Fenton pretreated mulberry wood

水解方案scheme酶水解得率enzymatichydrolysisyield/%第一段thefirststage第二段thesecondstage第三段thethirdstage第四段thefourthstage合计total24h39.2739.2712+12h24.0320.1744.208+8+8h19.2620.2015.9455.406+6+6+6h18.7217.6511.799.2457.40
表1所示。酶水解反应后,纤维素酶蛋白吸附于底物上,称之为结合酶。研究表明[12],分段酶水解充分利用了酶解残渣上的结合酶,简单离心分离解除产物抑制后,大量活性的纤维素酶蛋白吸附在底物上,酶解残渣上的结合酶的协同水解活性得到改善;短时间的反应使得温度、剪切力等因素对结合酶活性的影响不大,底物上的结合酶仍然具备高的协同降解天然纤维素的反应性。
由表1可知,NaOH-Fenton试剂预处理后的桑木经分段酶水解后,酶水解得率均高于一段水解。两段(12+12 h)、 三段(8+8+8 h)和四段(6+6+6+6 h)的水解得率分别为44.20 %、 55.40 %和57.40 %;同一段水解(24 h)的水解得率(39.27 %)相比,两段、三段和四段的水解得率分别提高了12.55 %、 41.07 %和46.17 %。这是因为分段水解技术通过简单的离心分离,解除了水解产物——纤维二糖和葡萄糖对反应的抑制作用。从表中可以看出,在两段、三段和四段的分段水解过程中,第二段的水解得率分别为20.17 %、 20.20 %和17.65 %,8 h的水解得率最大,虽然12 h水解得率与8 h相当,但第一段酶解残渣中的残糖比8 h多,并且水解时间长也影响了纤维素酶的活性,而6 h的水解时间较短,酶解得率不高;在三段和四段的分段水解过程中,第三段的水解得率分别为15.94 %和11.79 %,8 h的水解得率大于6 h,6 h的水解时间不够。第四段的水解得率为9.24 %,低的水解得率与底物结构和酶活力以及水解时间有关。理论上把酶水解过程进行无限分段后,纤维素将会被完全水解,如三段(8+8+8 h)比二段(12+12 h)、四段(6+6+6+6 h)比三段(8+8+8 h)能够得到更多的糖。但是分段越多,水解工艺就越复杂,操作费用也会相应增加,因此,本实验选择了三段酶水解技术。
2.2.3酶解条件对桑木三段酶水解的影响
2.2.3.1产物抑制的解除对三段水解反应速率的影响在纤维素酶水解过程中,各种酶组分的活力受其产物的反馈抑制调节。纤维素酶三段(8+8+8 h)水解可以达到一段72 h水解得率,并且反应时间比一段水解缩短了48 h。纤维素酶三段(8+8+8 h)水解过程中水解得率和酶平均反应速率的变化如图2所示。由图2可知,在三段水解过程中,随着反应过程中产物的去除,酶反应速率呈迅速增加趋势。在第一段除去终产物后,纤维素酶反应速率从1.25 g/(L·h)(8 h)提高到2.21 g/(L·h)(10 h),比一段水解的酶反应速率1.43 g/(L·h)(12 h)提高了54.55 %;在第二段除去终产物后,18 h纤维素酶反应速率为1.54 g/(L·h),比一段水解18 h的酶反应速率0.89 g/(L·h)提高了73 %。以上数据表明,纤维素酶分段水解,产物抑制的解除提高了酶水解反应的速率,从而改善了纤维素酶各组分协同降解纤维素的活性,导致了酶水解得率的增加。本研究选择三段水解,在水解8 h和16 h时及时地移走反应产物——纤维二糖和葡萄糖,有效地解除了产物抑制作用,使酶水解得率显著提高。

图 2 纤维素酶三段水解预处理桑木的得率 和平均酶反应速率Fig. 2 Three-stage enzymatic hydrolysis yield and average reaction rate on pretreated mulberry wood
2.2.3.2纤维素酶用量的影响在底物质量浓度100 g/L时,纤维素酶用量分别为15、 20、 25、 30、 35和40 FPIU/g,以纤维素酶一段水解NaOH-Fenton预处理桑木作为对照,酶用量对桑木一段和三段水解得率的影响如图3所示。
由图3 可知,无论是一段水解还是三段水解,纤维素酶水解得率均随着酶用量的增加而提高,在底物浓度不变的条件下,酶用量的增加意味着酶与底物接触的机会增加,酶-底物复合物形成的增加,从而导致更多的纤维素酶吸附到底物上,增加了酶平均反应速率。当酶用量从15 FPIU/g提高到40 FPIU/g时,在一段酶水解中,72 h纤维素酶水解得率从55.54 %提高到81.52 %;在三段酶水解中, 24 h纤维素酶水解得率从55.40 %提高到88.08 %。由图3(a)可以看出,相对于20~30 FPIU/g范围,酶用量在30~40 FPIU/g之间,对纤维素酶一段水解得率的影响变小,说明酶用量只是在一定范围内影响纤维素酶水解得率,除了酶用量外,底物中纤维素的聚合度、结晶度和木质素等对纤维素酶水解得率也有影响。同时由图3(b)还可以看出,在三段酶水解过程中,在第一个8 h,酶用量对纤维素酶水解得率的影响不大;而在第二段(8~16 h)和第三段(16~24 h)过程中,当酶用量在30~40 FPIU/g时,酶水解得率相对第一段增加更加明显。酶用量增加到一定程度时,水解速率增加缓慢,主要是由于纤维表面最初吸附的酶形成单分子层,当结合位点全部被纤维素酶分子饱和后,即使再增加过量的纤维素酶也起不到提高水解得率的作用[13]。因此,在木质纤维原料酶水解过程中,增加纤维素酶的用量在一定程度上对水解有利,可以提高水解得率,但当纤维素酶量超过一定量后,对水解的影响不大,而且过高的纤维素酶用量将直接导致水解成本的增加。

图 3 纤维素酶用量对预处理桑木水解得率的影响Fig. 3 Effect of enzymatic dosage on hydrolysis yield of pretreated mulberry wood
2.3纤维素酶在预处理桑木上的吸附研究
为了进一步分析水解底物上结合酶对分段酶水解的贡献,建立和分析了Langmuir吸附动力学方程和吸附等温曲线,以微晶纤维素Avicel做对比,比较了纤维素酶在NaOH-Fenton试剂预处理前后的桑木上的吸附情况,以在Avicel上的吸附作为对照样,吸附等温曲线见图4。大量研究表明,纤维素酶对纤维素的吸附符合Langmuir等温吸附方程。结合图4中的平衡吸附量计算得到,纤维素酶在桑木、NaOH-Fenton试剂预处理的桑木、Avicel和NaOH-Fenton试剂预处理Avicel上的最大吸附量Γmax分别为0、 8.08、 20.37和48.48 mg/g,分配系数R值分别为0、 0.03、 0.219和0.101 L/g。由数据可以看出桑木经NaOH-Fenton试剂预处理后,纤维素酶在底物上的最大吸附量得到了增加。这是由于经NaOH-Fenton试试剂预处理后的桑木,去除了半纤维素,并且改变了纤维素的超分子结构,增加了纤维素与纤维素酶的结合位点。同样地,以Avicel作为底物,经NaOH-Fenton预处理后的吸附量比原料增加了28.11 mg/g,这说明NaOH-Fenton试剂预处理能够解聚纤维素,使纤维素结构疏松,从而提供更多的结合位点,最终达到提高桑木酶水解得率的目的。
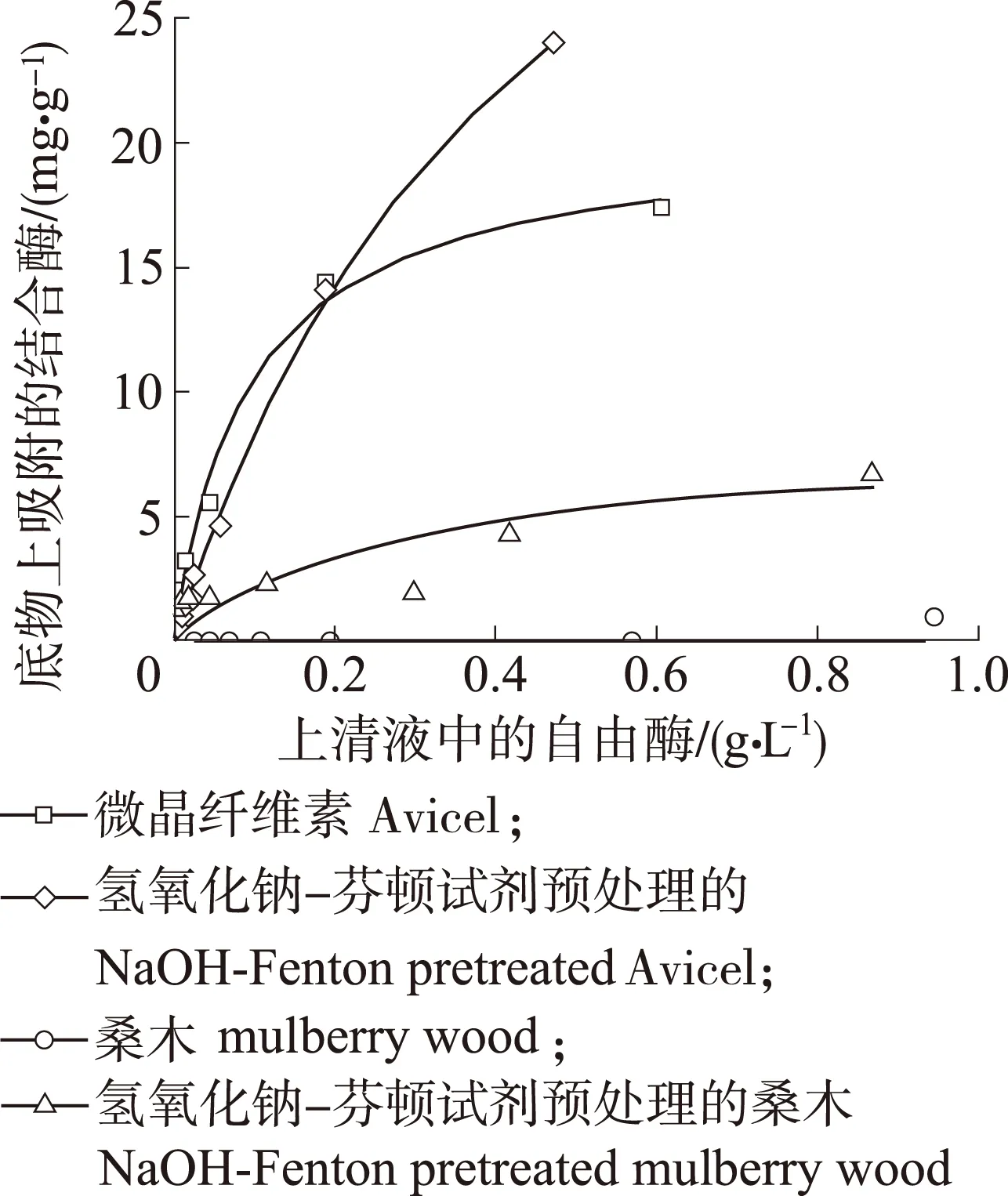
图 4 不同底物对纤维素酶的吸附Fig. 4 Cellulase adsorption on different subtrates
Langmuir常数K表示纤维素酶与底物之间的相对亲和力,纤维素酶与桑木、NaOH-Fenton试剂预处理的桑木之间的常数K分别为0和3.73 L/g。酶与底物的吸附作用主要受静电作用和疏水作用的影响,桑木由于复杂的木质纤维结构使其无法轻易和纤维素酶蛋白结合,故没经预处理的桑木难以吸附纤维素酶;经NaOH-Fenton试剂预处理后,破坏桑木中纤维素、半纤维素和木质素间的致密结构,暴露出纤维素酶的结合位点,其中包括纤维素酶与纤维素和木质素之间的吸附,因而亲和力增加。
3结 论
3.1采用分段酶水解经NaOH-Fenton试剂预处理的桑木,通过移除产物葡萄糖与纤维二糖来减轻抑制作用,提高桑木的酶水解得率及缩短反应时间。结果显示,三段水解(8+8+8 h)过程中,随着反应过程中产物的去除,酶反应速率呈迅速增加趋势。在第一段除去终产物后,纤维素酶反应速率从8 h时的1.25 g/(L·h)提高到10 h时的2.21 g/(L·h);在第二段除去终产物后,18 h纤维素酶反应速率为1.54 g/(L·h),比一段水解18 h的酶反应速率0.89 g/(L·h)提高了73 %。
3.2纤维素酶三段水解经NaOH-Fenton试剂预处理的桑木,水解过程中,纤维素酶水解得率随着酶用量的增加而提高,当酶用量为40 FPIU/g(以纤维素计)时,24 h纤维素酶水解得率达到88.08 %,三段水解充分利用了酶解残渣上的结合酶进行后续水解。
3.3桑木经NaOH-Fenton试剂预处理后,对纤维素酶的最大吸附量(Γmax)由未处理前的0增至8.08 mg/g,由此可见,预处理增加了纤维素酶与桑木间的吸附位点。
参考文献:
[1]储一宁,余茂德. 云南省桑属植物种质资源分类及生态分布研究[J]. 蚕业科学,2002,28(1):1-5.
[2]王燕云,杨静. 稀碱-芬顿试剂预处理对云南苦竹酶水解得率的影响[J]. 生物质化学工程,2015,49(5):17-22.
[3]TANKA M G,HERPOEL-GIMBERT I,MONOD F,et al. Enzymatic saccharification of wheat straw for bioethanol production by a combined cellulase xylanase and feruloyl esterase treatment[J]. Enzyme and Microbial Technology,2006,39(4):897-902.
[4]URSULA M,ESTEGHLALIAN A R,SADDLER J N,et al. Enhancing the enzymatic hydrolysis of cellulosic materials using simultaneous ball milling[J]. Applied Biochemistry and Biotechnology,2002,98(1):815-832.
[5]BALLESTEROS I,OLIVA J M,NEGRO M J,et al. Enzymic hydrolysis of steam exploded herbaceous agricultural waste (Brassicacarinata) at different particule sizes[J]. Process Biochemistry,2002,38(2):187-192.
[6]CHEN Ming,ZHAO Jing,XIA Li-ming. Enzymatic hydrolysis of maize straw polysaccharides for the production of reducing sugars[J]. Carbohydrate Polymers,2008,71(3):411-415.
[7]TU M B,PAN X J,SADDLER J N. Adsorption of cellulase on cellulolytic enzyme lignin from lodgepole pine[J]. Journal of Agricultural and Food Chemistry,2009,57(17):7771-7778.
[8]SLUITER A,HAMES B,RUIZ R,et al. Determination of structural carbohydrates and lignin in biomass,NREL/TP-510-42618[R]. Golden:U.S. Department of Energy Office of Energy and Renewable Energy,2008.
[9]GERBER P J,JOYCE T W,HEITMANN J A,et al.Adsorption of aTrichodermareeseiendoglucanase and cellobiohydrolase onto bleached kraft fibres[J]. Cellulose,1997,4(4):255-268.
[10]LAI Chen-huan,TU Mao-bing,LI Mi,et al. Remarkable solvent and extractable lignin effects on enzymatic digestibility of organosolv pretreated hardwood[J]. Bioresourse Technology,2014,156:92-99.
[11]KNUTSEN J S,DAVIS R H. Cellulase retention and sugar removal by membrane ultrafiltration during lignocellulosic biomass hydrolysis[J]. Applied Biochemistry and Biotechnology,2004,114(1):585-599.
[12]YANG Jing,ZHANG Xiao-ping,YONG Qiang,et al. Three-stage hydrolysis to enhance enzymatic saccharication of steam-exploded corn stover[J]. Bioresourse Technology,2010,101(13):4930-4935.
[13]黄爱玲,周美华. 玉米秸秆酶水解影响因素的研究[J]. 中国资源综合利用,2004,8:25-27.
doi:10.3969/j.issn.1673-5854.2016.04.006
收稿日期:2016-01-06
基金项目:云南省应用基础研究计划项目(2011FZ137);国家自然科学基金资助项目(31260162);广西林产化学与工程重点实验室开放课题(GXFC13-06)
作者简介:王燕云(1991— ),女,江苏苏州人,硕士生,研究方向为生物质能源;E-mail:1394938725@qq.com *通讯作者:杨 静(1976— ),女,博士,副教授,主要从事木质纤维素的生物降解与转化的研究;E-mail:kmjingyang@163.com。
中图分类号:TQ35
文献标识码:A
文章编号:1673-5854(2016)04-0031-06
Process Resrarch of Multi-stage Enzymatic Hydrolysis of NaOH-Fenton Pretreated Mulberry Wood
WANG Yan-yun1,2, WU Kai1,2, LEI Fu-hou3, YANG Jing1,2
(1. Yunnan Provincial Key Laboratory of Wood Adhesives and Glued Products,Southwest Forestry University, Kunming 650224,China; 2. College of Materials Science and Engineering,Southwest Forestry University, Kunming 650224, China ;3. Guangxi Key Laboratory of Chemistry and Engineering of Forest Products, Nanning 530006, China)
Abstruct:During the multi-stage enzymatic hydrolysis of lignocellulosic materials,the product inhibitions were reduced by the removal of end products at each stage to enhance the hydrolysis efficiency and shorten the hydrolysis time with NaOH-Fenton pretreated mulberry as raw material. During the three-stage (8+8+8 h) hydrolysis,as the enzymatic dosage was 15 FPIU/g(calculated by the mass of cellulose,similarly here in after),enzymatic average reaction rate increased from 1.25 to 2.21 g/(L·h) at the first stage,and after the second stage,it reached 1.54 g/(L·h) and increased rapidly by 73 % comparing with that of unsegmented hydrolysis.When enzymatic dosage was 40 FPIU/g ,the three-stage (8+8+8 h) hydrolysis could reach 88.08 %.Multi-stage hydrolysis made full use of the absorbed cellulase on substrate.The classical Langmuir adsorption isotherm was used tot the cellulase enzyme adsorption on substrates.The adsorption capacity of cellulase on NaOH-Fenton pretreated mulberry was studied with the maximum adsorption capacity of 8.08 mg/g substrate.The adsorbed sites were enhanced in the pretreatment process.
Key words:cellulase;enzymatic hydrolysis;enzymatic reaction rate;cellulose adsorption
·研究报告——生物质化学品·
