酶法提取夏秋季次品绿茶茶多酚工艺优化
2016-06-14黄德娜李锋曾承露张元彪刘洁
黄德娜+李锋+曾承露+张元彪+刘洁
摘要:以夏秋季产都匀毛尖为原料,利用响应面法对复合酶(纤维素酶和果胶酶)辅助提取毛尖茶中茶多酚的工艺进行优化。首先采用单因素试验分析pH值、料液比、提取温度、提取时间、酶用量5个因素对茶多酚提取率的影响,筛选出影响茶多酚提取率显著的因素,结合响应面法优化提取工艺参数,并对各个因素的显著性和交互性进行分析。结果显示毛尖茶中茶多酚的提取最佳工艺条件为:在 60 ℃的水浴条件下,pH值为5.5,酶解时间为70 min时,茶多酚的提取率可达22.39%。
关键词:都匀毛尖;绿茶;纤维素酶;果胶酶;茶多酚;响应面法
中图分类号: R284.2
文献标志码: A
文章编号:1002-1302(2016)04-0347-04
黔南地区茶叶资源丰富,都匀、贵定、瓮安等都是产茶大县,茶叶是该地区主导产业之一,但忽视夏秋茶生产的现象尤为突出。按照茶树1年萌发4轮新梢的生长规律,夏秋茶产量要占全年总产量的60%以上,若能很好利用夏秋茶资源,对于提高茶叶生产整体效益,有效增加茶农收入,推动黔南州茶叶产业健康发展,将发挥重要作用。茶叶中主要活性成分有茶多酚、茶多糖、咖啡碱、茶氨酸等。茶多酚为茶叶中多酚类的总称,其具有抗氧化、抗菌、抗癌等生理功能,对一些心血管、肿瘤等疾病有一定的预防作用[1-2],被广泛应用于药品、食品及保健等行业[3-4]。据报道,当前国内外对茶多酚的需求为2 000 t/年左右[5],其市场价值达到十几亿元,极具开发价值。目前对黔南地区夏秋低档绿茶的相关研究较少,若能从中提取茶多酚并进行相关研究,对黔南夏秋茶叶的综合利用具有极大意义。
目前,植物活性成分的提取方法种类较多(有机溶剂萃取法、微波法、超声波法等),但各有优缺点[6-8]。本研究采用酶技术提取茶多酚,酶具有专一性和高效性,只破坏细胞壁,从而有利于细胞壁内的有效成分溶出。此法提取条件温和、简单,克服活性成分结构被破坏的缺点,是一种安全、有效、无污染的提取方法[9]。本试验拟采用复合酶法提取茶叶中茶多酚,以茶多酚提取率为评价目标,从酶用量、时间、温度、pH值等方面考察复合酶法提取茶多酚的效果,并优化提取工艺条件,以期为次品茶叶或茶老叶的综合利用提供科学依据和技术参考。
1 材料与方法
1.1 材料与试剂
都匀毛尖茶(夏秋茶)购于贵州都匀,烘干粉碎后,过40目筛,装袋,4 ℃保存备用。纤维素酶、果胶酶购自国药集团化学试剂有限公司;95%乙醇、硫酸亚铁、酒石酸钾钠、十二水磷酸氢二钠、磷酸二氢钾等试剂均为分析纯,购自国药集团化学试剂公司;复合酶溶液为等体积1 mg/mL纤维素酶溶液和1 mg/mL 果胶酶溶液混合而成。
1.2 仪器
TU-1901 型双光束紫外-可见分光光度计(北京普析通用仪器有限责任公司);HH-S2 型数显恒温水浴锅(郑州英峪予华仪器有限公司);BS124S电子分析天平(赛多利斯)PH值S-2C数字式酸度计(上海理达仪器);优普超纯水器(成都超纯水有限公司);中草药高速粉碎机(北京科伟永兴有限公司)
1.3 方法
1.3.1 茶多酚提取工艺流程 茶叶→干燥→粉碎→称质量→酶法浸取→过滤→离心→上清液→定容检测→分析茶多酚含量。
1.3.2 单因素试验 称取绿茶样品粉末1.00 g,分别就不同温度(35、40、45、50、55、65 ℃),不同浸取时间(15、30、45、60、75、90 min),不同酶用量(50、100、150、300 μL),不同pH值(5.0、5.5、6.0、6.5、7.0)和不同料液比(g ∶mL,1 ∶40、1 ∶60、1 ∶80、1 ∶100、1 ∶120、1 ∶140)进行单因素试验,考察上述各因素对茶多酚提取率的影响,从中选取对提取率影响显著的因素进行后续优化试验。
1.3.3 响应面分析试验设计 在单因素试验基础上,选取pH值、提取时间、提取温度3个因素为试验因素,以茶多酚提取率为响应指标,采用Box-Behnken响应面法,利用Design-Expert V8.0.6软件研究各因素间的交互作用及其对茶多酚提取率的影响。试验设计见表1。
1.3.4 茶多酚提取率的测定 参考国家标准GB/T 8313—2002《茶 茶多酚测定》,采用酒石酸亚铁比色法测定,具体如下:准确吸取茶多酚提取试液1 mL于25 mL容量瓶中,加入4 mL水和5 mL酒石酸亚铁,充分混匀,用pH值为7.5的磷酸盐缓冲液定容,放置约5 min,以试剂空白做参比,于波长540 nm测吸光度D;整个显色过程在30 min内完成。茶多酚提取率以茶叶质量分数表示,按下式计算:
2 结果与分析
2.1 单因素试验
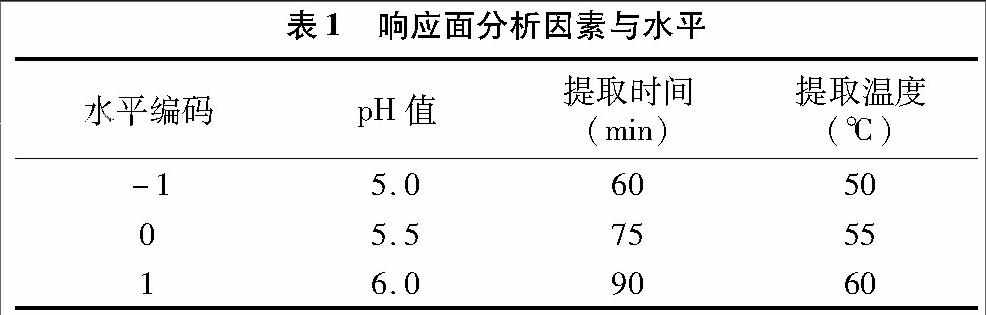
2.1.1 酶用量对茶多酚提取率的影响 由图1可知,随着酶用量的增加,茶多酚提取率呈上升趋势。在酶用量为100 μL时,提取率达到最高值,之后提取率略有上升呈平缓趋势,即酶用量达到饱和后,底物被水解的速率不再增加。因此,选用酶用量为100 μL用于后续试验。
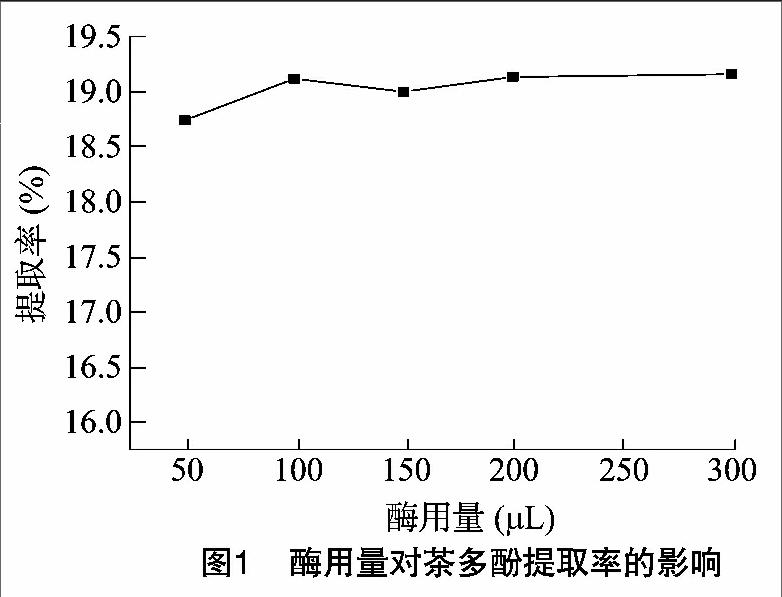
2.1.2 提取时间对茶多酚提取率的影响 由图2可知,随着浸取时间的增加,毛尖茶的茶多酚提取率呈直线上升趋势。在75 min之后茶多酚提取率减缓略有下降,说明通过增加时间无法增加茶多酚提取率;浸取时间过短导致茶多酚提取不完全,时间过长可能导致提取出的茶多酚被氧化;同时茶叶中的某些酚类、单宁及花色素是纤维素酶的天然抑制剂,如在溶液中浓度过度积累会对酶解反应造成抑制[10],所以最佳提取时间为75 min,作为后续试验参数。
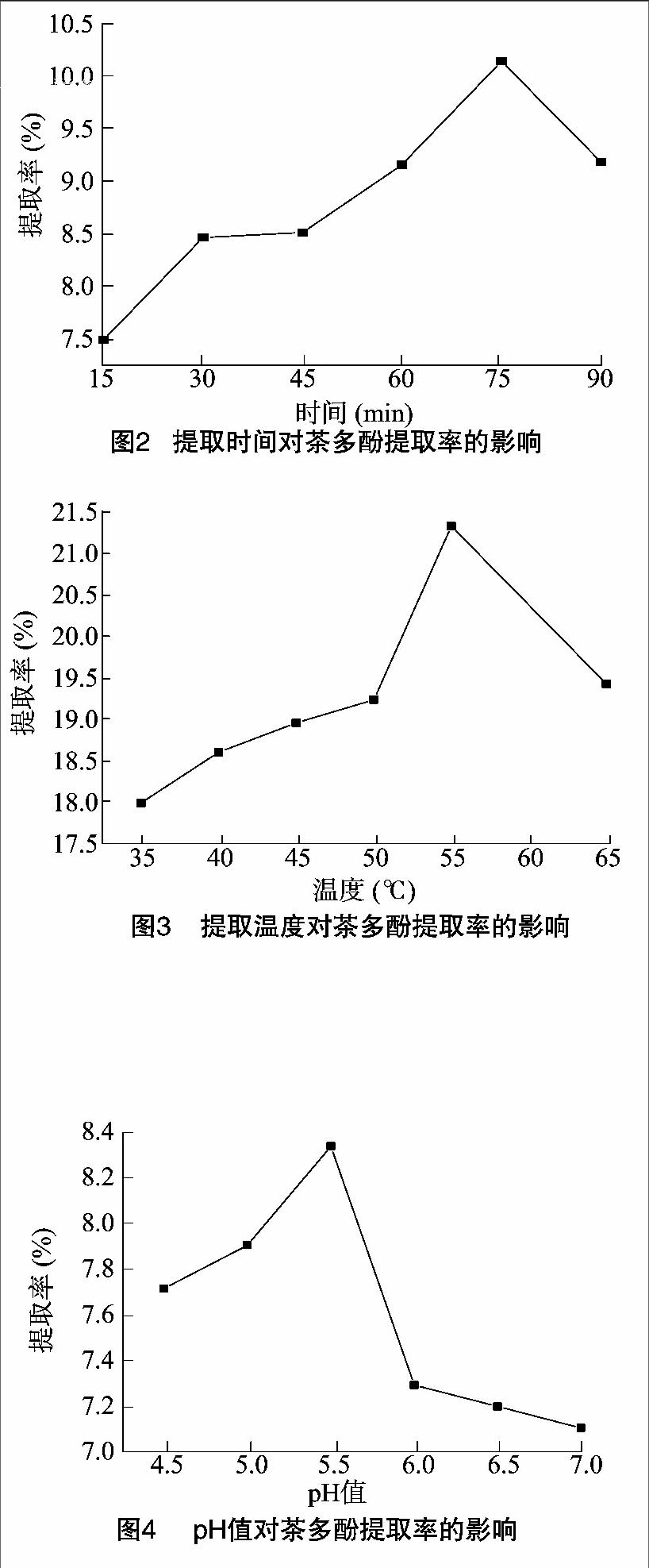
2.1.3 提取温度对茶多酚提取率的影响 由图3可知,随着浸取温度的提高,毛尖茶中茶多酚的提取率呈上升趋势。在浸取温度达到55 ℃时,茶多酚提取率达到最大值,是该体系的最佳反应温度。通过升高温度可以促进酶解作用,所以茶多酚提取率在这一段时间内不断提高;但55 ℃以后,提取率明显开始下降,这是因为超过酶活性温度后,部分或者全部酶失去活性,从而酶促反应受到抑制。
2.1.4 pH值对茶多酚提取率的影响 由图4可知,随着pH值的增大,茶多酚提取率呈上升趋势。在pH值为5.5时,提取率达到最高值,之后茶多酚提取率开始下降。与温度对茶多酚提取率类似,酶活性受pH值影响较大,每种酶都有最适pH值,当偏离最适值时,都会使酶蛋白活力降低或者变性。
2.1.5 料液比对茶多酚提取率的影响 由图5可知,随着料液比的增加,茶多酚提取率呈上升趋势。这是因为提取溶剂量的增大,可以提高茶叶粉末与水溶液间的茶多酚浓度差,更有利于茶多酚向水溶液中扩散。在料液比为1 g ∶120 mL后茶多酚溶出速率明显降低,继续增加溶剂会给后期提取过程造成负担,不易浓缩;因此选料液比为1 g ∶120 mL作为最佳值。
2.2 响应面分析法确定重要因素的最佳水平
2.2.1 试验设计及结果 根据Box-Behnken试验方案设计3因素3水平共17个试验点进行响应面分析,试验安排及结果见表2。
对模型方程进行方差分析得知(表3),P=0.000 2表明试验所选的模型极度显著;失拟项P= 0.762 1>0.05,表明失拟项差异不显著,说明回归模型与试验数据拟合度较高;回归模型决定系数R2=0.968 0,校正决定系数R2Adj=0.926 9,表明实测值与预测值高度相关,回归模型与实测值能够较好地拟合。模型方程的一次项C影响极显著(P<0.01);二次项A2、B2影响均显著(P<0.05);交互项AB、AC影响不显著(P>0.05),交互项BC影响显著(P<0.05);此结果表明各因素对茶多酚提取率的影响不是简单的线性关系。同时由表3可知,响应面优化酶法提取茶多酚的工艺参数中,所选各因素水平范围内,影响茶多酚提取率的因素按主次顺序排列为:温度>时间>pH值。
2.2.2 响应面图分析 由图6至图8可知,每个因素在特定的取值范围内,曲面图和等高线图都存在响应峰值;并且可以从图中直观地了解各因素的交互作用对茶多酚提取率的影响是否显著。从3组图中可知,三维曲面都为凸曲面,最高点落在所选区域内,说明选择因素水平合理;茶多酚提取率随pH值(A)、提取时间(B)和提取时间(C)的增加均呈现先增后降的二次关系,等高线的疏密及形状反映提取时间(B)和提取温度(C)交互作用对茶多酚提取率影响显著,pH值(A)和提取时间(B)、pH值(A)和提取温度(C)的交互作用对茶多酚提取率影响不显著。
2.3 模型验证
根据Design-Expert 8.0.6软件的优化功能得到最佳提取工艺条件为: pH值、提取时间和提取温度分别为5.50、7088 min和60 ℃时,茶多酚提取率预测最大值达到24.623 4%。为更方便操作,最佳提取工艺参数修正为:pH值为5.50、提取时间为70 min和提取温度为60 ℃;在此条件下进行3组平行试验,测得实际茶多酚平均提取率为22.39%,说明此方程模型能够真实反映所筛选因素对茶多酚提取率的影响。
3 结论
通过单因素试验和响应面法对茶多酚提取工艺进行优化,建立了pH值、提取时间和提取温度3个因素对茶多酚提取率的二次回归模型,经验证此模型准确有效;优化后的茶多酚提取工艺条件为pH值5.5、提取时间70 min和提取温度 60 ℃,在此条件下茶多酚提取率为22.39%。
参考文献:
[1]罗一帆,郭振飞,陈剑经.茶叶的有效成分及其抗癌作用[J]. 中草药,2004,35(增刊1):237-239.
[2]Macedo J A,Battestin V,Ribeiro M L,et al. Increasing the antioxidant power of tea extracts by biotransformation of polyphenols[J]. Food Chemistry,2011,126(2):491-497.
[3]Cho Y S,Oh J J,Oh K H. Antimicrobial activity and biofilm formation inhibition of green tea polyphenols on human teeth[J]. Biotechnology and Bioprocess Engineering,2010,15(2):359-364.
[4]陈铃容. 茶多酚的结构特性及开发前景[J]. 茶叶科学技术,2005(2):21.
[5]卫 哲,肖 维,黎忠健,等. 应用转盘塔逆流萃取器从夏秋季次品茶中制备茶多酚[J]. 食品科学,2013,34(14):35-39.
[6]黄丽凤,刘友平,黎代余. 茶多酚提取纯化工艺研究进展[J]. 中国食品添加剂,2010,98(1):69-72.
[7]王剑文,许云峰,周建芹,等. 酶法辅助强化中药提取过程研究进展[J]. 生物加工过程,2008,6(6):6-11.
[8]叶陈丽,贺 帅,曹伟灵,等. 中药提取分离新技术的研究进展[J]. 中草药,2015,46(3):457-464.
[9]王芸芸,李 莉,李香玉,等. 复合酶法提取甘草渣中总黄酮[J]. 化学与生物工程,2008,25(8):49-51.
[10]刘军海,杨海涛,刁宇清.复合酶法提取茶多酚工艺条件研究[J]. 食品与机械,2008,24(3):74-77,80.贾昌路,张锐利,张 宏,等. 新疆阿克苏地区核桃品质分析[J]. 江苏农业科学,2016,44(4):351-354.
