产胞外多糖植物乳杆菌的筛选及粗多糖的活性研究
2016-08-10冯小婉夏永军王光强艾连中上海理工大学医疗器械与食品学院上海200093
冯小婉,夏永军,王光强,艾连中*(上海理工大学医疗器械与食品学院,上海 200093)
产胞外多糖植物乳杆菌的筛选及粗多糖的活性研究
冯小婉,夏永军,王光强,艾连中*
(上海理工大学医疗器械与食品学院,上海 200093)
摘 要:通过观察乳酸菌菌落拉丝状况并测定其胞外多糖(exopolysaccharide,EPS)的产量,筛选出1 株所产EPS黏性好、产量高的乳酸菌AR307,经鉴定为植物乳杆菌。为得到更多的胞外多糖,对植物乳杆菌AR307的发酵条件进行优化,确定其在发酵温度32 ℃、发酵时间20 h条件下的产糖量为389 mg/L。在体外实验中,所得胞外多糖具有抑制HT-29肿瘤细胞活性、降低血糖水平的作用。
关键词:植物乳杆菌;发酵条件;胞外多糖
引文格式:
冯小婉, 夏永军, 王光强, 等.产胞外多糖植物乳杆菌的筛选及粗多糖的活性研究[J].食品科学, 2016, 37(13): 125-129.
FENG Xiaowan, XIA Yongjun, WANG Guangqiang, et al.Screening of exopolysaccharide (EPS)-producing Lactobacillus plantarum and bioactivity of the EPS[J].Food Science, 2016, 37(13): 125-129.(in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201613022. http://www.spkx.net.cn
乳酸菌在食品工业中应用广泛,除了具有维持胃肠道正常的微生态平衡、抑制病原菌的入侵与感染[1]、增强机体免疫力[2]、预防和抑制肿瘤发生[3]、降低胆固醇[4]以及抗氧化[5-6]等作用,乳酸菌胞外多糖因其独特的物理特性及良好的流变学特性[7],并且安全无毒,已被开发利用。Surayot等[8]研究了乳酸菌 TISTR 1498所产胞外多糖的分子特征和摩尔质量对免疫调节活性的作用,摩尔质量低于7.0×103g/mol的胞外多糖(exopolysaccharide,EPS)能有效刺激RAW264.7细胞产生促炎介质,部分水解的EPS能通过调节mRNA刺激RAW264.7细胞产生大量NO和各种细胞因子。
乳酸菌胞外多糖是微生物适应环境的产物[9],但产量低,菌株稳定性差, 提取成本高,制约着大规模工业生产[10]。除与菌种的遗传特性有密切关系外,培养基的成分(碳源和氮源)和生长环境(温度、pH值、培养时间)等都会直接影响乳酸菌胞外多糖的分泌积累[11],且不同营养条件和环境条件下产生的多糖的化学结构和生理功能也有差异[12]。因此发酵条件的优化,主要包括培养基成分的优化和生长环境因素的优化。本实验从实验室已有菌株中筛选出1 株高产EPS的乳酸菌,并优化其产胞外多糖的发酵条件,制备并研究其胞外多糖活性。
1 材料与方法
1.1 菌株与试剂
菌株:上海理工大学食品生物技术研究所保藏的乳酸菌共10 株。
葡萄糖、淀粉、三氯乙酸、苯酚、浓硫酸、阿卡波糖、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、二甲基亚砜(dimethyl sulfoxide,DMSO)等均购于国药化学试剂有限公司,为国产分析纯。
1.2 仪器与设备
3-18K型高速冷冻离心机 德国Sigma公司;紫外分光光度计 上海美谱达仪器有限公司;LDZX-30FA型立式压力蒸汽式灭菌锅 上海申安医疗器械厂;多功能酶标仪 美国Molecular Devices公司。
1.3 方法
1.3.1 高产胞外多糖乳酸菌的筛选
1.3.1.1 菌落拉丝法初筛
取-80 ℃保存的10 株菌株,涂布于MRS琼脂培养基中活化。观察菌株在平板上的菌落形态,挑取黏稠且有明显拉丝的单菌落,革兰氏染色并做H2O2酶实验,筛选出革兰氏染色阳性、H2O2酶实验阴性的菌株[13]。将菌株挑入MRS液体培养基培养18~24 h,4 ℃冰箱保藏。
1.3.1.2 粗多糖含量的测定
取20 mL发酵液,加1 mL质量分数为80%的三氯乙酸溶液,4 ℃静置过夜。4 ℃、10 000×g离心20 min,取上清液,去离子水透析3 d,每8 h换水1 次。以葡萄糖为标准,采用苯酚-硫酸法[14]测定粗多糖含量。
1.3.2 菌株的鉴定
将筛选到的高产黏性多糖的优良菌株,采用16S rDNA序列分析方法[15]鉴定。将高产黏性多糖的菌株接入5 mL MRS液体培养基中,37 ℃过夜培养。10 000 r/min离心5 min,弃去上清液。用1 mL无菌水洗涤菌体1~2 次后收集菌体,采用十六烷基三甲基溴化铵(cetyltrimethyl ammonium bromide,CTAB)法提取乳酸菌DNA,并进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。引物使用:27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′)。将扩增成功的PCR产物,送于生工生物工程(上海)股份有限公司进行序列测定,最后把所得菌株的DNA序列信息输入美国国家生物信息中心(National Center for Biotechnology Information,NCBI) 数据库进行局部序列比对,用基本检索工具(basic local alignment search tool,BLAST)进行分析。
1.3.3 发酵条件对菌株AR307产糖量的影响
1.3.3.1 发酵温度对菌株产糖量的影响
将活化好的菌株AR307按体积分数3%的接种量分别接种于20 mL MRS液体培养基中,分别置于26、28、30、32、34、36、38 ℃条件下恒温发酵24 h,以未接种的MRS液体培养基作为对照组,采用苯酚-硫酸法测不同温度下发酵液多糖的含量。
1.3.3.2 发酵时间对菌株产糖量的影响
将活化好的菌株AR307按体积分数3%接种量接入MRS液体培养基中,32 ℃恒温培养36 h,每隔4 h测定发酵液的EPS产量和活菌数。EPS产量采用苯酚-硫酸法测定,活菌数测定采用平板计数法。分别以EPS产量和活菌数对数值为纵坐标,发酵时间为横坐标,得到菌株在MRS培养基中的生长曲线和发酵时间对菌株产糖量的影响。
1.3.4 粗多糖的制备
取发酵一定时间的发酵液,沸水浴10 min,使可降解多糖的酶失活。然后4 ℃、10 000×g离心20 min除去菌体和凝结蛋白,上清液添加质量分数为80%的三氯乙酸至终质量分数为4%,静置过夜。4 ℃、10 000×g离心20 min除去沉淀蛋白,上清液浓缩后加体积分数95%乙醇至终体积分数为75%,4 ℃静置20 h。4 ℃、10 000×g离心20 min,取沉淀去离子水溶解,4 ℃、10 000×g离心20 min去沉淀,上清液去离子水透析3 d,每8 h换水1 次,冷冻干燥得粗多糖[16]。
1.3.5 粗多糖的抗肿瘤活性测定
采用CCK-8法[17]测定粗多糖对肿瘤细胞HT-29的影响。96孔培养板每孔加入100 µL肿瘤细胞悬液和10 µL不同质量浓度(10、100、200、500、800、1 000 µg/mL)的粗多糖样品,每个实验组设4 个复孔,置于37 ℃,5% CO2饱和湿度下培养24 h。向每孔加入10 µL细胞计数试剂盒(cell counting kit-8,CCK-8)溶液,继续培养4 h。培养结束后,用酶标仪测定450 nm波长处的吸光度。
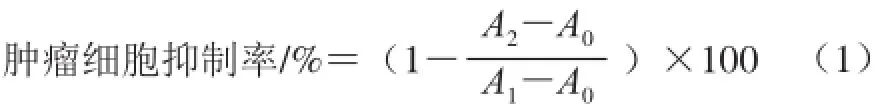
式中:A2为包含细胞、CCK溶液和药物溶液的孔的吸光度;A0为包含培养基和CCK溶液而没有细胞的孔的吸光度;A1为包含细胞、CCK溶液而没有药物溶液的孔的吸光度。
1.3.6 粗多糖的α-淀粉酶抑制作用
用1 mg/mL的DMSO分别配制不同质量浓度(25~800 µg/mL)的粗多糖和阿卡波糖。取不同质量浓度的上述2 种糖液各500 µL,加入500 µL α-淀粉酶(0.5 mg/mL),室温放置10 min,然后加入500 µL、1 g/100 mL的淀粉反应10 min后,1 mL DNS试剂加入混合液沸水浴5 min。冷却后,用蒸馏水稀释定容至10 mL,于540 nm波长处测定吸光度[18]。
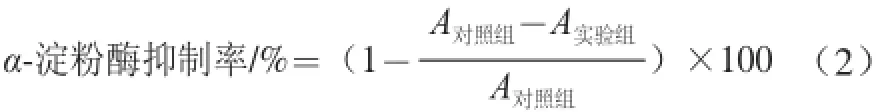
式中:A对照组为空白组吸光度;A实验组为实验组样品的吸光度。
1.4 数据处理
每个实验重复3 次,采用SPSS 17.0统计软件对数据进行处理,实验结果以±s表示。
2 结果与分析
2.1 产胞外多糖乳酸菌的筛选
产胞外多糖的菌株具有两类菌落特征,一类是具有黏丝状、黏稠状和黏液状的特征,另一类不具产黏特性[19]。实验筛选的为具有产黏性多糖的菌株。如表1所示,从实验室选取的10 株菌种,通过菌落拉丝法,结合粗多糖的产量,选取AR307进行后续的研究。
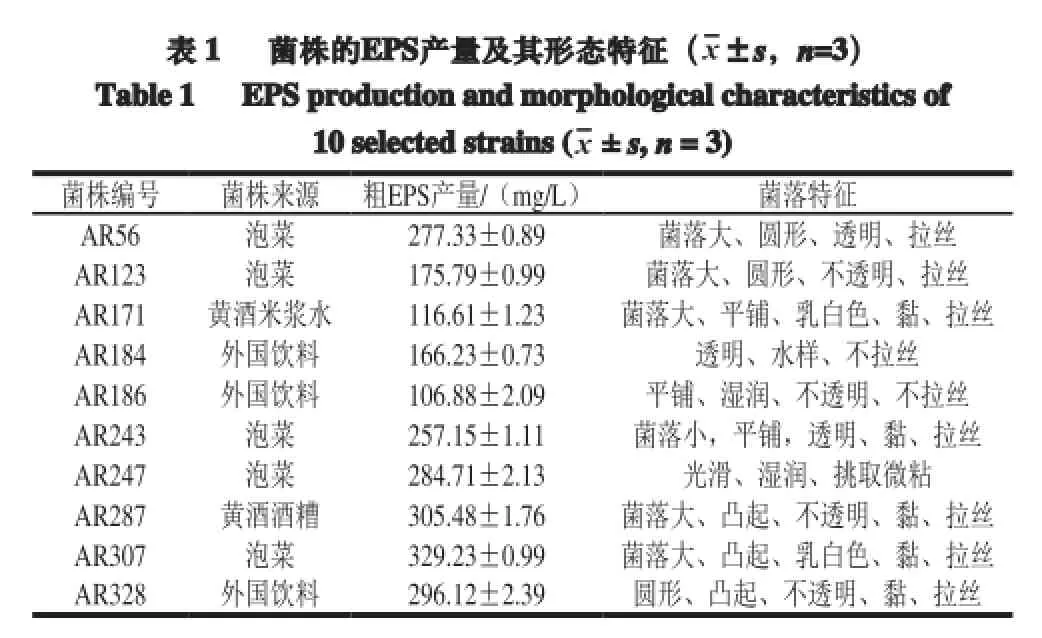
表 1 菌株的EPS产量及其形态特征(x±s,n=3)Table 1 EPSproductionandmorphological characteristics of10 selected strains (x± s,n= 3)菌株编号 菌株来源 粗EPS产量/(mg/L) 菌落特征AR56 泡菜 277.33±0.89 菌落大、圆形、透明、拉丝AR123 泡菜 175.79±0.99 菌落大、圆形、不透明、拉丝AR171 黄酒米浆水 116.61±1.23 菌落大、平铺、乳白色、黏、拉丝AR184 外国饮料 166.23±0.73 透明、水样、不拉丝AR186 外国饮料 106.88±2.09 平铺、湿润、不透明、不拉丝AR243 泡菜 257.15±1.11 菌落小,平铺,透明、黏、拉丝AR247 泡菜 284.71±2.13 光滑、湿润、挑取微粘AR287 黄酒酒糟 305.48±1.76 菌落大、凸起、不透明、黏、拉丝AR307 泡菜 329.23±0.99 菌落大、凸起、乳白色、黏、拉丝AR328 外国饮料 296.12±2.39 圆形、凸起、不透明、黏、拉丝
2.2 菌株鉴定结果
提取菌株AR307的基因组DNA,经PCR扩增后回收测序,根据16S rDNA核苷酸序列提交GenBank做BLAST分析,菌株AR307同源性最高的菌株为L.plantarum JCM 1149(NR117813),同源性为99%。由此可以推断,菌株AR307与L.plantarum JCM 1149 属于同一个种。依据形态特征、生理生化特征等微生物学特性[20]及其遗传特性16S rDNA[21]将菌株AR307初步鉴定为L.plantarum。
2.3 发酵条件对菌株AR307产糖量的影响
2.3.1 发酵温度对EPS产量的影响
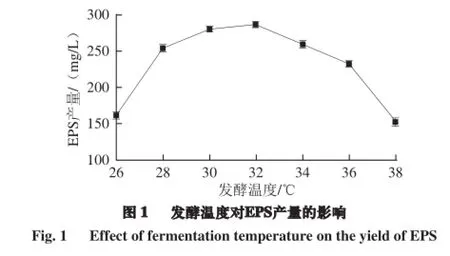
由图1可知,发酵温度在26~32 ℃时,EPS产量分别为(161.23±0.99)、(253.74±1.63)、(280.29±2.09)、(286.61±0.73) mg/L,EPS产量随温度升高而升高;而发酵温度从34 ℃开始,EPS产量随温度升高而降低。因此,发酵温度为32 ℃时,EPS产量最大,温度过高或过低都会影响EPS的产量。
温度通过影响蛋白质、核酸等生物大分子的结构和功能以及胞内酶的活性来影响微生物的生长、繁育和新陈代谢,不同的发酵温度不仅影响乳酸菌的生长,还影响代谢产物的产量和质量[22]。Subudhi等[23]研究无色杆菌在37 ℃时生物絮凝效果达到77%,而温度为50 ℃时其絮凝力降到38%,这是由于温度过高、过低导致酶失活或者活性降低。冯美琴等[24]研究了植物乳杆菌胞外多糖发酵条件的优化,温度是影响植物乳杆菌胞外多糖产量的主要因素之一,并且并不是在最适温度时产量最高,这还与各菌株的特性有关,其优化植物乳杆菌发酵温度为31 ℃时,产糖量达到425.16 mg/L。Gassm等[25]认为较低的接种温度导致活菌数量缓慢增加,有利于延长乳酸菌的对数期和稳定期,从而提高如胞外多糖等次级代谢产物的产量。因此,选择合适的菌株发酵温度不仅促进植物乳杆菌的生长,还可以大大提高胞外多糖的产量。
2.3.2 发酵时间对EPS产量的影响
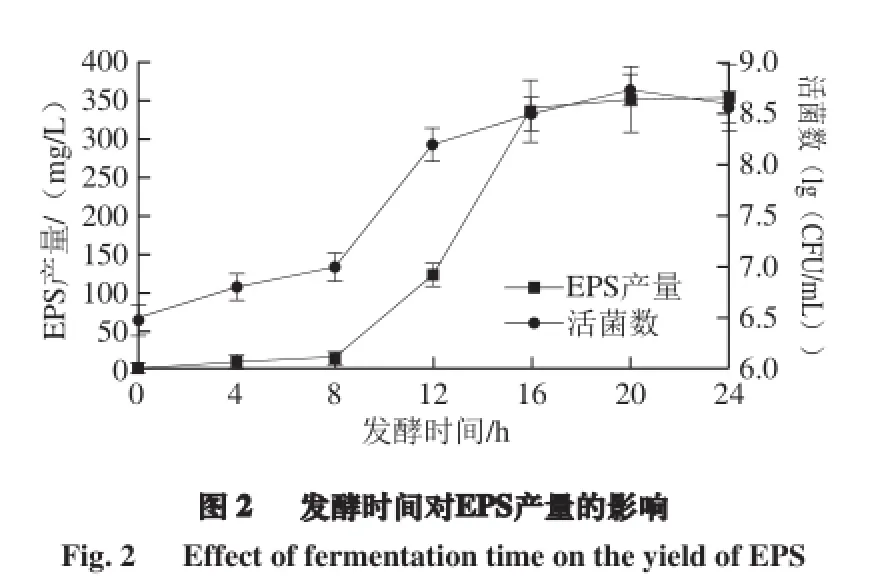
不同发酵时间EPS的产量以及植物乳杆菌AR307生长曲线见图2。在一定的温度条件下,发酵时间在0~16 h范围内,EPS产量随发酵时间的增加而不断增加;在16~24 h范围内,EPS产量趋于稳定。发酵时间在20 h左右时EPS产量达到最大,为(354.19±0.99) mg/L,在24 h时EPS产量基本不变。从生长曲线上来看,植物乳杆菌AR307的EPS产生始于菌体对数生长期,EPS 产量达到最大时,细菌的生物量也最大,延长发酵时间会使EPS发生降解,产量下降,这可能是多糖水解作用的结果。Li Dan等[26]研究了嗜热链球菌05-34在培养16、24、30 h时的EPS产量,在24 h时其产糖量最高为94.31 mg/L,30 h时其EPS产量下降到61.32 mg/L。陈若雯等[27]对乳酸乳杆菌发酵生产胞外多糖的发酵条件进行了优化,发酵时间为胞外多糖产量的显著影响因素之一,发酵时间23.18 h 时,乳酸乳杆菌胞外多糖实际产量可达3.910 g/L,发酵时间延长EPS显著降低可能与酶降解或培养基物理参数的改变有关[28],这与本实验的植物乳杆菌AR307发酵条件相符合。因此,选择适宜的发酵时间对乳酸菌胞外多糖的分泌积累具有重要的影响。
2.4 粗多糖的制备及分析
将活化好的植物乳杆菌AR307接种到MRS液体培养基中32 ℃培养20 h即可制得发酵液。发酵结束后,发酵液黏稠且有拉丝现象。发酵液经煮沸、三氯乙酸除蛋白、醇沉后收集沉淀,沉淀用去离子水溶解、透析,冷冻干燥得到蓬松的、白色的粗多糖,称质量大约每升发酵液含389 mg。Wang Ji等[29]从藏灵菇酸奶中筛选出植物乳杆菌YW11,并且提取胞外多糖的量为90 mg/L。冯美琴等[24]应用Plackett-Burman设计和响应面法进行植物乳杆菌胞外多糖发酵条件的优化,在蔗糖质量浓度34 g/L、接种量5%、发酵温度31 ℃条件下发酵的植物乳杆菌胞外多糖产量达425.16 mg/L。Li Dan等[26]通过优化嗜热链球菌05-34的发酵条件,EPS产量达到250 mg/L,比没有优化发酵条件时EPS产量提高了4.2 倍,并且条件优化后其增大了EPS分子质量,从而改变了其流变性能。因此,通过优化植物乳杆菌AR307发酵条件,提高胞外多糖产量,对进一步研究EPS分子质量、结构、活性以及流变学具有重要意义。
2.5 粗多糖的抗肿瘤活性
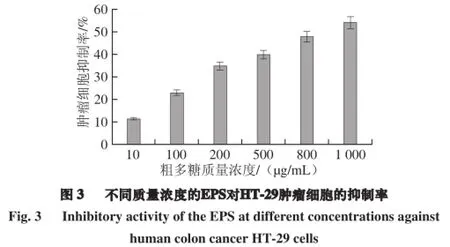
本实验利用CCK-8法研究了植物乳杆菌AR307的胞外多糖在一定的质量浓度梯度(10~1 000 µg/mL)下对肿瘤细胞HT-29的抑制率。由图3可知,随着质量浓度的升高,抑制率不断变大。培养24 h后,1 mg/mL EPS的HT-29细胞抑制率为(54.09~1.03)%。Wang Kun等[30]报道了植物乳杆菌70810发酵产生的胞外多糖c-EPS在600 µg/mL时培育72 h,对HT-29的抑制率达到88.34%。Liu Lei等[31]提取纯化丹参多糖SMP-W1,并对其进行抗细胞增殖和抑制肿瘤生长的实验,在质量浓度400 µg/mL 时SMP-W1就显示较高的抑制肝癌细胞活性,因此其对机体具有很好的免疫调节活性。不同菌种产生的胞外多糖的抗肿瘤活性也不同,可能由于多糖的构造、摩尔质量、单糖组成等特性的不同。因此,需要进一步研究其结构特征,了解其活性机制。
2.6 粗多糖的降血糖作用
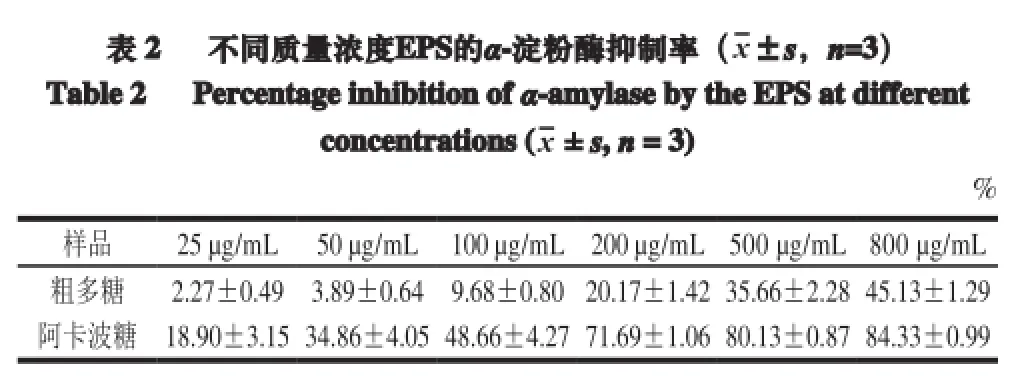
表 2 不同质量浓度EPS的a-淀粉酶抑制率(x±s,n=3)Table 2 Percentage inhibition ofa-amylaseby theEPSatdifferentconcentrations (x± s,n= 3)%样品 25 µg/mL 50 µg/mL 100 µg/mL 200 µg/mL 500 µg/mL 800 µg/mL粗多糖 2.27±0.49 3.89±0.64 9.68±0.80 20.17±1.42 35.66±2.28 45.13±1.29阿卡波糖 18.90±3.15 34.86±4.05 48.66±4.27 71.69±1.06 80.13±0.87 84.33±0.99
由表2可知,植物乳杆菌AR307胞外多糖在一定剂量下表现出α-淀粉酶抑制活性,EPS质量浓度小于200 µg/mL时,α-淀粉酶抑制率均小于10%,而800 µg/mL EPS的抑制率为(45.13±1.29)%,约占同质量浓度阿卡波糖抑制率((84.33±0.99)%)的50%。Dilna等[32]研究了在质量浓度为100 µg/mL和800 µg/mL情况下,植物乳杆菌RJF4胞外多糖α-淀粉酶的抑制率分别为25%和40%,而相同质量浓度下阿卡波糖的抑制率分别为91.75%和98%。Sivashanmugam等[18]对印度塔树叶提取物的降血糖作用进行体内外研究,体外实验利用酶动力学研究α-淀粉酶和α-葡萄糖的抑制率;体内实验研究提取物对链脲霉素诱导糖尿病小鼠的保护作用。结果表明植物乳杆菌RJF4胞外多糖具有一定降血糖作用,阿卡波糖作为一种常用药物,降低饮食后血糖水平,抑制α-淀粉酶和α-葡萄糖,因此可作为检查抗糖尿病特性的标准。
3 结 论
本实验从实验室保藏的10 株乳酸菌种筛选出1 株高产黏性胞外多糖的乳酸菌,经生理生化实验及16S rDNA序列分析,该菌株被鉴定为植物乳杆菌,命名为AR307。在发酵温度为32 ℃、发酵时间为20 h的最适条件下,AR307产生胞外多糖389 mg/L,其EPS具有抑制肿瘤,抑制α-淀粉酶、降低血糖水平的作用。该菌株可产生黏性活性多糖,因此还需对其胞外多糖的活性和结构进行近一步研究。
参考文献:
[1] BECK B R, KIM D, JEON J.The effects of combined dietary probiotics Lactococcus lactis BFE920 and Lactobacillus plantarum FGL0001 on innate immunity and disease resistance in olive flounder (Paralichthys olivaceus)[J].Fish Shellfish Immunology, 2015, 42(1): 177-183.DOI:10.1016/j.f si.2014.10.035.
[2] DUARY R K, BHAUSAHE M A, BATISH V K, et al.Antiinflammatory and immunomodulatory efficacy of indigenous probiotic Lactobacillus plantarum LP91 in colitis mouse model[J].Molecular Biology Reports, 2012, 39(4): 4765-75.DOI:10.1007/s11033-011-1269-1.
[3] LADDA B, THEPAREE T, CHIMCHANG, et al.In vitro modulation of tumor necrosis factor α production in THP-1 cells by lactic acid bacteria isolated from healthy human infants[J].Anaerobe, 2015, 33: 109-116.DOI:10.1016/j.Anaerobe.2015.03.002.
[4] WANG S C, CHANG C K, CHAN S C, et al.Effects of lactic acid bacteria isolated from fermented mustard on lowering cholesterol[J].Asian Pacific Journal of Tropical Biomedicine, 2014, 4(7): 523-528.DOI:10.12980/ apjtb.4.201414b5.
[5] LIU J G, HOU C W, LEE S Y, et al.Antioxidant effects and UVB protective activity of Spirulina (Arthrospira platensis) products fermented with lactic acid bacteria[J].Process Biochemistry, 2011,46(7): 1405-1410.DOI:10.1016/j.Procbio.2011.03.010.
[6] KUDA T, KAWAHARA M, NEMOTO M, et al.In vitro antioxidant and anti-inflammation properties of lactic acid bacteria isolated from fish intestines and fermented fish from the Sanriku Satoumi region in Japan[J].Food Research International, 2014, 64: 248-255.DOI:10.1016/j.Foodres.2014.06.028.
[7] MENDE S, PETER M, BARTELS K, et al.Addition of purified exopolysaccharide isolates from S.thermophilus to milk and their impact on the rheology of acid gels[J].Food Hydroeolloids, 2013, 32: 178-185.DOI:10.1016/j.Foodhyd.2012.12.011.
[8] SURAYOT U, WANG J, SEESURIYACHAN P, et al.Exopolysaccharides from lactic acid bacteria: structural analysis,molecular weight effect on immunomodulation[J].International Journal of Biological Macromolecules, 2014, 68: 233-240.DOI:10.1016/j.Ijbiomac.2014.05.005.
[9] VUYST L D, VIN F D, VANINGELGEM F, et al.Recent developments in the biosynthesis and applications of heteropolysaccharides from lactic acid bacteria[J].International Dariy Journal, 2001, 11(9): 687-707.DOI:10.1016/S0958-6946(01)00114-5.
[10] ARSKOLD E, SVENSSON M, GRAGE H, et al.Environmental influences on exopolysaccharide formation in Lactobacillus reuteri ATCC 55730[J].International Journal of Food Microbiology, 2007,116: 159-167.DOI:10.1016/j.ijfoodmicro.2006.12.010.
[11] HAJ-MUSTAFA M, ABDI R, SHEIKH-ZEINODDIN M.Statistical study on fermentation conditions in the optimization of exopolysaccharide production by Lactobacillus rhamnosus 519 in skimmed milk base media[J].Biocatalysis and Agricultural Biotechnology, 2015, 4(4): 521-527.DOI:10.1016 j.Bcab.2015.08.013.
[12] ALHUDHUD M, HUMPHREYS P, LAWS A.Development of a growth medium suitable for exopolysaccharide production and structural characterization by Bifidobacterium animalis ssp.lactis AD011[J].Microbiological Methods, 2014, 100(1): 93-98.DOI:10.1016/j.Mimet.2014.02.021.
[13] de ALMEIDA JÚNIOR W L G, FERRARI Í D S, de SOUZA J V,et al.Characterization and evaluation of lactic acid bacteria isolated from goat milk[J].Food Control, 2015, 53: 96-103.DOI:10.1016/ j.Foodcont.2015.01.013.
[14] MASUKE T, MINAMI A, IWASAKI N, et al.Carbohydrate analysis by a phenol-sulfuric acid method in microplate format[J].Analytical Biochemistry, 2005, 339(1): 69-72.DOI:10.1016/j.Ab.2004.12.001.
[15] 张洁, 徐桂花, 尤丽琴.16S rDNA序列分析法鉴定乳酸菌[J].农产品加工(创新版), 2009(4): 47-49.DOI:10.3969/ j.issn.1671-9646.2009.04.015.
[16] AI L Z, ZHANG H, GUO B H, et al.Preparation, partial characterization and bioactivity of exopolysaccharides from Lactobacillus casei LC2W[J].Carbohydrate Polymers, 2008, 74(3): 353-357.DOI:10.1016/j.Carbpol.2008.03.004.
[17] 马杉姗, 王世平, 连正兴.藏灵菇嗜热链球菌胞外多糖对人结肠癌细胞的增殖抑制[J].食品科学, 2008, 29(04): 405-408.
[18] SIVASHANMUGAM A T, CHATTERJEE T K.In vitro and in vivo antidiabetic activity of Polyalthia longifolia (Sonner.) Thw. leaves[J].Oriental Pharmacy and Experimental Medicine, 2013, 13(4): 289-300.DOI:10.1007/s13596-013-0118-2.
[19] RUAS-MADIEDO P, de los REYES-GAVILÁN C G.Invited review: methods for the screening, isolation, and characterization of exopolysaccharides produced by lactic acid bacteria[J].Journal of Dairy Science, 2005, 88(3): 843-856.DOI:10.3168/jds.S0022-0302(05)72750-8.
[20] 凌代文, 冬秀珠.乳酸菌分类鉴定及实验方法[M].北京: 中国轻工业出版社, 1998: 117-129.
[21] 涂宏钢, 李存瑞, 巫庆华, 等.利用16S rRNA全长序列鉴定植物乳杆菌[J].乳业科学与技术, 2004, 27(2): 57-60.DOI:10.3969/ j.issn.1671-5187.2004.02.004.
[22] 熊素玉, 姚新奎, 谭小海.不同温度及pH条件对乳酸菌生长影响的研究[J].新疆农业科学, 2006, 43(6): 533-538.
[23] SUBUDHI S, BISHT V, BATTA N, et al.Purification and characterization of exopolysaccharide bioflocculantproduced by heavy metal resistant Achromobacter xylosoxidans[J].Carbohydrate Polymers, 2016, 137: 441-451.DOI:10.1016/j.Carbpol.2015.10.066.
[24] 冯美琴, 邢家溧, 张琦.植物乳杆菌胞外多糖发酵条件的优化[J].食品科学, 2011, 32(23): 215-219.
[25] GASSM M, SCHMIDTAND K A, FRANK J F.Exopolysaccharide production from whey lactose by fermentation with Lactobacillus celbrueckill ssp.bulgaricus[J].Journal of Food Science, 1997, 62(1): 171-173; 207.DOI:10.1111/j.1365-2621.1997.tb04393.x.
[26] LI D, LI J, ZHAO F.The influence of fermentation condition on production and molecular mass of EPS produced by Streptococcus thermophilus 05-34 in milk-based medium[J].Food Chemistry, 2016,197: 367-372.DOI:10.1016/j.Foodchem.2015.10.129.
[27] 陈若雯, 李里, 段家彩.乳酸乳杆菌胞外多糖的发酵条件优化[J].食品与生物技术学报, 2010, 29(5): 770-776.
[28] MCKELLAR R C, GEEST J V, CUI W.Influence of culture and environmental conditions on the composition of exopolysaccharide produced by Agrobacterium radiobacter[J].Food Hydrocolloids, 2003,17: 429-437.DOI:10.1016/ S0268-005X(03)00030-4.
[29] WANG J, ZHAO X, TIAN Z, et al.Characterization of an exopolysaccharide produced by Lactobacillus plantarum YW11 isolated from Tibet Kefir[J].Carbohydrate Polymers, 2015, 125: 16-25.DOI:10.1016/j.Carbpol.2015.03.003.
[30] WANG K, LI W, RUI X.Characterization of a novel exopolysaccharide with antitumor activity from Lactobacillus plantarum 70810[J].International Journal of Biological Macromolecules, 2014, 63: 133-139.DOI:10.1016/j.Ijbiomac.2013.10.036.
[31] LIU L, JIA J, ZENG G.Studies on immunoregulatory and anti-tumor activities of a polysaccharide from Salvia miltiorrhiza Bunge[J].Carbohydrate Polymers, 2013, 92(1): 479-483.DOI:10.1016/ j.Carbpol.2012.09.061.
[32] DILNA S V, SURYA H, ASWATHY R G, et al.Characterization of an exopolysaccharide with potential health-benefit properties from a probiotic Lactobacillus plantarum RJF4[J].LWT-Food Science and Technology, 2015, 64(2): 1179-1186.DOI:10.1016/ j.lwt.2015.07.040.
DOI:10.7506/spkx1002-6630-201613022 10.7506/spkx1002-6630-201613022. http://www.spkx.net.cn
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2016)13-0125-05
收稿日期:2016-02-01
基金项目:国家自然科学基金面上项目(31371809);上海科委国际科技合作项目(14390711700)
作者简介:冯小婉(1991—),女,硕士研究生,研究方向为食品生物技术。E-mail:fxw2351@163.com
*通信作者:艾连中(1976—),男,教授,博士,研究方向为食品生物技术。E-mail:ailianzhong@163.com
Screening of Exopolysaccharide (EPS)-Producing Lactobacillus plantarum and Bioactivity of the EPS
FENG Xiaowan, XIA Yongjun, WANG Guangqiang, AI Lianzhong*
(School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China)
Abstract:The present study describes the screening of lactic acid bacterial (LAB) strains with high exopolysaccharide (EPS)-producing ability by observing whether they could form sticky colonies.One strain named AR307 was finally obtained and identified as Lactobacillus plantarum.In order to enhance EPS yield, the fermentation conditions for producing EPS by Lactobacillus plantarum AR307 were optimized.The yield of EPS produced by AR307 reached up to 389 mg/L after 20 h fermentation at 32 ℃.In vitro assay showed that the EPS had good inhibitory activity against colon cancer HT-29 cells and possessed an antidiabetic effect.
Key words:Lactobacillus plantarum; fermentation conditions; exopolysaccharide (EPS)
