杂交-杂交瘤技术制备BsMAb的研究进展及其在食品安全检测中的应用
2016-08-10肖治理华南农业大学食品学院广东省食品质量安全重点实验室广东广州510642
王 锋,王 宇,王 弘,肖治理*(华南农业大学食品学院,广东省食品质量安全重点实验室,广东 广州 510642)
杂交-杂交瘤技术制备BsMAb的研究进展及其在食品安全检测中的应用
王 锋,王 宇,王 弘,肖治理*
(华南农业大学食品学院,广东省食品质量安全重点实验室,广东 广州 510642)
摘 要:双特异性单克隆抗体(bispecific monoclonal antibody,BsMAb)是指具有两个不同特异性抗原结合位点的单克隆抗体分子。杂交-杂交瘤技术因其简便易行、制备周期短,在制备BsMAb方面有较大优势。基于杂交-杂交瘤技术能制备出可以特异性识别两种或者两类小分子药物的BsMAb,在食品安全多残留免疫分析检测中具有较好的应用价值。本文综述了杂交-杂交瘤技术制备BsMAb的进展,探讨了基于该技术的BsMAb生成机制,讨论分析了杂交-杂交瘤及BsMAb筛选制备的关键技术要点,并归纳了BsMAb在检测食品中小分子污染物方面的应用进展,旨在为食品安全多残留免疫分析技术的发展应用提供参考。
关键词:杂交-杂交瘤技术;双特异性单克隆抗体;多残留;免疫分析
引文格式:
王锋, 王宇, 王弘, 等.杂交-杂交瘤技术制备BsMAb的研究进展及其在食品安全检测中的应用[J].食品科学, 2016,37(13): 251-256.DOI:10.7506/spkx1002-6630-201613045. http://www.spkx.net.cn
WANG Feng, WANG Yu, WANG Hong, et al.Progress in hybrid-hybridoma technology to produce bispecific monoclonal antibody and its application in food safety detection[J].Food Science, 2016, 37(13): 251-256.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201613045. http://www.spkx.net.cn
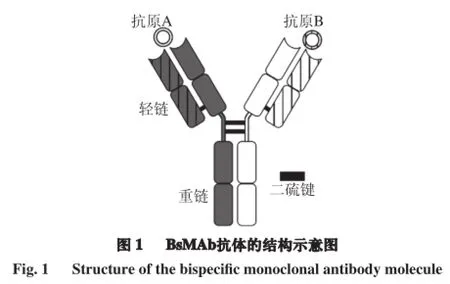
双特异性抗体(bispecific antibody,BsAb)是一类具有两种不同抗原结合位点,功能上单价,结构上双价的具有双重特异性的抗体分子的总称。而双特异性单克隆抗体(bispecific monoclonal antibody,BsMAb)是指基于杂交-杂交瘤技术制备的BsAb,其结构与常规单克隆抗体类似(图1)。1983年,Milstein等[1]首次采用杂交-杂交瘤的方法得到了抗生长抑素和抗过氧化物酶的BsMAb。目前,围绕BsAb的研究主要集中于临床医学以及肿瘤等疾病的诊断和治疗领域[2-4]。近年来,BsAb开始被应用于多组分免疫分析,与基于单克隆抗体的单组分检测方法和其他仪器方法相比表现出了极大的优势[5]。
制备BsAb的常规方法有化学重组法和基因重组法,前者产量较少、活性较低且易导致抗体变性,后者技术流程复杂且周期长[6-7]。杂交-杂交瘤技术是以传统单克隆抗体技术为基础,在常规杂交瘤的基础上进行再次杂交,获得杂交-杂交瘤,通过建立适当的选择标记方式[8-9]来制备BsAb的新技术。杂交-杂交瘤的产生可以是杂交瘤和脾细胞间的融合(三体杂交瘤/三体瘤),也可以是2 种杂交瘤细胞间的融合(四体杂交瘤/四体瘤)。通过该技术制备的BsMAb,其性质类似于天然抗体,生物活性高,制备技术上与常规杂交瘤制备相似,容易实现。
1 杂交-杂交瘤技术制备BsMAb的研究进展
目前已有多位学者通过杂交-杂交瘤技术制备出了BsMAb,并将其应用于临床医学、疾病诊断治疗及生化标记物替代物制备等领域(表1)。
Ferrini等[20]分别用8-氮鸟嘌呤(8-azaguanine,8-AG)和5-溴脱氧尿嘧啶核苷(5-bromo-2-deoxyuridine,5-BrdU)诱变抗CD16杂交瘤细胞和抗卵巢癌相关抗原杂交瘤细胞,经过细胞融合筛选获得了四体杂交瘤细胞株。
Lindhofer等[21]采用特异性分泌抗Thyl.2、CD45R、CD3等抗体的杂交瘤细胞进行两两组合制备了四种杂交-杂交瘤,使用8-AG对其中一个杂交瘤细胞株诱变,而另外一个杂交瘤细胞株对次黄嘌呤-氨基蝶呤-胸腺嘧啶脱氧核苷(hypoxanthine-aminopterin-thymidine,HAT)敏感,经碘乙酰胺处理后进行融合,筛选得到四体杂交瘤细胞株。
苏瑾等[22]采用细胞融合法,利用8-AG药物的诱变作用和neo基因的遗传筛选标记,经酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)及流式细胞仪筛选获得四体杂交瘤细胞,制备出了抗人CD3和抗人IgM µ链的双特异性抗体,且分泌BsMAb的杂交-杂交瘤的稳定性及特异性与亲本杂交瘤相似。
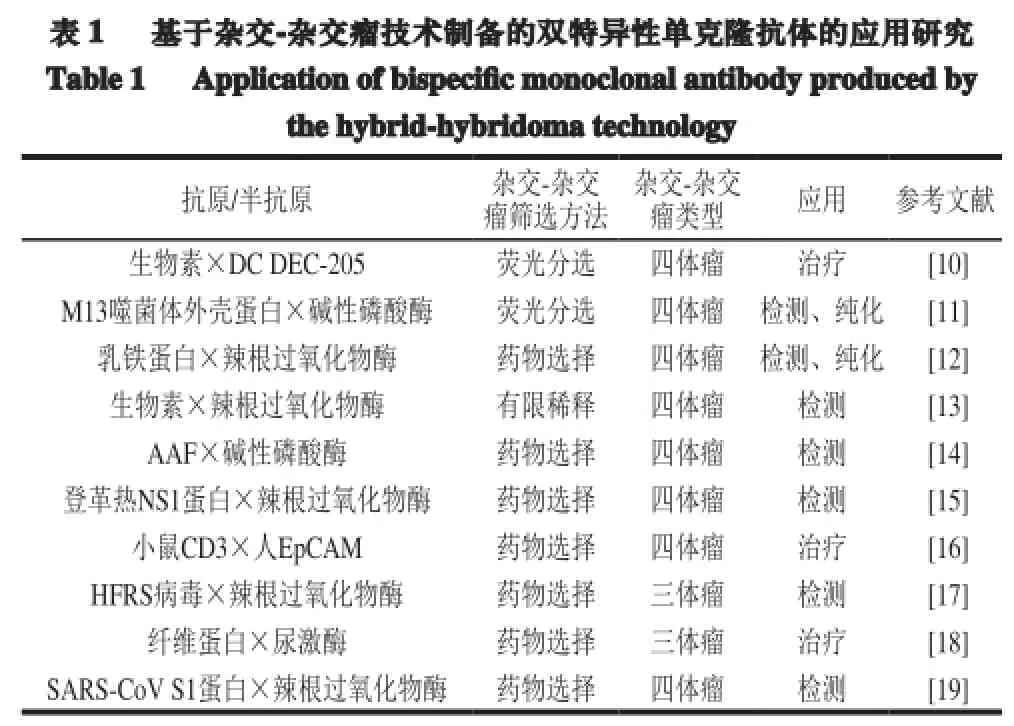
注:DC DEC-205.树突状细胞DEC-205(dendritic cell DEC-205);AAF.N-(2-芴基)乙酰胺(acetylaminofluoren);NS1蛋白.非结构蛋白 1(non-structural 1 protein);CD3.白 细 胞 分 化 抗 原 3(cluster of differentiation 3);EpCAM.上皮细胞黏附分子(epithelial cell adhesion molecule);HFRS.肾 综 合 征 出 血 热(hemorrhagic fever with renal syndrome);SARS-CoV.严重急性呼吸道综合征冠状病毒(severe acute respiratory syndrom coronavirus)。
2 基于杂交-杂交瘤技术的BsMAb生成机制
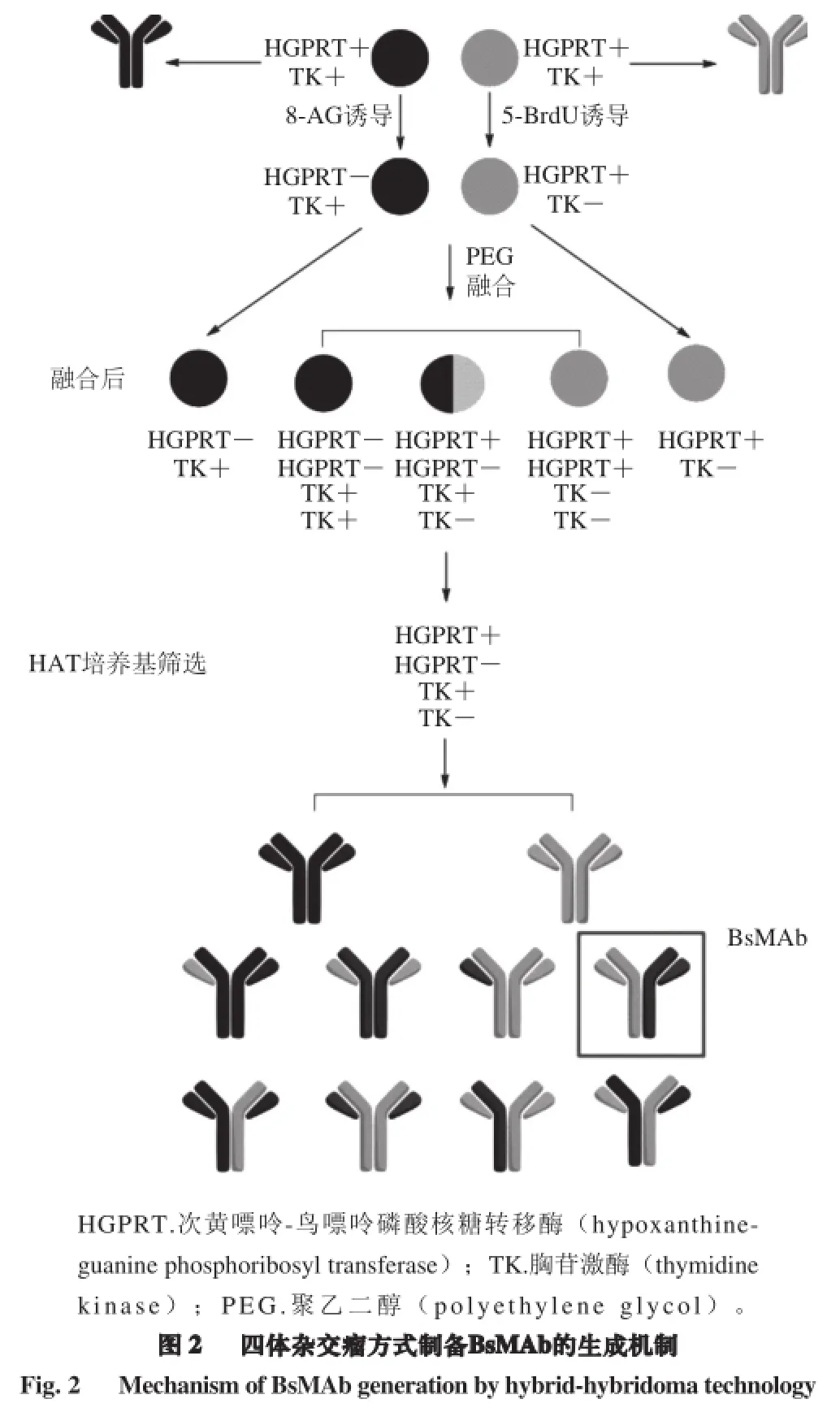
天然免疫球蛋白的产生遵循蛋白质生物合成的基本规律,其生成可分为合成、装配及分泌3 个阶段[23]:首先通过基因转录翻译,在核糖体上合成抗体的重链及轻链,之后主要通过两条通路对其进行装配,形成抗体的半分子结构,经铰链区二硫键的连接组装成完整的抗体分子,最后经体外分泌。而通过杂交-杂交瘤技术制备BsMAb的过程同样遵循此生物合成途径。 但现有研究尚未能完整阐述BsMAb在三体杂交瘤/四体杂交瘤细胞中以何种方式合成、装配并形成完整抗体分子。
目前,普遍推测BsMAb以图2所示机制进行抗体合成(以四体杂交瘤方式制备BsMAb为例)[1,4,24-25]。在二次杂交的过程中,亲本抗体的两套基因同时表达,分别形成两种重链及两种轻链,因此完整抗体的组装共有10 种方式,可分为单特异性抗体、双特异性抗体及无活性抗体三类。居漪等[26]的研究表明,经三体杂交瘤制备的腹水中同时存在这三类抗体,且含量不一,BsMAb含量为反应免疫球蛋白的36%。Massino等[27]采用亲和层析技术和放射免疫分析技术对四体杂交瘤中抗体分泌水平进行了研究分析。结果表明,双特异性抗体的含量为总蛋白量的30%,且两种单特异性抗体呈不均等性合成分泌。由两种不同重链亚类组合的抗体,因不同重链所带电荷的微小差异,在抗体的分离纯化方面有着独特的优势[28-29]。另有研究表明[30-32],不同特异性的两条轻链竞争结合一条重链时,同源的轻链与重链更容易结合。
3 杂交-杂交瘤及BsMAb筛选制备的关键技术要点
目前,关于杂交-杂交瘤技术制备BsMAb尚缺乏系统研究和理论指导,尤其是针对食品中的小分子污染物。围绕杂交-杂交瘤及BsMAb的筛选制备还存在一些值得深入探究的关键技术问题,包括亲本杂交瘤的选择、亲本杂交瘤的选择标记[8-9,33]、采用三体或四体杂交瘤的制备方式、杂交-杂交瘤的筛选、BsMAb的分离纯化等。这些技术问题在一定程度上限制了BsMAb在多残留检测中的应用。
亲本杂交瘤的特性对于二次杂交结果具有重要影响,其中至少包含抗体类型、杂交瘤稳定性两方面因素。刘瑛等[34]研究显示采用此方法制备的BsMAb抗体亚型与亲本抗体相同,均为IgG1型。孟文霞等[35]将两株分别分泌IgG2a型和IgG3型抗体的杂交瘤细胞融合后,成功获得6 株杂交-杂交瘤细胞株。李刚[36]选取了2 株杂交瘤细胞株,分泌的单克隆抗体分别为IgG3型和IgG1型,抗体轻链均为κ链,采用杂交-杂交瘤技术获得的三体杂交瘤和四体杂交瘤所产生的BsMAb分别为IgG2b-IgG1型和IgG3-IgG1型,抗体轻链均为κ链。至今尚未发现两种分别分泌IgG类和IgM类抗体的杂交瘤细胞融合得到BsMAb的报道。有文献表明,尽管不同类型的轻链与重链之间有可能发生随机组合,但异源重链间的重组可能导致轻链与重链间的随机组合被破坏,甚至导致丧失活性或仅有部分活性[37]。利用三体杂交瘤制备的抗体亚型不易推知。全昱东等[38]将分泌抗辣根过氧化物酶(horseradish peroxidase,HRP)的IgG1型抗体的杂交瘤细胞与角蛋白免疫刺激的脾细胞融合,最终得到具有IgG1-IgG2a型的双亚型BsMAb抗体分子。刘明旭等[39]将分泌IgG2a型抗体的杂交瘤细胞与经抗原免疫刺激的脾细胞融合,最终也得到具有IgG1-IgG2a型的BsMAb抗体分子。而徐青等[40]将人丙种球蛋白免疫刺激的BALB/c小鼠脾细胞与分泌抗HRP 的IgG1型抗体的杂交瘤细胞融合,获得5 株能分泌双特异性抗体的杂交瘤细胞株,其中1 株分泌的抗体亚型为IgG2a-IgG1,其余为IgG1-IgG1。推测产生差异的原因可能在于刺激脾细胞的抗原特性及刺激的过程有所不同。杂交瘤的稳定性对二次杂交的成功率和稳定性也存在较大影响,稳定性较差的杂交瘤在诱导缺陷型过程中及二次杂交的过程中较容易导致失败[41]。
亲本杂交瘤的选择标记常采用基于药物诱导酶缺陷型细胞株的方式,需要建立合适的细胞株筛选方案。不同的方案对于筛选得到的细胞株产生抗体的特异性、灵敏度有着重要的影响[42]。如果诱导药物浓度过低,所需的诱导时间就长,长时间体外传代可能会降低杂交瘤细胞的稳定性;诱导药物浓度过高,诱导时间短,但高浓度的药物又可能会诱发突变,造成阳性丢失。因此,可以考虑联合使用酶缺陷型筛选、耐细胞毒药物型筛选或荧光标记筛选等形式来提高筛选效率[43]。
理论上采用三体杂交瘤或四体杂交瘤的制备方法都可以得到BsMAb。从制备流程来讲,在制备三体杂交瘤过程中由于增加了免疫动物的步骤,增加了筛选的难度,但与四体瘤相比,三体瘤的染色体数目明显降低,这使得三体瘤细胞株更为稳定。而四体杂交瘤制备过程较为简单,只需建立合适的选择标记形式,但其染色体数目多,在传代中更容易发生阳性丢失现象。据李刚[36]报道,四体杂交瘤分泌的BsMAb具有两个亲本单克隆抗体相似的灵敏度,三体杂交瘤分泌的BsMAb的灵敏度不及两亲本抗体。
杂交-杂交瘤细胞株的筛选目前主要通过两种不同特异性目标分析物的检测结果来进行判定,操作较为繁琐费时,也有报道采用桥联ELISA和桥联荧光激活细胞分选仪(fluorescence-activated cell sorter,FACS)的方法来进行检测[44]。此外,可以将两亲本杂交瘤细胞分别标记不同的荧光素,融合后通过流式细胞仪进行筛选,这样既可以省略药物、毒物等对细胞株的诱导处理过程,又可以快速及时评估融合细胞的数量[45]。
采用动物体内诱生法或体外培养法获得的上清液中,常含有来自亲本的双价单克隆抗体,在一定程度上增加了BsMAb的分离纯化难度[46],建议可以采用亲和层析、羟基磷灰石柱层析、离子交换层析等方法[40,47-48]进行纯化。在前期筛选过程中,也可对杂交-杂交瘤细胞株进行多次的亚克隆,以提高其纯度和稳定性。
4 BsMAb在食品污染物多残留检测中的应用
近年来,由于药物的滥用,环境及食品中农兽药的残留问题比较突出[49]。Zhou Qi[50]、Gao Baolong[51]、Dong Jiexian[52]等建立了基于单克隆抗体或小分子抗体的一种或一类农兽药残留的免疫快速分析方法。但由于环境及食品中组分复杂,单一污染物残留检测已不能满足实际检测的需要[53]。发展多残留免疫检测技术成为现代农兽药残留检测技术发展的新趋势。基于BsMAb的食品中小分子污染物多残留检测方法近几年已有报道。
金仁耀等[54]采用药物诱导方法,经细胞融合得到抗克百威-抗三唑磷的四体杂交瘤细胞。以包被抗体、酶标半抗原模式建立ELISA法,结果显示BsMAb对克百威和三唑磷的IC50值分别为20 ng/mL和1.69 ng/mL,检测限IC20值分别为4.46 ng/mL和0.36 ng/mL。克百威和三唑磷在水、土壤等环境样品中的回收率为88.4%~117%。
李刚[36]采用杂交-杂交瘤技术制备得到了一株三体杂交瘤细胞LG-D6和一株四体杂交瘤细胞LG-A2。利用LG-D6细胞株分泌的BsMAb,建立了吡虫啉-甲基对硫磷多残留检测方法。该BsMAb对吡虫啉和甲基对硫磷的IC50值分别为121.6 ng/mL和8.3 ng/mL,检测限分别为69.8 ng/mL和1.9 ng/mL,水质样品的添加回收率为87.4%~104.0%。随后,Ouyang Hui等[55]将三体杂交瘤制备的BsMAb应用于化学发光动力学检测,将辣根过氧化物酶和碱性磷酸酶分别标记吡虫啉、甲基对硫磷两种药物半抗原,实现对两种药物的检测,检测限均为0.33 ng/mL,检测范围为1~500 ng/mL。
Hua Xiude等[56]采用三体杂交瘤技术制备了抗有机磷类和抗新烟碱类的BsMAb,建立的ELISA法结果表明,对于8 种有机磷农药和2 种新烟碱类杀虫剂的平均IC50值分别为114.6 ng/mL和129.8 ng/mL。自来水、池塘水、葡萄、黄瓜和土壤的添加回收实验结果表明,单一农药(甲基对硫磷或吡虫啉)的添加回收率为86.8%~125.0%。该方法能实现同时检测实际样品中的两类药物。
余厚美等[57]制备出能稳定分泌抗2 种β-激动剂(克伦特罗、莱克多巴胺)BsMAb的杂交-杂交瘤,并对抗体特异性、热稳定性等进行了研究,结果显示BsMAb只对克伦特罗、沙丁胺醇和莱克多巴胺有特异性反应,与上述3 种药物的交叉反应率分别为100%、83%、67%。
Guo Yirong等[58]将胶体金颗粒标记于呋喃丹、三唑磷2 种农药的单克隆抗体及能识别二者的BsMAb上,建立了同时检测呋喃丹和三唑磷的胶体金免疫层析技术,水样中两者的检测限分别为32 ng/mL和4 ng/mL。
5 结 语
随着单克隆抗体制备技术日趋成熟,基于杂交-杂交瘤技术的小分子多残留免疫检测技术在食品安全检测领域将有较大的研究应用空间,建立一套适合小分子化合物的BsMAb制备及多残留检测技术的研究体系就显得尤为重要。采用杂交-杂交瘤技术制备BsMAb时,在杂交瘤细胞的筛选、杂交方案的设计、BsMAb的纯化、多残留免疫分析方法的建立等方面均有待进一步系统深入研究。如何选择合适的杂交-杂交瘤筛选方法和BsMAb纯化方法成为双特异性抗体在食品安全检测应用中的新突破。此外,建立新型免疫分析方法过程中,如何将人工抗原或双特异性抗体进行多元标记(酶、荧光素、量子点或功能化纳米材料等),且如何保持标记物的稳定性成为目前限制其应用的另外一个重要原因。双特异性抗体的制备也可以为其在抗体基因方面的剪切修饰、BsMAb的三维空间结构研究及其与不同特异性抗原分子的识别机制等诸多领域提供研究基础材料。
因此,研究制备食品中不同污染物的BsMAb,建立基于BsMAb的多组分免疫分析技术是十分必要的,这也必将成为多残留检测领域新的研究热点,对于多组分免疫分析研究具有重要意义。
参考文献:
[1] MILSTEIN C, CUELLO A C.Hybrid hybridomas and their use in immunohistochemistry[J].Nature, 1983, 305: 537-540.DOI:10.1038/305537a0.
[2] RADER C.Chemically programmed antibodies[J].Trends in Biotechnology, 2014, 32(4): 186-197.DOI:10.1016/ j.tibtech.2014.02.003.
[3] SHEKHAR C.Double Whammy: bispecific antibodies help immune cells attack tumors[J].Chemistry Biology, 2008, 15(9): 877-878.DOI:10.1016/j.chembiol.2008.09.002.
[4] BYRNE H, CONROY P J, WHISSTOCK J C, et al.A tale of two specificities: bispecific antibodies for therapeutic and diagnostic applications[J].Trends in Biotechnology, 2013, 31(11): 621-632.DOI:10.1016/j.tibtech.2013.08.007.
[5] YAN X, LI H X, YAN Y, et al.Developments in pesticide analysis by multi-analyte immunoassays: a review[J].Analtical Methods, 2014,6(11): 3543-3554.DOI:10.1039/C3AY41946K.
[6] 李菁, 林彤, 宋帅, 等.基因工程抗体研究进展[J].生物技术通报,2009(10): 40-44.
[7] KONTERMANN R E.Bispecific antibodies[M].Germany: Springer Press, 2011: 29-46.DOI:10.1007/978-3-642-20910-9.
[8] KOOLWIJK P, ROZEMULLER E, STAD R K, et al.Enrichment and selection of hybrid hybridomas by percoll density gradient centrifugation and fluoreseent-aetivated[J].Hybridoma, 1988, 7(2): 217-224.DOI:10.1089/hyb.1988.7.217.
[9] 刘静, 殷竹君, 张耀娟, 等.次黄嘌呤-鸟嘌呤磷酸核糖转移酶缺陷型杂交瘤细胞的快速筛选方法[J].南京医科大学学报(自然科学版),2000, 20(3): 179-180.DOI:10.3969/j.issn.1007-4368.2000.03.006.
[10] WANG W W, DAS D, TANG X L, et al.Antigen targeting to dendritic cells with bispecific antibodies[J].Journal of Immunological Methods, 2005, 306(1): 80-92.DOI:10.1016/j.jim.2005.07.023.
[11] LIU F, GUTTIKONDA S, SURESH M R.Bispecific monoclonal antibodies against a viral and an enzyme: utilities in ultrasensitive virus ELISA and phage display technology[J].Journal of Immunological Methods, 2003, 274(1): 115-127.DOI:10.1016/S0022-1759(02)00511-2.
[12] SHINMOTO H, KOBORI M, TSUSHIDA T, et al.Competitive ELISA of bovine lactoferrin with bispecific monoclonal antibodies[J].Bioscience Biotechnology Biochemistry, 1997, 61(6): 1044-1046.DOI:10.1271/bbb.61.1044.
[13] CAO Y, CHRISTIAN S, SURESH M R.Development of a bispecific monoclonal antibody as a universal immunoprobe for detecting biotinylated macromolecules[J].Journal of Immunological Methods,1998, 220(1): 85-91.DOI:10.1016/S0022-1759(98)00154-9.
[14] AURIOL J, GUESDON J, MAZIE J C, et al.Development of a bispecific monoclonal antibody for use in molecular hybridisation[J].Journal of Immunological Methods, 1994, 169(1): 123-133.DOI:10.1016/0022-1759(94)90131-7.
[15] GANGULY A, MALABADI R B, LOBENBERG R, et al.Development of an ultrasensitive hetero-sandwich ELISA assay based on bispecific monoclonal antibody for the detection of dengue NS1 protein[J].Journal of Pharmacy Research, 2013, 7(5): 374-380.DOI:10.1016/j.jopr.2013.05.013.
[16] MORECKI S, LINDHOFER H, YACOVLEV E, et al.Induction of long-lasting antitumor immunity by concomitant cell therapy with allogeneic lymphocytes and trifunctional bispecific antibody[J].Experimental Hematology, 2008, 36(8): 997-1003.DOI:10.1016/ j.exphem.2008.03.005.
[17] 李荔, 陈伯权.抗肾综合征出血热病毒和抗辣根过氧化物酶的双特异性单克隆抗体的建立[J].病毒学报, 1989, 5(4): 334-339.
[18] 袁洪卫, 林汉, 朱锡霞, 等.抗纤维蛋白-抗尿激酶双特异性单克隆抗体的体内外溶栓效果的研究[J].中国医学科学院学报, 1998, 20(5): 357-360.
[19] SUNWOO H H, PALANIYAPPAN A, GANGULY A, et al.Quantitative and sensitive detection of the SARS-CoV spike protein using bispecific monoclonal antibody-based enzyme-linked immunoassay[J].Journal of Virological Methods, 2013, 187(1): 72-78.DOI:10.1016/j.jviromet.2012.09.006.
[20] FERRINI S, PRIGIONE I, MIOTTI S, et al.Bispecific monoclonal antibodies directed to CD16 and to a tumor-associated antigen induce target-cell lysis by resting NK cells and by a subset of NK clones[J].International Journal of Cancer, 1991, 48(2): 227-233.DOI:10.1002/ ijc.2910480213.
[21] LINDHOFER H, MOCIKAT R, STEIPE B, et al.Preferential species-restricted heavy/light chain pairing in rat/mouse quadromas: implications for a single-step purification of bispecific antibodies[J].Journal of Immunology, 1995, 155(1): 219-225.
[22] 苏瑾, 张亚莉, 郭志兵, 等.细胞融合法制备抗人CD3-抗人IgM µ链双特异性抗体[J].第一军医大学学报, 2001, 21(12): 902-905.
[23] 王廷华, 李官成.抗体理论与技术[M].北京: 科学出版社, 2013: 31-33.
[24] MOLDENHAUER G.Bispecific antibodies from hybrid hybridoma[M].Berlin: Springer, 2011: 29-46.
[25] KUFER P, LUTTERBÜSE R, BAEUERLE P A.A revival of bispecific antibodies[J].Trends in Biotechnology, 2004, 22(5): 238-244.DOI:10.1016/j.tibtech.2004.03.006.
[26] 居漪, 徐肇华, 胡畅中.亲和层析法提纯双特异性单克隆抗体[J].上海免疫学杂志, 1998, 18(5): 302-305.
[27] MASSINO Y S, DERGUNOVA N N, KIZIM E A, et al.Quantitative analysis of the products of IgG chain recombination in hybrid hybridomas based on affinity chromatography and radioimmunoassay[J].Journal of Immunological Methods, 1997,201(1): 57-66.DOI:10.1016/S0022-1759(96)00212-8.
[28] TAKAHASHI M, FULL S A.Production of murine hybrid-hybridomas secreting bispecific monoclonal antibodies for use in urease-based immunoassays[J].Clinical Chemistry, 1988, 34(9): 1693-1696.
[29] STAERZ U D, BEVAN M J.Hybrid hybridoma producing a bispecific monoclonal antibody that can focus effector T-cell activity[J].Proceedings of the National Academy of Sciences of the United Stases of America, 1986, 83(5): 1453-1457.DOI:10.1073/pnas.83.5.1453.
[30] de PREVAL C, FOUGEREAU M.Specific interaction between VH and VL regions of human monoclonal immunoglobulins[J].Journal of Molecular Biology, 1976, 102(3): 657-678.DOI:10.1016/0022-2836(76)90340-5.
[31] KRANZ D M, VOSS E W.Restricted reassociation of heavy and light chains from hapten-specific monoclonal antibodies[J].Proceedings of the National Academy of Sciences of the United Stases of America,1981, 78(9): 5807-5811.DOI:10.1073/pnas.78.9.5807.
[32] STEVENSON G T, MOLE L E.The specificity of chain interactions among immunoglobulins.combinations of gamma chains with kappa chains of the same subgroup as in the parent immunoglobulin G[J].Biochemical Journal, 1974, 139(2): 369-374.DOI:10.1042/bj1390369.
[33] 裘雪梅, 刘仁荣, 徐玲, 等.次黄嘌呤-鸟嘌呤磷酸核糖转移酶缺陷型产抗苏丹红I单克隆抗体杂交瘤细胞的筛选[J].时珍国医国药,2013, 23(11): 2669-2670.
[34] 刘瑛, 陶玉珍, 陈受霓.分泌抗HBsAg-抗HRP双特异单克隆抗体杂交-杂交瘤的建株[J].中国生物制品学杂志, 1992, 5(3): 111-113.
[35] 孟文霞, 王润田, 张玉芬, 等.抗HIV p24和人A型红细胞双特异性单克隆抗体的研制[J].细胞与分子免疫学杂志, 2004, 20(5): 582-584.
[36] 李刚.抗吡虫啉-甲基对硫磷双特异性单克隆抗体的研究[D].南京:南京农业大学, 2011: 1-85.
[37] de LAU W B, HEIJE K, NEEFJES J J, et al.Absence of preferential homologous H/L chain association in hybrid hybridomas[J].Journal Immunology, 1991, 146(3): 906-914.
[38] 全昱东, 赵莉, 程明, 等.角蛋白和过氧化物酶双特异性杂交杂交瘤的建立[J].单克隆抗体通讯, 1990, 6(1): 20-23.
[39] 刘明旭, 张瑛勋, 王建安, 等.抗TNF和抗CALLA三体瘤的研制及其分泌抗体的初步纯化[J].单克隆抗体通讯, 1993, 9(2): 1-4.
[40] 徐青, 汪厚平, 巫山, 等.抗人IgG-抗HRP双特异性单克隆抗体细胞株的建立与鉴定[J].免疫学杂志, 2000, 16(3): 225-227; 238.
[41] LANZAVECCHIA A, SCHEIDEGGER D.The use of hybrid hybridomas to target human cytotoxic T lymphocytes[J].European Journal of Immunology, 1987, 17(1): 105-111.DOI:10.1002/ eji.1830170118.
[42] 王宇.孔雀石绿及其代谢物免疫分析技术研究[D].广州: 华南农业大学, 2010: 112-123.
[43] BRANSCOMB E E, RUNGE M S, SAVARD C E, et al.Bispecific monoclonal antibodies produced by somatic cell fusion increase the potency of tissue plasminogen activator[J].Thrombosis and Haemostasis, 1990, 64(2): 260-266.
[44] SARKAR S, TANG X L, DAS D, et al.A bispecific antibody based assay shows potential for detecting tuberculosis in resource constrained laboratory settings[J].PLoS ONE, 2012, 7(2): e32340.DOI:10.1371/ journal.pone.0032340.
[45] KARAWAJEW L, MICHEEL B, BEHRSING O, et al.Bispecific antibody-producing hybrid hybridomas selected by a fluorescence activated cell sorter[J].Journal of Immunological Methods, 1987,96(2): 265-270.DOI:10.1016/0022-1759(87)90323-1.
[46] ARAGAY G, PINO F, MERKOCI A.Nanomaterials for sensing and destroying pesticides[J].Chemical Reviews, 2012, 112(10): 5317-5338.DOI:10.1021/cr300020c.
[47] 陈晓钎, 沈德诚, 孙同哲.CD3/CD19双特异性单克隆抗体的制备、鉴定及其再导向的研究[J].中国医学科学院学报, 1998,20(5): 351-356.
[48] 崔运昌.单克隆抗体研究新进展(双特异性单克隆抗体和杂交-杂交瘤技术)[J].第四军医大学学报, 1986, 7(2): 175-176.
[49] MOROZOVA V S, LEVASHOVA A I, EREMIN S A.Determination of pesticides by pesticide by enzyme immunoassay[J].Journal of Analytical Chemistry, 2005, 60(3): 202-217.DOI:10.1007/s10809-005-0075-0.
[50] ZHOU Q, PENG D P, WANG Y L, et al.A novel hapten and monoclonal-based enzyme-linked immunosorbent assay for sulfonamides in edible animal tissues[J].Food Chemistry, 2014, 154: 52-62.DOI:10.1016/j.foodchem.2014.01.016.
[51] GAO B L, LIU J, DONG L X, et al.Broad specific enzyme-linked immunosorbent assay for determination of residual phenothiazine drugs in swine tissues[J].Analtical Biochemistry, 2014, 454(1): 7-13.DOI:10.1016/j.ab.2014.02.032.
[52] DONG J X, LI Z F, LEI H T, et al.Development of a single-chain variable fragment-alkaline phosphatase fusion protein and a sensitive direct competitive chemiluminescent enzyme immunoassay for detection of ractopamine in pork[J].Analtical Chimica Acta, 2012,736: 85-91.DOI:10.1016/j.aca.2012.05.033.
[53] JIANG H, FAN M T.Multi-analyte immunoassay for pesticides: a review[J].Analtical Letters, 2012, 45(11): 1347-1364.DOI:10.1080/0 0032719.2012.675493.
[54] 金仁耀, 朱国念.基于双特异性单克隆抗体的克百威和三唑磷多残留ELISA分析方法研究及在环境样品中应用[J].核农学报, 2013,27(4): 515-522; 531.
[55] OUYANG H, WANG L M, YANG S J, et al.Chemiluminescence reaction kinetics-resolved multianalyte immunoassay strategy using a bispecific monoclonal antibody as the unique recognition reagent[J].Analtical Chemistry, 2015, 87(5): 2952-2958.DOI:10.1021/ ac5045093.
[56] HUA X D, WANG L M, LI G, et al.Multi-analyte enzymelinked immunosorbent assay for organophosphorus pesticides and neonicotinoid insecticides using a bispecific monoclonal antibody[J].Analtical Methods, 2013, 5(6): 1556-1563.DOI:10.1039/c3ay26398c.
[57] 余厚美, 崔廷婷, 冯才伟, 等.抗3种β-激动剂双特异性单克隆抗体的建立与鉴定[J].化学试剂, 2012, 34(7): 607-611.
[58] GUO Y R, LIU S Y, GUI W J, et al.Gold immunochromatographic assay for simultaneous detection of carbofuran and triazophos in water samples[J].Analtical Biochemistry, 2009, 389(1): 32-39.DOI:10.1016/j.ab.2009.03.020.
DOI:10.7506/spkx1002-6630-201613045
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2016)13-0251-06
收稿日期:2015-09-24
基金项目:广东省自然科学基金项目(S2012010010323);广东省科技计划项目(2014B070706001)
作者简介:王锋(1991—),男,硕士研究生,研究方向为食品质量与安全。E-mail:wangfg024@163.com
*通信作者:肖治理(1978—),女,副教授,博士,研究方向为食品质量与安全。E-mail:scauxzl@scau.edu.cn
Progress in Hybrid-Hybridoma Technology to Produce Bispecific Monoclonal Antibody and Its Application in Food Safety Detection
WANG Feng, WANG Yu, WANG Hong, XIAO Zhili*
(Guangdong Provincial Key Laboratory of Food Quality and Safety, College of Food Science, South China Agricultural University,Guangzhou 510642, China)
Abstract:Bispecific monoclonal antibodies (BsMAb) are monoclonal antibody molecules with two different specific antigen-binding sites.Hybrid-hybridoma technology has a great advantage in the preparation of BsMAb because of its easy operation and less time consumption.BsMAbs with 2 distinct antigen-binding sites produced by the hybrid-hybridoma technology could specifically recognize antigens of 2 drugs or 2 classes of drugs, and are applicable in the multi-residue determination of foods.In this paper, we elaborate recent progress in the development of hybrid-hybridoma technology and explore the mechanism of BsMAb generation by the hybrid-hybridoma method.Several important factors influencing the hybrid-hybridoma technology are discussed, and the application of BsMAb in food safety detection is also reviewed.This paper will provide some references for the development and application of BsMAb in multi-residue immunoassay of foods.
Key words:hybrid-hybridoma technology; bispecific monoclonal antibody (BsMAb); multi-residue; immunoassay
