活性氧的生成与健康和疾病关系研究进展
2016-08-10李兴太张春英仲伟利高明波大连民族大学生命科学学院辽宁大连6600黑龙江大兴安岭地区农业林业科学研究院黑龙江加格达奇65000
李兴太,张春英,仲伟利,高明波(.大连民族大学生命科学学院,辽宁 大连 6600;.黑龙江大兴安岭地区农业林业科学研究院,黑龙江 加格达奇 65000)
活性氧的生成与健康和疾病关系研究进展
李兴太1,张春英2,仲伟利2,高明波1
(1.大连民族大学生命科学学院,辽宁 大连 116600;2.黑龙江大兴安岭地区农业林业科学研究院,黑龙江 加格达奇 165000)
摘 要:从历史上看,活性氧(reactive oxygen species,ROS)被认为只引起细胞损伤及生理功能障碍,ROS及其氧化损伤与多种疾病,包括神经退行性疾病、糖尿病、癌症和过早衰老相关。然而,近年来,越来越多的证据显示,ROS对健康至关重要。在生理条件下,低水平ROS的生成被认为是信号分子。另一方面,ROS的过度生成,与ROS缓冲系统的功能障碍相关,会导致慢性疾病的发展。因此,ROS的慢性释放参与许多疾病的发病。而且,ROS生成过量诱导生物分子的氧化损伤,进而导致衰老、癌症和许多其他疾病。ROS已经参与100多种疾病的发生,包括威胁人类健康的重大疾病癌症、心血管疾病、糖尿病、神经退行性疾病(如帕金森病和阿尔茨海默病)、获得性免疫缺陷综合征、中风和衰老的发生。本文综述了氧的出现与需氧真核生物的进化、ROS的种类、ROS的生理病理多效性、机体内主要的ROS、ROS的生成与反应、ROS与线粒体氧化磷酸化、细胞凋亡、免疫防御和炎症、肿瘤等方面的最新进展,鉴于ATP和ROS对生命的重要性,提出,调控线粒体氧化磷酸化实现ATP与ROS生成的平衡将是健康的关键。
关键词:活性氧;线粒体;信号传导;氧化还原平衡;健康
引文格式:
李兴太, 张春英, 仲伟利, 等.活性氧的生成与健康和疾病关系研究进展[J].食品科学, 2016, 37(13): 257-270.
LI Xingtai, ZHANG Chunying, ZHONG Weili, et al.Advances in generation of reactive oxygen species associated with health and diseases[J].Food Science, 2016, 37(13): 257-270.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201613046. http://www.spkx.net.cn
近年来,广泛的研究显示,体内产生的活性氧(reactive oxygen species,ROS),在不同的细胞信号传导通路中发挥重要作用。与慢性疾病(如癌症)有关的绝大多数危险因素,如应激、烟草、环境污染物、辐射、病毒感染、膳食和细菌感染,均通过ROS的产生与细胞相互作用。ROS又可激活各种转录因子,例如,B细胞的核因子κ-轻链增强子(nuclear factor-kappa B,NF-κB)、活化蛋白-1、缺氧诱导因子-1α及信号转导子与转录激活子3(signal transducer and activator of transcription 3,STAT3),导致调控炎症、细胞转化、肿瘤细胞存活、肿瘤细胞增殖与侵袭、血管生成和转移的蛋白的表达。矛盾的是,ROS还控制各种肿瘤抑制基因(p53、Rb和PTEN基因)的表达。类似地,γ辐射和各种化学治疗剂用于治疗癌症,是通过ROS的产生介导其效应。有趣的是,ROS也参与源自水果、蔬菜、香料、和传统医学使用的其他天然产物的营养保健品的化学预防和抗肿瘤作用[1-4]。ROS是细胞信号传导途径的组成部分,并已被证明能调节细胞转化、存活、增殖、侵袭、血管生成和转移。近年发现,ROS的形成参与了食品的氧化变质,以及100多种人类疾病[5],如严重威胁人类健康的重大疾病心血管疾病(高血压、动脉粥样硬化等)[6-8]、糖尿病[9]、慢性炎症、神经退行性疾病和癌症[10]的发病机制及免疫[11]和衰老过程[12]。
氧化应激被定义为ROS的产生与抗氧化防御之间的失衡。由于助氧化-抗氧化反应平衡状态的破坏,ROS过量引起氧化应激,促进活细胞中脂质、蛋白质、DNA和RNA的氧化损伤,抑制细胞的正常功能[13-14]。ROS生成与消除(由抗氧化酶和抗氧化剂)之间保持平衡(氧化还原平衡)对健康具有重要意义[15]。这意味着,过量的ROS造成机体损伤。然而,完全消除ROS会抑制机体适应性应答外部应激因素反应的能力[3]。在这个复杂的系统中,近年出现了一个新概念,ROS对能量平衡起关键作用。作为神经信号的ROS途径的损伤导致自主神经系统和神经内分泌功能的改变,导致代谢性疾病,如肥胖和2型糖尿病[16]。ROS相关疾病可以是由于缺乏ROS(如慢性肉芽肿病,某些自身免疫性疾病)或ROS过剩(如心血管疾病和神经退行性疾病)引起[17]。事实上,虽然长时间暴露于高浓度ROS可能会导致蛋白质、脂质、核酸的非特异性损伤,低到中浓度ROS却通过调节细胞信号级联发挥效应[17]。近几十年的研究已经凸显出ROS在健康和疾病中的重要性。鉴于此,本文综述了ROS的种类、机体内主要的ROS、ROS的生成与反应等研究进展,为促进健康、防治疾病及抗氧化研究提供参考。
1 ROS的概念、种类及生理病理多效性
1.1 氧的出现与需氧真核生物的进化
由于蓝藻的光合作用,大约22亿年前,氧(O2)最初大量出现在地球上。首先,大部分O2与可溶性铁(Fe)反应生成不溶性氧化矿物[18]。该初始事件后,O2开始大量积聚于周围的环境和大气中。大气中氧浓度的急剧增加及形成各种矿物氧化物被称为大氧合事件(Great Oxygenation Event)[19],O2的增加导致了地球第一次大规模物种灭绝,这一事件也被称为大氧灾难。事实上,O2对厌氧生物有剧毒,O2的损伤效应与其自由基特性有关,其耗竭必要的硫醇并使Fe-S聚簇(厌氧生物代谢和大分子结构的生物合成所需)解聚[20]。大约15亿年前,需氧α-变形菌被原始真核细胞共生吞噬后,演变为线粒体,线粒体已进化为具有多种细胞功能的特化细胞器。近年来,线粒体因作为具有明显自主性的动态细胞器,密切参与策划各种各样的细胞活动,而成为舞台中心。由于O2是线粒体电子传递系统中的最终电子受体,氧化是电子从一个原子到另一个原子的转移,并代表有氧生活及新陈代谢的必须部分,以ATP的形式产生能量。氧状态的波动,有助于增加ROS的生成,这可能对高能需求或含大量线粒体的组织,如胎盘、大脑、心脏和骨骼肌尤为相关[21]。
自由基是指“能够独立存在、含一个或多个未配对电子的任何物质”,一个未配对电子自身占据一个原子轨道[18],是极不稳定的分子。考虑到基态氧在其最外层反键轨道有两个未配对电子,因此可归类为自由基[22]。O2最外层轨道的两个孤对电子具有相同的自旋量子数,对接受电子产生自旋限制[23]。因此,当其被还原为水时,O2一次只能接受一个电子,便可以产生几种自由基中间产物,即超氧阴离子(O·)、过氧化氢(H2O2)和羟自由基(·OH)[24]。这也使O2变得危险,因为其单价还原导致高活性中间产物的生成(图1)。自由基是活性代谢物,可由外来物质生成。由于电子“喜欢”配对形成化学键,自由基不能与亲核试剂发生共价反应;相反,其与另一种自由基反应形成共价键,从中性分子抽去氢原子,以生成一种新的自由基,或抽去一个电子形成阴离子并产生自由基阳离子。自由基可发生在脂类、氨基酸、核苷酸和含氧化合物等中。氧自由基特别重要,因为可以触发所有其他自由基的形成[25-26]。有氧呼吸期间O2逐步还原为水。辐射诱导的水裂解产生·OH,这可解释辐射疗法的损伤效应[26]。

适应于氧化环境为生物提供了一个重要的选择优势,可使酶活性与氧的利用相偶联[20,27]。在需氧细胞中,O2被许多酶系统利用,然而O2却是有氧三磷酸腺苷(adenosine triphosphate,ATP)生成背后的主要驱动力。在需氧真核生物中,O2在营养物代谢中的利用最大化节约了能量,促使生物复杂性的增加,最终进化出人类[28-29]。需氧真核生物氧化磷酸化产生ATP是发生在线粒体,该双层膜细胞器起源于原核生物,含有O·依赖性ATP生成(从碳氧化)所需的必要酶系统[30-31]。
1.2 ROS的概念与机体内ROS的种类
ROS可被定义为含氧中间代谢物,带或不带一个未成对电子,包括氧自由基(即以氧为中心的自由基),如O·、·OH、烷氧自由基(RO·)、过氧自由基(ROO·)和一氧化氮(NO·),与非自由基,如H2O2、次氯酸(HOCl)和单线态氧(1O2),其能够氧化其他成分并将其转变成自由基,往往引起连锁反应,导致形成许多新的自由基[32-34]。·OH(半衰期10-9s)和RO·(半衰期数秒)非常活泼,并迅速攻击附近细胞的分子,虽经修复过程其所造成的损伤可能是不可避免的。另一方面,O·、脂质氢过氧化物和NO·的活性较低[35]。ROS由机体的正常耗氧如呼吸和一些细胞介导的免疫功能连续生成[36]。在体内可以形成的主要自由基包括相对稳定的自由基,如尿酸自由基(UrH·-)、抗坏血酸自由基(Asc·-)、VE自由基(VE·)与苯氧自由基(Phl·)和活性自由基,包括碳中心自由基(如脂质自由基(L·))和硫中心自由基(如谷胱甘肽自由基(GS·)),其中,在有氧介质中,可导致具有较高氧化电位物质(如脂质过氧自由基(LOO·)、脂质烷氧自由基(LO·)和硫自由基(GSOO·、GSO·和GSO2OO·))。自由基链反应通常会继续,直到系统变得厌氧或底物(如膜脂肪酸(LH))被耗尽,但当两个自由基形成非自由基产物或存在链断裂抗氧化剂(如VE和多酚类物质)时,链反应可被停止[33]。氧化剂和还原剂是化学术语,在生物环境中,其通常分别被称为“助氧化剂和抗氧化剂”[37]。助氧化剂,对各种生物靶如核酸、脂类和蛋白质,可诱导其氧化损伤的物质。另一方面,抗氧化剂,可以有效地还原助氧化剂,同时生成无毒性或低毒性产物的物质。人类生活在各种无处不在的环境应激剂中,其中包括紫外线辐射、微生物、过敏原和各种污染物,如增多的臭氧、香烟烟雾和多环芳烃,可以增加机体ROS的产生[38-40]。
1.3 ROS的生理病理多效性
值得注意的是,ROS是一柄双刃剑。ROS一直被视为有害分子,通过氧化损伤各种细胞内分子并负责衰老和各种人类疾病。然而,最近的研究揭示细胞中产生的ROS的另一面,作为第二信使介导生理胞内信号。ROS-效应器蛋白的进展性鉴定,揭示ROS在生理和病理细胞生物学中的多效性功能[41]。一方面,其具有重要的生理功能,例如,NO·是一种重要的血管保护因子和神经系统的神经递质[42],氧自由基是免疫防御,以及调节细胞生长和基因表达必需的[43]。但是,过多的自由基,则是有害的,因为自由基是细胞代谢产生的非常危险的副产物[44]。氧化失衡,即ROS的生成与抗氧化防御系统之间平衡的破坏,被描述为氧化应激状态[45],这会导致细胞损伤,引起功能与完整性的丧失。不良影响包括直接与ROS化学反应使NO·失活及细胞成分如DNA和蛋白质的氧化损伤[46-47]。这些影响可能参与大量病理状态的发展[12,48],包括心血管疾病、神经系统疾病、癌症和衰老过程[49-50]。
此外,在怀孕期间ROS生成的变化,强调了胎盘中氧化信号传导的重要性,在人类怀孕的早期阶段,胎盘循环的建立与胎盘内氧水平的剧增相关,导致ROS生成增加及氧化应激,随着胎龄增加,胎盘氧合作用的改变对胎盘发育产生影响[21]。因此,了解氧化应激如何影响胎盘内氧化还原敏感的转录因子可能阐明潜在的治疗靶点,纠正异常的胎盘血管生成及功能。
2 机体内主要的ROS
ROS是由分子氧还原产生的高反应性分子。最常见的ROS是O·、·OH、H2O2。这些ROS主要是由线粒体氧化磷酸化(电子沿呼吸链酶传递并泄漏给分子氧)生成的。生理水平的ROS参与细胞信号通路,这对发育和细胞功能尤为重要。
H2O2是由两个电子还原O2生成的,不是一种自由基,但却是氧化剂。在O2和过渡金属离子存在下,H2O2可通过Fenton反应生成·OH。H2O2在生物体中作为氧化代谢的副产物自然产生,这是非自由基反应性物质,并易于在活细胞之间扩散,可被过氧化氢酶(catalase,CAT)有效地转化为水,该过程决定其半衰期。一些证据表明,H2O2通过核因子κB和载脂蛋白-1的途径调节基因的表达参与信号转导[56-57]。
因此,重要的是存在不同营养物和氧化还原环境改变时,要客观评价线粒体如何产生O·/H2O2,考虑到线粒体ROS排放对细胞通讯很重要。线粒体中有11 个潜在的O·/H2O2生成底物,其中5 种,即复合体Ⅰ、Ⅱ、Ⅲ、α-酮戊二酸脱氢酶(2-oxoglutarate dehydrogenase,ODH)、丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)作为线粒体O·/H2O2的主要来源。其他6 种酶,分别是电子传递黄素蛋白氧化还原酶(electron transfer flavoprotein oxidoreductase,ETFQO)、二氢乳清酸脱氢酶(dihydroorotate dehydrogenase,DHODH)、脯氨酸脱氢酶(proline dehydrogenase,PRODH)、琥珀酸:醌还原酶(succinate:quinone reductase,SQR)、sn-甘油-3-磷酸脱氢酶(sn-glycerol-3-phosphate dehydrogenase,G3PDH)、支链酮酸脱氢酶(branched chain keto acid dehydrogenase),只能少量产生O·/H2O2,但当高浓度的抑制剂和底物存在时生成量可增加[26]。然而,最近研究显示,O·等ROS也可产生有益的效应,其通过作为(氧化还原)信号参与细胞调节,且其有害作用主要是由于信号传导受损的结果,而不是由于直接损伤敏感的靶标。有趣的是,ROS也可作为促存活信号增加寿命[10]。
2.2 ·OH
·OH是由3 个电子还原O2生成的,是氢氧根离子(OH-)的中性形式,是最活泼的自由基,估计半衰期约10-9s。其可能会在体内由高能量照射裂解体内水分形成或金属催化内源性H2O2的过程中形成。紫外线不足以将水裂解,但却可以分解H2O2,得到两分子的·OH。该自由基的高反应性暗示了在其产生的地方立即发生反应[58]。
2.3 NO·与ONOO
NO·是哺乳动物(包括人类)重要的细胞信号传导分子,参与许多生理和病理过程[59]。NO·是一种信使,由精氨酸在酶作用下生成,并松弛血管壁的平滑肌导致血压降低。其也被激活的巨噬细胞在免疫防御期间所产生,过量的NO·具有细胞毒性,其可能会直接与生物分子反应或与O·结合生成过氧亚硝酸盐(ONOO-)。ONOO-能够诱导脂蛋白的脂质过氧化(lipid peroxidation,LPO),但还可能通过硝化蛋白质酪氨酸残基干扰细胞信号传导[60-61]。
2.4 ROO·与RO·
过氧自由基(ROO·)寿命较长,在生物系统中具有相当长的扩散路径。其可以产生于LPO反应的过程中,该过程是由多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)抽去H原子而起始,·OH能够启动该序列反应[62-63]。LPO反应产生的进一步产物是烷氧自由基(RO·)和有机氢过氧化物(ROOH)。后者可能重新排列为内过氧化物中间产物,其裂解后产生醛类,醛与蛋白氨基反应作为一种机制参与脂蛋白中蛋白部分的修饰[58]。
3 ROS的生成
ROS由细胞内的多个室和多种酶生成,其中大多都位于线粒体环境(如呼吸链复合体),复合体Ⅰ、复合体Ⅱ、复合体Ⅲ、线粒体甘油磷酸脱氢酶(mitochondrial glycerophosphate dehydrogenase,mGPDH,位于α-酮戊二酸脱氢酶附近)、电子传递黄素蛋白(electron transfer flavoprotein,ETF)、ETF泛醌氧化还原酶、丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)、顺乌头酸酶、替代氧化酶(alternative oxidase,AO)、复合体Ⅳ、DHODH,外部NADH脱氢酶(external NADH dehydrogenase,NADHDH)、蛋白质p66Shc、细胞色素(cyt)b5还原酶、单胺氧化酶(monoamine oxidase,MAO)和一氧化氮合酶(nitricoxide synthase,NOS)。其他蛋白或细胞器也可以导致ROS的产生[64-66]。然而,每种酶的精确贡献尚不清楚。线粒体呼吸链复合体被视为主要生产者,特别是复合体Ⅰ酶的几个位点,复合体Ⅲ与辅酶Q相互作用的亚基和低底物条件下的复合体Ⅱ[66]。ROS产生位点还包括NADPH氧化酶、黄嘌呤氧化酶、过氧化物酶、细胞色素P450、各种胞质溶胶酶(如环氧合酶)、脂氧合酶、红细胞中的血红蛋白[9]等。虽然所有这些来源有助于总的氧化负担,约90%细胞中的ROS源自线粒体。作为主要的细胞ROS的来源,线粒体参与衰老和寿命的调控[67]。线粒体ROS的产生是氧化磷酸化(oxidative phophorylation,OXPHOS)的结果,该过程将利用NADH或黄素胺腺嘌呤二核苷酸(reduced flavin adenine dinuleotide,FADH2)的控制氧化产生跨线粒体内膜的质子位能,然后,该位能通过F1F0ATP酶磷酸化ADP。在沿细胞色素链数个部位,来自于NADH或FADH2的电子可以直接与氧或其他电子受体反应,产生自由基。
由于ROS生成的确切机制未知,我们可以构建一个可能全面描述线粒体ROS生成的简单关系。ROS的形成是环境氧浓度的函数[68],细胞和有机体应答高浓度氧可能意味着应激,以探讨衰老的作用机制。虽然一般认为,耗氧量增加使ROS产生增加,如果耗氧量增加相对于更高的组织氧分压或“位点”(即功能线粒体)的数量增加是次要的,这种正相关关系才是正确的。与此相反,在恒定的组织氧浓度及固定数量的线粒体条件下,耗氧量增加则有利于降低ROS水平。对细胞高氧的反应也支持细胞内氧化剂,至少是决定培养的哺乳动物细胞寿命一个重要的决定因素[69]。研究者已发现降低环境的氧浓度可以显著延长培养的原代细胞寿命[70]。增强抗氧化剂的水平可以实现类似的细胞寿命延长。比如,增加SOD水平可延长原代成纤维细胞的寿命,同时也降低端粒缩短速率[71]。线粒体通过产生过多的ROS(爆发)从而损伤细胞组分,而在再灌注损伤中发挥关键作用,并启动细胞死亡。再灌注ROS的“爆发”,导致线粒体结构和功能损伤,诱导细胞死亡信号传导,最终损伤组织[72]。
基于前期研究结果,有研究者提出总氧耗的约2%用于ROS生成[73]。该数值已被广泛引用,尽管事实上,这些早期研究中ROS的测定是在人工条件下。随后,在更符合生理条件下的研究中,该基础值降至约0.2%[74-75]。这种较低的数值并不意味着ROS的基础生成速率不重要,但确实提示,在大多数组织中线粒体ROS的负载可能不像一度被认为的那么严重[69]。
4 生成ROS的反应
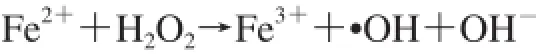
超氧化物作为还原剂,可以提供电子给Fe3+,经Haber-Weiss反应变成亚铁状态,因此驱动后续Fenton反应并增加·OH生成:

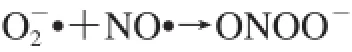
随后的PN分解导致形成额外的高反应性细胞毒自由基,包括二氧化氮(NO2·)和碳酸自由基(CO3·)。NO2·和CO3·是由PN质子化为过氧亚硝酸(ONOOH)或由PN与CO2反应以生成亚硝基过氧碳酸盐(ONOOCO2)而形成。单独分解ONOOH和ONOOCO2分别形成高活性的NO2·和·OH及NO2·和CO3·[76]。
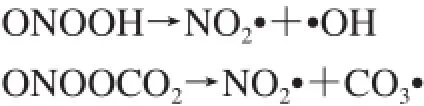
PN-衍生的自由基可诱导蛋白质、脂类(细胞膜和线粒体膜)和核酸的氧化损伤[60,77],例如,PN-衍生的NO2·诱导蛋白硝化导致结合蛋白的酪氨酸翻译后修饰为3-硝基酪氨酸(3-nitro tyrosine,3-NT),因此,3-NT作为ONOO-作用的生物标志物[78-79];此外,PN产物可以引发脂质过氧化(lipid peroxidation,LPO),进一步引起氧化和不可逆的细胞损伤。
根据其所处的环境超氧化物化学性质显著不同,在水溶液中,超氧化物是一种弱氧化剂和较强的还原剂,由于在水溶液中的歧化反应,超氧化物迅速消失,形成H2O2与 O2[80]:

H2O2是一种弱氧化剂和弱还原剂,且不存在过渡金属的情况下是相对稳定的。然而,超氧化物和H2O2本身的氧化毒性低,其均为净Haber-Weiss反应的组成部分,容易由铜或亚铁离子催化产生·OH:
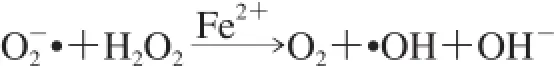
·OH非常活泼,其引起ROS对生物大分子产生的大部分损伤,生物·OH的主要来源是经Fenton反应(净Haber-Weiss反应的一半)由金属催化H2O2的分解[80]:Mn++ H2O2→M(n+1)++·OH+OH-。
由于其半衰期短,·OH攻击其生成部位附近的分子,由于具备非常高的反应性,使得其几乎不可能被清除。·OH与生物大分子的反应产生新的自由基,通常具有较低的活性。
5 ROS与线粒体氧化磷酸化(oxidative phophorylation,OXPHOS)
细胞的生死存亡很大程度上取决于线粒体的功能。大部分细胞ROS,作为呼吸链正常能量生成的副产物,是在线粒体生成。ROS主要在OXPHOS的呼吸态4生成,线粒体在呼吸态3向呼吸态4转换中,由于ADP耗尽,ATP积累,使O2消耗的主要途径被切断,导致O2浓度升高。而引起O2单电子还原的主要呼吸链成员都处于还原状态,高氧的环境和高还原态的呼吸链促使电子漏更易于生成O·。解偶联作用使线粒体内膜质子漏(proton leak)增加,线粒体膜电位(Δψm)降低,刺激O2的消耗,减少O·的生成,所以,解偶联抑制O2的单电子还原。解偶联蛋白作为线粒体ROS生成和生物能学调节器,腺苷酸激酶在哺乳动物雷帕霉素靶(mammalian target of rapamycin,mTOR,蛋白质合成的主要调节器)上游作为一种能量传感器[81]。转化生长因子-β(transforming growth factor-β,TGF-β)可激活mTOR途径,其在某种程度上,通过mTOR增加Δψm和耗氧速率,导致ROS生成增多而起作用,这可能导致足细胞损伤,TGF-β1可刺激培养的鼠足细胞线粒体OXPHOS 及ROS的生成[82]。当温和的解偶联不能阻止ROS的形成时,积累ROS将激活线粒体上非特异的线粒体通透性转换孔(mitochondrial permeability transition pore,MPTP)开放,过高的ROS持续积累导致MPTP的持续开放将引起细胞凋亡。
线粒体能量代谢,尤其是OXPHOS,受质子电化学梯度(由还原燃料的氧化和跨线粒体内膜的质子漏产生)严格控制。同样,线粒体ROS生成被描述为质子电化学梯度的直接函数,由经质子漏的温和解偶联所调控[83]。呼吸态3 H2O2的生成比呼吸态4低3~5 倍,这表明磷酸化线粒体H2O2生成比非磷酸化线粒体低几倍。呼吸态4高质子驱动力由于增加了超氧化物形成的概率,而对细胞可能是危险的[83]。ROS引起线粒体损伤时,影响线粒体呼吸链复合体的活力,降低线粒体的效能,从而影响线粒体OXPHOS,减少胞内ATP的合成,再经系列反应生成更多的ROS,使线粒体膜通透性增高,Δψm降低,从而形成ROS→线粒体损伤→ROS增多互为因果的恶性循环,损伤线粒体直至细胞功能受损甚至凋亡。线粒体ROS生成增加可导致ATP合成功能障碍[84]。由于降低的ADP可用性和增加的分子氧,在呼吸态4形成的超氧化物量增多(与呼吸态3相比),而解偶联可减少ROS的生成。低效线粒体呼吸条件下,由于复合体Ⅰ活性降低,ROS生成也可能增加[84]。
6 ROS与细胞凋亡
细胞凋亡对多细胞生物的组织分化、器官发育、维持机体稳态具有重要意义。ROS是细胞信号通路中的重要中介体,在维持胞内氧化还原平衡和细胞信号传导通路上发挥重要作用。ROS生成过多会引起细胞损伤,这可能作为信号触发凋亡信号转导途径,而在启动和调节细胞凋亡过程中扮演重要角色[85]。当凋亡启动后,ROS进一步增多可能加速凋亡过程。ROS的作用方式与其浓度相关,纳摩尔水平的ROS可促进细胞增殖,微摩尔水平的ROS可导致细胞凋亡,毫摩尔水平的ROS引起细胞的损伤死亡。细胞凋亡存在3 条途径:线粒体通路、内质网通路和死亡受体通路,均与ROS密切相关[86]。
线粒体既是ROS产生的主要部位,又是ROS作用的主要靶点。通过呼吸链电子漏途径,线粒体产生大量超氧阴离子,氧化应激可对膜磷脂和膜蛋白过氧化修饰,造成线粒体通透性转换(mitochondrial permeability transition,MPT),而引起线粒体损伤[87]。ROS激活MPTP开放,释放ROS、细胞色素c及凋亡诱导因子,从而使细胞进入不可逆的凋亡过程[88]。MPTP孔道持续不可逆地开放,引发线粒体内膜的通透性非特异地增大,内膜两侧的质子梯度消失,Δψm降低,呼吸链OXPHOS脱偶联,ATP合成受到抑制,ROS大量爆发[87]。
MPT是细胞凋亡的中心事件,可以通过MPTP开放介导,ROS通过降低Δψm及促使MPTP开放作为细胞凋亡信号分子。线粒体是影响细胞死亡和存活信号的一个关键集成点,其中OXPHOS系统中一个关键的电子载体——细胞色素c,从线粒体膜间隙释放到胞质溶胶,作为细胞凋亡的诱导事件。在某些情况下,这些事件的发生似乎需要OXPHOS系统的功能,而在其他情况下,OXPHOS功能障碍本身敏化细胞凋亡,甚至可直接诱导凋亡[89]。总之,机体95%以上的ROS都来自线粒体电子漏,ROS水平升高可诱发Δψm降低和细胞凋亡,ROS、MPT与细胞凋亡之间的关系既复杂又微妙且密不可分。
7 ROS与免疫防御和炎症
机体受细菌等致病微生物侵入后,通过先天性免疫和获得性免疫调动免疫效应细胞和免疫分子清除病原体。先天免疫系统遇到病原体引发急性炎症反应,伴随着全身性血管扩张,血管渗漏和白细胞迁移[90],从而在感染早期对机体进行免疫干预。先天免疫防御系统在进化过程中还形成了一套(100多种)模式识别受体(pattern recognition receptor,PRR)以识别各种入侵微生物(如病毒、细菌、真菌)的病原相关分子模式(pathogen associated molecular patterns,PAMP)的保守结构域,包括鞭毛蛋白、糖类和各种微生物的细胞壁成分,如肽聚糖和脂多糖(lipopolysaccharide,LPS),以及受伤细胞释放的危险相关分子模式,如哺乳动物双链DNA和尿酸结晶。PRR家族包括膜结合受体,如Toll样受体(toll-like receptor,TLR)和c-型凝集素受体,以及核苷酸寡聚区样受体(nucleotide-oligomerization domain-like receptors,NLR)和维甲酸诱导基因Ⅰ样受体(retinoic acid-inducible geneⅠ-like receptors,RLR)。PRR表达于多种免疫细胞,包括巨噬细胞、单核细胞、树突状细胞(dendritic cells,DCs),中性粒细胞,使早期检测病原体成为可能[91]。
通过抗原呈递细胞(巨噬细胞和树突状细胞)表面的PRR识别PAMP,诱导先天免疫反应,进行抗原呈递,募集并激活炎症效应细胞,释放炎症介质(如白细胞介素(interleukin,IL)-1、干扰素(interferon,IFN)α、IL-6、趋化因子)以及免疫效应因子(如IL-1、IL-5、IL-10、IL-12、转化生长因子(transforming growth factor,TGF)-β和IFNγ)等,同时激活获得性免疫。炎症是宿主对抗外来病原所产生的免疫防御应答,脊椎动物免疫系统已进化了这一生存策略以促进组织修复[92]。TLR家族是一类关键的病原PRR,通过识别自身及非自身分子模式调控先天免疫、抗原提呈和获得性免疫等多个免疫环节。大多数哺乳动物有10~14 种不同TLR,每一种识别不同的病原结构。例如,TLR2是一种靶向细菌细胞壁的脂蛋白,而TLR3识别病毒的双股RNA[93]。TLR4是其中重要成员之一,能够通过激活NADPH氧化酶在内的多个信号通路,上调TNF-α、IL-1、单核细胞趋化蛋白-1 (monocyte chemotactic protein-1,MCP-1)等炎症因子的分泌,在调节先天免疫和炎症反应方面起到举足轻重的作用。LPS是模式识别和促炎引发剂分子TLR4的微生物激活剂[94]。TLR4也是LPS的关键受体之一,LPS通过与TLR4结合后激活其下游信号通路,促进炎症因子释放,从而扩大炎症反应。
表达于上皮细胞以及吞噬细胞表面的PRR,如TLR家族的TLR1、2、4、5、6及CLR家族可识别细胞外病原体。而胞内微生物则由表达于细胞质内吞体或溶酶体的TLR3、7、8、9、10以及NLR和RLR识别[91]。吞噬细胞经过PRR识别入侵病原体的PAMP后,经由丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)、髓样分化因子88(myeloid differentiation factor 88, MyD88), Toll样受体结构域衔接蛋白(TLR adaptor molecule 1,TRIF)等通路激活NF-κB,分泌炎性细胞因子、趋化因子等募集血液循环中的单核细胞以及多形核中性粒细胞(polymorphonuclear neutrophils,PMN)至炎症部位,从而启动吞噬过程[95]。而ROS可激活单核细胞、巨噬细胞等多种免疫细胞释放大量炎性细胞因子(如TNF-α、IL-6等),引起全身炎症反应综合征。增加ROS的水平可以触发先天免疫,ROS与多种炎症应答相关[96],炎症反应也可以导致细胞凋亡或坏死[97]。
细胞凋亡信号调节激酶1(apoptosis signal-regulating kinase 1,ASK1),一种MAPK激酶(MAPK kinase kinase,MAP3K),在应激反应中扮演关键角色。此外,ASK1已成为PAMP和内源性危险信号引发的免疫应答的关键调节器。在免疫细胞中LPS-刺激的细胞因子生成及胞外ATP-诱导的细胞凋亡需要ROS依赖的ASK1激活。ASK1参与先天免疫的激活,而这又依赖于ROS[96]。ROS的生成是许多炎性疾病进程的核心。细胞产生的ROS参与寄主防御反应,如PMN,并通过关键细胞信号蛋白(如酪氨酸磷酸酶)的氧化,促进内皮功能障碍。ROS既是信号分子又作为炎症介质[92]。
氧化剂诱导炎症的作用一直被各种实验模型所大量研究。其从根本上参与应答已成共识,但其如何应答及抗氧化疗法是否是治疗炎症病人的有效手段仍悬而未决[92]。越来越多的证据表明,促进ROS的生成是TLR-介导的信号通路激活的中心。Ryan等[98]研究表明,ROS参与LPS/TLR4-介导的IL-8信号传导,抗氧化治疗减少LPS-诱导的人单核细胞中NF-κB的核易位及IL-8的生成。Park等[99]提出了TLR4调节ROS生成的直接机制。
炎症小体(inflammasome)是构成先天免疫系统的重要组成部分,这些新发现的多蛋白寡聚物平台是由胞内传感器(偶联胱冬肽酶)和白介素激活系统构成[100]。ROS是重要的炎症小体激活信号,ROS通过MAPK和胞外信号调节蛋白激酶1和2(extracellular signal-regulated protein kinases 1 and 2,ERK1/2)激活炎症小体,炎症小体的失调在各病理过程中起重要作用。病毒(如登革热和呼吸道合胞病毒)感染亦可激活炎症小体,矽肺和痛风发病过程中的晶体化合物也激发ROS的生成[100]。
炎症小体激活炎症诱导细胞发生炎性凋亡(pyroptosis),其为不同于细胞凋亡的程序性细胞死亡过程[101],且炎症小体的确切性质取决于活化剂。微生物或非微生物所致的组织损伤后,主要源于微生物的PAMP和损伤相关分子模式(damage-associated molecular patterns,DAMP)的释放是炎症小体两种常见的兴奋剂,以诱导促炎细胞因子的成熟[102]。Nod样受体蛋白(nod-like receptor protein,NLRP)3可能是研究最广泛的炎症小体,且被宿主源分子如过量的ATP、葡萄糖、ROS、鞘氨醇、神经酰胺、氧化型低密度脂蛋白、尿酸和胆固醇结晶所激活[103-107]。
很显然,ROS对炎症和组织损伤的发病机制很重要,但ROS在生理上如何发挥免疫防御功能及其引发炎症和组织损伤的机制还有待进一步研究。
8 ROS在肿瘤细胞中亦作为一柄双刃剑
生物体内存在着一套完善的氧化、抗氧化体系,正常情况下可将ROS维持在稳定范围内,并在抗炎、抗菌等方面发挥积极作用。当平衡打破,ROS持续升高,将可能促使细胞发生转化、导致恶性肿瘤的发生。尽管大多数研究主要集中在氧化应激参与癌症起始,ROS也作用于肿瘤转移并可能促进肿瘤侵袭与转移[108]。近年来ROS杀伤肿瘤细胞的作用也逐渐被认识。
ROS对调节正常细胞过程很重要,ROS过量或不足所致的氧化还原失衡是疾病发病机制的诱因,包括癌症的发生和进展,ROS与细胞氧化应激被认为是癌症发生的诱导物。然而,ROS与癌症的相关性既复杂,有时又矛盾[109]。ROS的形成对癌细胞的生长是必要且有益的事件,氧化还原失衡被认为可导致肿瘤细胞死亡[109]。ROS在调节细胞信号传导和体内平衡中有重要作用,ROS失衡会引起各种疾病(包括癌症)的发展。由于代谢加速,肿瘤细胞表现出增高的ROS水平(与正常细胞相比)[110],这使其更容易受到氧化应激诱导的细胞死亡,这也是其Achilles之踵(致命弱点)[111]。所以,进一步增加细胞的氧化应激已成为当前抗癌疗法的常见策略[111-112]。因为体内总氧化还原平衡是由ROS生成和清除之间的平衡来维持,特别是,增加ROS的产生或抑制ROS清除的外源性化合物,有利于癌细胞ROS的积累,从而引起细胞损伤,一旦达到“耐受”阈值甚至可诱导癌细胞死亡[113]。
Wang[114]和Laurent等[115]提出了一个新的假说,称为“ROS阈值概念”,进一步描述细胞内ROS在肿瘤细胞中的作用[116]。根据这一假说,细胞生存需要一定水平的ROS,但高浓度的ROS可以触发细胞死亡,且肿瘤细胞的ROS水平通常远远高于正常细胞。进一步增加ROS水平可使肿瘤细胞比正常细胞更早达到死亡阈值[117]。诱导ROS生成已成为癌症治疗一种新颖的方法[118-119]。这种策略激动人心的优势在于其良好的选择性,癌细胞通常处于氧化应激,且因此具有相对较高的ROS基础水平[113,120],肿瘤细胞ROS的轻微诱导可能推动ROS水平超过细胞死亡阈值,而正常细胞因为其较低的ROS基础水平和较强的抗氧化能力,可以更好地耐受氧化攻击[114,121]。
促进ROS生成的药物包括:1)线粒体电子传递链调节剂(如三氧化二砷、阿霉素、托泊替康等);2)氧化还原循环化合物(如莫特沙芬钆);3)破坏抗氧化防御机制的药物,如GSH-耗竭药物(如丁硫氨酸亚砜胺、β-苯乙基异硫氰酸酯(β-phenylethyl isothiocyanates,PEITC))、SOD抑制剂(如2-甲氧基雌二醇)和过氧化氢酶抑制剂(如3-氨基-1,2,4-三唑)[113,122-125]。3-甲基丙酮酸能激活人肺癌A549细胞和小鼠鳞状细胞癌SCCVII细胞线粒体能量代谢,细胞接触X射线后,用3-甲基丙酮酸预处理可显著促进这两个细胞系辐射诱导的细胞死亡,并导致Δψm的升高和线粒体源ROS的生成[117]。
综上,几乎所有肿瘤细胞均有一个共同点,氧化还原失衡、氧化应激水平增高,表现出ROS水平的升高和抗氧化酶活性的降低。ROS通过脂质过氧化、DNA损伤和蛋白质破坏等过程介入肿瘤的形成,并且在肿瘤的转移方面发挥重要的作用。细胞内ROS对恶性肿瘤的诱发和治疗具有双重作用,降低细胞中ROS的含量似乎可用于肿瘤的预防,而提高肿瘤细胞中ROS的含量似乎可用于肿瘤的治疗中,这将使ROS在肿瘤的防治中发挥更积极的作用。
随着对ROS生理功能了解的深入,且阈值理论正被实验,ROS不再仅仅被视为促肿瘤发生的分子。然而,促进ROS生成的策略对癌症治疗是否可行仍有待观察。诱导肿瘤细胞凋亡被认为是一个有效的抗癌策略,而肿瘤与正常细胞之间治疗的选择性始终是一个挑战。
增高的ROS水平和高糖酵解通量是肿瘤细胞的共同特征,这对癌症的发生和发展尤为重要。在有氧条件下,正常细胞主要通过OXPHOS产生ATP,缺氧时则主要依赖糖酵解;而肿瘤细胞即使在有氧条件下,也主要通过糖酵解产生ATP,因此称为“有氧糖酵解”(即Warburg效应),Warburg假设,肿瘤细胞以有氧糖酵解为主要产能方式是因为线粒体功能不可逆转的损伤(线粒体能量代谢缺陷)所致[126]。但目前认为,多数肿瘤的线粒体OXPHOS功能是完好的[127-128],并发现肿瘤细胞线粒体并没有缺陷[129-130],是由于糖酵解抑制了OXPHOS,而非线粒体功能出现不可逆转的损伤[131-132]。
与正常细胞的代谢相比,癌细胞经常发生如下代谢重新编程(癌细胞的代谢特征):癌细胞呈现增加的糖酵解、磷酸戊糖途径、谷氨酰胺消耗、合成代谢、Δψm和ROS的生成,以及降低的三羧酸循环通量、呼吸复合体活性、MPT和细胞凋亡[133]。可见,肿瘤细胞的代谢异常并非单一代谢通路的简单调整,而是整个细胞代谢网络颠覆性的改变,这也是癌邪峻烈难除的原因所在。
正常细胞与癌细胞之间线粒体功能的差异,可能为抗癌药物的设计提供独特的潜力,使药物靶向于线粒体以选择性杀死癌细胞。从癌症相关性线粒体异常的发现,到新颖的抗癌疗法临床探索的长期过程,表明癌症基本知识的积累最终产生医疗上可利用的信息是何等缓慢,成功地抗癌必须基于细胞能量代谢、线粒体的稳定性及肿瘤细胞对死亡刺激抗性的其他机制的协同调节。
9 结 语
近50多年来,ROS被视为有害物质,可以攻击蛋白质、脂质和核酸。为了应对ROS,线粒体进化了复杂的防御系统,以防止可能的伤害;ROS水平的增加可使防御系统受损,从而有助于阐明一些疾病的病理机制。然而,近年来,ROS对许多细胞信号通路的重要性已经被揭示,我们不应再将ROS只看作是线粒体呼吸的有毒副产物了[66]。ROS作为主要免疫防御的一部分在生物体产生,吞噬细胞如中性粒细胞、单核细胞或巨噬细胞通过合成大量的O·或NO·作为其杀伤机制的一部分抵御外来生物。一些疾病伴随着过多的巨噬细胞的激活导致组织损伤,至少部分是由于ROS的作用。而且,ROS生成过量诱导生物分子的氧化损伤,进而导致衰老、癌症和许多其他威胁人类健康的重大疾病[134]。此外,内源性ROS形成的生物途径是一整套反应中间物及其生成方式的实例。应当进一步指出,机体亦暴露于外源性ROS。在活生物体中,各种ROS可以以不同的方式生成。正常的有氧呼吸刺激多形核白细胞和巨噬细胞,及过氧化物酶体似乎是细胞产生氧化剂的主要内源性来源。外源性ROS来源包括烟草烟雾、某些污染物、有机溶剂和农药。许多助氧化剂性质的化合物,如苯醌具氧化还原循环能力,随膳食进入机体。一些自由基也随香烟烟雾吸入,据报道,因空气污染臭氧水平增加,臭氧是一种氧化脂质的ROS。
ROS,由于各种内源或外源因素产生于人体内。越来越多的证据表明,ROS,如ROO·、·OH、O·和1O2,都参与衰老和多种疾病,如癌症、阿尔茨海默病和帕金森病的病理生理学。ROS,通过UV光、X射线和γ射线在照射过程中产生,也是金属催化反应的产物;又在大气污染物中存在,嗜中性粒细胞和巨噬细胞在炎症过程中同样产生,还是线粒体催化的电子传递反应和其他机制的副产物。研究表明,α-生育酚保护角化细胞抵御紫外线A(ultraviolet A,UVA)辐射,可能是通过增加谷胱甘肽水平或减少脂质过氧化和ROS生成的水平[135]。胰岛素治疗可抑制ROS过度生成,从而缓解糖尿病条件下钛植入受损的骨生成(通过磷脂酰肌醇3-激酶/ Akt-依赖性机制),胰岛素的抗氧化与代谢特性应该使其成为一个可行的治疗选择以对抗糖尿病植入失败[136]。寻找有效的方法以减少或抑制自由基在体内的过量产生,对健康具有重要意义。
ROS作为信号分子在中枢神经系统,尤其是下丘脑,有强烈作用。由于下丘脑是参与体内能量平衡调控的一个关键区域,下丘脑ROS在能量代谢和食物摄入量调节中起重要作用[16]。能量代谢和食物摄入量是一个非常复杂的过程,它包括由下丘脑网络信号通路驱动的稳态机制。下丘脑ROS水平,由各种分子和燃料信号控制,在下丘脑控制能量平衡中扮演着重要角色。下丘脑ROS释放的控制涉及到许多分子事件,如线粒体动力学、NADPH氧化酶活性、突触弹性、过氧化物酶体和内质网。高水平ROS使缓冲机制饱和,可能启动神经元退化,并损伤体内能量平衡,导致疾病,如肥胖和2型糖尿病[16]。抑制与减少底物的量、低氧与高氧、或内源性与外源性应激均可增加ROS。因此,对于不同的机体生理状况或疾病状态一定存在多种机制并导致不同的答案。此外,对ROS的生成、来源及机制尚有待进一步充分研究。机体需要ROS是因为其保护最初的原核细胞在危险的环境中生存?或是基于某种目的而后发展起来的?机体如何影响ROS的生成水平?我们如何能从其外获得什么?由于诸多原因,开创了一个伟大的氧化还原生物学领域以进一步揭示其中的奥秘,并将为人类的健康做出贡献。
能量平衡是所有高等生物生存的主要决定因素,能量应激又可导致氧化应激。主要由线粒体ROS引起的蛋白质、核酸与脂质氧化,是决定健康和寿命的关键因素[137]。OXPHOS是线粒体一个关键的功能单位,并将电子传递与细胞呼吸和ATP的合成结合在一起,其不仅产生绝大部分细胞的能量,也参与了ROS的产生和细胞凋亡[138]。由线粒体的OXPHOS系统合成ATP是必需的以保持细胞活力,因为几乎所有的细胞内ATP都是在线粒体中生成,约1/3的细胞腺苷酸定位于该细胞器。因此,线粒体功能障碍具有多种功能后果,且发现于大多数的人类疾病[139-141],其特征是呼吸态3、呼吸控制率(respiratory control ratio,RCR)和Δψm降低,且呼吸态4和与氧化产物含量的增加相关的线粒体的大小和脆性增加。ROS介导的氧化是线粒体功能障碍和更替、细胞凋亡、组织功能及寿命的决定因素。线粒体不仅在生物能的供应和ROS的“调节器”中发挥了重要作用,而且还控制细胞的生和死。细胞缺乏能量、ROS生成过多、细胞凋亡的失调被单独或组合发现于大多数人类疾病,包括神经退行性疾病、中风、心脑血管疾病、缺血/再灌注损伤和癌症等。大量且还在不断增加的人类疾病都与OXPHOS功能障碍相关。所涉及的两个不同的关键因素是缺乏能量及ROS产生增加。由于细胞功能中OXPHOS的核心作用,其组件的活性不得不经过严密精细的调控,因为很显然要考虑发育和组织特异性的能量需求[142]。线粒体通过操纵生物能学、MPT和ROS等因素而调控细胞的生与死[143]。如何控制线粒体内ROS的生成并改善线粒体生物能学,防护线粒体损伤将成为研究者关注的热点。
综上,笔者认为,线粒体消耗人体约90%的氧,产生人体约90%的ROS和约90%的能量(ATP),线粒体控制细胞生死及整个生命过程(其本质就是氧化还原),线粒体成为生命的主宰。这一切也许最终是通过操纵ATP与ROS的生成实现的,而ATP与ROS的生成又主要是线粒体呼吸链氧化磷酸化的结果,如何通过调控线粒体氧化磷酸化实现ATP与ROS生成的平衡将是健康的关键。
参考文献:
[1] RAY P D, HUANG B W, TSUJI Y.Reactive oxygen species (ROS)homeostasis and redox regulation in cellular signaling[J].Cellular Signalling, 2012, 24(5): 981-990.DOI:10.1016/j.cellsig.2012.01.008.
[2] CORDEIRO R M.Reactive oxygen species at phospholipid bilayers: distribution, mobility and permeation[J].Biochimica et Biophysica Acta (BBA)-Biomembranes, 2014, 1838(1): 438-444.DOI:10.1016/ j.bbamem.2013.09.016.
[3] SCHMEIßER S, RISTOW M, BIRRINGER M.Recent reassessment of the role of reactive oxygen species (ROS)[J].Ernaehrungs Umschau International, 2013, 60(9): 162-167.
[4] GUPTA S C, HEVIA D, PATCHVA S, et al.Upsides and downsides of reactive oxygen species for cancer: the roles of reactive oxygen species in tumorigenesis, prevention, and therapy[J].Antioxidants & Redox Signaling, 2012, 16(11): 1295-1322.DOI:10.1089/ ars.2011.4414.
[5] FRANKEL E N, GERMAN J B.Antioxidants in foods and health: problems and fallacies in the field[J].Journal of the Science of Food and Agriculture, 2006, 86(13): 1999-2001.DOI:10.1002/jsfa.2616
[6] SANTOS C X C, NABEEBACCUS A A, SHAH A M, et al.Endoplasmic reticulum stress and Nox-mediated reactive oxygen species signaling in the peripheral vasculature: potential role in hypertension[J].Antioxidants & Redox Signaling, 2014, 20(1): 121-134.DOI:10.1089/ars.2013.5262.
[7] ZUO L, ROSE B A, ROBERTS W J, et al.Molecular characterization of reactive oxygen species in systemic and pulmonary hypertension[J].American Journal of Hypertension, 2014, 27(5): 643-650.DOI:10.1093/ajh/hpt292.
[8] GONCHAROV N V, AVDONIN P V, NADEEV A D, et al.Reactive oxygen species in pathogenesis of atherosclerosis[J].Current Pharmaceutical Design, 2015, 21(13): 1134-1146.DOI:10.2174/13816 12820666141014142557.
[9] FISHER-WELLMAN K, BELL H K, BLOOMER R J.Oxidative stress and antioxidant defense mechanisms linked to exercise during cardiopulmonary and metabolic disorders[J].Oxidative Medicine and Cellular Longevity, 2009, 2(1): 43-51.DOI:10.4161/oxim.2.1.7732.
[10] TAMURA M, MATSUI H, TOMITA T, et al.Mitochondrial reactive oxygen species accelerate gastric cancer cell invasion[J].Journal of Clinical Biochemistry and Nutrition, 2014, 54(1): 12-17.DOI:10.3164/ jcbn.13-36.
[11] NATHAN C, CUNNINGHAM-BUSSEL A.Beyond oxidative stress: an immunologist's guide to reactive oxygen species[J].Nature Reviews Immunology, 2013, 13(5): 349-361.DOI:10.1038/nri3423.
[12] LIOCHEV S I.Reactive oxygen species and the free radical theory of aging[J].Free Radical Biology and Medicine, 2013, 60(10): 1-4.DOI:10.1016/j.freeradbiomed.2013.02.011.
[13] GÜLÇIN İ, ELIAS R, GEPDIREMEN A, et al.Antioxidant activity of bisbenzylisoquinoline alkaloids from Stephania rotunda: cepharanthine and fangchinoline[J].Journal of Enzyme Inhibition and Medicinal Chemistry, 2010, 25(1): 44-53.DOI:10.3109/14756360902932792.
[14] GÜLÇIN İ, ELMASTAŞ M, ABOUL-ENEIN H Y.Antioxidant activity of clove oil:a powerful antioxidant source[J].Arabian Journal of Chemistry, 2012, 5(4): 489-499.DOI:10.1016/j.arabjc.2010.09.016.
[15] 李兴太, 纪莹.线粒体氧化应激与天然抗氧化剂研究进展[J].食品科学, 2015, 36(7): 268-277.DOI:10.7506/spkx1002-6630-201507049.
[16] DROUGARD A, FOURNEL A, VALET P, et al.Impact of hypothalamic reactive oxygen species in the regulation of energy metabolism and food intake[J].Frontiers in Neuroscience, 2015, 9: 1-12.DOI:10.3389/fnins.2015.00056.
[17] BRIEGER K, SCHIAVONE S, MILLER F J, Jr, et al.Reactive oxygen species: from health to disease[J].Swiss Medical Weekly,2012, 142: w13659.DOI:10.4414/smw.2012.13659.
[18] HALLIWELL B.Reactive species and antioxidants.Redox biology is a fundamental theme of aerobic life[J].Plant Physiology, 2006, 141(2): 312-322.DOI:10.1104/pp.106.077073.
[19] CROWE S A, DØSSING L N, BEUKES N J, et al.Atmospheric oxygenation three billion years ago[J].Nature, 2013, 501: 535-538.DOI:10.1038/nature12426.
[20] ILBERT M, BONNEFOY V.Insight into the evolution of the iron oxidation pathways[J].Biochimica et Biophysica Acta, 2013, 1827(2): 161-175.DOI:10.1016/j.bbabio.2012.10.001.
[21] PEREIRA R D, de LONG N E, WANG R C, et al.Angiogenesis in the placenta: the role of reactive oxygen species signaling[J].Biomed Research International, 2015, 2015: 814543.DOI:10.1155/2015/814543.
[22] MURPHY M P.How mitochondria produce reactive oxygen species[J].Biochemical Journal, 2009, 417(1): 1-13.DOI:10.1042/BJ20081386.
[23] GILL S S, TUTEJA N.Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J].Plant Physiology and Biochemistry, 2010, 48(12): 909-930.DOI:10.1016/ j.plaphy.2010.08.016.
[24] MAILLOUX R J, JIN X, WILLMORE W G.Redox regulation of mitochondrial function with emphasis on cysteine oxidation reactions[J].Redox Biology, 2014, 2(1): 123-139.DOI:10.1016/ j.redox.2013.12.011.
[25] ATTIA S M.Deleterious effects of reactive metabolites[J].Oxidative Medicine and Cellular Longevity, 2010, 3(4): 238-253.DOI:10.4161/ oxim.3.4.13246.
[26] MAILLOUX R J.Teaching the fundamentals of electron transfer reactions in mitochondria and the production and detection of reactive oxygen species[J].Redox Biology, 2015, 4: 381-398.DOI:10.1016/ j.redox.2015.02.001.
[27] HAREL A, BROMBERG Y, FALKOWSKI P G, et al.Evolutionary history of redox metal-binding domains across the tree of life[J].Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(19): 7042-7047.DOI:10.1073/ pnas.1403676111.
[28] LANE N.Bioenergetic constraints on the evolution of complex life[J].Cold Spring Harbor Perspectives in Biology, 2014, 6: a015982.DOI:10.1101/cshperspect.a015982.
[29] WALLACE D C.Colloquium paper: bioenergetics, the origins of complexity, and the ascent of man[J].Proceedings of the National Academy of Sciences of the United States of America, 2010,107(Suppl 2): 8947-8953.DOI:10.1073/pnas.0914635107.
[30] FERNIE A R, CARRARI F, SWEETLOVE L J.Respiratory metabolism: glycolysis, the TCA cycle and mitochondrial electron transport[J].Current Opinion in Plant Biology, 2004, 7(3): 254-261.DOI:10.1016/j.pbi.2004.03.007.
[31] LANE N, MARTIN W.The energetics of genome complexity[J].Nature, 2010, 467: 929-934.DOI:10.1038/nature09486.
[32] RAMMAL H, BOUAYED J, SOULIMANI R.A direct relationship between aggressive behavior in the resident/intruder test and cell oxidative status in adult male mice[J].European Journal of Pharmacology, 2010,627(1): 173-176.DOI:10.1016/j.ejphar.2009.11.001.
[33] VALKO M, LEIBFRITZ D, MONCOL J, et al.Free radicals and antioxidants in normal physiological functions and human disease[J].The International Journal of Biochemistry & Cell Biology, 2007,39(1): 44-84.DOI:10.1016/j.biocel.2006.07.001.
[34] BOUAYED J, BOHN T.Exogenous antioxidants: double-edged swords in cellular redox state: health beneficial effects at physiologic doses versus deleterious effects at high doses[J].Oxidative Medicine and Cellular Longevity, 2010, 3(4): 228-237.DOI:10.4161/oxim.3.4.12858.
[35] AMES B N, SHIGENAGA M K, HAGEN T M.Oxidants,antioxidants, and the degenerative diseases of aging[J].Proceedings of the National Academy of Sciences of the United States of America,1993, 90(17): 7915-7922.DOI:10.1073/pnas.90.17.7915.
[36] GÜLÇIN İ.Antioxidant and antiradical activities of L-carnitine[J].Life Sciences, 2006, 78(8): 803-811.DOI:10.1016/j.lfs.2005.05.103.
[37] CAO G, PRIOR R L.Comparison of different analytical methods for assessing total antioxidant capacity of human serum[J].Clinical Chemistry, 1998, 44(6): 1309-1315.
[38] SPLETTSTOESSER W D, SCHUFF-WERNER P.Oxidative stress in phagocytes: “the enemy within”[J].Microscopy Research and Technique, 2002, 57(6): 441-455.DOI:10.1002/jemt.10098.
[39] SAUNDERS C R, DAS S K, RAMESH A, et al.Benzo(a)pyrene-induced acute neurotoxicity in the F-344 rat: role of oxidative stress[J].Journal of Applied Toxicology, 2006, 26(5): 427-438.DOI:10.1002/jat.1157.
[40] MAIESE K.Environmental stimulus package: potential for a rising oxidative deficit[J].Oxidative Medicine and Cellular Longevity, 2009,2(4): 179-180.DOI:10.4161/oxim.2.4.9733.
[41] MIKI H, FUNATO Y.Regulation of intracellular signalling through cysteine oxidation by reactive oxygen species[J].Journal of Biochemistry, 2012, 151(3): 255-261.DOI:10.1093/jb/mvs006.
[42] VANHOUTTE P M.How we learned to say NO[J].Arteriosclerosis,Thrombosis, and Vascular Biology, 2009, 29(8): 1156-1160.DOI:10.1161/ATVBAHA.109.190215.
[43] BEDARD K, KRAUSE K H.The NOX family of ROS-generating NADPH oxidases: physiology and pathophysiology[J].Physiological Reviews, 2007, 87(1): 245-313.DOI:10.1152/physrev.00044.2005.
[44] WINGLER K, SCHMIDT H.Good stress, bad stress: the delicate balance in the vasculature[J].Deutsches Arzteblatt International, 2009,106(42): 677-684.
[45] GUTTERIDGE J, HALLIWELL B.Antioxidants: molecules,medicines, and myths[J].Biochemical and Biophysical Research Communications, 2010, 393(4): 561-564.DOI:10.1016/ j.bbrc.2010.02.071.
[46] BECKMAN J S.Understanding peroxynitrite biochemistry and its potential for treating human diseases[J].Archives of Biochemistry and Biophysics, 2009, 484(2): 114-116.DOI:10.1016/j.abb.2009.03.013.
[47] MCNALLY J S, DAVIS M E, GIDDENS D P, et al.Role of xanthine oxidoreductase and NAD(P)H oxidase in endothelial superoxide production in response to oscillatory shear stress[J].American Journal of Physiology-Heart and Circulatory Physiology, 2003, 285(6): H2290-H2297.DOI:10.1152/ajpheart.00515.2003.
[48] DALLE-DONNE I, ROSSI R, COLOMBO R, et al.Biomarkers of oxidative damage in human disease[J].Clinical Chemistry, 2006,52(4): 601-623.DOI:10.1373/clinchem.2005.061408.
[49] AFANAS'EV I.Reactive oxygen species and age-related genes p66shc,Sirtuin, FOXO3 and Klotho in senescence[J].Oxidative Medicine and Cellular Longevity, 2010, 3(2): 77-85.DOI:10.4161/oxim.3.2.11050.
[50] ESSICK E E, SAM F.Oxidative stress and autophagy in cardiac disease, neurological disorders, aging and cancer[J].Oxidative Medicine and Cellular Longevity, 2010, 3(3): 168-177.DOI:10.4161/ oxim.3.3.12106.
[51] FRIDOVICH I.Superoxide dismutases[J].Advances in Enzymology & Related Areas of Molecular Biology, 1986, 58(6): 61-97.DOI:10.1002/9780470123041.ch2.
[52] HALLIWELL B.Commentary oxidative stress, nutrition and health.experimental strategies for optimization of nutritional antioxidant intake in humans[J].Free Radical Research, 1996, 25(1): 57-74.DOI:10.3109/10715769609145656.
[53] KINUTA Y, KIMURA M, ITOKAWA Y, et al.Changes in xanthine oxidase in ischemic rat brain[J].Journal of Neurosurgery, 1989, 71(3): 417-420.DOI:10.3171/jns.1989.71.3.0417.
[54] LIPTON P.Ischemic cell death in brain neurons[J].Physiological Reviews, 1999, 79(4): 1431-1568.
[55] HALLIWELL B.Oxidative stress and neurodegeneration: where are we now?[J].Journal of Neurochemistry, 2006, 97(6): 1634-1658.DOI:10.1111/j.1471-4159.2006.03907.x.
[56] SCHRECK R, BAEUERLE P A.Assessing oxygen radicals as mediators in activation of inducible eukaryotic transcription factor NF-кB[J].Methods in Enzymology, 1994, 234(1): 151-163.DOI:10.1016/0076-6879(94)34085-4.
[57] SEN C K, PACKER L.Antioxidant and redox regulation of gene transcription[J].The FASEB Journal, 1996, 10(7): 709-720.
[58] DIPLOCK A T, CHARLEUX J L, CROZIER-WILLI G, et al.Functional food science and defence against reactive oxidative species[J].British Journal of Nutrition, 1998, 80(Suppl 1): 77-112.DOI:10.1079/BJN19980106.
[59] HOU Y C, JANCZUK A, WANG P G.Current trends in the development of nitric oxide donors[J].Current Pharmaceutical Design, 1999, 5(6): 417-441.
[60] BECKMAN J S.Oxidative damage and tyrosine nitration from peroxynitrite[J].Chemical Research in Toxicology, 1996, 9(5): 836-844.DOI:10.1021/tx9501445.
[61] PACKER L.Nitric oxide.Part A: sources and detection of NO; NO synthase[J].Methods in Enzymology, 1996, 268: 331-340.
[62] ESTERBAUER H, GEBICKI J, PUHL H, et al.The role of lipid peroxidation and antioxidants in oxidative modification of LDL[J].Free Radical Biology and Medicine, 1992, 13(4): 341-390.DOI:10.1016/0891-5849(92)90181-F.
[63] REAVEN P D, WITZTUM J L.Oxidized low density lipoproteins in atherogenesis: role of dietary modification[J].Annual Review of Nutrition, 1996, 16(1): 51-71.DOI:10.1146/annurev.nu.16.070196.000411.
[64] VENDITTI P, di STEFANO L, di MEO S.Mitochondrial metabolism of reactive oxygen species[J].Mitochondrion, 2013, 13(2): 71-82.DOI:10.1016/j.mito.2013.01.008.
[65] QUINLAN C L, ORR A L, PEREVOSHCHIKOVA I V, et al.Mitochondrial complex Ⅱ can generate reactive oxygen species at high rates in both the forward and reverse reactions[J].Journal of Biological Chemistry, 2012, 287(32): 27255-27264.DOI:10.1074/jbc.M112.374629.
[66] HOLZEROVÁ E, PROKISCH H.Mitochondria: Much ado about nothing? How dangerous is reactive oxygen species production?[J].International Journal of Biochemistry & Cell Biology, 2015, 63:16-20.DOI:10.1016/j.biocel.2015.01.021.
[67] QUINLAN C L, PEREVOSHCHIKOVA I V, HEY-MOGENSEN M,et al.Sites of reactive oxygen species generation by mitochondria oxidizing different substrates[J].Redox Biology, 2013, 1(1): 304-312.DOI:10.1016/j.redox.2013.04.005.
[68] TURRENS J F.Mitochondrial formation of reactive oxygen species[J].The Journal of Physiology, 2003, 552(2): 335-344.DOI:10.1113/ jphysiol.2003.049478.
[69] BALABAN R S, NEMOTO S, FINKEL T.Mitochondria, oxidants, and aging[J].Cell, 2005, 120(4): 483-495.DOI:10.1016/j.cell.2005.02.001.
[70] PACKER L, FUEHR K.Low oxygen concentration extends the lifespan of cultured human diploid cells[J].Nature, 1977, 267: 423-425.DOI:10.1038/267423a0.
[71] SERRA V, von ZGLINICKI T, LORENZ M, et al.Extracellular superoxide dismutase is a major antioxidant in human fibroblasts and slows telomere shortening[J].Journal of Biological Chemistry, 2003,278(9): 6824-6830.DOI:10.1074/jbc.M207939200.
[72] SANDERSON T H, REYNOLDS C A, KUMAR R, et al.Molecular mechanisms of ischemia-reperfusion injury in brain: pivotal role of the mitochondrial membrane potential in reactive oxygen species generation[J].Molecular Neurobiology, 2013, 47(1): 9-23.DOI:10.1007/s12035-012-8344-z.
[73] CHANCE B, SIES H, BOVERIS A.Hydroperoxide metabolism in mammalian organs[J].Physiological Reviews, 1979, 59(3): 527-605.
[74] STANIEK K, NOHL H.Are mitochondria a permanent source of reactive oxygen species?[J].Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2000, 1460(2): 268-275.DOI:10.1016/S0005-2728(00)00152-3.
[75] ST-PIERRE J, BUCKINGHAM J A, ROEBUCK S J, et al.Topology of superoxide production from different sites in the mitochondrial electron transport chain[J].Journal of Biological Chemistry, 2002,277(47): 44784-44790.DOI:10.1074/jbc.M207217200.
[76] BAINS M, HALL E D.Antioxidant therapies in traumatic brain and spinal cord injury[J].Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease, 2012, 1822(5): 675-684.DOI:10.1016/ j.bbadis.2011.10.017.
[77] RADI R.Peroxynitrite reactions and diffusion in biology[J].Chemical Research in Toxicology, 1998, 11(7): 720-721.DOI:10.1021/ tx980096z.
[78] HALL E D, OOSTVEEN J A, ANDRUS P K, et al.Immunocytochemical method for investigating in vivo neuronal oxygen radical-induced lipid peroxidation[J].Journal of Neuroscience Methods, 1997, 76(2): 115-122.DOI:10.1016/S0165-0270(97)00089-7.
[79] DENG Y, THOMPSON B M, GAO X, et al.Temporal relationship of peroxynitrite-induced oxidative damage, calpain-mediated cytoskeletal degradation and neuro-degeneration after traumatic brain injury[J].Experimental Neurology, 2007, 205: 154-165.DOI:10.1016/ j.expneurol.2007.01.023.
[80] KRIVORUCHKO A, STOREY K B.Forever young: mechanisms of natural anoxia tolerance and potential links to longevity[J].Oxidative Medicine and Cellular Longevity, 2010, 3(3): 186-198.DOI:10.4161/ oxim.3.3.12356.
[81] PUNG Y F.Mitochondria in cardiovascular physiology and disease: the role of mitochondrial bioenergetics and reactive oxygen species in coronary collateral growth[J].American Journal of Physiology-Heart and Circulatory Physiology, 2013, 305(9): H1275-H1280.DOI:10.1152/ajpheart.00077.2013.
[82] ABE Y, SAKAIRI T, BEESON C, et al.TGF-β1 stimulates mitochondrial oxidative phosphorylation and generation of reactive oxygen species in cultured mouse podocytes, mediated in part by the mTOR pathway[J].American Journal of Physiology-Renal Physiology,2013, 305(10): F1477-F1490.DOI:10.1152/ajprenal.00182.2013.
[83] JARMUSZKIEWICZ W, WOYDA-PLOSZCZYCA A, KOZIEL A,et al.Temperature controls the oxidative phosphorylation and reactive oxygen species production through uncoupling in rat skeletal muscle mitochondria[J].Free Radical Biology & Medicine, 2015, 83: 12-20.DOI:10.1016/j.freeradbiomed.2015.02.012.
[84] SHEERAN F L, PEPE S.Energy deficiency in the failing heart: linking increased reactive oxygen species and disruption of oxidative phosphorylation rate[J].Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2006, 1757(5): 543-552.DOI:10.1016/ j.bbabio.2006.03.008.
[85] 赵云罡, 徐建兴.线粒体, 活性氧和细胞凋亡[J].生物化学与生物物理进展, 2001, 28(2): 168-171.DOI:10.3321/ j.issn:1000-3282.2001.02.010.
[86] 刘卉, 刘延香.细胞凋亡与活性氧[J].现代肿瘤医学, 2008, 16(10): 1830-1832.DOI:10.3969/j.issn.1672-4992.2008.10.077.
[87] 马淇, 刘垒, 陈佺.活性氧、线粒体通透性转换与细胞凋亡[J].生物物理学报, 2012, 28(7): 523-536.
[88] 魏燕, 辛晓燕.活性氧调控的细胞凋亡信号[J].现代肿瘤医学, 2011,19(2): 371-373.DOI:10.3969/j.issn.1672-4992.2010.02.62.
[89] 李兴太, 刘德文, 张新, 等.线粒体通透性转换与细胞凋亡[J].中国公共卫生, 2015, 31(4): 529-532.DOI:10.11847/zgggws2015-31-04-45.
[90] CLARK R, KUPPER T.Old meets new: the interaction between innate and adaptive immunity[J].Journal of Investigative Dermatology, 2005,125(4): 629-637.DOI:10.1111/j.0022-202X.2005.23856.x.
[91] TAKEUCHI O, AKIRA S.Pattern recognition receptors and inflammation[J].Cell, 2010, 140(6): 805-820.DOI:10.1016/ j.cell.2010.01.022.
[92] MITTAL M, SIDDIQUI M R, TRAN K, et al.Reactive oxygen species in inflammation and tissue injury[J].Antioxidants & Redox Signaling, 2014, 20(7): 1126-1167.DOI:10.1089/ars.2012.5149.
[93] WALMSLEY S R, McGOVERN N N, WHYTE M K B, et al.The HIF/VHL pathway: from oxygen sensing to innate immunity[J].American Journal of Respiratory Cell and Molecular Biology, 2008,38(3): 251-255.DOI:10.1165/rcmb.2007-0331TR.
[94] PÅLSSON-MCDERMOTT E M, O'NEILL L A J.Signal transduction by the lipopolysaccharide receptor, Toll-like receptor-4[J].Immunology, 2004, 113(2): 153-162.DOI:10.1111/j.1365-2567.2004.01976.x.
[95] 朱莹, 叶嘉, 李强.下呼吸道固有免疫防御系统与下呼吸道感染[J].中国实用内科杂志, 2015, 35(5): 455-458.
[96] YAMAUCHI S, NOGUCHI T, ICHIJO H.Molecular mechanism of reactive oxygen species-dependent ASK1 activation in innate immunity[J].Immune Network, 2008, 8(1): 1-6.DOI:10.4110/ in.2008.8.1.1.
[97] XU J, LUPU F, ESMON C T.Inflammation, innate immunity and blood coagulation[J].Hamostaseologie, 2010, 30(1): 5-6; 8-9.
[98] RYAN K A, SMITH M F, SANDERS M K, et al.Reactive oxygen and nitrogen species differentially regulate Toll-like receptor 4-mediated activation of NF-κB and interleukin-8 expression[J].Infection and Immunity, 2004, 72(4): 2123-2130.DOI:10.1128/iai.72.4.2123-2130.2004.
[99] PARK H S, JUNG H Y, PARK E Y, et al.Cutting edge: direct interaction of TLR4 with NAD(P)H oxidase 4 isozyme is essential for lipopolysaccharide-induced production of reactive oxygen species and activation of NF-κB[J].The Journal of Immunology, 2004, 173(6): 3589-3593.DOI:10.4049/jimmunol.173.6.3589.
[100] HARIJITH A, EBENEZER D L, NATARAJAN V.Reactive oxygen species at the crossroads of inflammasome and inflammation[J].Frontiers in Physiology, 2014, 5: 352.DOI:10.3389/fphys.2014.00352.
[101] FINK S L, COOKSON B T.Apoptosis, pyroptosis, and necrosis: mechanistic description of dead and dying eukaryotic cells[J].Infection and Immunity,2005, 73(4): 1907-1916.DOI:10.1128/iai.73.4.1907-1916.2005.
[102] SAVAGE C D, LOPEZ-CASTEJON G, DENES A, et al.NLRP3-inflammasome activating DAMPs stimulate an inflammatory response in glia in the absence of priming which contributes to brain inflammation after injury[J].Frontiers in Immunology, 2012, 3: 288.DOI:10.3389/fimmu.2012.00288.
[103] DUEWELL P, KONO H, RAYNER K J, et al.NLRP3 inflammasomes are required for atherogenesis and activated by cholesterol crystals[J].Nature, 2010, 464: 1357-1361.DOI:10.1038/nature08938.
[104] JIANG Y, WANG M, HUANG K, et al.Oxidized low-density lipoprotein induces secretion of interleukin-1β by macrophages via reactive oxygen species-dependent NLRP3 inflammasome activation[J].Biochemical and Biophysical Research Communications,2012, 425(2): 121-126.DOI:10.1016/j.bbrc.2012.07.011.
[105] LUHESHI N M, GILES J A, LOPEZ-CASTEJON G, et al.Sphingosine regulates the NLRP3-inflammasome and IL-1β release from macrophages[J].European Journal of Immunology, 2012, 42(3): 716-725.DOI:10.1002/eji.201142079.
[106] BANDYOPADHYAY S, LANE T, VENUGOPAL R, et al.MicroRNA-133a-1 regulates inflammasome activation through uncoupling protein-2[J].Biochemical and Biophysical Research Communications, 2013, 439(3): 407-412.DOI:10.1016/ j.bbrc.2013.08.056.
[107] FUKUMOTO J, FUKUMOTO I, PARTHASARATHY P T, et al.NLRP3 deletion protects from hyperoxia-induced acute lung injury[J].American Journal of Physiology-Cell Physiology, 2013, 305(2): C182-C189.DOI:10.1152/ajpcell.00086.2013.
[108] SCIOR T, ALEXANDER C, ZAEHRINGER U.Reviewing and identifying amino acids of human, murine, canine and equine TLR4/ MD-2 receptor complexes conferring endotoxic innate immunity activation by LPS/lipid A, or antagonistic effects by Eritoran,in contrast to species-dependent modulation by lipid IVa[J].Computational & Structural Biotechnology Journal, 2013, 5(6): 1-13.DOI:10.5936/csbj.201302012.
[109] LIN B, TAN X, LIANG J, et al.A reduction in reactive oxygen species contributes to dihydromyricetin-induced apoptosis in human hepatocellular carcinoma cells[J].Scientific Reports, 2014, 4: 7041.DOI:10.1038/srep07041.
[110] JUNG K H, LEE J H, QUACH C H T, et al.Resveratrol suppresses cancer cell glucose uptake by targeting reactive oxygen speciesmediated hypoxia-inducible factor-1α activation[J].Journal of Nuclear Medicine, 2013, 54(12): 2161-2167.DOI:10.2967/ jnumed.112.115436.
[111] NOGUEIRA V, HAY N.Molecular pathways: reactive oxygen species homeostasis in cancer cells and implications for cancer therapy[J].Clinical Cancer Research, 2013, 19(16): 4309-4314.DOI:10.1158/1078-0432.CCR-12-1424.
[112] WEIDNER C, ROUSSEAU M, PLAUTH A, et al.Melissa officinalis extract induces apoptosis and inhibits proliferation in colon cancer cells through formation of reactive oxygen species[J].Phytomedicine,2015, 22(2): 262-270.DOI:10.1016/j.phymed.2014.12.008.
[113] TRACHOOTHAM D, ALEXANDRE J, HUANG P.Targeting cancer cells by ROS-mediated mechanisms: a radical therapeutic approach?[J].Nature Reviews Drug Discovery, 2009, 8(7): 579-591.DOI:10.1038/nrd2803.
[114] WANG J, YI J.Cancer cell killing via ROS: to increase or decrease, that is the question[J].Cancer Biology & Therapy, 2008, 7(12): 1875-1884.DOI:10.4161/cbt.7.12.7067.
[115] LAURENT A, NICCO C, CHÉREAU C, et al.Controlling tumor growth by modulating endogenous production of reactive oxygen species[J].Cancer Research, 2005, 65(3): 948-956.
[116] BENHAR M, ENGELBERG D, LEVITZKI A.ROS, stress-activated kinases and stress signaling in cancer[J].EMBO Reports, 2002, 3(5): 420-425.DOI:10.1093/embo-reports/kvf094.
[117] NISHIDA N, YASUI H, NAGANE M, et al.3-Methyl pyruvate enhances radiosensitivity through increasing mitochondria-derived reactive oxygen species in tumor cell lines[J].Journal of Radiation Research, 2014, 55(3): 455-463.DOI:10.1093/jrr/rrt142.
[118] CERNA D, LI H, FLAHERTY S, et al.Inhibition of nicotinamide phosphoribosyltransferase (NAMPT) activity by small molecule GMX1778 regulates reactive oxygen species (ROS)-mediated cytotoxicity in a p53- and nicotinic acid phosphoribosyltransferase1 (NAPRT1)-dependent manner[J].Journal of Biological Chemistry,2012, 287(26): 22408-22417.DOI:10.1074/jbc.m112.357301.
[119] WATSON J.Oxidants, antioxidants and the current incurability of metastatic cancers[J].Open Biology, 2013, 3(1): 120144.DOI:10.1098/rsob.120144.
[120] MAO L, WERTZLER K J, MALONEY S C, et al.HMGA1 levels influence mitochondrial function and mitochondrial DNA repair efficiency[J].Molecular and Cellular Biology, 2009, 29(20): 5426-5440.DOI:10.1128/MCB.00105-09.
[121] SUN X, AI M, WANG Y, et al.Selective induction of tumor cell apoptosis by a novel P450-mediated reactive oxygen species (ROS) inducer methyl 3-(4-nitrophenyl) propiolate[J].Journal of Biological Chemistry, 2013, 288(13): 8826-8837.DOI:10.1074/jbc.M112.429316.
[122] TRACHOOTHAM D, ZHOU Y, ZHANG H, et al.Selective killing of oncogenically transformed cells through a ROS-mediated mechanism by β-phenylethyl isothiocyanate[J].Cancer Cell, 2006, 10(3): 241-252.DOI:10.1016/j.ccr.2006.08.009.
[123] BARBIERI D, GRASSILLI E, MONTI D, et al.D-ribose and deoxy-D-ribose induce apoptosis in human quiescent peripheral blood mononuclear cells[J].Biochemical and Biophysical Research Communications, 1994,201(3): 1109-1116.DOI:10.1006/bbrc.1994.1820.
[124] CERUTI S, BARBIERI D, VERONESE E, et al.Different pathways of apoptosis revealed by 2-chloro-adenosine and deoxy-D-ribose in mammalian astroglial cells[J].Journal of Neuroscience Research, 1997, 47(4): 372-383.DOI:10.1002/(SICI)1097-4547(19970215)47:4%3C372::AID-JNR2%3E3.0.CO;2-B.
[125] XIAO D, LEW K L, ZENG Y, et al.Phenethyl isothiocyanate-induced apoptosis in PC-3 human prostate cancer cells is mediated by reactive oxygen species-dependent disruption of the mitochondrial membrane potential[J].Carcinogenesis, 2006, 27(11): 2223-2234.DOI:10.1093/ carcin/bgl087.
[126] WARBURG O.On the origin of cancer cells[J].Science, 1956, 123: 309-314.DOI:10.1126/science.123.3191.309.
[127] BONUCCELLI G, TSIRIGOS A, WHITAKER-MENEZES D, et al.Ketones and lactate “fuel” tumor growth and metastasis: Evidence that epithelial cancer cells use oxidative mitochondrial metabolism[J].Cell Cycle, 2010, 9(17): 3506-3514.DOI:10.4161/cc.9.17.12731.
[128] LIM H Y, HO Q S, LOW J, et al.Respiratory competent mitochondria in human ovarian and peritoneal cancer[J].Mitochondrion, 2011,11(3): 437-443.DOI:10.1016/j.mito.2010.12.015.
[129] FANTIN V R, ST-PIERRE J, LEDER P.Attenuation of LDH-A expression uncovers a link between glycolysis, mitochondrial physiology, and tumor maintenance[J].Cancer Cell, 2006, 9(6): 425-434.DOI:10.1016/j.ccr.2006.04.023.
[130] GOGVADZE V, ORRENIUS S, ZHIVOTOVSKY B.Mitochondria in cancer cells: what is so special about them?[J].Trends in Cell Biology,2008, 18(4): 165-173.DOI:10.1016/j.tcb.2008.01.006.
[131] SHYH-CHANG N, ZHU H, de SOYSA T Y, et al.Lin28 enhances tissue repair by reprogramming cellular metabolism[J].Cell, 2013,155(4): 778-792.DOI:10.1016/j.cell.2013.09.059.
[132] LIU W, BECK B H, VAIDYA K S, et al.Metastasis suppressor KISS1 seems to reverse the Warburg effect by enhancing mitochondrial biogenesis[J].Cancer Research, 2014, 74(3): 954-963.DOI:10.1158/0008-5472.CAN-13-1183.
[133] LI Xingtai, ZHAO Jia.Cancer-preventive mechanism from the perspective of effects of the Astragalus polysaccharides on mitochondrial energy metabolism improvement[M].Brisbane: iConcept Press, 2014: 141-180.
[134] SENA L A, CHANDEL N S.Physiological roles of mitochondrial reactive oxygen species[J].Molecular Cell, 2012, 48(2): 158-167.DOI:10.1016/j.molcel.2012.09.025.
[135] WU C M, CHENG Y L, DAI Y H, et al.α-Tocopherol protects keratinocytes against ultraviolet A irradiation by suppressing glutathione depletion, lipid peroxidation and reactive oxygen species generation[J].Biomedical Reports, 2014, 2(3): 419-423.
[136] WANG L, ZHAO X, WEI B Y, et al.Insulin improves osteogenesis of titanium implants under diabetic conditions by inhibiting reactive oxygen species overproduction via the PI3K-Akt pathway[J].Biochimie, 2015, 108: 85-93.DOI:10.1016/j.biochi.2014.10.004.
[137] de CAVANAGH E M V, INSERRA F, FERDER L.Angiotensin II blockade: a strategy to slow aging by protecting mitochondria?[J].Cardiovascular Research, 2011, 89(1): 31-40.DOI:10.1093/cvr/ cvq285.
[138] NAVARRO A, BOVERIS A.The mitochondrial energy transduction system and the aging process[J].American Journal of Physiology-Cell Physiology, 2007, 292(2): C670-C686.
[139] HUNT N D, HYUN D H, ALLARD J S, et al.Bioenergetics of aging and calorie restriction[J].Ageing Research Reviews, 2006, 5(2): 125-143.DOI:10.1016/j.arr.2006.03.006.
[140] HALESTRAP A P, CLARKE S J, KHALIULIN I.The role of mitochondria in protection of the heart by preconditioning[J].Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2007, 1767(8): 1007-1031.DOI:10.1016/j.bbabio.2007.05.008.
[141] KIM J, WEI Y, SOWERS J R.Role of mitochondrial dysfunction in insulin resistance[J].Circulation Research, 2008, 102(4): 401-414.DOI:10.1161/CIRCRESAHA.107.165472.
[142] HÜTTEMANN M, LEE I, SAMAVATI L, et al.Regulation of mitochondrial oxidative phosphorylation through cell signaling[J].Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2007,1773(12): 1701-1720.DOI:10.1016/j.bbamcr.2007.10.001.
[143] FERNANDES M A S, MARQUES R J F, VICENTE J A F, et al.Sildenafil citrate concentrations not affecting oxidative phosphorylation depress H2O2generation by rat heart mitochondria[J].Molecular and Cellular Biochemistry, 2008, 309(1/2): 77-85.DOI:10.1007/s11010-007-9645-9.
大连民族大学人才引进科研项目(20116126)
DOI:10.7506/spkx1002-6630-201613046 10.7506/spkx1002-6630-201613046 http://www.spkx.net.cn
中图分类号:Q505
文献标志码:A
文章编号:1002-6630(2016)13-0257-14
收稿日期:2015-05-10
基金项目:大连市科学技术计划项目(2013E15SF131);大兴安岭地区科技计划项目博士后基金资助项目(LRB10-316);
作者简介:李兴太(1966—),男,副教授,博士,研究方向为功能食品及中药线粒体生化药理。E-mail:xtli@dlnu.edu.cn
Advances in Generation of Reactive Oxygen Species Associated with Health and Diseases
LI Xingtai1, ZHANG Chunying2, ZHONG Weili2, GAO Mingbo1
(1.College of Life Science, Dalian Nationalities University, Dalian 116600, China;2.Heilongjiang Daxing'anling Academy of Agriculture and Forestry Sciences, Jiagedaqi 165000, China)
Abstract:Historically, reactive oxygen species (ROS) are thought to exclusively cause cellular damage and physiological dysfunctions.The accumulation of ROS and oxidative damage has been linked to multiple pathologies, including neurodegenerative diseases, diabetes, cancer, and premature aging.Accumulating evidence in recent years suggests that ROS are critical for health.In physiological conditions, ROS are considered as a signaling molecule produced at low level and in a transient manner.On the other hand, over-production of ROS, associated with the dysfunction of ROS buffering systems, can lead to the development of chronic diseases.Thus, chronic ROS release participates in the occurrence of over 100 kinds of diseases, including major diseases that threaten human health, such as cancer, cardiovascular diseases, diabetes,neurodegenerative diseases (Parkinson's and Alzheimer's diseases), acquired immune defciency syndrome, stroke and aging.This paper reviewes the latest progress in the presence of oxygen on earth and the evolution of aerobic eukaryotic organisms,ROS types, physiological and pathological pleiotropy of ROS, the major ROS in the body, the generation and reactions of ROS, the association of ROS with mitochondrial oxidative phosphorylation, apoptosis, immune defense, infammation and cancers.Given the importance of ATP and ROS to life, we propose that the balance between the generation of ATP and ROS by regulation of mitochondrial oxidative phosphorylation will be the key to human health.
Key words:reactive oxygen species; mitochondria; signal transduction; redox balance; health
